Современные подходы к назначению add-back-терапии больным генитальным эндометриозом uMEDp
Агонисты гонадотропин-рилизинг гормона доказали высокую эффективность и широко применяются в комбинированном лечении генитального эндометриоза. Однако терапия агонистами гонадотропин-рилизинг гормона ассоциирована с выраженными побочными эффектами, связанными с индуцированной гипоэстрогенемией. Для нивелирования возникающих побочных эффектов предназначена add-back-терапия. В статье рассматривается эффективность и безопасность различных групп препаратов, используемых в качестве add-back-терапии.
Введение
Основополагающая патогенетически обоснованная терапия наружного генитального эндометриоза как эстрогензависимого заболевания направлена не только на подавление овариального синтеза эстрогенов, но и на уменьшение их выработки в самих эндометриоидных гетеротопиях.
Правильно подобранная терапия генитального эндометриоза позволяет устранить болевой синдром, уменьшить степень распространенности заболевания, реализовать репродуктивную функцию, максимально увеличить безрецидивный период заболевания, а также улучшить качество жизни больных [1].
Послеоперационная медикаментозная терапия эндометриоза проводится с целью устранения микроскопических очагов, которые не были удалены во время хирургического вмешательства, и подавления овуляции, которая, как считается в настоящее время, играет важную роль в развитии эндометриоидных кист [2, 3].
В консервативной терапии наружного генитального эндометриоза применяются различные группы гормональных препаратов: агонисты гонадотропин-рилизинг гормона (ГнРГ), антагонисты люлиберинов, антигонадотропины, прогестагены, андроген с антипрогестероновым и антиэстрогенным эффектами (гестринон), комбинированные эстроген-прогестагенные контрацептивы, ингибиторы ароматаз, антиэстрогены, селективные модуляторы прогестероновых рецепторов.
Патогенез эндометриоза и механизм действия агонистов ГнРГ
В 1971 г. A.V. Sсhally и соавт. [4] расшифровали структуру ГнРГ, эта работа позднее (в 1977 г.) была отмечена Нобелевской премией в области медицины. Гипоталамический декапептид играет важную роль в регуляции репродуктивной функции, он выделяется гипоталамусом в пульсирующем режиме (примерно один раз в 60 минут), стимулируя синтез и выработку лютеинизирующего и фолликулостимулирующего гормонов.
Гипоталамический декапептид играет важную роль в регуляции репродуктивной функции, он выделяется гипоталамусом в пульсирующем режиме (примерно один раз в 60 минут), стимулируя синтез и выработку лютеинизирующего и фолликулостимулирующего гормонов.
Следует отметить, что агонисты ГнРГ используются более 30 лет и остаются золотым стандартом терапии наружного генитального эндометриоза. В настоящее время синтезировано более 3000 агонистов ГнРГ, наиболее активными являются те препараты, у которых замещены аминокислоты в положениях 6 и 10. Замещение аминокислоты в молекуле ГнРГ в положении 6 защищает ее от ферментативного распада, что приводит к замедлению скорости распада, а замещение в положении 10 повышает активность аналогов ГнРГ, что также снижает протеолиз. Например, особенности молекулы трипторелина (замена L-глицина на D-триптофан в положении 6) обеспечивают наибольший по сравнению с другими агонистами ГнРГ (гозерелином, лейпрорелином) период полураспада в сыворотке крови – 7,5 часа [4].
Применение агонистов ГнРГ приводит к уменьшению уровня мидкайна в фолликулярной и перитонеальной жидкостях пациенток с наружным генитальным эндометриозом [5, 6]. Мидкайн является фактором роста и связан с ангиогенезом, хемотаксисом, митотической активностью, принимает участие в воспалении [7], что обусловливает его важную роль в патогенезе эндометриоза.
Механизм действия агонистов ГнРГ включает две фазы. Первая – кратковременная фаза стимуляции или «вспышки», которая проявляется повышением содержания в крови лютеинизирующего и фолликулостимулирующего гормонов и, как следствие, ведет к возрастанию эстрадиола и в меньшей степени прогестерона в крови. Вторая – фаза десенситизации гипофиза: гонадотрофы остаются резистентными к стимуляции, и уровень гонадотропинов в крови снижается. Интенсивность и длительность второй фазы зависят от дозы агонистов ГнРГ [8].
Описаны две формы высокоаффинных рецепторов гонадолиберинов: ГнРГ I и ГнРГ II. Определено, что рецепторы типа I вовлечены в патогенез эндометриоза, так как могут ингибировать пролиферацию и стимулировать апоптоз эндометриоидных и эндометриальных клеток. P. Limonta и соавт. [9] установили, что ГнРГ I регулирует стероидогенез и ингибирует клеточный рост в клетках яичника человека. Присутствие мРНК ГнРГ I в гранулезных клетках первичных, вторичных и третичных фолликулов продемонстрировано в исследованиях гибридизации
Определено, что рецепторы типа I вовлечены в патогенез эндометриоза, так как могут ингибировать пролиферацию и стимулировать апоптоз эндометриоидных и эндометриальных клеток. P. Limonta и соавт. [9] установили, что ГнРГ I регулирует стероидогенез и ингибирует клеточный рост в клетках яичника человека. Присутствие мРНК ГнРГ I в гранулезных клетках первичных, вторичных и третичных фолликулов продемонстрировано в исследованиях гибридизации
В ряде исследований было показано, что рецепторы ГнРГ II также вовлечены в патогенез наружного генитального эндометриоза. Группа японских ученых [10] определила, что ГнРГ II ингибируют пролиферацию клеток стромы эндометрия, а также индуцированную интерлейкином 1-бета экспрессию интерлейкина 8 и циклооксигеназы 2 в клетках стромы эндометрия. Однако уровни экспрессии ГнРГ II были ниже в эндометриоидных гетеротопиях и эндометрии больных эндометриозом по сравнению с таковыми у женщин без данного заболевания независимо от фазы менструального цикла [10], и этот факт может служить одним из звеньев развития заболевания. I.S. Hong и соавт. [11] подтвердили экспрессию ГнРГ II в гранулезно-лютеиновых клетках, в поверхностном эпителии яичников, а также при раке яичников. Кроме того, была обнаружена высокая экспрессия ГнРГ II в экстрагипоталамических областях, включая эндометрий [12] и молочные железы [13]. Известно, что агонисты ГнРГ, в частности трипторелин, обладают высокой аффинностью к рецепторам ГнРГ, превосходя активность нативного гонадолиберина в 100 раз.
I.S. Hong и соавт. [11] подтвердили экспрессию ГнРГ II в гранулезно-лютеиновых клетках, в поверхностном эпителии яичников, а также при раке яичников. Кроме того, была обнаружена высокая экспрессия ГнРГ II в экстрагипоталамических областях, включая эндометрий [12] и молочные железы [13]. Известно, что агонисты ГнРГ, в частности трипторелин, обладают высокой аффинностью к рецепторам ГнРГ, превосходя активность нативного гонадолиберина в 100 раз.
Долгое время считалось, что основным механизмом действия агонистов ГнРГ является подавление секреции эстрадиола яичниками. Однако в последние годы описано разнонаправленное влияние данного класса препаратов на очаг эндометриоза – антипролиферативное, проапоптотическое, антиангиогенное [6, 14–18].
Эффективность агонистов ГнРГ также может быть связана с уменьшением на фоне их применения чувствительности эндометриоидных очагов к тромбину, что сопровождается уменьшением воспалительной реакции и прекращением кровотечения. Известно, что тромбин и его специфические, активируемые протеазой, рецепторы участвуют в воспалении, пролиферации клеток и кровотечении [6].
Известно, что тромбин и его специфические, активируемые протеазой, рецепторы участвуют в воспалении, пролиферации клеток и кровотечении [6].
Получила подтверждение роль в патогенезе генитального эндометриоза фермента ароматазы, осуществляющего конвертацию андрогенов в эстрогены. Определено, что эндометриоидные гетеротопии могут продуцировать собственные эстрогены и поэтому существовать и самоподдерживаться автономно в связи с повышенной экспрессией ароматазы в очаге эндометриоза [19, 20]. Согласно нашим данным [21], у женщин с эндометриозом в раннюю фолликулярную фазу менструального цикла (до инициации доминантного фолликула) отмечается гиперэстрогенемия, которая может нарушать функцию яичников за счет преждевременного пика гонадотропинов. Базальная гиперэстрогенемия у пациенток с наружным генитальным эндометриозом обусловлена повышенной ароматазной активностью антральных фолликулов, что может способствовать развитию и прогрессированию заболевания [21]. Таким образом, терапия агонистами ГнРГ, несомненно, является патогенетически обоснованной, поскольку приводит к подавлению ароматазной активности [22, 23].
Наружный генитальный эндометриоз как эстрогензависимая воспалительная реакция может сопровождаться повышением уровня цитокинов: интерлейкинов 1-бета, 6, 8, 10, фактора некроза опухоли альфа, хемокинов (хемоаттрактантного белка моноцитов (monocyte chemoattractant protein 1 – МСР-1), монокина, индуцируемого интерфероном гамма (monokin induced by IFN-gamma – MIG), хемокина, регулирующего активацию, экспрессию и секрецию нормальных Т-клеток (regulated on activation normal T-cell expressed and secreted – RANTES)), факторов роста (фактора роста эндотелия сосудов, инсулиноподобного фактора роста), ангиогенина, а также матриксных металлопротеиназ 1, 2, 3, 7, 9, 10, причем уровень ферментов возрастает с увеличением тяжести и распространенности заболевания [24–26].
Эффективность агонистов ГнРГ также обусловлена снижением уровня провоспалительных интерлейкинов 2, 6, 8 [27], фактора роста эндотелия сосудов [5, 28], ряда хемокинов (MCP-1, MIG и RANTES), матриксных металлопротеиназ [29]. Определена роль трансформирующего фактора роста бета, который, будучи вовлеченным в клеточную дифференциацию и ремоделирование тканей, является плейотропным фактором развития и прогрессирования эндометриоза. Вероятно, терапевтический эффект агонистов ГнРГ может быть опосредован ингибиторным влиянием на сигнальные пути трансформирующего фактора роста бета [30].
Определена роль трансформирующего фактора роста бета, который, будучи вовлеченным в клеточную дифференциацию и ремоделирование тканей, является плейотропным фактором развития и прогрессирования эндометриоза. Вероятно, терапевтический эффект агонистов ГнРГ может быть опосредован ингибиторным влиянием на сигнальные пути трансформирующего фактора роста бета [30].
Add-back-терапия как метод преодоления нежелательных явлений, сопровождающих прием агонистов ГнРГ
Большинство побочных эффектов, возникающих при терапии агонистами ГнРГ, связаны с гипоэстрогенемией и включают нейровегетативные и психоэмоциональные симптомы (приливы жара, потливость, нарушения сна, эмоциональную лабильность, депрессию, утомляемость, раздражительность) и атрофию слизистых мочеполового тракта. Среди других частых побочных эффектов можно отметить головные боли, снижение либидо, кровянистые выделения из половых путей, артралгию, миалгию и снижение эластичности кожи [18].
С целью уменьшения гипоэстрогенных побочных эффектов, индуцированных агонистами ГнРГ, назначается так называемая add-back-терапия (возвратная терапия, или терапия прикрытия). Add-back-терапия подразумевает применение различных лекарственных средств на фоне лечения агонистами ГнРГ с целью минимизации либо устранения гипоэстрогенных побочных эффектов, но, что является принципиально важным, при сохранении терапевтической эффективности аналогов ГнРГ. Купирование вазомоторных побочных эффектов способствует тому, что лечение легче переносится, следовательно, повышается приверженность терапии. Нивелирование негативного влияния на костную ткань и снижение риска развития осложнений со стороны сердечно-сосудистой системы позволяют увеличить продолжительность лечения [31].
Add-back-терапия подразумевает применение различных лекарственных средств на фоне лечения агонистами ГнРГ с целью минимизации либо устранения гипоэстрогенных побочных эффектов, но, что является принципиально важным, при сохранении терапевтической эффективности аналогов ГнРГ. Купирование вазомоторных побочных эффектов способствует тому, что лечение легче переносится, следовательно, повышается приверженность терапии. Нивелирование негативного влияния на костную ткань и снижение риска развития осложнений со стороны сердечно-сосудистой системы позволяют увеличить продолжительность лечения [31].
Применение add-back-терапии основано на гипотезе «пороговой концентрации эстрогенов», которая была предложена R.L. Barbieri в 1992 г. и заключается в том, что ткани имеют различную чувствительность к эстрогенам. Согласно этой теории для роста эндометрий-подобной ткани необходимы высокие концентрации эстрадиола (от 100 до 300 пг/мл), тогда как для нормального процесса ремоделирования костной ткани достаточны относительно невысокие дозы эстрадиола (менее 50 пг/мл). Таким образом создается так называемое терапевтическое окно при концентрации эстрадиола от 20 до 50 пг/мл, в рамках которого эндометриоидные ткани подвергаются атрофии без негативного влияния на костную ткань [32].
Таким образом создается так называемое терапевтическое окно при концентрации эстрадиола от 20 до 50 пг/мл, в рамках которого эндометриоидные ткани подвергаются атрофии без негативного влияния на костную ткань [32].
В рекомендациях Европейского общества репродукции человека и эмбриологии, опубликованных в 2014 г., также отмечается необходимость назначения add-back-терапии для предотвращения потери костной ткани и гипоэстрогенных побочных эффектов во время лечения агонистами ГнРГ [33].
Считается, что при применении агонистов ГнРГ продолжительностью более трех месяцев необходимо назначение add-back-терапии [31]. Мы также придерживаемся данной точки зрения и считаем целесообразным назначение препаратов менопаузальной гормональной терапии в качестве add-back-терапии через три месяца от начала приема агонистов ГнРГ.
В нашей практике женщинам, получающим агонисты ГнРГ, рутинно мы рекомендуем использование фитоэстрогенов (Феминал, Иноклим, Менорил, Климадинон), комбинированных препаратов (Эстровэл), гомеопатических препаратов (Климактоплан Н), возможно, Клималанина. Однако вышеперечисленные препараты следует принимать не ранее чем через две-три недели после первой инъекции агонистов ГнРГ, учитывая механизм действия и длительность фазы «вспышки» [34, 35]. Пациенткам с наружным генитальным эндометриозом при нейровегетативных и психоэмоциональных проявлениях легкой или средней степени выраженности, не имеющих факторов риска остеопороза, можно продолжать прием вышеперечисленных препаратов до конца курса лечения агонистами ГнРГ [36]. Следует отметить, что выраженность нейровегетативных и психоэмоциональных проявлений, связанных с применением агонистов ГнРГ, может быть различной.
Однако вышеперечисленные препараты следует принимать не ранее чем через две-три недели после первой инъекции агонистов ГнРГ, учитывая механизм действия и длительность фазы «вспышки» [34, 35]. Пациенткам с наружным генитальным эндометриозом при нейровегетативных и психоэмоциональных проявлениях легкой или средней степени выраженности, не имеющих факторов риска остеопороза, можно продолжать прием вышеперечисленных препаратов до конца курса лечения агонистами ГнРГ [36]. Следует отметить, что выраженность нейровегетативных и психоэмоциональных проявлений, связанных с применением агонистов ГнРГ, может быть различной.
В Российских рекомендациях по ведению больных с эндометриозом 2013 г. указано, что агонисты ГнРГ в виде монотерапии могут назначаться на срок не более шести месяцев, в дальнейшем данный вид лечения можно продолжать только в сочетании с add-back-терапией.
В российском многоцентровом наблюдательном исследовании больных с эндометриозом (n = 1000, средний возраст 34 года) на фоне терапии трипторелином в дозе 3,75 мг на протяжении четырех – шести месяцев только у 11,3% пациенток были отмечены приливы, однако ни в одном случае не возникло необходимости в назначении add-back-терапии. При этом уровень эстрадиола в плазме крови на фоне лечения трипторелином приближен к терапевтическому окну с максимальным профилем эффективности лечения эндометриоза [37].
При этом уровень эстрадиола в плазме крови на фоне лечения трипторелином приближен к терапевтическому окну с максимальным профилем эффективности лечения эндометриоза [37].
В литературе описаны следующие виды add-back-терапии: монотерапия прогестагенами, монотерапия эстрогенами, комбинированная терапия натуральными эстрогенами и прогестагенами, применение тиболона, ралоксифена, бисфосфонатов, кальцитонина, витамина D, паратиреоидного гормона [31, 38].
Большинство исследований было посвящено терапии прогестагенами, эстрогенами, биоидентичными натуральным, и их комбинациями. Так, изучалась эффективность медропрогестерона ацетата и норэтиндрона в качестве монокомпонентной add-back-терапии при назначении агонистов ГнРГ.
M.I. Cedars и соавт. [39] обнаружили, что вазомоторные симптомы и потеря костной ткани уменьшались на фоне стандартной дозы медропрогестерона ацетата по сравнению с контрольной группой, однако купирование симптомов эндометриоза было недостаточным. Когда L. Makarainen и соавт. [40] ввели большую дозу медропрогестерона ацетата, симптомы эндометриоза контролировались лучше, но были более выражены побочные эффекты прогестагенов, а именно задержка жидкости. Между тем были получены данные о том, что использование депо-формы медропрогестерона ацетата у подростков с эндометриозом сопровождалось уменьшением минеральной плотности костной ткани [41, 42]. Управление по контролю качества пищевых продуктов и лекарственных препаратов США не рекомендует депо-формы медропрогестерона ацетата из-за отрицательного влияния на костную ткань [43]. E.S. Surrey и соавт. [44] определили, что на фоне применения норэтиндрона уменьшалась выраженность вазомоторных проявлений и отсутствовали симптомы эндометриоза, потеря костной ткани не прогрессировала.
Когда L. Makarainen и соавт. [40] ввели большую дозу медропрогестерона ацетата, симптомы эндометриоза контролировались лучше, но были более выражены побочные эффекты прогестагенов, а именно задержка жидкости. Между тем были получены данные о том, что использование депо-формы медропрогестерона ацетата у подростков с эндометриозом сопровождалось уменьшением минеральной плотности костной ткани [41, 42]. Управление по контролю качества пищевых продуктов и лекарственных препаратов США не рекомендует депо-формы медропрогестерона ацетата из-за отрицательного влияния на костную ткань [43]. E.S. Surrey и соавт. [44] определили, что на фоне применения норэтиндрона уменьшалась выраженность вазомоторных проявлений и отсутствовали симптомы эндометриоза, потеря костной ткани не прогрессировала.
Монотерапия эстрогенами в качестве add-back-терапии несколько противоречива. Согласно гипотезе «пороговой концентрации эстрогенов» данная терапия сопровождается эффективным устранением нейровегетативных и психоэмоциональных проявлений, а также позитивно влияет на минеральную плотность костной ткани. Однако этот вид лечения может приводить к стимуляции роста эндометрия и эндометрий-подобных тканей. N.Y. Kim и соавт. [45] сравнивали монотерапию низкими дозами эстрадиола валерата (1 мг) и тиболона в качестве add-back-терапии, была продемонстрирована достаточная эффективность и хорошая переносимость обоих методов. Тем не менее было отмечено, что толщина эндометрия после окончания терапии была больше у женщин, принимавших в качестве add-back-терапии эстрадиола валерат, по сравнению с пациентками, получавшими тиболон [45].
Однако этот вид лечения может приводить к стимуляции роста эндометрия и эндометрий-подобных тканей. N.Y. Kim и соавт. [45] сравнивали монотерапию низкими дозами эстрадиола валерата (1 мг) и тиболона в качестве add-back-терапии, была продемонстрирована достаточная эффективность и хорошая переносимость обоих методов. Тем не менее было отмечено, что толщина эндометрия после окончания терапии была больше у женщин, принимавших в качестве add-back-терапии эстрадиола валерат, по сравнению с пациентками, получавшими тиболон [45].
В настоящее время в качестве add-back-терапии наиболее популярен и хорошо изучен режим комбинированной терапии эстрогенами, биоидентичными натуральным, в сочетании с гестагенами [31]. На фоне комбинации конъюгированных эквин-эстрогенов с медропрогестерона ацетатом эффективность терапии агонистами ГнРГ сохранялась, а также уменьшалась степень негативного влияния на костную ткань [46]. Сочетанное применение эстрадиола и норэтиндрона также оказалось эффективным и минимизировало вазомоторные симптомы и снижение минеральной плотности костной ткани [47]. Согласно результатам рандомизированного исследования E.S. Surrey и соавт., терапия агонистами ГнРГ и норэтиндрона ацетатом в качестве монотерапии (в дозе 5 мг ежедневно) или в комбинации с низкой дозой конъюгированных эстрогенов (0,625 или 1,25 мг ежедневно), назначаемая пациенткам с эндометриозом в течение 12 месяцев, способствовала пролонгированному уменьшению болевого синдрома и сохранению минеральной плотности костной ткани после завершения терапии [48].
Согласно результатам рандомизированного исследования E.S. Surrey и соавт., терапия агонистами ГнРГ и норэтиндрона ацетатом в качестве монотерапии (в дозе 5 мг ежедневно) или в комбинации с низкой дозой конъюгированных эстрогенов (0,625 или 1,25 мг ежедневно), назначаемая пациенткам с эндометриозом в течение 12 месяцев, способствовала пролонгированному уменьшению болевого синдрома и сохранению минеральной плотности костной ткани после завершения терапии [48].
По данным исследования E. Zupi и соавт., add-back-терапия позволяет проводить эффективное лечение женщин с рецидивом наружного генитального эндометриоза и эндометриоз-ассоциированным болевым синдромом в течение более продолжительного периода времени по сравнению с женщинами, получающими монотерапию агонистами ГнРГ или принимающими оральные контрацептивы [49]. При этом на фоне терапии прикрытия отмечались хороший контроль симптомов эндометриоза, более высокое качество жизни пациенток и протективный эффект в отношении костной ткани [49].
С целью изучения эффективности и безопасности лечения хронической тазовой боли у больных эндометриозом было проведено проспективное исследование, оценивающее применение агонистов ГнРГ в течение 18 месяцев [50]. Больные были разделены на две группы: пациенткам первой группы тиболон в качестве терапии прикрытия был назначен сразу, во второй группе – шесть месяцев спустя. В дальнейшем пациентки наблюдались в течение 12 месяцев, отслеживались такие показатели, как качество жизни и минеральная плотность костной ткани. Через шесть месяцев терапии у больных из первой группы было отмечено меньшее снижение минеральной плотности костной ткани, у них реже возникали приливы по сравнению со второй группой. Однако динамика болевого синдрома, качества жизни и минеральной плотности костной ткани оказалась сходной в обеих группах женщин.
Таким образом, длительное лечение агонистами ГнРГ на фоне раннего назначения add-back-терапии зарекомендовало себя как безопасный и приемлемый подход у больных наружным генитальным эндометриозом с болевым синдромом, нуждающихся в долговременной терапии аналогами ГнРГ [50, 51].
По данным ряда метаанализов, в качестве add-back-терапии возможно применение монотерапии гестагенами либо комбинации эстрогенов и гестагенов, а также тиболона, причем существенных отличий в эффективности какого-либо режима выявлено не было [18, 52].
Принципы назначения add-back-терапии на фоне агонистов ГнРГ во многом основываются на правилах подбора менопаузальной гормональной терапии у больных с эндометриозом. На сегодняшний день не существует единой тактики выбора менопаузальной гормональной терапии у пациенток с эндометриозом в анамнезе. Основными рекомендациями являются отказ от монотерапии эстрогенами, преимущественное использование комбинированной менопаузальной гормональной терапии с гестагенами, даже после перенесенной гистерэктомии, и прекращение терапии при подозрении на рецидив заболевания.
М.И. Ярмолинская (2009) проанализировала истории болезни женщин с наружным генитальным эндометриозом в пери- и постменопаузе, получавших менопаузальную гормональную терапию по поводу климактерического синдрома различной степени тяжести. Период назначения менопаузальной гормональной терапии варьировал от восьми месяцев до полутора лет. Особый интерес представляли пациентки, у которых было выполнено оперативное лечение по поводу рецидива наружного генитального эндометриоза (преимущественно третьей-четвертой степени) на фоне менопаузальной гормональной терапии. Больные получали различные гормональные препараты (в пременопаузе в циклическом режиме, в постменопаузе – монофазные в непрерывном режиме). Несмотря на большое разнообразие препаратов, применявшихся для лечения климактерического синдрома у больных наружным генитальным эндометриозом в пери- и постменопаузе, общей для всех была доза эстрогенного компонента 2 мг. Таким образом, женщинам с наружным генитальным эндометриозом в анамнезе, нуждающимся в менопаузальной гормональной терапии, целесообразно назначать минимальные дозы (0,5–1,0 мг) эстрогенов, биоидентичных натуральным [35].
Период назначения менопаузальной гормональной терапии варьировал от восьми месяцев до полутора лет. Особый интерес представляли пациентки, у которых было выполнено оперативное лечение по поводу рецидива наружного генитального эндометриоза (преимущественно третьей-четвертой степени) на фоне менопаузальной гормональной терапии. Больные получали различные гормональные препараты (в пременопаузе в циклическом режиме, в постменопаузе – монофазные в непрерывном режиме). Несмотря на большое разнообразие препаратов, применявшихся для лечения климактерического синдрома у больных наружным генитальным эндометриозом в пери- и постменопаузе, общей для всех была доза эстрогенного компонента 2 мг. Таким образом, женщинам с наружным генитальным эндометриозом в анамнезе, нуждающимся в менопаузальной гормональной терапии, целесообразно назначать минимальные дозы (0,5–1,0 мг) эстрогенов, биоидентичных натуральным [35].
Индивидуальный выбор гормональных препаратов, в том числе дозы, типа и пути введения, подразумевает обеспечение оптимальной клинической эффективности и безопасности с учетом возможности рецидива наружного генитального эндометриоза и экстрагенитальных заболеваний. Сопутствующие экстрагенитальные заболевания печени, поджелудочной железы, расстройства коагуляции, риск венозного тромбоза, гипертриглицеридемия, мигренозные головные боли являются показанием для выбора парентерального пути введения гормональных средств.
Сопутствующие экстрагенитальные заболевания печени, поджелудочной железы, расстройства коагуляции, риск венозного тромбоза, гипертриглицеридемия, мигренозные головные боли являются показанием для выбора парентерального пути введения гормональных средств.
Наш опыт назначения возвратной терапии на фоне применения агонистов ГнРГ включал препараты для монофазного комбинированного режима менопаузальной гормональной терапии: 1 мг 17-бета-эстрадиола в сочетании с 5 мг дидрогестерона, 1 мг 17-бета-эстрадиола в сочетании с 2 мг дроспиренона, а также трансдермальные формы 17-бета-эстрадиола 0,5, 0,75 или 1 мг/сут в качестве монотерапии или в ряде случаев на фоне интравагинального непрерывного введения микронизированного прогестерона в дозе 200 мг (у больных с противопоказаниями для перорального применения менопаузальной гормональной терапии) [35]. Полученные данные показали, что вышеперечисленные препараты в качестве add-back-терапии более быстро и эффективно по сравнению с фитоэстрогенами и гомеопатическими препаратами устраняют тяжелые нейровегетативные и психоэмоциональные проявления, вызванные приемом агонистов ГнРГ. Важно отметить, что 17-бета-эстрадиол в дозе 0,5 мг был чуть менее эффективным, чем в дозе 1 мг. Несомненно, альтернативные препараты, использующиеся в менопаузальной гормональной терапии, с гораздо меньшей активностью, чем у натуральных эстрогенов, более безопасны с точки зрения возможного рецидива заболевания, однако менее эффективны в устранении гипоэстрогенных проявлений [35]. Поддержание концентрации эстрадиола в пределах определенной пороговой нормы способствует профилактике остеопении или остеопороза.
Важно отметить, что 17-бета-эстрадиол в дозе 0,5 мг был чуть менее эффективным, чем в дозе 1 мг. Несомненно, альтернативные препараты, использующиеся в менопаузальной гормональной терапии, с гораздо меньшей активностью, чем у натуральных эстрогенов, более безопасны с точки зрения возможного рецидива заболевания, однако менее эффективны в устранении гипоэстрогенных проявлений [35]. Поддержание концентрации эстрадиола в пределах определенной пороговой нормы способствует профилактике остеопении или остеопороза.
Целесообразно назначать с профилактической целью на фоне терапии агонистами ГнРГ препараты кальция с витамином D3
(обычно начиная со второго-третьего месяца лечения), а также проводить двухэнергетическую рентгеновскую абсорбциометрию перед началом терапии агонистами ГнРГ у пациенток, имеющих факторы риска развития остеопороза. У больных наружным генитальным эндометриозом с выраженной остеопенией или остеопорозом на фоне терапии агонистами ГнРГ и препаратами кальция с витамином D3 возможно применение бисфосфонатов.
Принимая во внимание вышеперечисленные факторы эффективности и переносимости различных режимов add-back-терапии, наиболее целесообразным представляется назначение низких доз эстрогенов, биоидентичных натуральным (не более 1 мг/сут), как в качестве монотерапии, так и в сочетании с гестагенами. Минимизация количества эстрогенов не снижает эффективности add-back-терапии, не увеличивает частоту побочных эффектов, а комбинация эстрогенов с гестагенами позволяет избежать риска роста эндометрий-подобных тканей. Безопасно также в качестве возвратной терапии у больных наружным генитальным эндометриозом можно использовать тиболон. Кроме того, важными элементами в поддержании необходимого состояния костной ткани во время приема агонистов ГнРГ (в сочетании с add-back-терапией или без нее) являются изменение режима, адекватная физическая нагрузка, прием препаратов кальция и витамина D3.
Заключение
Add-back-терапия, сохраняя эффективность лечения, позволяет улучшить качество жизни пациенток с эндометриозом, повысить их приверженность терапии, особенно при необходимости длительного курса приема агонистов ГнРГ (Диферелин®) или при агрессивном рецидивирующем характере течения эндометриоза.
Терапия прикрытия в лечении эндометриоза агонистами гонадотропин-рилизинг-гормона » Акушерство и Гинекология
С целью увеличения приемлемости терапии агонистами гонадотропин-рилизинг-гормона (ГнРГ) для проведения эффективного курса и преодоления гипоэстрогенных побочных реакций используется так называемая терапия прикрытия. Она способствует уменьшению частоты и выраженности побочных реакций, связанных с приемом агонистов ГнРГ, без влияния на их эффективность. Для минимизации потерь костного вещества, устранения приливов, вагинальной сухости, при сохранении эффективности лечения основного заболевания были предложены следующие варианты лекарственных воздействий: монотерапия прогестинами, прогестины и органические бисфосфонаты, низкие дозы прогестинов и эстрогенов, тиболон, паратиреоидный гормон в пульсирующем режиме. Разработка новых схем и режимов терапии прикрытия может улучшить исходы лечения пролиферативных гормонозависимых заболеваний.Эндометриоз является одной из важнейших проблем современной гинекологии, актуальность которой обусловлена бесплодием, болевым синдромом, способностью к инфильтративному росту [6, 28, 38].
Избыточная концентрация простагландинов в тканях и в системном кровотоке ответственна, наряду с цитокинами, за клиническую симптоматику эндометриоза – боль, нарушение репродуктив-
ной функции, менструальную дисфункцию [28].
У больных эндометриозом обнаруживается полиморфизм генов, ассоциированных со снижением
фибринолиза, следовательно, образование спаек оказывается не столько результатом функционирования гетеротопий, сколько следствием генных и иммунных поломок, лежащих в основе возникновения эндометриоза [36].
При наружном эндометриозе имеют место значительные изменения активности протеаз и ингибиторов протеаз в перитонеальной жидкости [4]. Следствием этого становится как изменение апоптоза при снижении активности катепсинов и повышении активности их ингибиторов, так и увеличение инвазивного потенциала самого эндометрия в связи с повышением активности плазмина. В результате эндометриальные клетки, попадая в перитонеальную жидкость с измененными свойствами, не подвергаются апоптозу и внедряются в брюшинный покров.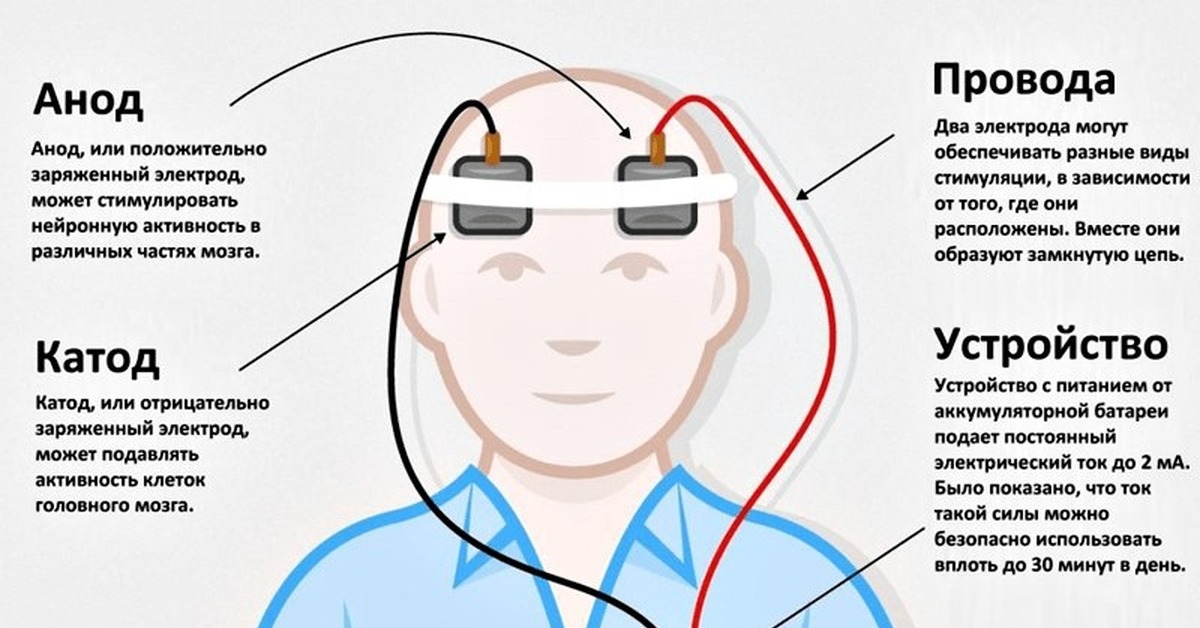
Эндометриоидные гетеротопии в меньшей степени чувствительны к гормонам, чем нормальный эндометрий, что подтверждается снижением экспрессии рецепторов эстрадиола и прогестерона,
прямо пропорциональной степени удаленности очага поражения от матки. Более того, при эндометриозе наблюдаются аномалии рецептора прогестерона, обусловленные генетически [37]. При
снижении чувствительности к прогестерону эндометриоидные гетеротопии обладают способностью
локального синтеза эстрогенов, в пользу которого свидетельствует наличие повышенной экспрессии
ароматазы и других ферментов стероидогенеза [15, 16]. Клинические симптомы эндометриоза в равной степени зависят от функционирования эндометриоидных имплантов и от тех патофизиологических изменений, которые приводят к развитию эндометриоза. Например, наиболее частую жалобу пациенток с эндометриозом – на боль в нижних отделах живота [19] – связывают с повышенной продукцией простагландинов, а также с отеком и выделением крови из эндометриоидных имплантов.
Традиционная тактика ведения больных эндометриозом предполагает хирургическое вмешательство. Гормональная терапия часто используется до и после операции, а также как альтернатива операции в лечении умеренно выраженной или легкой тазовой боли, ассоциированной с эндометриозом [7].
Основой гормональной терапии является применение препаратов, способных снизить уровень эстрогенов как одного из важных факторов персистенции эндометриоидных имплантов [10]. Среди
лекарственных средств для гормональной терапии эндометриоза наибольшей популярностью пользуются агонисты гонадотропин-рилизинг-гормона (ГнРГ). Наиболее изученным из них является лейпрорелина ацетат (люкрин депо).
Агонисты ГнРГ изначально создавались как лекарственные средства, обладающие большей активностью и длительностью действия по сравнению с эндогенным ГнРГ. Эндогенный гонадолиберин синтезируется в гипоталамусе и в пульсирующем режиме с интервалом 90 мин поступает в гипофиз. Этот «рилизинг-фактор» имеет выраженную специфичность и взаимодействует преимущественно с соответствующими рецепторами передней доли гипофиза и лишь с незначительным количеством других белков. В свою очередь синтетические аналоги гонадолиберина обладают в сотни раз большим сродством к эндогенным рецепторам благодаря замене нескольких аминокислот в их структуре. Вследствие этого передняя доля гипофиза как бы лишается чувствительности к пульсирующему ритму естественного (эндогенного) нейротрансмиттера. После первоначальной фазы активации гипофиза в течение первых 5–10 дней наступает его полная десенситизация к концу второй недели действия агониста ГнРГ. Происходит снижение уровней фолликулостимулирующего и лютеинизирующего гормонов, прогестерона и тестостерона. Уровень эстрадиола падает ниже 100 пмоль/л, приходя в соответствие содержанию эстрогенов в постменопаузе.
В свою очередь синтетические аналоги гонадолиберина обладают в сотни раз большим сродством к эндогенным рецепторам благодаря замене нескольких аминокислот в их структуре. Вследствие этого передняя доля гипофиза как бы лишается чувствительности к пульсирующему ритму естественного (эндогенного) нейротрансмиттера. После первоначальной фазы активации гипофиза в течение первых 5–10 дней наступает его полная десенситизация к концу второй недели действия агониста ГнРГ. Происходит снижение уровней фолликулостимулирующего и лютеинизирующего гормонов, прогестерона и тестостерона. Уровень эстрадиола падает ниже 100 пмоль/л, приходя в соответствие содержанию эстрогенов в постменопаузе.
В результате выключения функции яичников на фоне снижения содержания всех фракций стероидных гормонов в организме формируется состояние «псевдоменопаузы». Слизистая оболочка тела матки закономерно реагирует на значительное уменьшение эстрогенных влияний прекращением пролиферативных процессов [26]. Состояние эндометрия на фоне применения агонистов ГнРГ (люкрина депо) характеризуется атрофией либо резко выраженной гипоплазией с отсутствием пролиферативной активности желез, сходные процессы протекают в эндометриоидных имплантах [14].
Помимо гипофиза, рецепторы к ГнРГ обнаружены в ряде тканей, в том числе в яичниках, эндометрии и клетках злокачественных опухолей яичников и молочных желез, следовательно, действие агонистов ГнРГ не ограничивается центральным компонентом, а имеет и местный характер. Исследования, проводимые при применении люкрина депо, показали, что он непосредственно влияет на эпителиальные и стромальные клетки эндометрия и эндометриоподобной ткани, вмешиваясь в процесс внутриклеточных взаимодействий [23]. Описан блокирующий эффект агонистов ГнРГ в отношении рецепторов эпидермального фактора роста, что также может обеспечивать снижение пролиферативного потенциала ткани [5, 12]. Положительные изменения, индуцируемые агонистами ГнРГ (лейпрорелина ацетат), характеризуют нарушенный иммунный статус: уменьшение естественных клеток-киллеров, увеличение процентного содержания Т-хелперов и снижение Т-супрессоров, нормализация иммунорегуляторного индекса, содержания В-клеток,С4-компонента комплемента, С-реактивного белка.
Комплексное воздействие на органы репродуктивной системы в итоге способствует устранению
болевого синдрома и уменьшению распространенности эндометриоидных поражений у 75–92%
больных [9, 12, 13].
Агонисты ГнРГ (в частности, люкрин депо) назначают перед оперативным лечением для подавления
роста эндометриоидных имплантатов, что позволяет выполнять щадящие хирургические вмешательства и сохранять детородную функцию [21, 22]. У женщин, перенесших нерадикальное хирургическое вмешательство, агонисты ГнРГ используют после операции для профилактики рецидива
заболевания [8].
Агонисты ГнРГ могут рекомендоваться для эмпирического применения при хронической тазовой боли женщинам с подозрением на эндометриоз. В течение первых 3 мес лечения положительный эффект в отношении болевых симптомов достигается в 80–100% случаев. Частота рецидивов симптомов эндометриоза через 4–12 мес после окончания терапии агонистами ГнРГ колеблется в пределах 15–20%.
В лечении бесплодия, ассоциированного с эндометриозом, агонисты ГнРГ также дают эффект: частота наступления беременности после комбинированного (хирургического и гормонального) лечения составляет 24–52%.
Агонисты ГнРГ эффективны в лечении наружного генитального эндометриоза, однако с их приемом связано много гипоэстрогенных побочных реакций, иногда значительно нарушающих качество жизни.
Наиболее распространенные причины прерывания лечения агонистами ГнРГ до истечения эффективного 6-месячного курса – это прорывные кровотечения, приливы жара, вагинальная
сухость, перемены настроения, снижение либидо и обратимое снижение минеральной плотности
костной ткани (МПКТ). Установлено, что за 6 мес терапии ГнРГ может быть утеряно до 6% минеральной плотности кости. Эта утрата практически полностью возмещается в течение 2 лет после окончания лечения, но если агонисты назначаются женщинам, еще не накопившим или уже начавшим терять костную массу, полного восстановления МПКТ может не состояться [29].
При пролонгированном (более 6 мес) лечении агонистами ГнРГ потеря МПКТ может стать необратимой и привести к остеопорозу [30].
С целью увеличения приемлемости терапии агонистами ГнРГ (лейпрорелина ацетат) для проведения эффективного курса и преодоления гипоэстрогенных побочных реакций используется так называемая терапия прикрытия [27].
Терапия прикрытия способствует снижению частоты и выраженности побочных реакций, связанных с приемом агонистов ГнРГ, без влияния на их эффективность. Начинать ее рекомендуют одновременно (в день первой инъекции) с лечением агонистами ГнРГ. Длительность планируемого курса терапии прикрытия определяется ее целями. 6-месячный курс предназначен для контроля кратковременных симптомов, таких как вазомоторные, и вагинальной атрофии. Более длительная терапия прикрытия при продлении курса лечения агонистами ГнРГ имеет дополнительную цель защиты МПКТ.
В идеале терапия прикрытия должна устранять риски, связанные с приемом агонистов ГнРГ, не влияя на их эффективность, улучшать качество жизни больных и в дополнение иметь собственный лечебный потенциал в отношении эндометриоидных имплантов и симптомов эндометриоза. Хотя ни один из существующих в настоящее время методов терапии прикрытия не отвечает всем этим требованиям, возможность индивидуального выбора все же есть.
Для минимизации потерь костного вещества, устранения приливов, вагинальной сухости при сохранении эффективности лечения основного заболевания были предложены следующие варианты лекарственных воздействий: монотерапия прогестинами, прогестины и органические бисфосфонаты, низкие дозы прогестинов и эстрогенов, тиболон, паратиреоидный гормон в пульсирующем режиме.
Известно, что прогестины препятствуют имплантации и росту эндометриодных гетеротопий, избыточной пролиферации миометрия и эндометрия путем подавления экспрессии матриксных
металлопротеаз и угнетения ангиогенеза, что позволяет надеяться на их дополнительное лечебное
воздействие [1]. В качестве терапии прикрытия исследовались следующие прогестины: медроксипрогестерона ацетат (МПА), норэтиндрона ацетат (европейский эквивалент – норэтистерона ацетат), тиболон.
Продемонстрирована эффективность МПА в снижении частоты и выраженности вазомоторных симптомов и поддержании МПКТ в суточной дозе 20–30 мг в течение 6-месячного курсового приема; более длительный прием не изучался. Сравнительное исследование монотерапии агонистом ГнРГ (люкрин депо) и его комбинации с МПА в течение 24 нед подтвердило снижение частоты и интенсивности таких гипоэстрогенных побочных эффектов агониста ГнРГ, как приливы, вагинальная сухость, потеря МПКТ, а также болевого симптома эндометриоза на фоне сочетанной терапии при сохранении негативной гипоэстрогенной симптоматики в группе женщин, получавших только агонист ГнРГ [18]. Недостаточный эффект МПА наблюдался в отношении защиты костной ткани.
Недостаточный эффект МПА наблюдался в отношении защиты костной ткани.
Ежедневное применение норэтиндрона ацетата – прогестина, производного 19-нортестостерона – в суточных дозах 1,4–10 мг одновременно с агонистом ГнРГ в течение 24 нед приводило к подавлению боли, связанной с эндометриозом, и прогрессированию заболевания. Повышение доз норэтиндрона ацетата способствовало положительной динамике оценки приливов и препятствовало уменьшению МПКТ на протяжении 48 нед лечения [35].
Эффект прогестинов в отношении вазомоторных симптомов и особенно сохранения костной ткани
дозозависим. Преодолеть недостаточный потенциал в отношении потери МПК можно дополнительным использованием бисфосфонатов.
В целях предотвращения гипоэстрогенных побочных реакций и продления курса медикаментозного лечения эндометриоза проводилось расширенное проспективное рандомизированное клиническое исследование варианта «вспомогательной терапии» длительностью более 48 нед – комбинация циклического приема этидроната натрия и низких доз норэтиндроната с аГнРГ (люкрином депо). Лечение оказалось клинически эффективным в плане купирования нежелательных гипоэстрогенных явлений. Органический бисфосфонат этидронат натрия в дозе 400 мг/сут в течение 14 дней при чередовании в циклическом режиме с карбонатом кальция 500 мг/cут в течение 42 дней с минимальными побочными эффектами ингибирует активность остеокластов и снижает риск развития остеопороза [24].
Лечение оказалось клинически эффективным в плане купирования нежелательных гипоэстрогенных явлений. Органический бисфосфонат этидронат натрия в дозе 400 мг/сут в течение 14 дней при чередовании в циклическом режиме с карбонатом кальция 500 мг/cут в течение 42 дней с минимальными побочными эффектами ингибирует активность остеокластов и снижает риск развития остеопороза [24].
Чередование приема этидроната натрия с карбонатом кальция последовательно повторялось
в течение 6 мес исследования. Пациенты также получали перорально 2,5 мг/сут норэтинодроната
[34]. Этот вариант циклического приема приводит к выраженной супрессии резорбции кости и может
представлять собой идеальный подход для резистентных пациентов, которым требуется длительное
медикаментозное лечение эндометриоза, он обеспечивает терапевтическую эффективность с одновременным улучшением самочувствия пациента при безопасности комплекса терапии.
Недостатком применения высоких доз прогестинов в качестве терапии прикрытия является их потенциальное неблагоприятное влияние на липидный профиль. В рандомизированном двойном слепом исследовании продолжительностью 48 нед прием 2,5 мг/сут норэтиндрона ацетата совместно с депопрепаратом лейпрорелина ацетата и органическим бисфосфонатом приводил к снижению циркулирующих уровней холестерина липопротеидов высокой плотности при отсутствии значимых изменений соотношения холестерина липопротеидов низкой и высокой плотности. В группе пациентов, получавших 10 мг норэтиндрона ацетата, было отмечено повышение данного соотношения в 2 раза [25]. Хотя клиническое значение этих данных полностью не определено, устранение таких неблагоприятных изменений липидного профиля, несомненно, является желательным.
В рандомизированном двойном слепом исследовании продолжительностью 48 нед прием 2,5 мг/сут норэтиндрона ацетата совместно с депопрепаратом лейпрорелина ацетата и органическим бисфосфонатом приводил к снижению циркулирующих уровней холестерина липопротеидов высокой плотности при отсутствии значимых изменений соотношения холестерина липопротеидов низкой и высокой плотности. В группе пациентов, получавших 10 мг норэтиндрона ацетата, было отмечено повышение данного соотношения в 2 раза [25]. Хотя клиническое значение этих данных полностью не определено, устранение таких неблагоприятных изменений липидного профиля, несомненно, является желательным.
Возможно также применение других лекарственных средств, например, тиболона, оказывающего эстрогеноподобное действие без повышения пролиферативного потенциала гормонозависимых тканей [31]. Именно тиболон, прогестаген с комбинированным, благодаря образованию
периферических метаболитов, эстрогенным, прогестагенным и андрогенным действием, приобрел наибольшую популярность как препарат для терапии прикрытия. Подтверждена возможность
Подтверждена возможность
безопасного использования тиболона, не снижающего эффективность терапии агонистами ГнРГ.
Однако, не умаляя значение тиболона для терапии прикрытия, следует признать, что он не имеет
доказанных преимуществ перед комбинированными монофазными эстрогенпрогестагенными препаратами.
В 12-месячном многоцентровом проспективном рандомизированном двойном слепом исследовании пациентки получали депонированную форму лейпрорелина ацетата в дозе 3,75 мг внутримышечно каждые 4 нед плюс одну из четырех комбинаций терапии прикрытия: плацебо (группа А), норэтиндрона ацетат 5 мг/сут и плацебо вместо эстрогена (группа В), норэтиндрона ацетат 5 мг/сут плюс конъюгированные эстрогены 0,625 мг/сут (группа С), а также норэтиндрона ацетат 5 мг/сут плюс конъюгированные эстрогены 1,25 мг/сут (группа D). Независимо от дозы эстрадиола в препарате тазовая боль имела одинаковую динамику снижения интенсивности во всех четырех группах. Вазомоторные симптомы были меньше выражены в группах пациенток, получавших терапию прикрытия. Снижение МПКТ от исходного уровня наблюдалось преимущественно в группе изолированного приема агониста ГнРГ. Таким образом, все виды терапии прикрытия уменьшали выраженность побочных симптомов без влияния на эффективность основного лечения. Тем не менее наблюдались тенденция лучшей динамики симптомов эстрогенного дефицита у женщин, принимавших
Снижение МПКТ от исходного уровня наблюдалось преимущественно в группе изолированного приема агониста ГнРГ. Таким образом, все виды терапии прикрытия уменьшали выраженность побочных симптомов без влияния на эффективность основного лечения. Тем не менее наблюдались тенденция лучшей динамики симптомов эстрогенного дефицита у женщин, принимавших
эстрогены, и одновременно меньший эффект снижения тазовой боли при приеме 1,25 мг конъюгированных эстрогенов [20].
Для увеличения чувствительности гормонозависимых тканей к половым стероидам предложен новый режим продолжительной терапии прикрытия эстрогенами и прогестероном в пульсовом режиме. Этот режим представляет собой пероральное введение 1 мг микронизированного эстрадиола ежедневно и 0,35 мг норэтиндрона ежедневно в течение 2 дней, перемежающееся с 2 днями приема эстрогена без прогестина [17]. Положительный опыт (уменьшение гипоэстрогенных побочных эффектов) применения такого режима позволяет рекомендовать низкие дозы эстрогена (1 мг) и прогестина (0,35 мг) для гормональной терапии прикрытия с прекрасными терапевтическими результатами. Эта комбинация эффективна в поддержании МПКТ при совместном введении с агонистами ГнРГ до 32 мес при лечении боли, ассоциированной с эндометриозом [32].
Эта комбинация эффективна в поддержании МПКТ при совместном введении с агонистами ГнРГ до 32 мес при лечении боли, ассоциированной с эндометриозом [32].
В других работах изучали использование низких доз эстрогена, применяемых в традиционном лечении постменопаузальных расстройств в виде заместительной гормональной терапии (ЗГТ), как терапию прикрытия. В 6-месячном исследовании оценивали эффекты агонистов ГнРГ в сочетании с низкой либо средней дозой конъюгированных эстрогенов (0,3 или 0,625 мг) и с параллельным приемом медроксипрогестерона в дозировке 5 мг в день. Симптомы оценивали по балльной системе в течение 24 нед. В группе без терапии прикрытия у пациенток наблюдалось больше побочных реакций. Агонист ГнРГ (люкрин депо) в сочетании с ЗГТ был так же эффективен в облегчении тазовой боли при эндометриозе, как и изолированный прием агониста ГнРГ. Эстрогенгестагенная комбинация препятствовала снижению МПКТ и развитию побочных эффектов, таких как приливы и сухость влагалища, связанные с терапией ГнРГ [33].
Отсутствие пролиферативного эффекта при назначении монофазных эстрогенгестагенных препаратов подтверждено клиническими исследованиями в постменопаузе [3], следовательно, для терапии прикрытия целесообразно назначать низкодозированные (1 мг эстрадиола) комбинированные монофазные препараты. Одним из наиболее приемлемых вариантов терапии прикрытия с помощью перепаратов заместительной гормональной терапии является фемостон 1/5 (неопубликованные данные).
Еще одним перспективным направлением является использование в качестве терапии прикрытия низкодозированных комбинированных оральных контрацептивов [11]. При использовании орального контрацептива, содержащего 30 мкг этинилэстрадиола и 0,15 мкг дезогестрела, одновременно с 6-месячным курсом приема лейпрорелина ацетата отмечено предотвращение развития гипоэстрогенных побочных реакций. Исключение составила головная боль, частота и выраженность которой при использовании комбинированных оральных контрацептивов и плацебо не различались.
Перечисленные гормональные методы терапии прикрытия далеко не исчерпывают весь спектр ее возможностей. На сегодняшний день главным нерешенным вопросом этой проблемы является дифференцированный подбор варианта терапии прикрытия при различных заболеваниях и различном исходном статусе больной. Очевидно, что терапия прикрытия может играть двойную роль, обеспечивая минимизацию побочных эффектов агонистов ГнРГ и положительно влияя на течение основного заболевания. Разработка новых схем и режимов терапии прикрытия может улучшить
исходы лечения пролиферативных гормонозависимых заболеваний.
1. Адамян Л.В., Ткаченко Э.Р., Киселев С.И. и др. Современные методы диагностики и альтернативные методы лечения гиперпластических процессов и опухолей матки//Практическая гинекология (клинические лекции). – М.:МЕДпресс-информ, 2001. ‒ С. 89‒115.
2. Баскаков В.П., Цвелев Ю.В., Кира Е.Ф. Эндометриоидная болезнь. – СПб: Издательство Н-Л, 2002.
3. Гасанова С.Х., Минасян Л.С., Зайдиева Я. З. и др. Низкодозированная непрерывная гормонотерапия:
З. и др. Низкодозированная непрерывная гормонотерапия:
характеристика эндометрия и профиль кровотечений // Акуш. и гин. – 2007. – № 4. – С. 19–24.
4. Герасимов А.М. Одно из звеньев патогенеза бесплодия при наружном генитальном эндометриозе// Пробл. репрод. – 2004. – № 4. – С. 35–39.
5. Ермолова Н.В., Орлов В.Н. Значение факторов роста в патогенезе бесплодия у пациенток с наружным генитальным эндометриозом //Высокие медицинские технологии в эндокринологии: Материалы V Всероссийского конгресса эндокринологов. – М.: АртМедиаПринт, 2006.
6. Ищенко А.И., Кудрина Е.А. Эндометриоз. Современные аспекты. – М., 2008. – С. 21–28, 70–76.
7. Кузнецова И.В. Возможности консервативной терапии сочетанной патологии тела матки: Материалы 3-го Международного науч. конгресса «Новые технологии в акушерстве и гинекологии» //Журн. акуш. и жен. бол. – 2007. – Спец. выпуск. – С. 126.
8. Кира Е.Ф., Ермолинский И.И., Мелько А.И. Эндометриоидная болезнь. Современные принци-
пы лечения //Гинекология. – 2004. – Т. 6, № 5. – С. 19–24.
– 2004. – Т. 6, № 5. – С. 19–24.
9. Лубнин Д.М., Тихомиров А.Л. Принципы лечения миомы матки: от агонистов ГнРГ до эмболизации маточных артерий //Вопр. гин., акуш. и перинатол. – 2005. – Т. 4, № 4. – С. 76–82.
10. Сметник В.П., Тумилович Л.Г. Неоперативная гинекология. – М.: Мединформ, 2000.
11. Сперофф Л., Дарни Ф.Д. Клиническое руководство по контрацепции: пер с англ. – М.: Издательство
БИНОМ, 2009.
12. Тихомиров А.Л., Лубнин Д.М. Патогенетическое обоснование применения агонистов ГнРГ в терапии сочетанной гинекологической патологии// Вопр. гин., акуш. и перинатол. – 2006. – Т. 5, № 1. – С. 82–87.
13. Ушакова Е.Л. Применение Люкрина депо при эндометриозе, миоме матки и других заболеваниях //Бесплодный брак: Руководство для врачей/ Под ред. В.И.Кулакова. – М.: ГЭОТАР–Медиа, 2005. – С. 30–37.
14. Чернуха Г.Е., Сухих Г.Т., Сметник В.П. и др. Состояние процессов пролиферации в гиперплазированной ткани эндометрия у женщин репродуктивного возраста//Пробл. репрод. – 2004. – № 4. – С. 30–34.
– 2004. – № 4. – С. 30–34.
15. Attar E., Bulun S.E. Aromatase and other steroidogenic genes in endometriosis: translation aspects// Hum. Reprod. Update. – 2006. – Vol. 12. – Р. 49–56.
16. Bulun S.E., Yang S., Fang Z. et al. Role of aromatase in endometrial disease// J. Steroid. Biochem. Mol. Biol. – 2001. – Vol. 79. – Р. 19–25.
17. Casper RF. Estrogen with interrupted progestin HRT: a review of experimental and clinical studies/ Maturitas. – 2000. – Vol. 34. – P. 97–108.
18. Cedars M., Lu K., Meldrum D.R. et al. Treatment of endometriosis with a long-acting gonadotropin-releasing hormone agonist plus medroxyproges-terone acetate//Obstet. Gynecol. – 1990. – Vol. 75. – P. 641–645.
19. Giudice L.C., Kao L.C. Endometriosis. – Lancet. – 2004. – Vol. 364. – P. 1789–1799.
20. Hornstein M.D., Surrey E.S., Weisberg G.W. et al. Leuprolide acetate depot and hormonal add-back in endometriosis: A 12-month study. Lupron Add-Back Study Group// Obstet. and Gynecol. – 1998. – Vol. 91, № 1. – Р. 16–24.
91, № 1. – Р. 16–24.
21. Lessey B.A. Medical management of endometriosis and infertility// Fertil. and Steril. – 2000. – Vol. 73. – P. 1089– 1096.
22. Lethaby A., Vollenhoeven B., Sowter M. Preoperative GnRHanalogue therapy before hysterectomy or myomectomy for uterinefibroids// Cochrane Database Syst. Rev. – 2001. – Vol. 2. – CD000547.
23. Luo X., Xu J., Chegini N. Gonadotropin releasing hormone analogue (GnRHa) alters the expression and activation of smad in human endometrial epithelial and stromal cells//Reprod. Biol. Endocrinol. – 2003. – Vol. 16, № 1. – P. 125.
24. Lundon K.M., Jayo M.J., Register T.C. et al. The effect of androstenedione/estrone supplementation on cortical and cancellous bone in the young intact female monkey: a model for the effects of polycystic ovarian disease on the skeleton? //Osteoporos Int. – 2000. – Vol. 11. – P. 778–779.
25. Lindgren R., Berg G., Hammar M. et al.. Plasma lipid and lipoprotein effects of transdermal administration of estradiol and estradiol norethindrone acetate// Eur. J. Obstet. Gynecol. – 1992. – Vol. 47. – P. 213–221.
J. Obstet. Gynecol. – 1992. – Vol. 47. – P. 213–221.
26. Marsden D.E., Hacker N.F. Optimal management of endometrial hyperplasia //Best. Pract. Res. Clin. Obstet. Gynecol. – 2001. – Vol. 15, № 3. – P. 393–405.
27. Mitwally M.F., Gotlieb L, Casper R.F. Prevention of bone loss and hypoestrogenic symptoms by estrogen and interrupted progestogen add-back in long-term GnRHagonist down-regulated patients with endometriosis and premenstrual syndrome//Menopause. – 2002. – Vol. 9. – P. 236–241.
28. Nothnick W.B. Treating endometriosis as an autoimmune disease// Fertil. and Steril. – 2001. – Vol. 76. – P. 223–229.
29. Paoletti A.M., Serra G.G., Cagnacci A. et al. Spontaneous reversibility of bone loss induced by gonadotropinreleasing hormone analog treatment// Fertil. and Steril. – 1996. – Vol. 65. – P. 707–710.
30. Pickersgill A. GnRH agonists and add-back therapy: is there a perfect combination? //Brit. J. Obstet. Gynaecol. – 1998. – Vol. 105. – P. 475–485.
31. Palomba S. , Affinito P., Di Carlo C. et al.Long-term administration of tibolone plus gonadotropin-releasing
, Affinito P., Di Carlo C. et al.Long-term administration of tibolone plus gonadotropin-releasing
hormone agonist for the treatment of uterine leiomyomas: effectiveness and effects on vasomotor symptoms, bone mass, and lipid profiles //Fertil. and Steril. – 1999. – Vol. 72. – P. 889–895.
32. Peeyananjarassri K., Baber R. Effect osoflowdose hormone therapy on menopausal symptoms, onemineraldensity, endometrium, and the cardiovascularsystem: are view of randomized clinicaltrails //Climacteric. ‒ 2005. ‒ Vol. 23. ‒ P. 16‒24.
33. Rossouw J.E., Anderson G.L., Prentice R.L. et al. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results From the Women’s Health Initiative randomized controlled trial// J.A.M.A. –2002. – Vol. 288. – P. 321–333.
34. Surrey E.S., Voigt B., Fournet N. et al. Prolonged gonadotropinreleasing hormone agonist treatment of symptomatic endometriosis: The role of cyclic sodium etidronate and low-dose norethindrone «add-back» therapy //Fertil. and Steril. – 1995. – Vol. 63. – P. 747–755.
and Steril. – 1995. – Vol. 63. – P. 747–755.
35. Surrey E.S., Gambone J.C., Lu J.K. at al. The effects of combining norethindrone with a gonadotropin-releasing + hormone agonist in the treat-ment of symptomatic endometriosis // Fertil. and Steril. – 1990. – Vol. 53, № 4. – Р. 620–626.
36. Sinaii N., Cleary S.D., Ballweg M.L. et al. High rates of autoimmune and endocrine disorders, fibromyalgia, chronic fatigue syndrome and atopic dise-ase among women with endometriosis: a survey analysis// Hum. Reprod. – 2002. – Vol 17. – P. 2715–2722.
37. Van Kaam K. J. A. F., Romano A., Schouten J.P. et al. Progesterone receptor polymorphism +331G/A is associated with a decreased risk of deep infiltrating endometriosis//Hum. Reprod. – 2007. – Vol. 22, № 1. – Р. 129–135.
38. Witz C., Thomas M., Montoya-Rodriguez I. et al. Shortterm culture of peritoneum explants confirms attachment of endometrium to intact perito-neal mesothelium// Fertil. and Steril. – 2001. – Vol. 75. – P. 385–390.
 акушерства и гинекологии педиатрического фак-та ГОУ ВПО Российская медицинская академия последипломного образования; ГКБ № 23 им. Медсантруд
акушерства и гинекологии педиатрического фак-та ГОУ ВПО Российская медицинская академия последипломного образования; ГКБ № 23 им. МедсантрудАдрес: 109240, Москва, ул. Яузская, д. 11
Телефон: 786-45-22
E-mail: [email protected]
Мое путешествие в ад и обратно автора Грег Стайдель
Перейти к содержимомуПредыдущий Следующий
- Посмотреть увеличенное изображение
В 2003 году мне было около 20 лет. Я весил 150 фунтов и был в феноменальной форме. У меня не было проблем со спиной, и я вел нормальный образ жизни.
Однажды я занимался ландшафтным дизайном в доме моих родителей и решил стать настоящим суперменом, создавая каменную лестницу. Я был на нижней ступени и знал, что мне нужна большая база. Поэтому я выбрал камень, который был слишком тяжелым, и решил просто пойти на это. Именно тогда я услышал поп. Первая поп-музыка, которая меняет нашу жизнь как страдающих от болей в спине.
Я немедленно перешел в режим кренделя и начал ходить криво (мы все знаем эту походку, когда ты наклоняешься в одну сторону, как парень из старой рекламы V-8, потому что ты только что нанес серьезный ущерб). Вы всегда помните свою первую грыжу диска, потому что все восходит к ней.
Через пять дней после постельного режима я полностью вернулся к нормальной жизни. Но несколько лет спустя, в 2005 году, во время одной из моих ежедневных пробежек я почувствовал напряжение в ягодичных мышцах и нижней части спины. Меня это бесило. Поэтому я сделал то, что делают многие люди, и пошел к мануальному терапевту.
Костопрактик дал мне то, что мы все получили: нормальное лечение плюс упражнения на растяжку этих групп мышц. Конечно, ничего из этого не сработало. Грустно то, что, оглядываясь назад, это была такая минутная, излечимая боль. Но, конечно, когда вы новичок в этом, вы этого не понимаете. Вы просто хотите, чтобы это исчезло.
Мой следующий визит к мануальному терапевту прошел не так хорошо. Используя силу гигантского тяжелоатлета/военного врача (которым он и был), он так сильно толкнул меня в поясницу, что причинил мне сильнейшую боль, какую только можно вообразить. Я закричала так громко, что пациенты и персонал в приемной встали. Я знаю это, потому что моя мама ждала меня там.
Используя силу гигантского тяжелоатлета/военного врача (которым он и был), он так сильно толкнул меня в поясницу, что причинил мне сильнейшую боль, какую только можно вообразить. Я закричала так громко, что пациенты и персонал в приемной встали. Я знаю это, потому что моя мама ждала меня там.
Я мало что помню из этого, но она вбежала, и мануальный терапевт заставил меня стоять на коленях в инвалидном кресле, полностью скрученным, так что я смотрел боком, колени прижаты к спине, потому что это был единственный способ, которым я мог быть, не потеряв сознание . Он сильно разорвал мой диск и оставил мне подарок… Cauda Equina. Потрясающий соус.
Стоящий врач, которым он был, затем заставил мою маму развернуться, чтобы меня можно было вкатить в гараж через заднюю дверь, чтобы его пациенты не увидели, что он со мной сделал. Несколько часов спустя я был в экстренной хирургии, где нейрохирург делал ламинэктомию. Я мог быть парализован ниже пояса.
Я проснулась от этого ощущения свободы, будто все вернулось на круги своя. Но мой последующий визит к нейрохирургу был не тем, что я хотел услышать. — У тебя будут проблемы на всю оставшуюся жизнь. Больше никакого бега, никакого тенниса, ни того, ни того». Никто не собирался мне этого говорить.
Но мой последующий визит к нейрохирургу был не тем, что я хотел услышать. — У тебя будут проблемы на всю оставшуюся жизнь. Больше никакого бега, никакого тенниса, ни того, ни того». Никто не собирался мне этого говорить.
После восстановления после операции я продолжал жить своей жизнью. Целых два месяца. Затем, среди прочего, начались удары в спину, удары молнии и болезненное сидение. Это было не так уж плохо, подумал я, просто когда-нибудь это закончится. К сожалению, это также привело меня к менталитету «у меня больная спина, я не могу сделать X». Поэтому я стал намного менее активным. Мне было 27, и я уже был морально побежден, хотя еще не осознавал этого.
Это начало реальной части программы. Жить с этим дерьмом. Я много сидел, много ложился, мало участвовал, работал на работе. Я много «проваливал» диски, много пил и начал свой опиоидный путь. AKA каждый врач в Америке справляется с неудачной операцией на спине. У них должен быть справочник, потому что я падал прямо на каждой ступеньке. Когда у меня был приступ, это были две недели в постели, несколько дополнительных таблеток, и я обычно снова вставал на ноги… ну, в любом случае, достаточно, чтобы делать то, что мне нужно. Жить в боли — отстой, и ты забываешь, что значит жить без нее.
Когда у меня был приступ, это были две недели в постели, несколько дополнительных таблеток, и я обычно снова вставал на ноги… ну, в любом случае, достаточно, чтобы делать то, что мне нужно. Жить в боли — отстой, и ты забываешь, что значит жить без нее.
Этот образ жизни с вращающимися дверями продолжался в течение следующего десятилетия. Я набрал 50 фунтов, и моя жизнь состояла из работы, постели и бара несколько вечеров в неделю, чтобы заглушить боль. И много таблеток. Я еженедельно проводил сеансы Airrosti и каждую неделю обращался к мануальному терапевту. Да, Airrosti каждую неделю в течение пяти лет подряд — я, безусловно, их самый постоянный клиент в США! Я боялся всего остального. И я действительно убедил себя, что это нормально.
Затем произошел сбой. В июне 2021 года у меня случился приступ. Поэтому я сделал то, что делал всегда: лег, принял лекарства и стал ждать. За исключением того, что он никогда не исчезал. Стало хуже. У меня был сеанс с практиком нежной йоги, моим Airrosti и еженедельником Chiro. Наряду с несколькими сильнодействующими лекарствами, к которым я теперь так привык, что отказаться от них было невозможно. Я буквально застрял.
Наряду с несколькими сильнодействующими лекарствами, к которым я теперь так привык, что отказаться от них было невозможно. Я буквально застрял.
Мои мышцы перестали работать. Меня приходилось нести и класть на заднее сиденье лежа, чтобы идти куда угодно. Я ходил к каждому типу документов в книге для этого… они все говорили одно и то же (включая мой PT)… «Вы попали в серую зону, которую наука/медицина не догнала». Опять же, круто.
Темные месяцы, молившиеся об этом, стали еще темнее. День за днем пробираюсь в ванную и обратно в постель. Отличный способ жить. Я просто хотел вернуть свою прежнюю жизнь (ту, где я еще ни хрена не делал, но хотя бы мог работать). Поэтому мой врач по обезболиванию порекомендовал стимулятор спинного мозга. То, что она назвала «последним вздохом, это все, что осталось сделать». Испытание было запланировано на ноябрь, а полная имплантация — на начало декабря.
Я так сильно хотел, чтобы это сработало, что сказал им, что испытание сработало, потому что снова хотел верить, что оно сработает… и что мне нужно дать ему шанс. Но это не так. Ничего этого не было. Я потратил 100 тысяч долларов на медицинские услуги в 2021 году, и ничего из этого не вышло.
Но это не так. Ничего этого не было. Я потратил 100 тысяч долларов на медицинские услуги в 2021 году, и ничего из этого не вышло.
Наступил январь. Я начал думать о других вариантах, например, о выписке (не в первый раз это пришло мне в голову во время этого испытания, но мое тело поддерживало меня в этом). Я больше не собирался так жить. Если мои родители приходили, они должны были просто сидеть рядом с моей кроватью и есть на подносе. Если бы я встал, мое правое бедро не поддерживало бы меня, поэтому меня пришлось нести.
Все было болью. Не было никаких планов на ужин, планов на отпуск или вообще каких-либо планов. Кровать. Вот оно. Я наклонился вправо так сильно, что только для того, чтобы встать на унитаз, понадобился лишний человек. Я закончил. Я сдался. В последние несколько месяцев я разминал правое бедро каждые пять минут, просто чтобы получить хоть какое-то облегчение. Мои сгибатели бедра нарастали узлами.
Все это время я искал что-нибудь, что-нибудь, чтобы помочь. Я читал бесчисленное количество статей и смотрел бесконечные видеоролики на YouTube о том, как исправить свое состояние, и ничего из этого не помогло. Некоторые сделали еще хуже. И вот однажды в феврале все изменилось. Я наткнулся на видео Сары под названием «Почему растяжка не работает». Одно название пело мне. Видео тоже имело смысл, но опять же, многие из них имели смысл. Надежды больше не было у меня.
Я читал бесчисленное количество статей и смотрел бесконечные видеоролики на YouTube о том, как исправить свое состояние, и ничего из этого не помогло. Некоторые сделали еще хуже. И вот однажды в феврале все изменилось. Я наткнулся на видео Сары под названием «Почему растяжка не работает». Одно название пело мне. Видео тоже имело смысл, но опять же, многие из них имели смысл. Надежды больше не было у меня.
Но все остальное я пробовал. Итак, почему бы и нет… Хуже, чем я уже был, быть не может. Я нашел видео Arch & Flatten и Iliopsoas на странице Центра соматических движений на YouTube. После выполнения каждого из них несколько раз моя боль в бедре, только одна из многих болей, ушла на ЧАСЫ. Я немедленно заказал курс первого уровня.
Через несколько дней все стало настолько хорошо, что я даже не могу это описать. И это была не просто боль. Я был спокоен. Раньше я был воспаленной развалиной. Одни только пятнадцать минут Arch & Flatten привели меня в состояние дзен. Это то, чего йога никогда не делала. Я почувствовал надежду. Я чувствовал себя непринужденно. Всего семь, точно семь, через несколько недель я могу сказать, что мне 9.5 процентов безболезненно, а остальные, я знаю, скоро исчезнут.
Я почувствовал надежду. Я чувствовал себя непринужденно. Всего семь, точно семь, через несколько недель я могу сказать, что мне 9.5 процентов безболезненно, а остальные, я знаю, скоро исчезнут.
Мое тело так сильно изменилось. Я чувствую то, чего не чувствовал десятилетиями. Например, как ДОЛЖНА ощущаться ходьба. Или сидя. Или садясь. Или стоя. Я мог бы продолжить. Мой врач по обезболиванию даже не стал делать мне инъекции в триггерные точки, когда я только что увидел ее, потому что они мне были не нужны. Она была поражена тем, как двигались мои мускулы. Мой мануальный терапевт понятия не имеет, как я вернул себе правильную осанку и почему меня так легко приспособить сейчас, или, должен сказать, как легко мое тело принимает манипуляции. Мне не понадобится ни одна из этих вещей в ближайшее время, и я знаю это сейчас.
Моя жена не может поверить в то, что произошло, или в то, что я теперь такой прямой. Моя мать заметила, что я, кажется, выросла… слезы, которые текут по ее лицу из-за того, что ее ребенок больше не испытывает боли, заставляют меня работать еще усерднее и тренироваться еще усерднее. И я практикуюсь… потому что А) ЭТО НА САМОМ ДЕЛЕ РАБОТАЕТ и Б) Мне очень нравится то, как я себя чувствую.
И я практикуюсь… потому что А) ЭТО НА САМОМ ДЕЛЕ РАБОТАЕТ и Б) Мне очень нравится то, как я себя чувствую.
Два месяца назад я боялся пятиминутной поездки в аэропорт, потому что если бы я села, то испытала бы сильную боль. Десять дней назад я съездил в Мехико, и у меня не было серьезных проблем. Чудо. Это единственный способ описать Сару и Центр соматических движений. Я заказал второй уровень, но на самом деле сосредоточился на совершенствовании всех упражнений первого уровня, прежде чем начать.
Я не знаю, чем все это закончится, но я знаю, что вернул себе жизнь. Я могу только представить, как я буду себя чувствовать через несколько недель/месяцев. От всего сердца и от всей моей семьи спасибо, Сара. Мы/я всегда будем в долгу перед вами.
Верхнее число показывает, насколько сильно латерально смещен позвоночник (смещен в сторону). За шесть месяцев позвоночник Грега сместился с 9,17 мм в сторону всего на 0,7 мм.
Среднее число — это разница в высоте бедер. За шесть месяцев разница в высоте бедер Грега увеличилась с 10,01 мм до всего 4,34.
За шесть месяцев разница в высоте бедер Грега увеличилась с 10,01 мм до всего 4,34.
Нижнее число показывает, насколько нижняя часть таза смещена в боковом направлении. За шесть месяцев таз Грега сместился с 15,29 мм до 11,68 мм.
Сара Уоррен — сертифицированный преподаватель клинической соматики, зарегистрированный преподаватель соматического движения и владелица Центра соматического движения. Она помогла людям с такими заболеваниями, как хронические боли в спине, шее и плечах, бедрах и коленях, радикулит и сколиоз, избавиться от боли, практикуя метод клинического соматического обучения Томаса Ханны. Уоррен — автор книги Секрет облегчения боли , в котором объясняется, почему изученные мышечные модели приводят к хронической боли и дегенерации, и как клиническая соматика переучивает нервную систему, облегчая многие распространенные болевые состояния.
Ссылка для загрузки страницы Перейти к началуУстройства, предназначенные для облегчения боли, вызывают травму
- Exclusive
- National
- Science
Это было опубликовано 1 год назад
Автор: Liam Mannix
, зарегистрируйтесь или подпишитесь, чтобы сохранять статьи на потом.
Сохранение статей на потом
Добавляйте статьи в сохраненный список и возвращайтесь к ним в любое время.
РекламаЛечение стоимостью 35 000 долларов, основанное на передовых медицинских технологиях, которое накачивает электрические импульсы в позвоночник пациентов с хроническими болями в спине, приводит к недержанию мочи, неспособности ходить или, в некоторых случаях, к смерти.
Расследование Эпоха и The Sydney Morning Herald сообщает, что стимуляторы спинного мозга или операции по их установке привели к 520 серьезным осложнениям, о которых сообщается в Администрацию терапевтических товаров, хотя производители устройств утверждают, что терапия доказала свою эффективность безопасно и эффективно.
Адам Янг со стимулятором спинного мозга. Авторы и права: Пол Харрис
«Эти устройства дороги, инвазивны, вызывают проблемы и часто удаляются», — сказала Кейтлин Джонс, исследователь из Сиднейского университета, которая в этом месяце опубликовала анализ осложнений, связанных со стимуляторами.
«Данные по безопасности ужасны, особенно если учесть, что мы не уверены, эффективно ли лечение. Использование методов лечения, эффективность которых неясна, но существует значительный вред, — это идеальный шторм».
Стимуляторы спинного мозга представляют собой небольшие компьютеры, подключенные к нервам, спинному или головному мозгу, используемые в основном для лечения болей в спине и хронических болей. Терапия предназначена для работы с использованием мягких электрических импульсов для маскировки или прерывания болевых сигналов до того, как они достигнут мозга.
Число австралийцев, участвующих в операции, выросло с 1355 в 2008–2009 годах до 4433 в 2016–2017 годах, и прогнозируется, что к 2030 году быстрорастущая отрасль будет стоить 5 миллиардов долларов США (7 миллиардов австралийских долларов) во всем мире.
Между В июле 2012 г. и январе 2019 г. Управление терапевтических товаров получило 520 сообщений о серьезных травмах, связанных со стимуляторами спинного мозга. Согласно анализу, проведенному г-жой Джонс, 79% были тяжелыми и 13% опасными для жизни. Около 83 процентов случаев потребовали хирургического вмешательства для исправления.
Согласно анализу, проведенному г-жой Джонс, 79% были тяжелыми и 13% опасными для жизни. Около 83 процентов случаев потребовали хирургического вмешательства для исправления.
The Age и Вестник запросили комментарий у основных производителей стимуляторов. Только Boston Scientific ответила, что стоит за «безопасностью, качеством и эффективностью» своих устройств, которые «подкреплены надежными данными клинических испытаний и реальными доказательствами».
РекламаНик Кристелис, президент Общества нейромодуляции Австралии, говорит, что устройства сопряжены лишь с «незначительным риском».
«Сегодня, благодаря новым технологиям, мы можем рассчитывать на 80-процентный контроль над болью и более», — сказал доктор Кристелис.
Исследования, показывающие более высокий уровень осложнений, были основаны на старых устройствах, и анестезиологи лучше устанавливали их сейчас, сказал он.
«Коэффициент осложнений составляет примерно один к 10 в течение срока службы устройства, что может быть чем угодно: от легкого дискомфорта в месте, где находится батарея, до полномасштабной инфекции, требующей удаления».
Адам Янг получил стимулятор для лечения болей в спине, вызванных выпадением двух межпозвонковых дисков. Устройство стоимостью 40 000 долларов теперь живет в его шкафу.
«Это просто пустая трата времени и абсолютная трата денег», — сказал он The Age и Herald.
Шрам на спине Адама Янга Предоставлено: Пол Харрис
«Это должно было помочь мне во всех отношениях. И все же я не мог ходить в нем. Я не мог ходить 20 минут. Такое ощущение, что это задевало и другие нервы. Я пытался лечь с ним в постель и просто ворочался. Какие бы настройки у меня не были. Поэтому мне пришлось отключить его.
«Не делай этого. Сначала исчерпайте все возможные пути.
Майкл Джонсон, президент Общества позвоночника Австралии в период с 2018 по 2020 год, сказал The Age и Herald , что он призывает к созданию регистра стимуляции позвоночника в Австралии, чтобы контролировать, насколько хорошо устройства действительно работают, и сколько вреда они причинили.
«Я думаю, что небольшое количество стимуляторов введено не по назначению», — сказал он. «За последний год я прооперировал трех человек… достал стимулятор и выбросил его в мусорное ведро. Это довольно существенная инвестиция, чтобы просто выбросить ее в мусорное ведро. И ни один из этих людей не получил заключения спинального хирурга».
Лорен Якобуччи сначала почувствовала облегчение от своего стимулятора. Но потом, после падения, она почувствовала, как электроды вышли из ее позвоночника.
«Мне сделали операцию по фиксации электродов, а потом они опять сместились. Через месяц после той операции мне сделали еще одну операцию, чтобы исправить их снова. И тогда рана просто не заживала. Он просто продолжал открываться, и провода просто протыкали мою кожу».
Миссис Якобуччи перенесла в общей сложности шесть операций, прежде чем сдалась и потребовала удалить устройство. «Это было ужасно. Я не могу это описать. Только недавно я начал переваривать то, через что я прошел.
«Но пусть моя история вас не смущает. Я думаю, что это редкое явление. Это могло бы работать очень хорошо для них, и быть действительно хорошим вариантом. Но углубитесь в это, проведите исследование, потому что это не просто исправление».
«Не делай этого. Сначала исчерпайте все возможные пути».
Адам Янг
Согласно данным, полученным The Age и Herald в ответ на заявление о свободе информации, история миссис Якобуччи не является чем-то необычным.
В Америке стимуляторы спинного мозга занимают третье место по количеству сообщений о травмах от медицинских устройств, поступивших в Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США.
В Австралии производители устройств обязаны уведомлять TGA о серьезных нежелательных явлениях и подозрениях, но не уверенных, что травма была вызвана медицинским устройством или операцией по его введению. Некоторые события могут быть просто случайными, например, у пациента случился инсульт во время операции.:max_bytes(150000):strip_icc()/breast-cancer-radiation-methods-430554-7a72a3ce05e244aba75360a3248b6f15.png)
Однако реальное количество событий может быть намного больше. 2019 годАнализ, проведенный собственным персоналом TGA по медицинскому оборудованию, показывает, что только 0,5% всех проблем могут быть зарегистрированы.
Среди жалоб, поступивших на ТГА, два пациента потеряли возможность пользоваться ногами до тех пор, пока стимулятор не был удален, и даже после этого они восстановили лишь частичную подвижность. Очередная потеря чувствительности в тазу. У другого была «слабость рук»; МРТ показало повреждение позвоночника. У другого подогнулись колени; они упали, ударились головой и оказались в искусственной коме.
Рентгеновский снимок, показывающий стимулятор спинного мозга Лорен Якобуччи на месте.
Некоторые пациенты длительное время страдали от недержания мочи.
У других были разрывы и проколы спинного мозга. У другого произошла утечка спинномозговой жидкости. Другой получил разрыв спинного мозга, который вызвал недержание мочи.
У одного пациента в месте операции развилась инфекция, вызвавшая полиорганную недостаточность или сепсис, что привело к их гибели. Другой перенес инсульт из-за длительного пребывания в операционной и умер.
Другой перенес инсульт из-за длительного пребывания в операционной и умер.
Кроме того, были более распространенные побочные эффекты. К ним относятся чрезмерная стимуляция, постоянное воздействие электрического тока, неэффективная стимуляция, неисправность устройства, головные боли, инфекция, боль в месте хирургического вмешательства или отсоединение электродов от позвоночника и их перемещение в теле или выступание через кожу.
Из зарегистрированных событий 296 были связаны с неисправностями устройства, при этом движение проводов электродов было наиболее распространенной проблемой; 83 процента проблем потребовали дальнейшего хирургического вмешательства. На каждые 10 имплантированных в Австралии стимуляторов приходится четыре удаления.
Некоторые пациенты решили написать напрямую в TGA о своем опыте.
«Это болезненно и неконтролируемо потрясало меня, пока я не попытался дотянуться до пульта дистанционного управления, чтобы выключить его», — написал один пациент в жалобе в TGA. Если бы он не был дома с пультом, устройство продолжало бы причинять ему «мучительную боль».
Если бы он не был дома с пультом, устройство продолжало бы причинять ему «мучительную боль».
Хирург удалил стимулятор, но боль не прошла. Более поздний рентген показал, что хирург оставил проводник, который теперь прорастал через его кожу.
«Тот факт, что люди [производителя устройства] не проявили никакого беспокойства и заставили меня чувствовать себя бесполезной морской свинкой, оставляет во мне чувство безнадежности и беспомощности в отношении моего будущего и качества жизни», — написал он в жалобе. «Пожалуйста, помогите как можно скорее».
«С тех пор, как он у меня был, у меня было шесть ревизий», — написал другой пациент. «Конечно, этого не может быть… Все эти процедуры, травмы и боль. Что мне делать? Я не знаю, с кем поговорить или получить совет. Нужна ли мне юридическая консультация?»
The Age и Herald предоставил базу данных отчетов TGA профессору Кристоферу Махеру, директору Института скелетно-мышечного здоровья и одному из ведущих мировых экспертов по боли в спине.
Профессор Махер и группа исследователей под руководством г-жи Джонс опубликовали в этом месяце анализ набора данных в Journal of Patient Safety .
Из 520 событий в базе данных команда классифицировала 93% как серьезные или опасные для жизни. Более половины из них были вызваны неисправностью самого стимулятора.
Исследователи отметили, что на каждые 100 вставленных стимуляторов приходится 31 извлекаемый.
Стимулятор Адама Янга теперь живет в шкафу. Кредит: Пол Харрис
Насколько хорошо они работают — и работают ли они вообще — остается глубоко спорным.
Кокрановский обзор 2021 года, который обычно считается золотым стандартом доказательств, пришел к выводу, что стимулятор, вероятно, не обеспечивает клинически значимого уменьшения боли по сравнению с плацебо, хотя в целом доказательства были очень низкого качества.
Стимуляторы часто имплантируют, чтобы помочь пациентам отказаться от опиоидов, но исследование более полумиллиона пациентов, опубликованное в журнале Anesthesiology в январе, обнаружило незначительную разницу в употреблении опиоидов в течение 12 месяцев.
«Люди, рассматривающие эту процедуру, должны знать, что хотя некоторые люди, получающие стимулятор, испытывают значительное облегчение боли. В настоящее время мы очень не уверены, какая часть этого облегчения обеспечивается конкретной технологией, а какая является результатом эффектов плацебо», — сказал доктор Нил О’Коннелл, исследователь из Лондонского университета Брунеля, который руководил Кокрейновским обзором.
Исследование, проведенное в 2011 году при финансовой поддержке отрасли, показало, что частота осложнений составляет 34%. Исследование показало, что у одного пациента из каждых 10 будет смещение или перелом электрода, что обычно требует хирургического вмешательства.
«Тридцать процентов для разумного человека кажутся очень высокими», — говорит доктор Крис Хейс, директор Объединенной службы боли Хантера и бывший декан австралийского факультета медицины боли.
В начале своей карьеры доктор Хейс регулярно имплантировал стимуляторы спинного мозга. Он больше не выполняет эту процедуру.
Он больше не выполняет эту процедуру.
«Мы решили, что результаты не очень хорошие. У нас было довольно много возвратов в театр. Вред пациента. Со стимуляторами электрод нередко смещается — тогда вам нужно вернуть пациента в операционную и вернуть электрод туда, где он должен быть.
«И эти устройства могут быть заражены. Мы обнаружили достаточно высокий уровень осложнений, даже пытаясь быть очень осторожными.
«Возможно, есть место для стимуляторов у очень избранных пациентов. Но мы говорим, учитывая текущие данные, что мы не предлагаем это лечение в данный момент».
Пресс-секретарь TGA заявила, что сообщения о происшествиях, связанных с использованием медицинских устройств, не обязательно означают, что устройство было виновато и стало причиной происшествия.
«Стимуляторы спинного мозга, довольно широко используемые как в Австралии, так и во всем мире, представляют собой устройства высокого риска и, как известно, имеют осложнения, связанные с их использованием», — сказала пресс-секретарь.