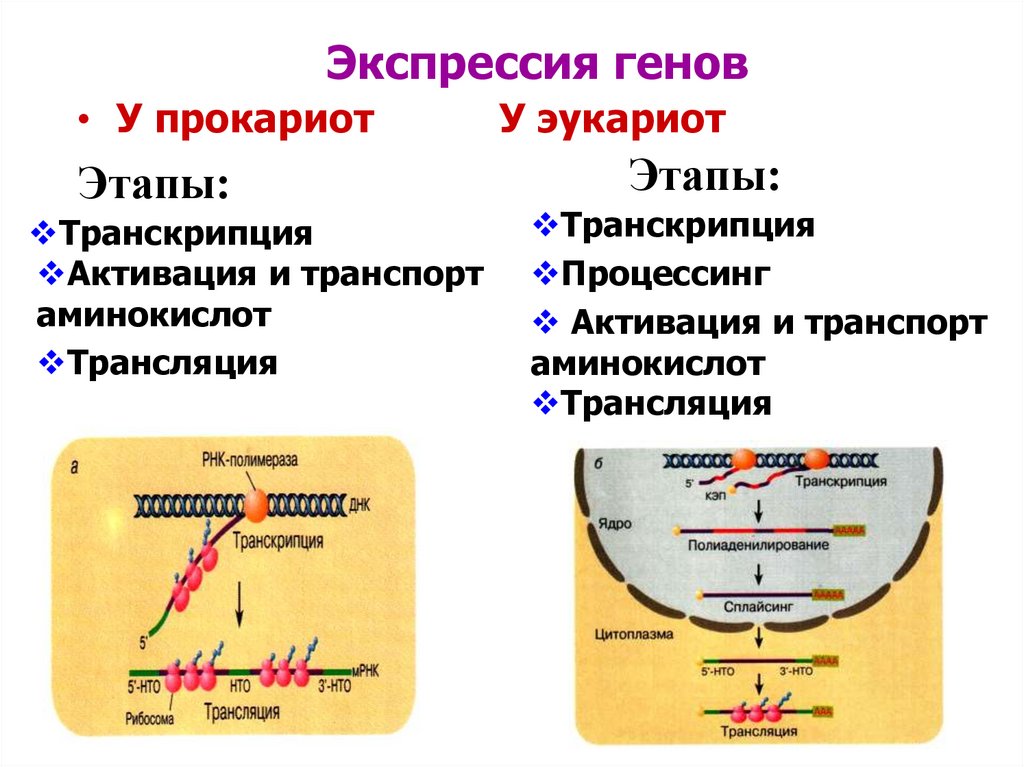
Рак предстательной железы — комплексное иммуноморфологическое исследование биоптатов предстательной железы с оценкой экспрессии AMACR (a-methylacyl-CoA racemase, P504S), цитокератинов высокого молекулярного веса (34bE12), белка p63
Метод определения
Гистологическое исследование биоптатов предстательной железы (окрашивание гематоксилином-эозином) с морфологической оценкой опухоли согласно гистологической классификации ВОЗ, определением степени злокачественности по шкале Глисона.
Иммуногистохимическое исследование с применением антител к цитокератинам высокомолекулярного веса (HMW, клон 34be12), белку р63 и альфа-метилацил-коА-рацемазе (AMACR) (пероксидазный и авидин-биотиновый методы).
Исследуемый материал парафиновый блок с биоптатами предстательной железы
Согласно требованиям п. 17 Правил проведения патолого-анатомических исследований, утв. Приказом Минздрава России от 24.03.2016 № 179н, в целях уточнения диагноза заболевания (состояния) с учетом требований стандартов медицинской помощи и клинических рекомендаций (протоколов лечения) по вопросам оказания медицинской помощи на этапе микроскопии биопсийного (операционного) материала врачом-патологоанатомом дополнительно может быть назначено проведение:
Приказом Минздрава России от 24.03.2016 № 179н, в целях уточнения диагноза заболевания (состояния) с учетом требований стандартов медицинской помощи и клинических рекомендаций (протоколов лечения) по вопросам оказания медицинской помощи на этапе микроскопии биопсийного (операционного) материала врачом-патологоанатомом дополнительно может быть назначено проведение:
- дополнительных методов окраски микропрепаратов (постановки реакции, определения) — гистохимических, иммуногистохимических, электронно-микроскопических, молекулярно-биологических, генетических и иных методов;
- дополнительных методов микроскопии — поляризационной, флуоресцентной, трансмиссионной или сканирующей электронной и иных методов.
Применение вышеуказанных методов исследования, назначенных врачом-патологоанатомом при проведении исследования в целях уточнения диагноза заболевания (состояния), подлежит дополнительной оплате по стоимости, указанной в утвержденном прайс-листе медицинского центра ИНВИТРО
Комплекс иммуногистохимических маркеров для выявления аденокарциномы простаты.
Рак предстательной железы (РПЖ) входит в число наиболее частых онкологических заболеваний, поражающих мужское население разного возраста. Ранняя диагностика этого заболевания является приоритетной задачей современной урологии. Трансректальная биопсия предстательной железы с последующим гистологическим исследованием биоптата – метод, считающийся «золотым стандартом» диагностики при подозрении на РПЖ. Исследование позволяет выявить у пациента предраковое поражение (простатическая интраэпителиальная неоплазия: ПИН – prostatic intraepithelial neoplasia: PIN) или рак. А также определить локализацию опухоли, протяженность опухоли в биоптате, наличие периневральной инвазии или инвазии капсулы предстательной железы, стадию дифференцировки опухолевых клеток (градация по шкале Глисона). Однако, у части пациентов невозможно безошибочно определить злокачественный потенциал морфологических изменений, в частности, при выявлении так называемой атипической мелкоацинарной пролиферации» (atypical small acinar proliferation – ASAP).
Параллельное исследование экспрессии AMACR, высокомолекулярных цитокератинов 34ßE12 и белка p63 рекомендовано Международным обществом урологической патологии (International Society of Urological Pathology – ISUP) при иммуногистохимическом исследовании биоптатов простаты, для выявления мелких очагов атипичных желез при подозрении на аденокарциному предстательной железы. Повышенная экспрессия AMACR в комбинации с отсутствием маркёров базальных клеток (высокомолекулярных цитокератинов 34ßE12 и белка p63) – типичны для классической ацинарной аденокарциномы простаты.
AMACR (P504S, альфа-метилацил-коэнзим А рацемаза) – белок, участвующий в бета-окислении разветвленных жирных кислот и метаболизме желчных кислот. Присутствие этого белка можно обнаружить в нормальных тканях – печени (гепатоциты), почках (тубулярный эпителий), легких (эпителий бронхов), желчном пузыре и др. В качестве маркёра опухолей он рассматривается с 2000 года, когда было продемонстрировано, что карциномы простаты характеризуются повышенной экспрессией AMACR. Это не является уникальным для рака предстательной железы. Повышенная экспрессия AMACR выявлена в карциномах — колоректальных, овариальных, груди, мочевого пузыря, легких, почечно-клеточных, а также лимфомах и меланоме. Считается, что это потенциально важный маркер различных видов рака и соответствующих предраковых поражений, в особенности, ассоциируемых с высоким потреблением животных жиров.
В исследованиях уротелиального рака отмечается положительная корреляция между экспрессией AMACR, высокой гистопатологической градацией опухоли и опухолевой прогрессией. Гиперэкспрессия AMACR в опухолевой ткани делает этот фермент потенциальной мишенью для противоопухолевой терапии. AMACR является высокоэффективным и чувствительным маркером при иммуногистохимической диагностике РПЖ и позволяет с высокой чувствительностью и специфичностью дифференцировать рак предстательной железы от других патологических процессов, а также более точно определить стадию заболевания. По данным исследований, маркер позитивен в 80-100% случаев карцином простаты и ПИН высокой степени.
Гиперэкспрессия AMACR в опухолевой ткани делает этот фермент потенциальной мишенью для противоопухолевой терапии. AMACR является высокоэффективным и чувствительным маркером при иммуногистохимической диагностике РПЖ и позволяет с высокой чувствительностью и специфичностью дифференцировать рак предстательной железы от других патологических процессов, а также более точно определить стадию заболевания. По данным исследований, маркер позитивен в 80-100% случаев карцином простаты и ПИН высокой степени.
Белок p63 экспрессируется в ядрах базальных клеток различных видов эпителия, является транскрипционным фактором, играя ключевую роль в регуляции процессов пролиферации и дифференцировки эпителия и тканевого гомеостаза. Ген р63 находится на хромосоме 3q27-29 и принадлежит к семейству p53 опухолевых супрессорных генов, связанных с регуляцией клеточного цикла, апоптоза и опухолевой трансформации. Роль этого белка при раке (как в качестве опухолевого супрессора, так и онкогена) продолжает исследоваться. Определение экспрессии р63 является важным инструментом для дифференцировки между доброкачественными и злокачественными изменениями в предстательной железе (а также может использоваться для дифференцировки плоскоклеточного рака легких и аденокарциномы легких, плоскоклеточного рака шейки и аденокарциномы шейки матки, рака молочной железы in situ и аденокарциномы молочной железы).
Определение экспрессии р63 является важным инструментом для дифференцировки между доброкачественными и злокачественными изменениями в предстательной железе (а также может использоваться для дифференцировки плоскоклеточного рака легких и аденокарциномы легких, плоскоклеточного рака шейки и аденокарциномы шейки матки, рака молочной железы in situ и аденокарциномы молочной железы).
Высокомолекулярные цитокератины 34ßE12, как и p63, характерны для базального эпителия предстательной железы, исследование их экспрессии в комбинации с белком p63 повышает информативность и специфичность иммуногистохимического исследования биоптатов простаты. При РПЖ экспрессия цитокератинов высокомолекулярного веса (HMW) значительно снижается, что выявляется при ИГХ-исследовании.
Примечание: см. также тесты №5111ИГХ, №5222ИГХ (Ki-67-экспрессия, иммуногистохимическое исследование (MIB-1)) – лабораторное исследование для оценки потенциала злокачественности опухоли.
Экспрессия генов факторов роста эндотелия сосудов и их рецепторов при различных вариантах течения множественной миеломы
КМ — костный мозг
ММ — множественная миелома
ПЦР-ОТ — полимеразная цепная реакция с обратной транскрипцией
ФРЭС — фактор роста эндотелия сосудов
Изучение опухолевого ангиогенеза при множественной миеломе (ММ) важно для понимания особенностей патогенеза опухолевого роста, клинических проявлений болезни, ее диагностики и ответа на цитостатическую терапию.


Цель исследования: установить значение активности ангиогенеза, оцениваемой по экспрессии генов факторов роста эндотелия сосудов (ФРЭС) VEGF-A, VEGF-C и VEGF-D и их рецепторов VEGFR1, VEGFR1s, VEGFR2, VEGFR3 в мононуклеарной фракции аспиратов КМ с преобладанием опухолевых плазматических клеток при различных вариантах течения ММ.
Материалы и методы
В исследование включили 33 больных (14 мужчин, 19 женщин в возрасте от 37 до 75 лет) с ММ ІІІ стадии. Диагноз устанавливали на основании жалоб больных (боли в костях различной интенсивности, в поясничном отделе позвоночника, обусловленные корешковым синдромом). Видимые опухоли имелись у 3 больных. Диагноз подтверждали результатами цитологических исследований аспиратов КМ, в которых выявлялась плазмоклеточная инфильтрация. Всем больным проводили рентгенографию костей скелета в двух проекциях. Генерализованный остеолитический синдром диагностирован у 24 из 33 больных. У 8 пациентов с упорными корешковыми болями выявлен внутриспинальный опухолевый рост без симптомов компрессии спинного мозга (по данным магнитно-резонансной томографии позвоночника).
Выделение РНК из клеток КМ. После аспирации клетки костного мозга (ККМ) наслаивали на Ficoll и центрифугировали, после чего на границе раздела фаз отбирали мононуклеарную фракцию клеток ККМ, содержащую преимущественно плазматические клетки.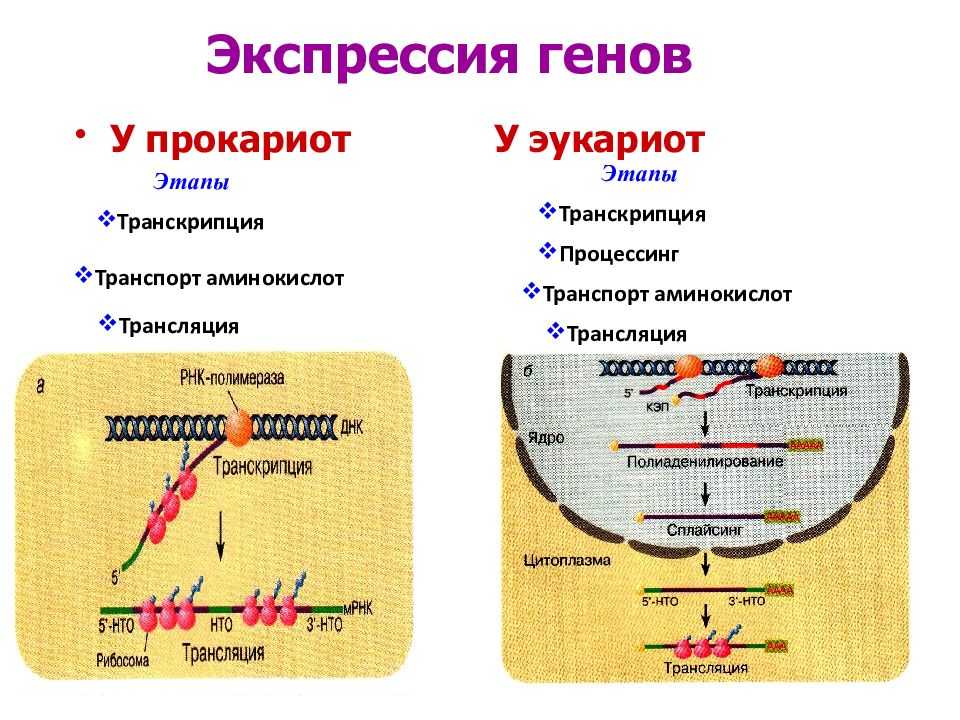 К осадку клеток добавляли Trizol. Выделения РНК проводили согласно стандартному протоколу. Концентрацию РНК определяли спектрофотометрически по поглощению света при длине волны 260 нм. Электрофорез выделенной РНК проводили в 1% агарозном геле с добавлением бромида этидия. Качество выделенной РНК оценивали визуально по наличию полос рибосомальной РНК.
К осадку клеток добавляли Trizol. Выделения РНК проводили согласно стандартному протоколу. Концентрацию РНК определяли спектрофотометрически по поглощению света при длине волны 260 нм. Электрофорез выделенной РНК проводили в 1% агарозном геле с добавлением бромида этидия. Качество выделенной РНК оценивали визуально по наличию полос рибосомальной РНК.
Полимеразная цепная реакция с обратной транскрипцией (ПЦР-ОТ). Экспрессию мРНК генов, кодирующих (ФРЭС) VEGF-A, VEGF-C, VEGF-D и рецепторы VEGFR1, VEGFR1s, VEGFR2 и VEGFR3 определяли методом ПЦР-ОТ на амплификаторе Терцик («ДНК-технология», Россия). Нуклеотидные последовательности использованных специфических праймеров приведены в таблице. В качестве внутреннего контроля для оценки количества взятой в реакцию РНК определяли экспрессию β2-микроглобулина. Продукты ПЦР-ОТ анализировали с помощью электрофореза в 2% агарозном геле с добавлением бромидэтидия. Размеры фрагментов оценивали визуально в соответствии с расположением полос маркерной ДНК. Гель фотографировали при ультрафиолетовом возбуждении с помощью цифровой камеры Samsung CCTV LENZ.
Гель фотографировали при ультрафиолетовом возбуждении с помощью цифровой камеры Samsung CCTV LENZ.
Цитологическая оценка аспиратов КМ больных ММ. При установлении диагноза проводили стандартную цитологическую оценку аспирата КМ, окрашенного по Романовскому (ув. 1000). Затем проводили расширенный анализ аспиратов КМ больных с подсчетом количества плазматических клеток, кластеров плазматических клеток (клеточная структура, содержащая от 3 плазматических клеток) и эндотелия сосудов (однослойный пласт эндотелиальных клеток, выстилающих участок кровеносного сосуда изнутри) в одном поле зрения (ув. 200). В каждом аспирате КМ произведен подсчет 50 полей зрения, что является репрезентативной выборкой. Для контроля клеточного состава проводили цитологическую оценку полученной мононуклеарной фракции КМ, которая содержала от 74,2 до 93,6% опухолевых плазматических клеток.
Оценка остеодеструктивного процесса в костях скелета больных ММ. Критерии оценки остеолиза разработаны в отделении клинической гематологии и иммунотерапии МОНИКИ им. М.Ф. Владимирского. Для оценки выбирали 4 зоны: череп, ребра, позвоночник, таз. Остеолиз оценивали в баллах: отсутствие очагов остеолиза — 0 баллов, 1 или 2 очага в одной зоне — 1 балл, множественные (≥ очаги в одной зоне) и/или мягкотканевой — 2 балла.
М.Ф. Владимирского. Для оценки выбирали 4 зоны: череп, ребра, позвоночник, таз. Остеолиз оценивали в баллах: отсутствие очагов остеолиза — 0 баллов, 1 или 2 очага в одной зоне — 1 балл, множественные (≥ очаги в одной зоне) и/или мягкотканевой — 2 балла.
Характеристику распространенности остеолитического процесса получали при суммировании баллов каждой из исследованных рентгенологических зон костной системы (в 2 проекциях). Минимальная оценка составляла 1 балл, максимальная — 8 баллов.
Статистическую обработку данных проводили определением достоверности методом непрямых разностей (Монцевичюте—Эрингене, 1964). Общую выживаемость больных оценивали с помощью теста Вилкоксона—Гехана. Различия считали достоверными при р<0,05.
Результаты и обсуждение
При анализе экспрессии генов ФРЭС VEGF-A, VEGF-C, VEGF-D у больных ММ экспрессия гена ФРЭС VEGF-A выявлена у 24 (72,7%), ген VEGF-C был экспрессирован у 13 (39%), мРНК фактора роста VEGF-D — у 7(21,2%). Таким образом, мРНК основного ФРЭС VEGF-A имелась у большинства больных.
Таким образом, мРНК основного ФРЭС VEGF-A имелась у большинства больных.
При анализе результатов экспрессии генов рецепторов ФРЭС VEGFR1, VEGFR1s, VEGFR2, VEGFR3 экспрессия гена рецептора VEGFR1 была выявлена у 25 (75,7%) больных, ген растворимой формы рецептора VEGFR1s — у 27 (81,8%), экспрессия гена VEGFR2 — у 3 (9%), экспрессия гена рецептора VEGFR3 — у 25 (75,7%). Таким образом, экспрессия генов рецепторов VEGFR1, VEGFR1s и VEGFR3 выявлена у большинства больных ММ, а экспрессия гена рецептора VEGFR2 встречалась редко.
Представляло интерес проанализировать коэкспрессию генов ФРЭС VEGF-A,VEGF-C,VEGF-D. У 8 (24,2%) больных экспрессия генов ФРЭС не отмечена, ген одного из факторов VEGF был экспрессирован у 8 (24,2%) пациентов, гены 2 факторов VEGF — у 14 (42,4%), у 3 (9%) обнаружена экспрессия генов 3 ФРЭС.
Исходя из полученных результатов можно сделать заключение о достаточно высокой частоте экспрессии генов ФРЭС при ММ: у 51,4% больных обнаружена коэкспрессия 2 или 3 генов исследованных ФРЭС. При изучении коэкспрессии генов рецепторов ФРЭС установлено, что гены VEGFR экспрессированы или коэкспрессированы у всех 33 пациентов. Ген одного из рецепторов экспрессирован у 5 (15,1%) больных, гены 2 рецепторов — у 9 (27,3%), 3 рецепторов — у 17 (51,5%) и 4 рецепторов — у 2 (6%).
При изучении коэкспрессии генов рецепторов ФРЭС установлено, что гены VEGFR экспрессированы или коэкспрессированы у всех 33 пациентов. Ген одного из рецепторов экспрессирован у 5 (15,1%) больных, гены 2 рецепторов — у 9 (27,3%), 3 рецепторов — у 17 (51,5%) и 4 рецепторов — у 2 (6%).
Высокая частота экспрессии генов рецепторов ФРЭС VEGFR свидетельствует о том, что опухолевые плазматические клетки, преимущественно содержащиеся в мононуклеарной фракции аспиратов КМ больных ММ, способны отвечать на сигналы факторов роста VEGF, секретируемых либо клетками стромы микроокружения, либо самими плазматическими клетками, тем самым поддерживая активность опухолевого роста.
Исходя из анализа экспрессии и коэкспрессии генов ФРЭС VEGF-A, VEGF-C, VEGF-D и их рецепторов VEGFR1, VEGFR1s, VEGFR2, VEGFR3 создавались предпосылки для разделения больных на группы по наличию или отсутствию экспрессии. В результате мы выделили 2 группы: 24 (72,7%) больных с наличием и/или высокой экспрессией генов («васкулярный» тип) и 9 (27,3%) — с низкой и/или отсутствующей экспрессией («аваскулярный» тип). При этом в «аваскулярной» группе у всех 9 больных ММ отсутствовала экспрессия гена фактора роста VEGF-A, который является одним из основных факторов ангиогенеза. Экспрессия гена VEGF-C выявлена только у 1 больного этой группы. У этих же больных экспрессия гена фактора VEGF-D не определялась. В то же время экспрессия гена рецептора VEGFR1 выявлена у 5 из 9 больных. Высокая частота экспрессии гена растворимой молекулы VEGFR1s встречалась у 6 больных из 9. мРНК гена рецептора VEGFR3 обнаружена у 5 больных из 9. При этом следует отметить полное отсутствие в данной группе больных экспрессии гена рецептора VEGFR2 — основного рецептора для VEGF-A.
При этом в «аваскулярной» группе у всех 9 больных ММ отсутствовала экспрессия гена фактора роста VEGF-A, который является одним из основных факторов ангиогенеза. Экспрессия гена VEGF-C выявлена только у 1 больного этой группы. У этих же больных экспрессия гена фактора VEGF-D не определялась. В то же время экспрессия гена рецептора VEGFR1 выявлена у 5 из 9 больных. Высокая частота экспрессии гена растворимой молекулы VEGFR1s встречалась у 6 больных из 9. мРНК гена рецептора VEGFR3 обнаружена у 5 больных из 9. При этом следует отметить полное отсутствие в данной группе больных экспрессии гена рецептора VEGFR2 — основного рецептора для VEGF-A.
Проведена оценка экспрессии генов в «васкулярной» группе из 24 (72,7%) больных с высокой экспрессией генов ФРЭС и их рецепторов.
У всех 24 больных этой группы выявлена экспрессия гена фактора VEGF-A — одного из основных факторов ангиогенеза. Экспрессия генов факторов VEGF-C и VEGF-D встречалась в этой группе с меньшей частотой (12 и 7 больных соответственно), причем выявлялись случаи коэкспрессии 2 и 3 факторов.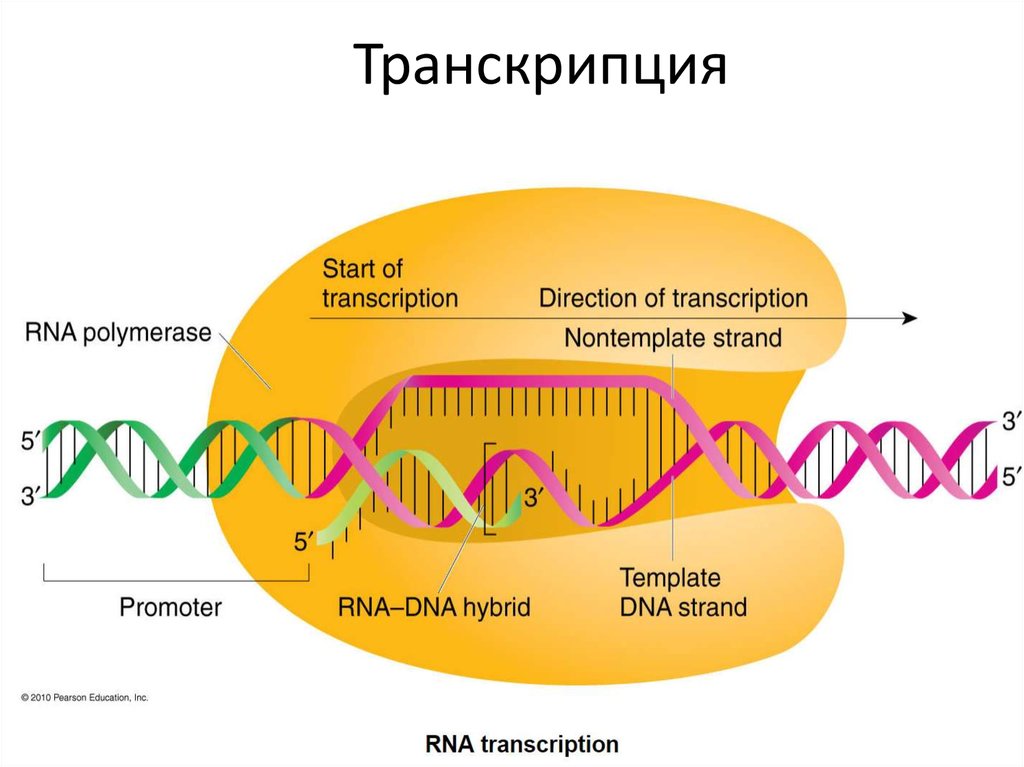 Следует также отметить, что при этом варианте ММ была высокая частота экспрессии и коэкспрессии генов рецепторов VEGFR1, VEGFR1s и VEGFR3. Экспрессия гена рецептора VEGFR2 выявлена лишь у 3 из 24 больных.
Следует также отметить, что при этом варианте ММ была высокая частота экспрессии и коэкспрессии генов рецепторов VEGFR1, VEGFR1s и VEGFR3. Экспрессия гена рецептора VEGFR2 выявлена лишь у 3 из 24 больных.
На основании полученных нами данных составлена логическая модель ангиогенеза при ММ. Опухолевая плазматическая клетка в большинстве случаев характеризуется активной функцией генов ФРЭС, включая ген, кодирующий один из основных ангиогенных факторов, — VEGF-A. В результате активной функции гена синтезированный фактор выделяется в окружающую среду, где взаимодействует со своим рецептором VEGFR2, который представлен на эндотелии сосудов микроокружения, что стимулирует образование новых сосудов вокруг плазматической клетки. Подобный рецептор практически не синтезируется на опухолевой плазматической клетке, что подтверждается нашими исследованиями, которые выявили активность этого гена лишь у 9% больных. Это обстоятельство имеет большое биологическое значение, которое заключается в том, что взаимодействие VEGF-A со своими рецепторами не будет блокироваться опухолевой клеткой.
Кроме указанного главного механизма стимуляции ангиогенеза опухолевыми миеломными клетками, осуществляемого при взаимодействии VEGF-A с VEGFR2, существуют дополнительные механизмы, которые могут усиливать или подавлять ангиогенное воздействие опухолевой клетки на эндотелий сосудов. К дополнительным факторам, усиливающим ангиогенез, следует отнести VEGF-D, который экспрессировался при ММ у 21,2% больных. Как показали опубликованные исследования, фактор VEGF-D обладает возможностью стимулировать лимфангиогенез и рост эндотелия сосудов при взаимодействии с VEGFR2. Аналогичные данные литературы известны и в отношении фактора роста VEGF-C. К факторам, блокирующим стимуляцию ангиогенеза опухолевой клеткой, следует отнести экспрессию растворимой формы рецептора VEGFR1s на плазматической клетке, который связывает некоторое количество фактора VEGF-A, конкурируя с расположенным на мембране клетки рецептором VEGFR1 за связывание с VEGF-A. Кроме того, VEGFR1, локализованный на клетках стромы, также будет связывать фактор VEGF-A, снижая его взаимодействие с VEGFR2. Следует отметить, что расположенные на мембранах плазматических и стромальных клеток рецепторы VEGFR1 и VEGFR3 могут связываться с экспрессируемыми этими клетками факторами роста семейства VEGF, обеспечивая тем самым аутокринный опухолевый рост.
Следует отметить, что расположенные на мембранах плазматических и стромальных клеток рецепторы VEGFR1 и VEGFR3 могут связываться с экспрессируемыми этими клетками факторами роста семейства VEGF, обеспечивая тем самым аутокринный опухолевый рост.
Достаточно высокая активность экспрессии генов ФРЭС и их рецепторов свидетельствует о возможности поддержания опухолевого роста как по аутокринному, так и по паракринному механизму. Группа больных с низкой экспрессией генов ФРЭС характеризуется наличием опухолевых плазмоцитов, которые не оказывают ангиогенное воздействие на эндотелий сосудов микроокружения. Однако при наличии в этих опухолевых клетках экспрессии генов рецепторов поддержание их роста может обеспечиваться по паракринному механизму за счет влияния на опухолевую клетку ангиогенных факторов VEGF стромального микроокружения. В связи с этим данный тип ММ не будет характеризоваться интенсивным опухолевым ростом.
Полученные результаты позволяют нам выделить «васкулярный» (с наличием экспрессии генов) и «аваскулярный» (без экспрессии генов) типы ММ как самостоятельные патогенетически обусловленные варианты течения заболевания. Указание на подобные варианты течения болезни имелись и в работе А. Vacca, D. Ribatti [20]. При сравнительном анализе представленных результатов, прежде всего, следует обратить внимание на различие экспрессии генов ангиогенеза у этих групп больных.
Указание на подобные варианты течения болезни имелись и в работе А. Vacca, D. Ribatti [20]. При сравнительном анализе представленных результатов, прежде всего, следует обратить внимание на различие экспрессии генов ангиогенеза у этих групп больных.
Так, в «васкулярной» группе больных ММ мРНК генов факторов VEGF-A, VEGF-C и VEGF-D нам встречалась с частотой 100, 50 и 29,1% соответственно. В то же время у больных «аваскулярной» группы экспрессия аналогичных генов практически отсутствовала и составляла 0, 11,1% и 0 соответственно. В «васкулярной» группе больных частота выявления генов рецепторов VEGFR1, VEGFR1s, VEGFR2, VEGFR3 составила 83,3, 95,8, 12,5 и 29,1% соответственно. Следует также отметить меньшую частоту выявления экспрессии генов рецепторов ФРЭС у больных в «аваскулярной» группе по всем изучаемым рецепторам — VEGFR1, VEGFR1s, VEGFR2, VEGFR3, что составило 55,5, 66,6, 0 и 22,2% соответственно. Исходя из логической модели ангиогенеза, которая может быть сформулирована при анализе полученных данных, можно понять значение исследуемых генов в патогенезе опухолевого роста при ММ. У больных с «васкулярным» типом болезни опухолевые клетки имеют активно функционирующие гены ФРЭС и их рецепторного аппарата. При этом возникают предпосылки для активации пролиферативной активности эндотелия сосудов микроокружения. Кроме того, активный рецепторный аппарат этих клеток воспринимает сигналы VEGF клеток стромы и самих опухолевых клеток, вызывая активацию их роста по аутокринному и паракринному механизмам. У больных с «аваскулярным» типом болезни опухолевые клетки не будут активировать эндотелий стромы микроокружения, а рецепторный аппарат клеток будет взаимодействовать только с фактором роста VEGF, секретируемыми клетками стромы. В этом случае активность данных сигнальных систем будет ниже и в силу своей невысокой активности будет слабее активироваться опухолевый рост по аутокринному и паракринному механизмам.
У больных с «васкулярным» типом болезни опухолевые клетки имеют активно функционирующие гены ФРЭС и их рецепторного аппарата. При этом возникают предпосылки для активации пролиферативной активности эндотелия сосудов микроокружения. Кроме того, активный рецепторный аппарат этих клеток воспринимает сигналы VEGF клеток стромы и самих опухолевых клеток, вызывая активацию их роста по аутокринному и паракринному механизмам. У больных с «аваскулярным» типом болезни опухолевые клетки не будут активировать эндотелий стромы микроокружения, а рецепторный аппарат клеток будет взаимодействовать только с фактором роста VEGF, секретируемыми клетками стромы. В этом случае активность данных сигнальных систем будет ниже и в силу своей невысокой активности будет слабее активироваться опухолевый рост по аутокринному и паракринному механизмам.
Клиническая и цитологическая характеристика больных ММ с различной экспрессией генов ФРЭС и их рецепторов. При цитологической оценке аспиратов КМ в 2 группах больных проведен сравнительный анализ результатов подсчета кластеров миеломных клеток.
В группе из 24 больных с «васкулярным» типом количество кластеров миеломных клеток в аспиратах КМ было достоверно больше (3,76±1,16), чем в группе из 9 больных с «аваскулярным» типом (0,48±0,08; p<0,01). Среднее количество эндотелия сосудов в аспиратах КМ было достоверно больше у больных с «васкулярным» типом ММ, чем у больных «аваскулярным» типом (0,0075±0,001; p<0,001).
При визуальной оценке аспиратов КМ у больных с «васкулярным» типом определялись большие кластеры плазматических клеток как с эндотелием сосудов, так и без него (рис. 1, а),Рисунок 1. Картина КМ у пациентов с ММ (ув. 200). а — ММ44. тогда как у больных с «васкулярным» типом выявлялись поля кластеров плазматических клеток без эндотелия сосудов. На рис. 1, бРисунок 1. Картина КМ у пациентов с ММ (ув. 200). б — ММ11. отражена картина КМ пациента с ММ «васкулярный» тип, где определяется большой кластер плазматических клеток с эндотелием сосуда внутри кластера.
В связи с высоким количеством кластеров опухолевых клеток в аспиратах КМ больных с коэкспрессией генов VEGF и их рецепторов представляло интерес проанализировать интенсивность остеолиза у этих больных. При оценке остеолитического процесса в костях скелета интенсивность остеолиза у больных с «васкулярным» типом была значительно выше, чем у больных с «аваскулярным» типом течения ММ: в среднем 1,76±0,12 и 0,8±0,31 балла (р<0,06).
При оценке остеолитического процесса в костях скелета интенсивность остеолиза у больных с «васкулярным» типом была значительно выше, чем у больных с «аваскулярным» типом течения ММ: в среднем 1,76±0,12 и 0,8±0,31 балла (р<0,06).
При сравнении выживаемости в 2 группах выявлены статистически значимые различия (рис. 2).Рисунок 2. Выживаемость в 2 группах больных ММ с различной экспрессией генов. У больных с «аваскулярным» типом выживаемость составила 67 мес, что достоверно выше, чем больных с «васкулярным» типом течения — 29 мес (p<0,05).
Заключение
Полученные данные отражают высокую значимость для диагностики, расширения знаний о патогенезе ММ и свидетельствуют, что мононуклеарная фракция КМ с преимущественным содержанием опухолевых плазматических клеток у больных ММ характеризуется различной степенью экспрессии генов ФРЭС и их рецепторов. Установлена высокая экспрессия растворимой формы молекулы гена VEGFR1s. Интегральная оценка полученной экспрессии генов ФРЭС и их рецепторов позволила разделить больных на 2 группы с высокой и низкой активностью генов. У больных с наличием экспрессии генов ФРЭС и их рецепторов количество кластеров и эндотелия сосудов в аспиратах КМ больных ММ достоверно выше, чем у больных с низкой экспрессией их или в их отсутствие. Данные исследования позволяют расширить возможности цитологической диагностики ММ за счет включения в оценку аспиратов КМ подсчета количества кластеров плазматических клеток и эндотелия сосудов. Повышенное количество кластеров, наличие эндотелия сосудов в аспиратах может быть предиктором тяжелого течения болезни. Остеодеструктивный процесс в костях скелета больных ММ у больных с экспрессией генов ФРЭС и их рецепторов достоверно выше, чем у больных с низкой их экспрессией. «Аваскулярный» тип ММ (с низкой активностью экспрессии исследованных генов) имел большую медиану общей выживаемости, чем «васкулярный» тип (с наличием экспрессии).
У больных с наличием экспрессии генов ФРЭС и их рецепторов количество кластеров и эндотелия сосудов в аспиратах КМ больных ММ достоверно выше, чем у больных с низкой экспрессией их или в их отсутствие. Данные исследования позволяют расширить возможности цитологической диагностики ММ за счет включения в оценку аспиратов КМ подсчета количества кластеров плазматических клеток и эндотелия сосудов. Повышенное количество кластеров, наличие эндотелия сосудов в аспиратах может быть предиктором тяжелого течения болезни. Остеодеструктивный процесс в костях скелета больных ММ у больных с экспрессией генов ФРЭС и их рецепторов достоверно выше, чем у больных с низкой их экспрессией. «Аваскулярный» тип ММ (с низкой активностью экспрессии исследованных генов) имел большую медиану общей выживаемости, чем «васкулярный» тип (с наличием экспрессии).
Таким образом, исследование позволило дать оценку процессам ангиогенеза при ММ и установить взаимосвязь с клиническими проявлениями и цитологическими характеристиками. Оценку экспрессии генов ФРЭС и их рецепторов при ММ следует проводить для более полной диагностики заболевания. Введение новой оценочной категории в описательную часть миелограммы при ММ (подсчет кластеров опухолевых плазматических клеток и эндотелия сосудов) позволяет определить прогноз заболевания и она может быть рекомендована к применению в широкой клинической практике.
Оценку экспрессии генов ФРЭС и их рецепторов при ММ следует проводить для более полной диагностики заболевания. Введение новой оценочной категории в описательную часть миелограммы при ММ (подсчет кластеров опухолевых плазматических клеток и эндотелия сосудов) позволяет определить прогноз заболевания и она может быть рекомендована к применению в широкой клинической практике.
Части выражения
Алгебраические выражения представляют собой комбинации переменные , числа и хотя бы одно арифметическое действие.
Например, 2 Икс + 4 у − 9 является алгебраическим выражением.
Срок: Каждое выражение состоит из терминов. Терм может быть числом со знаком, переменной или константой, умноженной на переменную или переменные.
Фактор: Что-то, что умножается на что-то другое. Фактор может быть числом, переменной, термином или более длинным выражением. Например, выражение
7
Икс
(
у
+
3
)
имеет три фактора:
7
,
Икс
, и
(
у
+
3
)
.
Фактор может быть числом, переменной, термином или более длинным выражением. Например, выражение
7
Икс
(
у
+
3
)
имеет три фактора:
7
,
Икс
, и
(
у
+
3
)
.
Коэффициент: Числовой коэффициент выражения умножения, содержащего переменную. Рассмотрим выражение на рисунке выше, 2 Икс + 4 у − 9. В первый срок, 2 Икс , коэффициент 2 : во второй срок, 4 у , коэффициент 4 .
Постоянный: Число, которое не может изменить свое значение. В выражении
2
Икс
+
4
у
−
9
, термин
9
является константой.
Нравятся условия: Термины, содержащие одни и те же переменные, такие как 2 м , 6 м или 3 Икс у и 7 Икс у . Если выражение имеет более одного постоянного члена, они также похожи на термы.
|
|
|
|
|
|
|
|
|
|
Пример:
Определите термины, такие как термины, коэффициенты и константы в выражении.
9 м − 5 н + 2 + м − 7
Во-первых, мы можем переписать вычитания как сложения.
9 м − 5 н + 2 + м − 7 «=» 9 м + ( − 5 н ) + 2 + м + ( − 7 )
Итак условия являются
9
м
,
(
−
5
н
)
,
м
,
2
, и
(
−
7
)
.
Нравятся условия являются терминами, которые содержат одни и те же переменные.
9 м и 9м являются парой как термины . Постоянные условия 2 и − 7 также как термины.
Коэффициенты числовые части термина, содержащего переменную.
Итак, вот коэффициенты являются 9 , ( − 5 ) , и 1 . ( 1 коэффициент члена м .)
постоянный термины — это термины без переменных, в этом случае 2 и − 7 .
Алгебраические выражения должны быть тщательно написаны и интерпретированы. Алгебраическое выражение
5
(
Икс
+
9
)
является нет эквивалентно алгебраическому выражению,
5
Икс
+
9.
Алгебраическое выражение
5
(
Икс
+
9
)
является нет эквивалентно алгебраическому выражению,
5
Икс
+
9.
См. разницу между двумя выражениями в таблице ниже.
| Словосочетания | Алгебраическое выражение |
| Пятикратная сумма числа и девяти | 5 ( Икс + 9 ) |
| Девять более пяти раз число | 5 Икс + 9 |
При записи выражений для неизвестных величин часто пользуются стандартными формулами. Например, алгебраическое выражение для «расстояния, если скорость
50
миль в час и время
Т
часов» это
Д
«=»
50
Т
(по формуле
Д
«=»
р
Т
).
Например, алгебраическое выражение для «расстояния, если скорость
50
миль в час и время
Т
часов» это
Д
«=»
50
Т
(по формуле
Д
«=»
р
Т
).
Выражение вроде Икс н называется силой. Здесь Икс является базой, и н является показателем. Показатель степени — это количество раз, когда основание используется в качестве множителя. Словосочетание для этого выражения: « Икс к н й власть.»
Вот несколько примеров использования экспонент.
| Словосочетания | Алгебраическое выражение |
| Семь раз м в четвертой степени | 7 м 4 |
| Сумма Икс в квадрате и 12 времена у | Икс 2 + 12 у |
| Икс в кубе раз у в шестой степени | Икс 3 ⋅ у 6 |
Если выражение равно (ModelBuilder) — ArcGIS Pro
Вернуться к началу
В этом разделе
- Сводка
- Использование
- Параметры
- Среды
- Лицензионная информация
Сводка
Оценивает, является ли заданное выражение Python истинным или ложным.
Узнайте, как If Expression Is работает в ModelBuilder
Использование
Этот инструмент доступен только на ленте ModelBuilder для использования в моделях. Инструмент недоступен на панели Геообработка или в Python.
Инструмент имеет два логических выхода: True и False. В зависимости от оцениваемого условия один из двух выходных логических значений является истинным, а другой — ложным после запуска инструмента. Эти логические выходные данные должны быть установлены в качестве предварительного условия для нижестоящих инструментов, чтобы они выполнялись, если одно из предварительных условий истинно.
Параметр Expression поддерживает только выражения Python. Другие языки сценариев не поддерживаются.
Используйте параметр Expression для коротких однострочных выражений.
 Используйте параметр Блок кода для более сложных выражений, таких как многострочные вычисления или логические операции. Параметр Code Block не может использоваться сам по себе; его необходимо использовать вместе с параметром Expression.
Используйте параметр Блок кода для более сложных выражений, таких как многострочные вычисления или логические операции. Параметр Code Block не может использоваться сам по себе; его необходимо использовать вместе с параметром Expression.Переменные, созданные в ModelBuilder, могут использоваться этим инструментом, но не могут быть связаны напрямую с параметром Expression. Чтобы использовать переменную в выражении, заключите имя переменной в знаки процента.
Вы не можете получить доступ к переменным модели в параметре Code Block. Эти переменные должны быть переданы в блок кода из выражения. Для этого создайте определение функции в параметре Code Block и укажите значение параметра Expression.
В Python правильный отступ является частью синтаксиса. Уровень отступа (два пробела или четыре пробела) не имеет значения, если он одинаков во всем кодовом блоке.

Параметры
| Метка | Объяснение | Тип данных |
Выражение | Выражение Python для оценки. | Выражение SQL |
Блок кода | Блок кода Python. Код в блоке кода должен быть указан в параметре Expression. | Строка |
Производный вывод
| Метка | Объяснение | Тип данных |
| Истина | Если для указанного параметра установлено значение Истина, то для этого параметра будет установлено значение Истина. | Логический |
| Ложь | Если указанный критерий оценивается как Ложь, для этого параметра будет установлено значение Истина. |
 Используйте параметр Блок кода для более сложных выражений, таких как многострочные вычисления или логические операции. Параметр Code Block не может использоваться сам по себе; его необходимо использовать вместе с параметром Expression.
Используйте параметр Блок кода для более сложных выражений, таких как многострочные вычисления или логические операции. Параметр Code Block не может использоваться сам по себе; его необходимо использовать вместе с параметром Expression.