Главная / Гимназия №159
Новости
Последний звонок
Дорогие выпускники!
Сегодня звучит ваш последний звонок. В его мелодичных…
Подробнее »
«Сад Памяти»
20 мая, в день Гимназии, было решено провести акцию «Сад Памяти»… памяти наших…
Подробнее »
САММИТ «ОМСКИЙ ДИАЛОГ-2023»
19 мая в Областном Конгресс-холле прошел МЕЖДУНАРОДНЫЙ УПРАВЛЕНЧЕСКИЙ САММИТ «ОМСКИЙ…
Подробнее »
Прощай, 4 класс!
16 мая был необычный день – день прощания с начальной школой, прощание с первой…
Подробнее »
календарь праздников на май
Подробнее »
Добро пожаловать в гимназию № 159!
Здравствуйте, дорогие друзья! Сердечно приветствую вас и надеюсь, что знакомство с нашим образовательным учреждением будет для вас не только интересным, но и полезным.
Бюджетное общеобразовательное учреждение города Омска «Гимназия № 159»– это уникальная школа, и не только потому, что самая большая во всем Амурском поселке города Омска, а потому что БОУ г. Омска «Гимназия № 159» – это школа Успеха: мы не боремся с недостатками, мы развиваем достоинства. Гимназия №159 – это школа равных, но разнообразных возможностей. Мы утверждаем, что неуспешных людей нет. Успеха может добиться каждый, если предоставить ему соответствующие условия. Такие условия мы обеспечиваем всем желающим.
Наша Гимназия – это школа, в которой интересно учиться детям и интересно работать учителям. В зданиях Гимназии царствует Его Величество Урок. Урок – это время увлекательного общения учителя и ученика, это пора споров, дискуссий, поиска новых знаний и истины. Это часы использования традиционных, хорошо зарекомендовавших себя методов и приемов обучения, а также самых современных информационно-коммуникационных технологий.
Внутри гимназии ежегодно работает большое количество кружков и секций разной направленности (социально-гуманитарной, научно-технической, спортивной и др.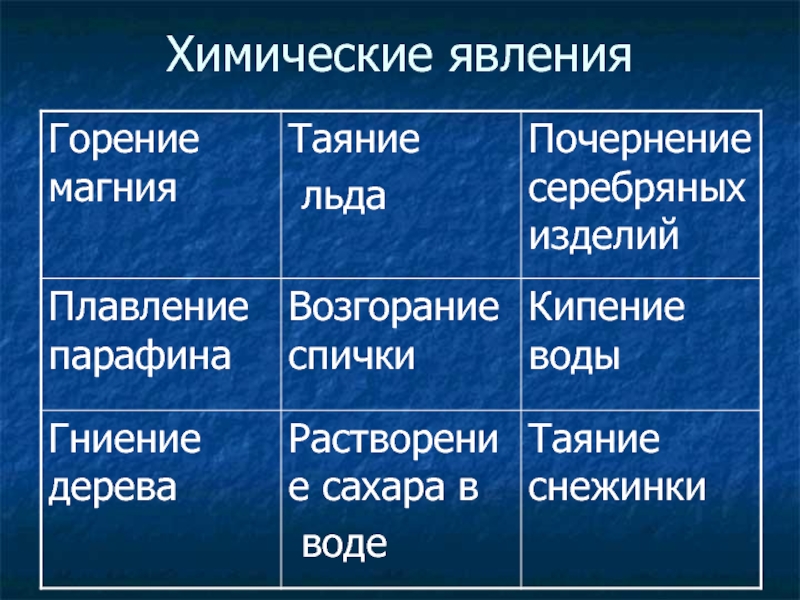
Любой успех ученика рождает интерес. Современная школа раскрывает таланты каждого ребенка и помогает ему создать целостную картину мира.
Школьная система образовательного процесса и образовательного пространства выстроена таким образом, чтобы предоставить каждому ученику возможность ВЫБОРА максимально освоить те сферы, в которых он стремится себя реализовать наилучшим образом. А основная задача наших учителей в быстро меняющемся мире сводится в первую очередь к помощи ученикам ДЕЛАТЬ ПРАВИЛЬНЫЙ ВЫБОР в той области (предметы, навыки, умения…), в которой ученик будет максимально успешен. А УМЕНИЕ ДЕЛАТЬ ПРАВИЛЬНЫЙ ВЫБОР — одна из КЛЮЧЕВЫХ КОМПЕТЕНЦИЙ, позволяющих каждому осознанно относиться к вопросам профориентации.
Огромную роль в развитии предпрофессионального образования играют наши социальные и сетевые партнёры. Гимназия № 159 – это школа, в которой создана особая, эмоционально привлекательная среда. Яркая атмосфера общешкольных праздников, работа Детского Общественного Объединения «Рассвет», деятельность Совета старшеклассников, концерты, фестивали, творческие игры – вот то, чем живут учителя и ученики нашей Гимназии.
Мы видим современную школу как творческую мастерскую, в которой все участники образовательного процесса путём совместной деятельности формируют личность, способную осознать свою созидательную роль в современном обществе, взращивают лидеров современного общества.
Школа должна выявить и развить заложенные в каждом человеке способности, дать ему возможность наиболее целесообразно и ярко проявить себя. В этом и адаптация, и самоутверждение, и успешность.
С уважением, директор
Татьяна Владимировна Шефер
Примеры физических и химических явлений, и их значение в жизни и деятельности человека. — Знания.site
- Главная
- Химия
- Примеры физичес…
Примеры физических и химических явлений, и их значение в жизни и деятельности человека.
Ответы 1
Физические явления — это явления, при которых может изменятся агрегатное состояние, форма тела и так далее, но состав вещества остаётся прежним:1) Таяние льда
2) Плавление металлов
3) Испарение воды
4) Ударение мяча об пол
5) Растворение сахара
В жизни человека эти явления происходят по всюду, куда не посмотри, и без них просто невозможен мир.

Химические явления — это явления, при которых одни вещества превращаются в другие:
1) Ржавление металлов
2) Фотосинтез
3) Скисание молока
4) Образование в чайнике накипи
5) Горение свечи
Химические явления в жизни человека важны и придают ему значимость, интересность. Без них невозможны были бы многие типичные бытовые заботы.
Знаешь ответ? Добавь его сюда!
Последние вопросы
- Физика
7 часов назад
Металлический предмет кубической формы со стороной 40 см плавает в сосуде с ртутью. В сосуд налили жидкость таким образом, что её верхний уровень совпал с верхней горизонтальной поверхностью предмета. Рассчитай высоту столба налитой в сосуд жидкости. Справочные данные: плотность металла 7800 кг/м³, плотность ртути 13600 кг/м³, плотность жидкости — 1000 кг/м³.
(Ответ округли до десятых.)
- Математика
8 часов назад
кто такой джокер
- Математика
8 часов назад
Маша кормит собачек
У Маши три собачки Диди, Мими и Фифи.
 Диди весит 3 кг, Фифи 3,5 кг, а Мими 4,5 кг.
Диди весит 3 кг, Фифи 3,5 кг, а Мими 4,5 кг.Всего у Маши 33 кг корма на месяц для собачек. Она хочет пересыпать корм в коробки пропорционально весу каждой собаки. Сколько корма в какую коробку она должна пересыпать? Ответы дайте в килограммах.
- Физика
9 часов назад
Металлический предмет кубической формы со стороной 30 см. плавает в резервуаре с ртутью. В резервуар налили жидкость таким образом, что её верхний уровень совпал с верхней горизонтальной поверхностью предмета. Найди высоту столба налитой в резервуар жидкости. Справочные данные: плотность металла 2700 кг/м², плотность ртути — 13600 кг/м³, плотность жидкости — 1000 кг/м³.
(Ответ округли до десятых.)
- Другие предметы
12 часов назад
Что это означает?
- Математика
20 часов назад
сторона правильной треугольной пирамиды равна 8 найдите площадь полной поверхности пирамиды если ее апофема равна корень 8 из 3
- Математика
20 часов назад
сторона правильной треугольной пирамиды равна 8 найдите объем пирамиды если ее апофема равна 13
- Математика
20 часов назад
два ребра прямоугольного паралепипеда выходящие из одной вершины равны 72 и 18 найти объем
- Математика
1 день назад
У трикутнику ABC <A= 90°, <B=30°, АВ=6 см.
 Знайдіть інші сторони трикутника.
Знайдіть інші сторони трикутника. - Химия
1 день назад
Алканы.Непредельные углеводороды. Арены
Назовите следующие соединения
- Физика
2 дня назад
Линза имеет оптическую силу 2 дптр, и дала увеличение поставленного перед ней объекта в 25 раз. Найти расстояние от линзы до поставленного объекта. Ответ дайте в см, округлив до целого числа. СРОЧНО МОЛЮ(((
- Математика
2 дня назад
В коробке находится 15 теннисных мячей, 9 из которых новые. Для первой игры случайным образом выбираются три мяча, которые после игры возвращаются в коробку. Для второй игры снова случайным образом выбираются три мяча. Вычислите вероятность того, что все три мяча, выбранные для второй игры, новые. какой будет %
какой будет % - Английский язык
3 дня назад
Степени сравнения прилагательных
- Английский язык
3 дня назад
Finish the sentences below with your ideas connected with food
3 дня назад
Помогите с физикой пж!
How much to ban the user?
1 hour 1 day 100 years3.10: Химические реакции в живых существах
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 17003
- Сюзанна Ваким и Мандип Грюал
- Колледж Бьютт
Сборочный конвейер
Мы остаемся в живых, потому что в нашем организме постоянно происходят миллионы различных химических реакций. Каждая из наших ячеек похожа на загруженный конвейер по сборке автомобилей, изображенный здесь. Сырье, полуфабрикаты и отходы постоянно используются, производятся, транспортируются и выводятся из организма. «Рабочие» на клеточной сборочной линии в основном ферменты. Это белки, которые запускают биохимические реакции.
Каждая из наших ячеек похожа на загруженный конвейер по сборке автомобилей, изображенный здесь. Сырье, полуфабрикаты и отходы постоянно используются, производятся, транспортируются и выводятся из организма. «Рабочие» на клеточной сборочной линии в основном ферменты. Это белки, которые запускают биохимические реакции.
Что такое биохимические реакции?
Химические реакции, протекающие внутри живых существ, называются биохимическими реакциями. Сумма всех биохимических реакций в организме называется метаболизмом . Метаболизм включает как экзотермические (с выделением тепла) химические реакции, так и эндотермические (с теплопоглощением) химические реакции.
Катаболические реакции
Экзергонические реакции в организмах называются катаболическими реакциями . Эти реакции расщепляют молекулы на более мелкие единицы и высвобождают энергию. Примером катаболической реакции является расщепление глюкозы при клеточном дыхании, при котором высвобождается энергия, необходимая клеткам для осуществления жизненных процессов.
Анаболические реакции
Эндергонические реакции в организмах называются анаболическими реакциями . Эти реакции поглощают энергию и строят большие молекулы из меньших. Примером анаболической реакции является соединение аминокислот с образованием белка. Как вы думаете, какие типы реакций — катаболические или анаболические — происходят, когда ваш организм переваривает пищу?
Ферменты
Для протекания большинства биохимических реакций в организме требуется помощь. Почему это так? Во-первых, температура внутри живых существ обычно слишком низка, чтобы биохимические реакции происходили достаточно быстро, чтобы поддерживать жизнь. Концентрации реагентов также могут быть слишком низкими, чтобы они могли собраться вместе и вступить в реакцию. Откуда биохимические реакции получают необходимую им помощь? На помощь приходят ферменты.
Фермент — это белок, ускоряющий биохимическую реакцию. Это биологический катализатор. Фермент обычно работает за счет уменьшения количества энергии активации, необходимой для начала реакции. На рисунке \(\PageIndex{2}\) показана энергия активации, необходимая для соединения глюкозы с кислородом с образованием углекислого газа и воды. Общая реакция высвобождает энергию, но для начала процесса необходима начальная энергия активации. Энергия активации без фермента намного выше, чем энергия активации при использовании фермента.
Фермент обычно работает за счет уменьшения количества энергии активации, необходимой для начала реакции. На рисунке \(\PageIndex{2}\) показана энергия активации, необходимая для соединения глюкозы с кислородом с образованием углекислого газа и воды. Общая реакция высвобождает энергию, но для начала процесса необходима начальная энергия активации. Энергия активации без фермента намного выше, чем энергия активации при использовании фермента.
Насколько хорошо работают ферменты
Ферменты участвуют в большинстве биохимических реакций и очень хорошо справляются со своей задачей. Типичная биохимическая реакция, для протекания которой без фермента потребовалось бы несколько дней или даже несколько столетий, с надлежащим ферментом, скорее всего, произойдет всего за долю секунды! Без ферментов, ускоряющих биохимические реакции, большинство организмов не смогли бы выжить. Ферменты субстрат-специфичны. Субстратом фермента является конкретное вещество, на которое он действует (рис. \(\PageIndex{3}\)). Каждый фермент работает только с определенным субстратом, что объясняет, почему существует так много разных ферментов. Кроме того, для работы фермента требуются определенные условия, такие как правильная температура и pH. Некоторые ферменты лучше всего работают в кислой среде, например, в то время как другие лучше всего работают в нейтральной среде.
Ферменты субстрат-специфичны. Субстратом фермента является конкретное вещество, на которое он действует (рис. \(\PageIndex{3}\)). Каждый фермент работает только с определенным субстратом, что объясняет, почему существует так много разных ферментов. Кроме того, для работы фермента требуются определенные условия, такие как правильная температура и pH. Некоторые ферменты лучше всего работают в кислой среде, например, в то время как другие лучше всего работают в нейтральной среде.
Энзимодефицитные заболевания
У человека известны сотни наследственных нарушений обмена веществ. В большинстве из них один фермент либо вообще не вырабатывается организмом, либо вырабатывается в неработающей форме. Отсутствующий или дефектный фермент подобен отсутствующему рабочему на сборочном конвейере клетки. Отсутствие нормального фермента означает, что не образуются токсичные химические вещества или не производится необходимый продукт. Как правило, нормальный фермент отсутствует, потому что человек с заболеванием унаследовал две копии генной мутации, которая, возможно, изначально произошла много поколений назад.
Любое наследственное нарушение обмена веществ, как правило, довольно редко встречается среди населения в целом. Однако существует так много различных нарушений обмена веществ, что можно ожидать, что в общей сложности они будут у 1 из 1000–2500 новорожденных. В некоторых этнических группах, таких как ашкеназские евреи (евреи центрально- и восточноевропейского происхождения), уровень определенных наследственных нарушений обмена веществ намного выше.
Рисунок \(\PageIndex{3}\): На рисунке показано, как ферменты превращают субстраты в продукты. субстрат (A) связывается в месте активации фермента (D) и образует комплекс субстрат-фермент (B). Затем фермент превращает субстрат в продукт (С), разрывая или создавая связи между атомами субстрата.Характеристика: Надежные источники
Наиболее распространенным из всех известных нарушений ферментной недостаточности является недостаточность глюкозо-6-фосфат-дегидрогеназы или G6PD. В США это заболевание чаще всего встречается у мужчин афроамериканского происхождения. Фермент G6PD необходим для предотвращения аномального распада эритроцитов. Без фермента эритроциты преждевременно разрушаются, что приводит к анемии.
Фермент G6PD необходим для предотвращения аномального распада эритроцитов. Без фермента эритроциты преждевременно разрушаются, что приводит к анемии.
Выберите одну из следующих тем о дефиците G6PD:
- генетическая основа
- признаки и симптомы
- диагностика и лечение
- распространение по всему миру
Для выбранной вами темы зайдите в Интернет, чтобы узнать о ней больше. Найдите как минимум три источника дополнительной информации, которые вы считаете надежными. Сравните информацию, предоставленную различными источниками, и выявите любые расхождения между ними. При необходимости проведите дополнительное онлайн-исследование, чтобы попытаться найти надежное единодушное мнение по противоречивой проблеме.
Обзор
- Что такое биохимические реакции?
- Дайте определение метаболизму.
- Сравните и сопоставьте катаболические и анаболические реакции.
- Объясните роль ферментов в биохимических реакциях.

- Что такое нарушения ферментной недостаточности?
- Верно или неверно. Метаболизм является одним из видов катаболизма.
- Верно или неверно. Биохимические реакции включают катаболические и анаболические реакции.
- Объясните, почему относительно низкая температура живых существ, а также низкая концентрация реагентов вызывают очень медленное протекание биохимических реакций в организме без участия ферментов.
- Ответьте на следующие вопросы о том, что происходит после того, как вы съедите бутерброд.
- Кусочки бутерброда попадают в желудок, где находятся пищеварительные ферменты, расщепляющие пищу. Какой тип метаболической реакции это? Поясните свой ответ.
- В процессе пищеварения часть бутерброда расщепляется до глюкозы, которая затем расщепляется дальше, чтобы высвободить энергию, которую могут использовать ваши клетки. Это экзергоническая или эндергоническая реакция? Поясните свой ответ.

- Белки в сыре, мясе и хлебе в сэндвиче расщепляются на составляющие их аминокислоты. Затем ваше тело использует эти аминокислоты для создания новых белков. Какая метаболическая реакция представлена образованием этих новых белков? Поясните свой ответ.
- Объясните, почему ваш организм не использует один или два фермента для всех своих биохимических реакций.
- Как называется конкретное вещество, на которое действует фермент в биохимической реакции?
- Фермент – это биологический
- катаболизм
- форма энергии активации
- катализатор
- реагент
Attributions
- Окончательная сборка Брайана Снельсона, лицензия CC BY 2.0 через Wikimedia Commons
- Ферментное действие Ханы Завадской для CK-12 с лицензией CC BY-NC 3.0
- Ферменты от SweetChickaD, лицензия CC BY-NC-SA 2.
 0 через Flickr
0 через Flickr - Текст адаптирован из биологии человека по лицензии CK-12 CC BY-NC 3.0
Эта страница под названием 3.10: Химические реакции в живых существах распространяется под лицензией CK-12 и была создана, изменена и/или курирована Сюзанной Ваким и Мандипом Грюалом посредством исходного контента, который был отредактирован в соответствии со стилем и стандартами LibreTexts. Платформа; подробная история редактирования доступна по запросу.
ПОД ЛИЦЕНЗИЕЙ- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Сюзанна Ваким и Мандип Гревал
- Количество столбцов печати
- Два
- Печать CSS
- Плотный
- Лицензия
- СК-12
- Версия лицензии
- 3,0
- Программа OER или Publisher
- Программа ASCCC OERI
- Показать оглавление
- да
- Теги
- энергия активации
- анаболическая реакция
- биохимические реакции
- катаболическая реакция
- фермент
- метаболизм
- продукт
- реагент
- источник@https://www.
 ck12.org/book/ck-12-human-biology/
ck12.org/book/ck-12-human-biology/
Центральная роль ферментов как биологических катализаторов — Клетка
Фундаментальная задача белков — действовать как ферменты — катализаторы, увеличивающие скорость практически всех химических реакций внутри клеток. Хотя РНК способны катализировать некоторые реакции, большинство биологических реакций катализируются белками. В отсутствие ферментативного катализа большинство биохимических реакций протекают настолько медленно, что не могли бы протекать в умеренных условиях температуры и давления, совместимых с жизнью. Ферменты ускоряют скорость таких реакций более чем в миллион раз, поэтому реакции, которые без катализа заняли бы годы, могут протекать за доли секунд, если их катализирует соответствующий фермент. Клетки содержат тысячи различных ферментов, и их активность определяет, какие из многих возможных химических реакций действительно происходят внутри клетки.
Каталитическая активность ферментов
Как и все другие катализаторы, ферменты характеризуются двумя фундаментальными свойствами. Во-первых, они увеличивают скорость химических реакций, но сами не поглощаются и не изменяются в результате реакции. Во-вторых, они увеличивают скорость реакции, не нарушая химического равновесия между реагентами и продуктами.
Во-первых, они увеличивают скорость химических реакций, но сами не поглощаются и не изменяются в результате реакции. Во-вторых, они увеличивают скорость реакции, не нарушая химического равновесия между реагентами и продуктами.
Эти принципы ферментативного катализа проиллюстрированы в следующем примере, в котором молекула подвергается действию фермента (называемой субстратом [ S ]) в результате реакции превращается в продукт ( P ). В отсутствие фермента реакция может быть записана следующим образом:
Химическое равновесие между S и P определяется законами термодинамики (как обсуждается далее в следующем разделе этой главы) и представлено отношением скоростей прямой и обратной реакции ( S → P и P → S , соответственно). В присутствии соответствующего фермента превращение S в P ускоряется, но равновесие между S и P не изменяется. Следовательно, фермент должен одинаково ускорять и прямую, и обратную реакции. Реакция может быть записана следующим образом:
Реакция может быть записана следующим образом:
Обратите внимание, что фермент ( E ) не изменяется в результате реакции, поэтому химическое равновесие остается неизменным, определяемым исключительно термодинамическими свойствами S и P .
Влияние фермента на такую реакцию лучше всего иллюстрируется энергетическими изменениями, которые должны происходить при превращении S в P (). Равновесие реакции определяется конечными энергетическими состояниями S и P , на которые не влияет ферментативный катализ. Однако для того, чтобы реакция шла, субстрат должен быть сначала преобразован в более высокое энергетическое состояние, называемое переходным состоянием 9.0261 . Энергия, необходимая для достижения переходного состояния (энергия активации), представляет собой барьер для протекания реакции, ограничивая скорость реакции. Ферменты (и другие катализаторы) действуют, уменьшая энергию активации, тем самым увеличивая скорость реакции. Повышенная скорость одинакова как в прямом, так и в обратном направлении, поскольку оба должны пройти через одно и то же переходное состояние.
Повышенная скорость одинакова как в прямом, так и в обратном направлении, поскольку оба должны пройти через одно и то же переходное состояние.
Рисунок 2.22
Энергетические диаграммы для катализируемых и некаталитических реакций. Проиллюстрированная реакция представляет собой простое превращение субстрата S в продукт P. Поскольку конечное энергетическое состояние P ниже, чем у S , реакция протекает слева направо. Для (подробнее…)
Каталитическая активность ферментов заключается в связывании их субстратов с образованием комплекса фермент-субстрат ( ES ). Субстрат связывается с определенной областью фермента, называемой активным центром. Связанный с активным центром субстрат превращается в продукт реакции, который затем высвобождается из фермента. Таким образом, катализируемая ферментом реакция может быть записана следующим образом:
Обратите внимание, что E не меняется в обеих частях уравнения, поэтому равновесие не изменяется. Однако фермент обеспечивает поверхность, на которой реакции превращения S в P могут происходить более легко. Это результат взаимодействий между ферментом и субстратом, которые снижают энергию активации и способствуют образованию переходного состояния.
Однако фермент обеспечивает поверхность, на которой реакции превращения S в P могут происходить более легко. Это результат взаимодействий между ферментом и субстратом, которые снижают энергию активации и способствуют образованию переходного состояния.
Механизмы ферментативного катализа
Связывание субстрата с активным центром фермента представляет собой очень специфическое взаимодействие. Активные центры представляют собой щели или бороздки на поверхности фермента, обычно состоящие из аминокислот из разных частей полипептидной цепи, объединенных в третичную структуру свернутого белка. Субстраты первоначально связываются с активным центром посредством нековалентных взаимодействий, включая водородные связи, ионные связи и гидрофобные взаимодействия. Как только субстрат связывается с активным центром фермента, несколько механизмов могут ускорить его превращение в продукт реакции.
Хотя в простом примере, рассмотренном в предыдущем разделе, использовалась только одна молекула субстрата, большинство биохимических реакций включают взаимодействие между двумя или более различными субстратами. Например, образование пептидной связи предполагает соединение двух аминокислот. Для таких реакций связывание двух или более субстратов с активным центром в правильном положении и ориентации ускоряет реакцию (1). Фермент обеспечивает матрицу, на которой реагенты собираются вместе и должным образом ориентируются, чтобы способствовать образованию переходного состояния, в котором они взаимодействуют.
Например, образование пептидной связи предполагает соединение двух аминокислот. Для таких реакций связывание двух или более субстратов с активным центром в правильном положении и ориентации ускоряет реакцию (1). Фермент обеспечивает матрицу, на которой реагенты собираются вместе и должным образом ориентируются, чтобы способствовать образованию переходного состояния, в котором они взаимодействуют.
Рисунок 2.23
Ферментативный катализ реакции между двумя субстратами. Фермент обеспечивает матрицу, на которой два субстрата соединяются вместе в правильном положении и ориентации для взаимодействия друг с другом.
Ферменты ускоряют реакции также путем изменения конформации их субстратов, приближая их к конформации переходного состояния. Простейшей моделью взаимодействия фермент-субстрат является модель типа «замок-ключ» , в которой субстрат точно вписывается в активный центр (). Однако во многих случаях конфигурация как фермента, так и субстрата модифицируется за счет связывания субстрата — процесс, называемый индуцированная посадка . В таких случаях конформация субстрата изменяется так, что она больше напоминает переходное состояние. Напряжение, создаваемое таким искажением подложки, может дополнительно способствовать ее переходу в переходное состояние за счет ослабления критических связей. Более того, переходное состояние стабилизируется его прочным связыванием с ферментом, что снижает необходимую энергию активации.
В таких случаях конформация субстрата изменяется так, что она больше напоминает переходное состояние. Напряжение, создаваемое таким искажением подложки, может дополнительно способствовать ее переходу в переходное состояние за счет ослабления критических связей. Более того, переходное состояние стабилизируется его прочным связыванием с ферментом, что снижает необходимую энергию активации.
Рисунок 2.24
Модели фермент-субстратного взаимодействия. (A) В модели «замок-ключ» субстрат точно соответствует активному центру фермента. (B) В модели индуцированного соответствия связывание субстрата искажает конформации как субстрата, так и фермента. Это искажение (далее…)
В дополнение к объединению нескольких субстратов и искажению конформации субстратов для приближения к переходному состоянию многие ферменты непосредственно участвуют в каталитическом процессе. В таких случаях специфические боковые цепи аминокислот в активном центре могут реагировать с субстратом и образовывать связи с промежуточными продуктами реакции.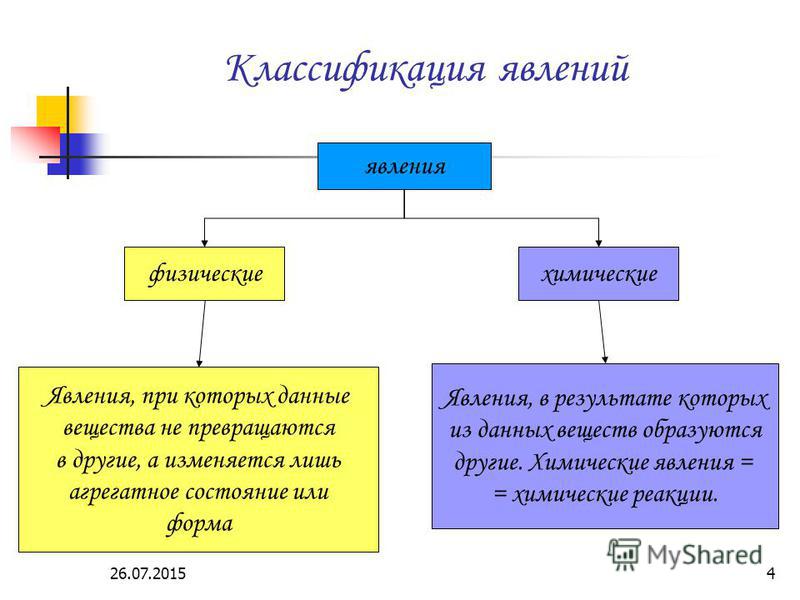 Кислые и основные аминокислоты часто участвуют в этих каталитических механизмах, как показано в последующем обсуждении химотрипсина как примера ферментативного катализа.
Кислые и основные аминокислоты часто участвуют в этих каталитических механизмах, как показано в последующем обсуждении химотрипсина как примера ферментативного катализа.
Химотрипсин относится к семейству ферментов (сериновых протеаз), которые расщепляют белки, катализируя гидролиз пептидных связей. Реакция может быть записана следующим образом:
Различные представители семейства сериновых протеаз (включая химотрипсин, трипсин, эластазу и тромбин) обладают различной субстратной специфичностью; они преимущественно расщепляют пептидные связи, расположенные рядом с разными аминокислотами. Например, в то время как химотрипсин расщепляет связи рядом с гидрофобными аминокислотами, такими как триптофан и фенилаланин, трипсин расщепляет связи рядом с основными аминокислотами, такими как лизин и аргинин. Однако все сериновые протеазы сходны по структуре и используют один и тот же механизм катализа. Активные центры этих ферментов содержат три критически важные аминокислоты — серин, гистидин и аспартат, — которые управляют гидролизом пептидной связи. Действительно, эти ферменты называются сериновыми протеазами из-за центральной роли остатка серина.
Действительно, эти ферменты называются сериновыми протеазами из-за центральной роли остатка серина.
Субстраты связываются с сериновыми протеазами путем встраивания аминокислоты, примыкающей к сайту расщепления, в карман в активном центре фермента (). Природа этого кармана определяет субстратную специфичность различных членов семейства сериновых протеаз. Например, связывающий карман химотрипсина содержит гидрофобные аминокислоты, которые взаимодействуют с гидрофобными боковыми цепями его предпочтительных субстратов. Напротив, связывающий карман трипсина содержит отрицательно заряженную кислую аминокислоту (аспартат), которая способна образовывать ионную связь с остатками лизина или аргинина своих субстратов.
Рисунок 2.25
Связывание субстрата сериновыми протеазами. Аминокислота, примыкающая к расщепляемой пептидной связи, вставляется в карман в активном центре фермента. У химотрипсина карман связывает гидрофобные аминокислоты; связывающий карман трипсина содержит (подробнее. ..)
..)
Связывание субстрата позиционирует расщепляемую пептидную связь рядом с активным центром серина (). Затем протон этого серина переносится в активный центр гистидина. Конформация активного центра способствует переносу протона, поскольку гистидин взаимодействует с отрицательно заряженным аспартатным остатком. Серин реагирует с субстратом, образуя тетраэдрическое переходное состояние. Затем пептидная связь расщепляется, и С-концевая часть субстрата высвобождается из фермента. Однако N-концевой пептид остается связанным с серином. Эта ситуация разрешается, когда молекула воды (второй субстрат) входит в активный центр и обращает предшествующие реакции. Протон молекулы воды переносится на гистидин, а его гидроксильная группа – на пептид, образуя второе тетраэдрическое переходное состояние. Затем протон переносится с гистидина обратно на серин, а пептид высвобождается из фермента, завершая реакцию.
Рисунок 2.26
Каталитический механизм химотрипсина. Три аминокислоты в активном центре (Ser-195, His-57 и Asp-102) играют решающую роль в катализе.
Этот пример иллюстрирует некоторые особенности ферментативного катализа; специфичность фермент-субстратных взаимодействий, расположение различных молекул субстрата в активном центре и участие остатков активного центра в формировании и стабилизации переходного состояния. Хотя тысячи ферментов в клетках катализируют множество различных типов химических реакций, в их работе применяются одни и те же основные принципы.
Коэнзимы
Помимо связывания своих субстратов, активные центры многих ферментов связывают другие малые молекулы, участвующие в катализе. Простетические группы представляют собой небольшие молекулы, связанные с белками, в которых они играют важную функциональную роль. Например, кислород, переносимый миоглобином и гемоглобином, связан с гемом, простетической группой этих белков. Во многих случаях ионы металлов (например, цинка или железа) связаны с ферментами и играют центральную роль в каталитическом процессе. Кроме того, различные низкомолекулярные органические молекулы участвуют в специфических типах ферментативных реакций. Эти молекулы называются коферментами, потому что они работают вместе с ферментами, увеличивая скорость реакции. В отличие от субстратов коферменты не изменяются необратимо в результате реакций, в которых они участвуют. Скорее, они перерабатываются и могут участвовать во многих ферментативных реакциях.
Эти молекулы называются коферментами, потому что они работают вместе с ферментами, увеличивая скорость реакции. В отличие от субстратов коферменты не изменяются необратимо в результате реакций, в которых они участвуют. Скорее, они перерабатываются и могут участвовать во многих ферментативных реакциях.
Коферменты служат переносчиками нескольких типов химических групп. Ярким примером кофермента является никотинамидадениндинуклеотид ( НАД + ), который функционирует как переносчик электронов в окислительно-восстановительных реакциях (). НАД + может принять ион водорода (Н + ) и два электрона (е — ) с одного субстрата, образуя НАДН. Затем NADH может отдавать эти электроны второму субстрату, вновь образуя NAD + . Таким образом, НАД + переносит электроны с первого субстрата (который окисляется) на второй (который восстанавливается).
Рис. 2.27
Роль НАД + в окислительно-восстановительных реакциях. (A) Никотинамидадениндинуклеотид (НАД + ) действует как переносчик электронов в окислительно-восстановительных реакциях, принимая электроны (е — ) с образованием НАДН. (B) Например, NAD + может принимать электроны от одного субстрата (подробнее…)
(A) Никотинамидадениндинуклеотид (НАД + ) действует как переносчик электронов в окислительно-восстановительных реакциях, принимая электроны (е — ) с образованием НАДН. (B) Например, NAD + может принимать электроны от одного субстрата (подробнее…)
Несколько других коферментов также действуют как переносчики электронов, а третьи участвуют в переносе множества дополнительных химических групп (например, , карбоксильные группы и ацильные группы; ). Одни и те же коферменты действуют вместе с множеством различных ферментов, катализируя перенос определенных химических групп между широким спектром субстратов. Многие коферменты тесно связаны с витаминами, которые частично или полностью составляют структуру кофермента. Витамины не требуются бактериям, таким как E. coli , но являются необходимыми компонентами рациона человека и других высших животных, утративших способность синтезировать эти соединения.
Таблица 2.1
Примеры коферментов и витаминов.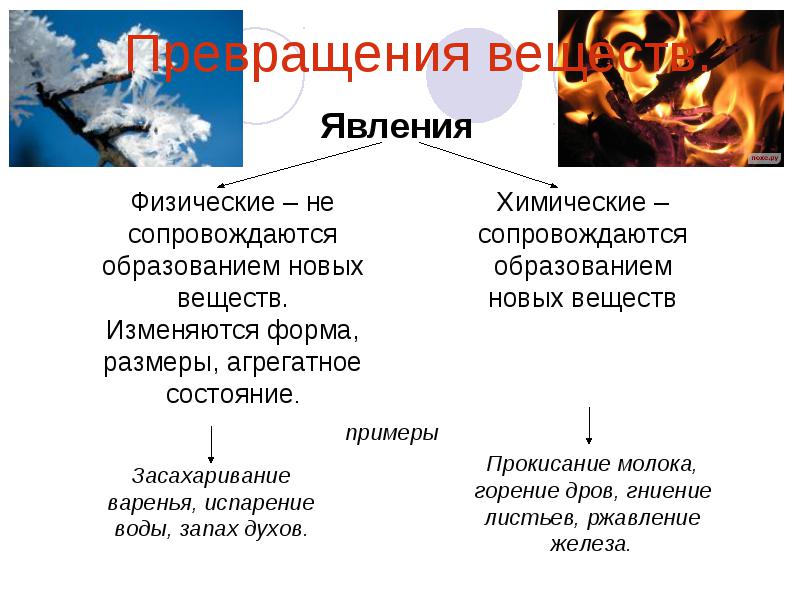
Регулирование активности ферментов
Важной особенностью большинства ферментов является то, что их активность не постоянна, а может модулироваться. То есть активность ферментов можно регулировать так, чтобы они функционировали надлежащим образом для удовлетворения различных физиологических потребностей, которые могут возникнуть в течение жизни клетки.
Одним из распространенных типов регуляции ферментов является ингибирование по принципу обратной связи, при котором продукт метаболического пути ингибирует активность фермента, участвующего в его синтезе. Например, аминокислота изолейцин синтезируется серией реакций, начиная с аминокислоты треонина (). Первый этап пути катализируется ферментом треониндезаминазой, которая ингибируется изолейцином, конечным продуктом пути. Таким образом, достаточное количество изолейцина в клетке ингибирует треониндезаминазу, блокируя дальнейший синтез изолейцина. Если концентрация изолейцина снижается, ингибирование по принципу обратной связи снимается, треониндезаминаза больше не ингибируется и синтезируется дополнительный изолейцин. Регулируя таким образом активность треониндезаминазы, клетка синтезирует необходимое количество изолейцина, но избегает затрат энергии на синтез большего количества изолейцина, чем необходимо.
Регулируя таким образом активность треониндезаминазы, клетка синтезирует необходимое количество изолейцина, но избегает затрат энергии на синтез большего количества изолейцина, чем необходимо.
Рисунок 2.28
Подавление обратной связи. Первый этап превращения треонина в изолейцин катализируется ферментом треониндезаминазой. Активность этого фермента ингибируется изолейцином, конечным продуктом пути.
Ингибирование по принципу обратной связи является одним из примеров аллостерической регуляции, при которой активность фермента контролируется путем связывания малых молекул с регуляторными участками фермента (). Термин «аллостерическая регуляция» происходит от того факта, что регуляторные молекулы связываются не с каталитическим участком, а с отдельным участком на белке (9).0258 алло = «другое» и steric = «сайт»). Связывание регуляторной молекулы изменяет конформацию белка, что, в свою очередь, изменяет форму активного центра и каталитическую активность фермента. В случае треониндезаминазы связывание регуляторной молекулы (изолейцина) ингибирует ферментативную активность. В других случаях регуляторные молекулы служат активаторами, стимулируя, а не ингибируя ферменты-мишени.
В случае треониндезаминазы связывание регуляторной молекулы (изолейцина) ингибирует ферментативную активность. В других случаях регуляторные молекулы служат активаторами, стимулируя, а не ингибируя ферменты-мишени.
Рисунок 2.29
Аллостерическая регуляция. В этом примере активность фермента ингибируется связыванием регуляторной молекулы с аллостерическим сайтом. В отсутствие ингибитора субстрат связывается с активным центром фермента, и реакция протекает. Переплет (далее…)
Активность ферментов также можно регулировать путем их взаимодействия с другими белками и ковалентными модификациями, такими как добавление фосфатных групп к остаткам серина, треонина или тирозина. Фосфорилирование является особенно распространенным механизмом регуляции активности ферментов; добавление фосфатных групп либо стимулирует, либо ингибирует активность многих различных ферментов (). Например, мышечные клетки реагируют на эпинефрин (адреналин), расщепляя гликоген на глюкозу, тем самым обеспечивая источник энергии для повышения мышечной активности.
 Диди весит 3 кг, Фифи 3,5 кг, а Мими 4,5 кг.
Диди весит 3 кг, Фифи 3,5 кг, а Мими 4,5 кг. Знайдіть інші сторони трикутника.
Знайдіть інші сторони трикутника. какой будет %
какой будет %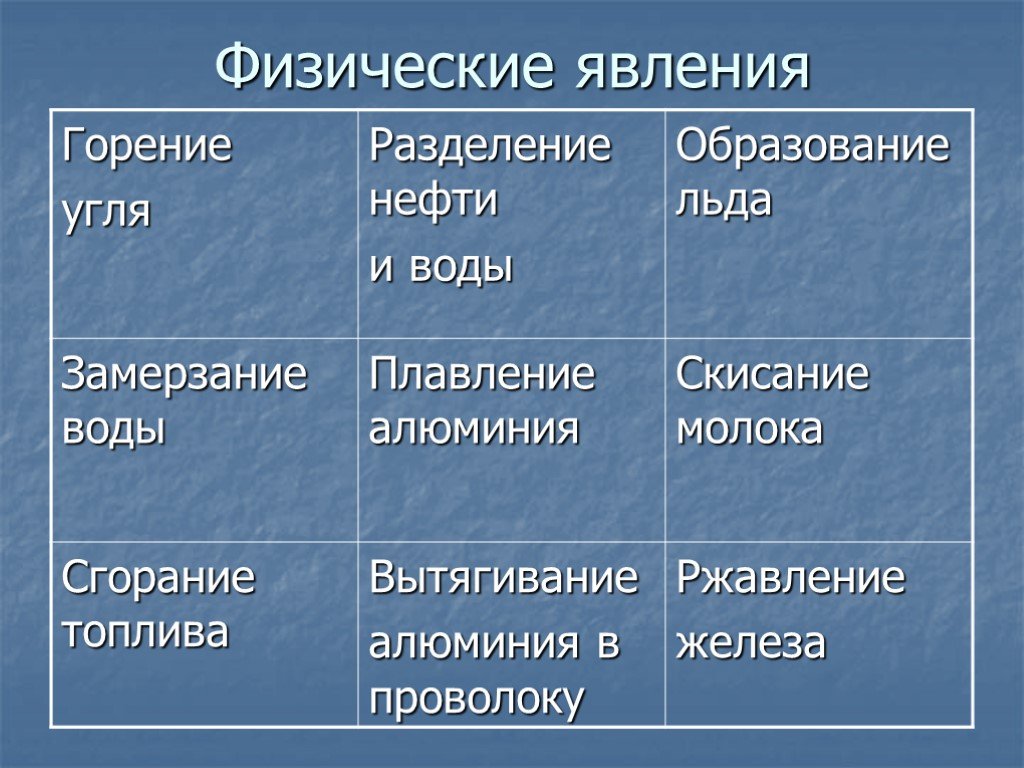

 0 через Flickr
0 через Flickr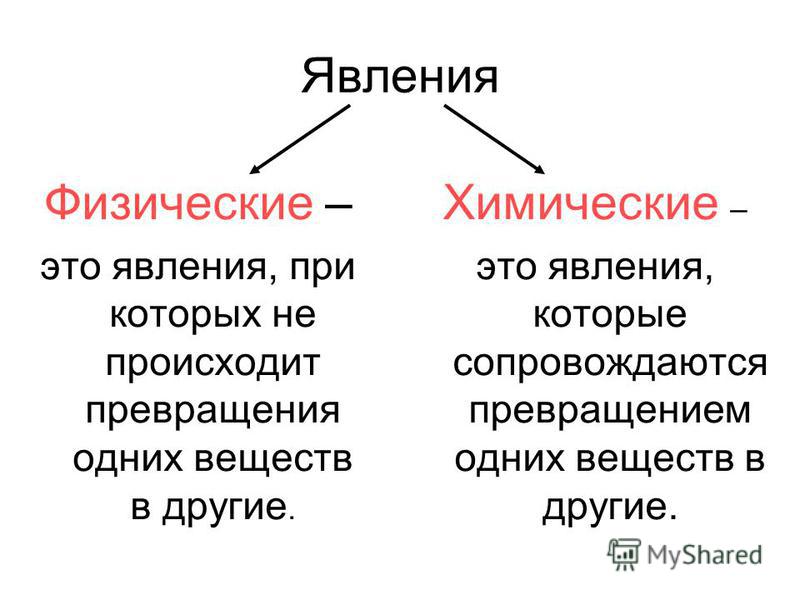 ck12.org/book/ck-12-human-biology/
ck12.org/book/ck-12-human-biology/