Показатели вегетативного гомеостаза как предикторы индивидуального риска развития инсульта и их динамика на фоне лечения актовегином
Международные крупномасштабные исследования демонстрируют тесную связь сердечно-сосудистой патологии с риском развития инсульта [1, 2]. Большинство авторов [3—7] среди основных этиопатогенетических факторов инсульта особо выделяют артериальную гипертензию (АГ), атеросклероз, аномалии строения и деформации артериального русла, гемореологические и кардиоаритмические расстройства.
В то же время накоплен значительный объем сведений о неотъемлемом участии автономной дизрегуляции в развитии АГ и нарушений сердечного ритма (СР), которые в свою очередь ведут к формированию так называемого кардиоцеребрального синдрома, усугубляющего течение не только острых нарушений мозгового кровообращения, но и хронической ишемии головного мозга (ХИГМ) [8—11].
Ряд авторов [12—15] утверждают, что именно вегетативно-сосудистая дисфункция как отдельное (первичное) заболевание вегетативной нервной системы (ВНС) является пусковым фактором в развитии кардиоваскулярных нарушений и возникновении начальных проявлений ХИГМ.
Существует и противоположная точка зрения. Часть исследователей склоняются к тому, что вегетативный гомеостаз у пациентов с ХИГМ изменяется вторично на фоне развивающихся сосудистых нарушений в образованиях промежуточного мозга, который является своеобразным «высшим вегетативным центром» [16—18].
В рамках формирования кардиоваскулярных расстройств при ХИГМ патологию ВНС традиционно связывают с избыточной активностью симпатоадреналовой системы [19—23]. Кроме того, в литературе имеются сведения о том, что функциональные и структурные изменения, приводящие к развитию АГ и аритмий, могут локализовываться не только в центральном, но и в афферентно-эфферентном звене нейрогенного контура регуляции кровообращения [24—27]. Таким образом, динамика показателей вегетативного гомеостаза на уровне центрального и периферического звеньев ВНС может выступать прогностическим маркером в развитии кардиоцеребрального синдрома при ХИГМ.
Как было упомянуто выше, наличие кардиоцеребрального синдрома усугубляет течение как хронической, так и острой цереброваскулярной патологии. Следовательно, можно говорить о том, что он служит предиктором индивидуального риска развития инсульта в первом случае и предиктором риска летального исхода — во втором. Однако необходимо подчеркнуть, что в то время как связь вегетативных расстройств с фатальными аритмиями и внезапной сердечной смертью при острой ишемии головного мозга имеет обширную доказательную базу, индивидуальный риск развития инсульта при ХИГМ с позиций изменения вегетативного гомеостаза до настоящего времени не изучался [1, 2, 28—30].
Следовательно, можно говорить о том, что он служит предиктором индивидуального риска развития инсульта в первом случае и предиктором риска летального исхода — во втором. Однако необходимо подчеркнуть, что в то время как связь вегетативных расстройств с фатальными аритмиями и внезапной сердечной смертью при острой ишемии головного мозга имеет обширную доказательную базу, индивидуальный риск развития инсульта при ХИГМ с позиций изменения вегетативного гомеостаза до настоящего времени не изучался [1, 2, 28—30].
С учетом того, что при хронической ишемии в вертебрально-базилярной системе (ВБС) патологический процесс локализуется преимущественно в стволовых структурах головного мозга, предиктивными маркерами индивидуального риска развития инсульта у данной категории пациентов мы считали изменения показателей вегетативного гомеостаза, которые характеризуют работу центрального и автономного контуров вегетативной регуляции по барорефлекторному и рефлекторному каналам (рис. 1) [31]. Такой подход позволил комплексно оценивать степень кардиоваскулярной и кардиореспираторной дисфункций у каждого пациента на этапах до и после лечения путем сравнительного анализа параметров состояния центральных и периферических вегетативных компонентов.
Известно, что тяжесть течения ишемического процесса вне зависимости от страдания центральных или периферических структур нервной системы в конечном итоге определяется особенностями вторичных неспецифических метаболических расстройств, степенью дестабилизации клеточных мембран, а также возможностями реактивации структурных и ферментных белков в условиях гипоксии [32].
Руководствуясь общепринятыми классификациями, гипоксию при ХИГМ можно определить как вторичную тканевую гипоксию на фоне первичной циркуляторной [33]. Так как основным энергетическим субстратом для нервной системы является глюкоза, при циркуляторной гипоксии в первую очередь нарушаются углеводный и, как следствие, энергетический обмены (табл. 1). Дефицит макроэргов и уменьшение содержания АТФ в клетках приводят к компенсаторному усилению гликолиза, но за счет того, что он протекает в анаэробных условиях, в организме снижается содержание пировиноградной и повышается содержание молочной кислоты. Развивается метаболический ацидоз, который в свою очередь приводит к нарушению метаболизма липидов и белков. Нарушение обменных процессов обусловливает структурно-функциональные изменения и повреждение клеток с последующим развитием гипоксического и свободнорадикального некробиоза нейронов. На данном этапе начинается формирование вторичной тканевой гипоксии. Морфологическим субстратом при этом выступают снижение скорости окислительного фосфорилирования в митохондриях и дезинтеграция структуры митохондриальных мембран. Недостаточность АТФ в клетке ведет к утрате нормального калий-натриевого градиента, гипергидратации и набуханию клетки, в результате чего уменьшается потенциал покоя — клетки становятся менее возбудимыми и не способными к межклеточному взаимодействию. Прогрессирующий ацидоз вызывает денатурацию клеточных белков и помутнение цитоплазмы. «Мутное набухание» клетки — один из типичных признаков ранней обратимой стадии некробиоза при гипоксии [34, 35]. В случае усугубления ишемии, на глубоких стадиях гипоксического некробиоза, ключевую роль играет увеличение содержания ионизированного внутриклеточного кальция.
Развивается метаболический ацидоз, который в свою очередь приводит к нарушению метаболизма липидов и белков. Нарушение обменных процессов обусловливает структурно-функциональные изменения и повреждение клеток с последующим развитием гипоксического и свободнорадикального некробиоза нейронов. На данном этапе начинается формирование вторичной тканевой гипоксии. Морфологическим субстратом при этом выступают снижение скорости окислительного фосфорилирования в митохондриях и дезинтеграция структуры митохондриальных мембран. Недостаточность АТФ в клетке ведет к утрате нормального калий-натриевого градиента, гипергидратации и набуханию клетки, в результате чего уменьшается потенциал покоя — клетки становятся менее возбудимыми и не способными к межклеточному взаимодействию. Прогрессирующий ацидоз вызывает денатурацию клеточных белков и помутнение цитоплазмы. «Мутное набухание» клетки — один из типичных признаков ранней обратимой стадии некробиоза при гипоксии [34, 35]. В случае усугубления ишемии, на глубоких стадиях гипоксического некробиоза, ключевую роль играет увеличение содержания ионизированного внутриклеточного кальция.
При развитии острой и ХИГМ в клинике используется целый ряд препаратов, оказывающих разнонаправленное действие. Выбор актовегина для лечения пациентов был продиктован влиянием данного препарата на вышеописанные патогенетические механизмы развития гипоксии при ХИГМ.
Актовегин — депротеинизированный гемодериват (лиофилизат и ультрафильтрат) плазмы крови молочных телят, обладающий антигипоксантным действием, активизирующий обмен веществ в тканях, улучшающий их трофику и стимулирующий процессы регенерации.
 Кроме того, актовегин влияет на образование различных факторов роста и/или действует на их рецепторы, купируя прогрессирование апоптоза, а также блокирует запускающие его цистеиновые протеинкиназы (каспаз) [38].
Кроме того, актовегин влияет на образование различных факторов роста и/или действует на их рецепторы, купируя прогрессирование апоптоза, а также блокирует запускающие его цистеиновые протеинкиназы (каспаз) [38].Влияние актовегина на звенья патологического каскада при первичной циркуляторной и вторичной тканевой гипоксии представлено на рис. 2.
Таким образом, актовегин способен блокировать расстройства энергометаболизма на первых этапах как общей, так и тканевой гипоксии, поддерживая тем самым системный и внутриклеточный гомеостаз в организме пациентов с ХИГМ.
Мы полагаем, что опосредованно актовегин может благотворно влиять и на состояние симпатоадреналовой системы, которая, как известно, при гипоксических явлениях имеет тенденцию к чрезмерной активации с выбросом катехоламинов и глюкокортикостероидов, что изначально является реакцией адаптации, но затем довольно быстро трансформируется в дезадаптационный процесс [39].
Цель настоящей работы — определение индивидуального риска развития инсульта в ближайшие 10 лет у пациентов, страдающих ХИГМ с дисциркуляцией преимущественно в ВБС, выявление предикторов данного риска и оценка его динамики на фоне лечения актовегином, который нивелирует патологические процессы системной и тканевой гипоксии стволовых структур и корригирует проявления дезадаптационного синдрома опосредованным влиянием на центральные и периферические вегетативные структуры.
Материал и методы
В исследовании приняли участие 54 пациента в возрасте 62,1±8,6 года с ХИГМ преимущественно в ВБС с поражением в основном стволовых структур, что было подтверждено ультразвуковыми и нейровизуализационными методами. Были отобраны пациенты, не принимающие регулярной антигипертензивной терапии, и исключены лица, страдающие мерцательной аритмией, сахарным диабетом, а также имеющие снижение толерантности к глюкозе по данным биохимического анализа крови.
Клинические проявления у пациентов с ХИГМ с преимущественным поражением стволовых структур отличались характерными полисимптомностью и мозаичностью, обусловленными особенностями кровоснабжения головного мозга сосудами ВББ. Было выявлено сочетание атактического и кохлеовестибулярного синдромов со зрительными и/или глазодвигательными нарушениями.
По данным экстракраниального и транскраниального ультразвукового дуплексного сканирования, выполненного на ультразвуковой установке экспертного класса Vivid 7 PRO «GE Medical Systems» (США), у всех пациентов выявлялось сочетание гипоплазии и/или деформации позвоночных артерий в I и II сегментах с их атеросклеротическим стенозированием менее 50%.
На МР-томограммах головного мозга отмечались мелкоочаговые и диффузные постгипоксические изменения в мозжечке, стволе, зрительном бугре, затылочных долях и медиобазальных отделах височных долей. МРТ выполнялась на установках серии Magnetom фирмы «Siemens» (Германия) с напряженностью магнитного поля 1,5 и 2 Тл.
В рамках исследования предусматривалось 3 визита. При каждом визите выполнялся комплекс обследований: тестирование по модифицированной Фремингемской шкале (МФШ), суточное мониторирование АД, исследование вариабельности ритма сердца (ВРС).
Тестирование и анализ данных по МФШ проводились для определения индивидуального риска развития инсульта согласно коллегиальным рекомендациям Научного общества специалистов по проблемам женского здоровья, Всероссийского научного медицинского общества терапевтов, Общества специалистов по сердечной недостаточности, Всероссийского научного общества кардиологов, Антигипертензивной Лиги [40]. Для расчета риска развития инсульта в ближайшие 10 лет использовалась специальная таблица (табл. 2). Риск в пределах 1—10% условились считать низким, в пределах 11—15% — средним, в пределах 16—20% — высоким, а при значениях 21% и более — очень высоким.
Для расчета риска развития инсульта в ближайшие 10 лет использовалась специальная таблица (табл. 2). Риск в пределах 1—10% условились считать низким, в пределах 11—15% — средним, в пределах 16—20% — высоким, а при значениях 21% и более — очень высоким.
Суточное мониторирование АД проводилось при помощи прибора BPLab фирмы ООО «Петр Телегин» (Нижний Новгород). Регистрировались среднесуточные значения АД. О наличии АГ судили по среднесуточному АД >130/80 мм рт.ст. [40, 41]. Характеристики полученных суточных профилей АД принимались во внимание при подборе индивидуальных дозировок и времени приема гипотензивных средств.
Исследование ВРС выполняли по стандартной методике при помощи прибора ВНС-Спектр фирмы ООО «Нейрософт» (Иваново) [11, 42]. Проводились фоновая проба, проба с глубоким управляемым дыханием, проба Вальсальвы и активная ортостатическая проба (АОП). Анализировались следующие показатели вегетативного гомеостаза: 1) соотношение величины высокочастотных колебаний к величине низкочастотных колебаний в фоновой пробе (LF/HFфон), характеризующее баланс симпатического и парасимпатического отделов ВНС в состоянии покоя [11, 43, 44]; 2) показатель кардиореспираторной синхронизации (KRS), отражающий особенности взаимодействия между дыхательным и сердечно-сосудистым центрами ствола головного мозга и позволяющий судить о регуляторно-адаптивных возможностях организма [45]; 3) коэффициент дыхания (Кдых), определяющий функцию дыхательного контура, опосредуемую через парасимпатическую часть барорефлекторной дуги [46]; 4) коэффициенты симпатических и парасимпатических барорецепторов (КБРс и КБРп/с), дающие представление о функциональных возможностях данных барорецепторов; 5) коэффициент 30/15 (К30/15), предназначенный для оценки реактивности блуждающего нерва; 6) соотношение LF/HF при выполнении АОП (LF/HFаоп), характеризующее баланс симпатического и парасимпатического отделов ВНС при предъявлении нагрузки; 7) показатель процента прироста/убыли соотношения LF/HF (% п/у LF/HF), являющийся мерой адаптационных резервов организма. Интерпретация полученных данных производилась на основе их сравнения с общепринятыми значениями соответствующих коэффициентов (табл. 3, 4, 5) [11, 42], а также со значениями оригинально разработанных нами коэффициентов, определенными в предыдущих работах у относительно здоровых испытуемых, сопоставимых по полу и возрасту с наблюдаемыми пациентами (табл. 6) [47].
Интерпретация полученных данных производилась на основе их сравнения с общепринятыми значениями соответствующих коэффициентов (табл. 3, 4, 5) [11, 42], а также со значениями оригинально разработанных нами коэффициентов, определенными в предыдущих работах у относительно здоровых испытуемых, сопоставимых по полу и возрасту с наблюдаемыми пациентами (табл. 6) [47].
После обследования при первом визите пациентам назначали антигипертензивную терапию по двум схемам: каждый нечетный по выборке пациент в ближайшие 2 нед должен был принимать селективный бета1-адреноблокатор метопролол, каждый четный — ингибитор ангиотензинпревращающего фер-мента (ИАПФ) эналаприл в индивидуально подобранных дозировках с учетом среднесуточных цифр АД. В среднем суточная доза метопролола колебалась по подгруппе в пределах 50—100 мг, эналаприла — 15—40 мг. Терапию антигипертензивными препаратами проводили с целью достичь у всех испытуемых желаемого уровня среднесуточного САД — 130—140 мм рт.ст., что должно было уменьшить вклад данного фактора в общую сумму риска по МФШ до 5—6 баллов.
Со второго (0+2 нед) визита подключали терапию актовегином. Актовегин назначали курсом продолжительностью 1,5 мес внутривенно в дозе 1000 мг/сут в течение 2 нед, затем в таблетках по 200 мг 3 раза в день в течение 4 нед. Для исключения влияния эффекта плацебо и контроля реальной эффективности терапии из каждой группы в случайном порядке при помощи средств пакета MS Excel отбирали 10 пациентов, получавших вместо актовегина чистый физиологический раствор внутривенно, а затем нейробион в таблетках.
Третий (0+8 нед) визит являлся контрольным.
Статистическая обработка полученных данных проводилась на персональном компьютере с применением программных продуктов Microsoft Office Excel 2007 и Statistica 6.0. Качественный анализ сводился к вычислению абсолютных и относительных частот для каждого изучаемого признака. Относительные величины представлены в виде целых чисел со знаком %. Тип распределения количественных признаков определялся при помощи критерия нормальности Шапиро—Уилка. В зависимости от типа распределения все данные представлены в виде М± s среднее (одно стандартное отклонение), либо в виде Ме (25;75) (медиана (25-й и 75-й квартили)). При сравнительном анализе для всех показателей использовали непараметрический тест Манна—Уитни. Различия считались достоверными при уровне значимости р<0,05.
В зависимости от типа распределения все данные представлены в виде М± s среднее (одно стандартное отклонение), либо в виде Ме (25;75) (медиана (25-й и 75-й квартили)). При сравнительном анализе для всех показателей использовали непараметрический тест Манна—Уитни. Различия считались достоверными при уровне значимости р<0,05.
Результаты и обсуждение
При первоначальной оценке риск развития инсульта в ближайшие 10 лет оказался очень высоким у 57% пациентов, высоким — у 13% пациентов, средним — у 21% пациентов и низким — лишь у 9% пациентов. При этом в группе с очень высоким риском вероятность развития инсульта в ближайшие 10 лет варьировала в пределах от 22 до 57%.
Среднесуточные значения САД свидетельствовали о наличии АГ у всех пациентов и колебались в пределах 157—197 мм рт.ст. При этом анализ МФШ при исключении других факторов показал прямую зависимость роста риска развития инсульта от величины САД как у мужчин, так и у женщин (рис. 3).
3).
Анализ состояния периферической части барорефлекторно-рефлекторной (БР) дуги показал, что функция блуждающего нерва у всех обследованных пациентов оставалась сохранной, а показатели функций как симпатических (БРс), так и парасимпатических (БРп/с) барорецепторов находились в диапазоне пограничных значений у большей части и укладывались в интервал возрастной нормы у меньшей части пациентов без четкой обоюдной зависимости. В то же время при оценке реактивности дыхательного контура, которая опосредуется только через парасимпатические структуры БР дуги (блуждающий нерв и БРп/с), в большинстве случаев (91%) были получены адекватные значения показателя Кдых, что могло свидетельствовать о вторичном, преходящем характере БР несостоятельности, выявляемой при прицельном исследовании функции БРс и БРп/с в пробе Вальсальвы.
По профилю ВРС при проведении фоновой пробы относительный баланс определялся лишь у 7% пациентов, в то время как у 93% больных он имел гиперсимпатическую направленность со значениями показателя LF/HFфон по группе в диапазоне 1,36 (1,29; 1,47) у. е. При проведении АОП у всех пациентов наблюдалось выраженное смещение вегетативного баланса в сторону преобладания симпатических влияний (в 57% случаев увеличение показателя LF/HFаоп >7,5 у.е., в 35% — >9 у.е., в 8% — >10,5 у.е.), что было обусловлено не только гиперактивацией симпатических стволовых структур, но и снижением вклада парасимпатических влияний в модуляцию СР.
е. При проведении АОП у всех пациентов наблюдалось выраженное смещение вегетативного баланса в сторону преобладания симпатических влияний (в 57% случаев увеличение показателя LF/HFаоп >7,5 у.е., в 35% — >9 у.е., в 8% — >10,5 у.е.), что было обусловлено не только гиперактивацией симпатических стволовых структур, но и снижением вклада парасимпатических влияний в модуляцию СР.
Состояние адаптационных резервов организма соответствовало перенапряжению адаптации у всех рандомизированных пациентов.
По истечении 2 нед гипотензивной терапии результаты анкетирования по МФШ выглядели следующим образом: 1) по всей выборке очень высокий риск — 50% пациентов, высокий риск — 13%, средний риск — 26%, низкий риск — 11% пациентов; 2) в подгруппе метопролола: очень высокий риск — 44% пациентов, высокий риск — 15%, средний риск — 26%, низкий риск — 15%; 3) в подгруппе эналаприла: очень высокий риск — 56% пациентов, высокий риск — 11%, средний риск — 26%, низкий риск — 7%.
При этом среднесуточные величины САД, по данным суточного мониторирования АД, у пациентов, принимавших метопролол, укладывались в заданный целевой диапазон и колебались в пределах 126—141 мм рт. ст., а у пациентов, принимавших эналаприл, даже при назначении максимальной суточной дозы были несколько выше желаемых значений и находились в пределах 138—147 мм рт.ст. Сравнение категоризированных величин САД по группам также показало, что эффективность гипотензивной терапии метопрололом в целом была достоверно выше (U-критерий Манна—Уитни, p<0,01) (рис. 4). Учитывая картину вегетативных профилей, полученных при обследовании при первом визите, можно считать антигипертензивную терапию, проводимую в подгруппе метопролола, патогенетической, а антигипертензивную терапию, проводимую в подгруппе эналаприла, — симптоматической. Известно, что одним из механизмов гипотензивного действия метопролола является восстановление чувствительности барорецепторов дуги аорты, что, на наш взгляд, делает его назначение более обоснованным при выявлении вегетативной дисфункции по барорефлекторному каналу. Основной механизм действия эналаприла связан с прямым уменьшением образования ангиотензина II и секреции альдостерона.
ст., а у пациентов, принимавших эналаприл, даже при назначении максимальной суточной дозы были несколько выше желаемых значений и находились в пределах 138—147 мм рт.ст. Сравнение категоризированных величин САД по группам также показало, что эффективность гипотензивной терапии метопрололом в целом была достоверно выше (U-критерий Манна—Уитни, p<0,01) (рис. 4). Учитывая картину вегетативных профилей, полученных при обследовании при первом визите, можно считать антигипертензивную терапию, проводимую в подгруппе метопролола, патогенетической, а антигипертензивную терапию, проводимую в подгруппе эналаприла, — симптоматической. Известно, что одним из механизмов гипотензивного действия метопролола является восстановление чувствительности барорецепторов дуги аорты, что, на наш взгляд, делает его назначение более обоснованным при выявлении вегетативной дисфункции по барорефлекторному каналу. Основной механизм действия эналаприла связан с прямым уменьшением образования ангиотензина II и секреции альдостерона. Принимая во внимание фармакодинамику представленных препаратов, мы полагаем, что преходящая барорефлекторная несостоятельность у пациентов нивелировалась на фоне приема метопролола и не ответила на терапию эналаприлом. Таким образом, полученные данные подтверждают обоснованность подбора патогенетической гипотензивной терапии с учетом особенностей вегетативной дизрегуляции, несмотря на то что ИАПФ признаны «золотым стандартом» в лечении АГ.
Принимая во внимание фармакодинамику представленных препаратов, мы полагаем, что преходящая барорефлекторная несостоятельность у пациентов нивелировалась на фоне приема метопролола и не ответила на терапию эналаприлом. Таким образом, полученные данные подтверждают обоснованность подбора патогенетической гипотензивной терапии с учетом особенностей вегетативной дизрегуляции, несмотря на то что ИАПФ признаны «золотым стандартом» в лечении АГ.
При исследовании вегетативного профиля статистически значимой динамики показателей вегетативного гомеостаза и адаптационных возможностей обнаружено не было. Однако все пациенты, получавшие метопролол, при проведении пробы Вальсальвы показали достаточную реактивность барорецепторов, в то время как у 71% пациентов, принимавших эналаприл, значения коэффициентов барорефлекторной функции по-прежнему оставались в пределах пограничных значений. Кроме того, интересными оказались данные, полученные при анализе кардиоритмограммы в пробе с глубоким управляемым дыханием и АОП у пациентов, принимавших эналаприл: в пограничном диапазоне находились значения показателя Кдых у всех испытуемых и значения показателя К30/15 в 74% случаев. Создавалось впечатление об угнетении вагусной реактивности, что, возможно, объяснялось истощением функциональных резервов блуждающего нерва на фоне повышения тонуса его чувствительной порции, опосредованного способностью ИАПФ увеличивать уровень брадикинина и субстанции Р, раздражающих парасимпатические афферентные волокна [48, 49].
Создавалось впечатление об угнетении вагусной реактивности, что, возможно, объяснялось истощением функциональных резервов блуждающего нерва на фоне повышения тонуса его чувствительной порции, опосредованного способностью ИАПФ увеличивать уровень брадикинина и субстанции Р, раздражающих парасимпатические афферентные волокна [48, 49].
Таким образом, к моменту назначения терапии актовегином при 2-м визите состояние ВНС у одной половины рандомизированных пациентов характеризовалось дисфункцией на стволовом уровне, а у другой половины первичной стволовой дисфункции сопутствовала вторичная несостоятельность периферических вегетативных структур (табл. 7). Данное обстоятельство давало возможность оценивать эффективность назначаемого препарата в модальностях как центрального, так и периферического фармакологического действия.
Повторное тестирование по МФШ через 6 нед терапии актовегином и плацебо показало следующие результаты: в подгруппе «актовегин + метопролол» очень высокий риск был у 41% пациентов, высокий риск — у 18%, средний риск — у 12%, низкий риск — у 29%; в подгруппе «плацебо + метопролол»: очень высокий риск — у 30%, высокий риск — у 30%, средний риск — у 30%, низкий риск — у 10%; в подгруппе «актовегин + эналаприл»: очень высокий риск — у 53% пациентов, высокий риск — у 6%, средний риск — у 6% пациентов, низкий риск — у 35%; в подгруппе «плацебо + эналаприл»: очень высокий риск — у 50% пациентов, высокий риск — у 30%, средний риск — у 10%, низкий риск — у 10%. Для наглядности полученные данные усреднены методом последовательных наложенных графиков и представлены в виде динамики риска развития инсульта у пациентов с ХИГМ преимущественно в ВБС в зависимости от получаемой ими терапии.
Для наглядности полученные данные усреднены методом последовательных наложенных графиков и представлены в виде динамики риска развития инсульта у пациентов с ХИГМ преимущественно в ВБС в зависимости от получаемой ими терапии.
Ко 2-му визиту риск развития инсульта, согласно балльной оценке по МФШ, уменьшался значительнее у пациентов, принимавших метопролол. При 3-м визите, после курса терапии актовегином, заметное снижение риска наблюдалось как в группе метопролола, так и в группе эналаприла. В то же время к 3-му визиту риск развития инсульта оставался на прежнем уровне (по сравнению со 2-м визитом) у всех пациентов, получавших плацебо, вне зависимости от схемы гипотензивной терапии.
Риск развития инсульта имеет прямую зависимость от величины САД как у мужчин, так и у женщин. На фоне терапии актовегином цифры САД к моменту 3-го визита имели четкую тенденцию к снижению (U-критерий Манна—Уитни; p<0,01) как в группе метопролола, так и в группе эналаприла (рис. 5). При этом медианы САД в группах пациентов, получавших актовегин, статистически достоверно отличались от медиан САД в группах, получавших витаминотерапию нейробионом (U-критерий Манна—Уитни; p<0,01), что исключало возможность влияния эффекта плацебо на результаты, полученные в первом случае (табл. 8).
5). При этом медианы САД в группах пациентов, получавших актовегин, статистически достоверно отличались от медиан САД в группах, получавших витаминотерапию нейробионом (U-критерий Манна—Уитни; p<0,01), что исключало возможность влияния эффекта плацебо на результаты, полученные в первом случае (табл. 8).
Мы полагаем, что опосредованный гипотензивный эффект актовегина обусловлен его эндотелиопротективным действием, которое включает гемодинамические и метаболические механизмы. Гемодинамические эффекты заключаются в повышении NO-опосредованной функции эндотелия с уменьшением тонуса и величины просвета прекапиллярных артериол; снижении уровня АД; уменьшении артериоло-венулярного шунтирования крови; увеличении скорости капиллярного кровотока. Метаболические эффекты проявляются улучшением фильтрационно-реабсорбционного механизма обмена веществ с уменьшением степени гидратации интерстициального пространства (т.е. скрытой задержки жидкости в тканях), что невозможно без улучшения функционального состояния самих эндотелиоцитов, которые являются единственным структурным элементом сосудистого русла на уровне капилляров и посткапиллярных венул [50].
Кроме того, немаловажную роль в снижении АД у наблюдаемых нами пациентов сыграло влияние актовегина на нейрогенные факторы регуляции сосудистого тонуса, что было доказано при анализе записей ВРС и кардиоваскулярных проб, произведенных при 3-м визите.
В группе пациентов, получавших метопролол, дисбаланс стволовых вегетативных центров с преобладанием симпатических влияний полностью нивелировался на фоне приема актовегина, и вегетативный профиль приобрел физиологичную парасимпатическую направленность у всех пациентов. В группе пациентов, получавших эналаприл, терапия актовегином способствовала изменению характера вегетативного профиля на смешанный симпато-парасимпатический в 94% случаев. В подгруппах плацебо каких-либо значимых изменений состояния стволовых вегетативных структур по сравнению со 2-м визитом не отмечено.
Актовегин показал эффективность терапевтического воздействия и на периферические вегетативные структуры у пациентов, получавших эналаприл. При повторном обследовании вторичная дисфункция блуждающего нерва выявлялась лишь у 12% пациентов, вторичная неселективная барорефлекторная несостоятельность — у 29% пациентов данной группы.
На фоне общей стабилизации состояния ВНС перенапряжение механизмов адаптации сменилось состоянием удовлетворительной адаптации у пациентов, лечившихся по схеме «актовегин + метопролол», и состоянием повышенного функционального напряжения механизмов адаптации у пациентов, получавших лечение по схеме «актовегин + эналаприл».
Таким образом, по результатам проведенного исследования можно сделать следующие выводы: 1) ХИГМ с преимущественным поражением стволовых структур непосредственно коррелирует с индивидуальным риском развития инсульта в ближайшие 10 лет, что обусловлено особенностями кровоснабжения данной области и сопровождается значительной дизрегуляцией гомеостатических процессов даже при минимальной дисциркуляции; 2) предиктивными маркерами индивидуального риска развития инсульта у пациентов с ХИГМ преимущественно в ВБС могут служить изменения показателей вегетативного гомеостаза; 3) терапия актовегином нивелирует патологические эффекты системной и тканевой гипоксии стволовых структур и корригирует проявления дезадаптационного синдрома через опосредованное влияние на центральные и периферические вегетативные структуры, что в итоге снижает индивидуальный риск развития инсульта в ближайшие 10 лет у пациентов с ХИГМ преимущественно в ВБС.
Роль бета-клеток в регуляции гомеостаза глюкозыв норме и при сахарном диабете 2 типа | Аметов
Сахарный диабет представляет собой серьезную медико-социальную проблему, что обусловлено его высокой распространенностью, сохраняющейся тенденцией к росту числа больных, хроническим течением, определяющим кумулятивный характер заболевания, высокой инвалидизацией больных и необходимостью создания системы специализированной помощи. В настоящее время во всем мире насчитывается 250 млн больных сахарным диабетом, а по прогнозу экспертов ВОЗ уже в 2025 году число лиц, страдающих этим заболеванием, составит около 380 млн человек.
Сахарный диабет 2 типа (СД2) составляет 85–90% от общего количества больных диабетом. Он, как правило, развивается у лиц старше 40-летнего возраста. Более 80% этих пациентов имеют избыточный вес или ожирение и ведут малоподвижный образ жизни.
Согласно общепринятому мнению (Gerich J., 2000), СД2 является гетерогенным заболеванием, развивающимся в результате комбинации врожденных и приобретенных факторов.
Риск развития СД2 возрастает от 2 до 6 раз при наличии диабета у родителей или ближайших родственников. В настоящее время наличие генетической основы для развития этого заболевания не вызывает никаких сомнений. Причем, генетические детерминанты при СД2 имеют еще более важный характер, чем при СД1. Однако говоря о практически 100% генетической основе данного заболевания, следует отметить, что в настоящее время первичный генетический дефект, ответственный за развитие СД2, до конца не установлен. Необходимо помнить, что генетика этого заболевания сложна, и очевидно речь идет о комбинированном полигенном расстройстве, за исключением диабета MODY, редких генетических дефектов рецепторов инсулина и СД1 с поздним началом (LADA), составляющих только около 15% фенотипов СД2 (Fajans S., 1989; Taylor S., 1992; Turner R. с соавт., 1999).
Длительное время применительно к этому заболеванию существовало ошибочное мнение, что это легкая форма диабета, при которой осложнения могут и не возникать, что цели терапии могут быть не столь жесткими, а ожирение лучше всего игнорировать поскольку мы не умеем лечить это заболевание. В настоящее время ученые твердо убеждены, что речь идет о тяжелом хроническом, постоянно прогрессирующем заболевании, составляющем 85–90% от общего количества больных диабетом. Заболевания, при котором в момент установления диагноза более 50% больных уже имеют поздние осложнения диабета.
В настоящее время ученые твердо убеждены, что речь идет о тяжелом хроническом, постоянно прогрессирующем заболевании, составляющем 85–90% от общего количества больных диабетом. Заболевания, при котором в момент установления диагноза более 50% больных уже имеют поздние осложнения диабета.
Согласно исследованию CODE-2 прямые расходы для обеспечения 10 млн больных в Европе составили 29 млрд Евро. Было подсчитано, что обеспечение пациентов пероральными сахароснижающими препаратами составляет почти 4% от всех затрат на здравоохранение. Было также отмечено, что наличие микро- и макрососудистых осложнений увеличивает расходы на диабет более чем в 3 раза.
Следует особо подчеркнуть, что 21 декабря 2006 года на 61 сессии Генеральной Ассамблеи ООН была принята Резолюция Организации Объединенных наций по сахарному диабету, в которой было сказано: «Сахарный диабет приобрел черты неинфекционной эпидемии и является четвертым заболеванием после ВИЧ-инфекции, туберкулеза и малярии, и стал реальной угрозой для здоровья человечества».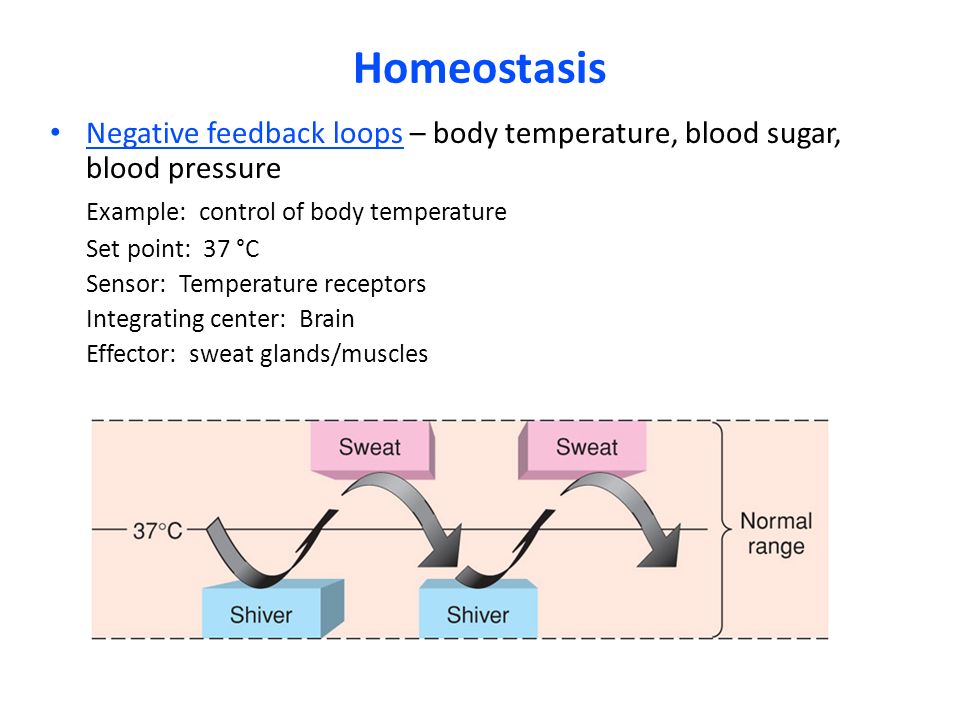
В последние годы основные усилия ученых были сконцентрированы на изучении островковых клеток поджелудочной железы. Было установлено, что поджелудочная железа у человека содержит от 1 до 3 млн островковых клеток, что составляет около 1% от общей массы панкреатической ткани.
В свою очередь, островковая клетка является самостоятельным органом, предназначенным для производства и секреции инсулина в необходимое время и в необходимых количествах.
Островок имеет 200 µ в диаметре и содержит 3000–5000 клеток, из которых b-клетки составляют 70%.
Каждая b-клетка содержит 10 000 секреторных гранул (0,2 µ в диаметре).
В каждой грануле содержатся кристаллы инсулина. Каждый кристалл содержит около 200 000 молекул инсулина.
b-клетки сообщаются друг с другом – они электрически сопряжены по принципу елочной гирлянды.
Чем больше инсулина нужно произвести, тем большее число соседних клеток включается в это процесс.

Несмотря на кажущуюся идентичность b-клеток, среди них выделены «водители ритма», отличающиеся от остальных.
Однако наряду с b-клетками, островок содержит и другие типы клеток (табл. 1).
Хорошо известно, что практически все перечисленные в таблице гормоны играют важную роль в регулировании гомеостаза глюкозы, хотя наиболее изученными являются, вне сомнения, b-клетки.
В своей замечательной статье, опубликованной в журнале Lancet (1969) Джон Хендерсон отметил: «100 лет тому назад П.Лангерганс очень скромно написал, что он обнаружил в поджелудочной железе кролика некоторые бледные (палевые) пятна, которые на протяжении многих лет являлись предметом устойчивого внимания и удивления исследователей: их окрашивали и делили, вводили пациентам и давали вместе с пищей, их маркировали, пытались сосчитать, их извлекали и выделяли, их пытались истощать и, наоборот, стимулировать, и все-таки до сих пор неясно, почему они должны существовать в таком виде» (цит. Malaisse W.J., 2001).
Malaisse W.J., 2001).
Известно, что b-клетка поджелудочной железы у человека содержит более 10 000 секреторных гранул. Исследования кинетики экзоцитоза в различных эндокринных клетках и нейронах позволили сделать вывод, что секреторные гранулы, содержащие инсулин, существуют в виде так называемого общего функционального пула.
В настоящее время убедительно доказано (Barg S. Et al, 2002), что только около 50 секреторных гранул (0,5 %) из более чем 10 000 способны к немедленному высвобождению и фактически составляют пул моментального острого реагирования.
Важно отметить, что секреция инсулина зависит от количества высвободившихся гранул. Также считается, что в норме в результате 1-й фазы высвобождается 50–100 секреторных гранул инсулина, а в результате 2-й фазы выделяется, в среднем, около 40 гранул инсулина. Кроме того на пике первой фазы инсулиновой секреции b-клетка высвобождает гранулы с приблизительной скоростью: одна гранула каждые 3 секунды. В течение второй фазы поддерживаемой инсулиновой секреции b-клетка высвобождает гранулы со скоростью: одна гранула каждые 10 секунд.
В течение второй фазы поддерживаемой инсулиновой секреции b-клетка высвобождает гранулы со скоростью: одна гранула каждые 10 секунд.
В настоящее время появились убедительные доказательства (S.Bonner-Weir, 2001) того, что b-клетки поджелудочной железы существуют в организме человека в динамическом состоянии. Установлено, что структуральные параметры b-клеток позволяют им меняться в течение жизни за счет процессов репликации, неогенеза, изменения объема клеток и, наконец, смерти b-клеток в результате апоптоза или некроза.
Было показано, что в течение всей жизни существует рост b-клеток, а наряду с постоянным обновлением могут происходить потери, что включается в понятие «кругооборот b-клеток».
Важно отметить, что в любой момент времени b-клетки могут быть в различной возрастной категории, а любые ограничения репликации и неогенеза b-клеток могут повлечь за собой нарушение гомеостаза глюкозы.
И, пожалуй, самое главное – существуют дополнительные компенсаторные возможности, необходимые для поддержания гомеостаза глюкозы. В этой связи абсолютно правомочным звучит термин «пластичность» эндокринной части поджелудочной железы, которая определяется как способность массы b-клеток адаптироваться к потребностям организма в инсулине (Bernard-Kargar C., 2001). В этой связи необходимо отметить, что резервные способности у массы b-клеток значительно больше, чем об этом думали и знали ранее.
В этой связи абсолютно правомочным звучит термин «пластичность» эндокринной части поджелудочной железы, которая определяется как способность массы b-клеток адаптироваться к потребностям организма в инсулине (Bernard-Kargar C., 2001). В этой связи необходимо отметить, что резервные способности у массы b-клеток значительно больше, чем об этом думали и знали ранее.
В настоящее время и в связи с изучением особенностей патогенеза СД2, и с получением неудачных результатов лечения данного заболевания, что было продемонстрировано в рамках исследования UKPDS, особое внимание ученых привлекает изучение массы функционирующих b-клеток в норме и при СД2.
Известно, что увеличение массы b-клеток может происходить в результате увеличения количества b-клеток (гиперплазия) или в результате увеличения объема отдельных b-клеток (гипертрофия). В то же время изменение массы b-клеток может быть определено как разница между скоростью образования новых клеток и скоростью их смерти.
Таким образом, скорость образования новых b-клеток поджелудочной железы может определяться двумя факторами:
Известно, что гибель b-клеток может происходить в результате некроза или апоптоза.
За некоторым исключением, большинство исследований, выполненных на аутопсии, убедительно показывают снижение массы b-клеток на 40–60% у больных СД2. Наибольший интерес представляют данные Kloppel (1985), который обнаружил, что наибольшая масса b-клеток поджелудочной железы имеет место у лиц с ожирением и без диабета, а наименьшая масса b-клеток была у лиц с СД2, но без ожирения. У последних было обнаружено снижение массы b-клеток на 50%.
Другими словами, уменьшение массы b-клеток поджелудочной железы может способствовать снижению резервных возможностей в отношении секреции инсулина.
Следует особо подчеркнуть, что нарушение пластичности b-клеток параллельно снижению массы обуславливает нарушение секреции инсулина в ответ на нагрузку глюкозой. В то же время инсулиновая секреция в ответ на другие стимулы может быть абсолютно нормальной.
В то же время инсулиновая секреция в ответ на другие стимулы может быть абсолютно нормальной.
Заслуживает внимания также факт, свидетельствующий о том, что нарушение толерантности к глюкозе часто совпадает со снижением способности b-клеток к репликации.
Остается открытым вопрос, является ли этот дефект результатом генетической предрасположенности или измененного метаболизма за счет влияния факторов окружающей среды. Хотя оба эти предположения не являются взаимоисключающими.
Хорошо известно, что в организме человека существует инсулинопосредованный захват глюкозы (ИОЗГ) и инсулиннеопосредованный захват глюкозы (ИНОЗГ). В базальном состоянии (натощак) преобладает ИНОЗГ, отвечающий практически за 70% (!) общего распределения глюкозы в организме человека (рис. 1).
В норме скорость секреции распределения глюкозы составляет 2 мг/кг/мин. В этом случае ИНОЗГ составит 1,4 мг/кг/мин (70%), а ИОЗГ будет равен 0,6 мг/кг/мин (30%).
Известно, что уровень глюкозы натощак отражает баланс между продукцией глюкозы и распределением глюкозы в тканях. В связи с этим снижение распределения, как правило, не приводит к значительному повышению уровня глюкозы натощак. В то же время повышение продукции глюкозы печенью является фактором, непосредственно отвечающим за развитие гипергликемии натощак.
В связи с этим снижение распределения, как правило, не приводит к значительному повышению уровня глюкозы натощак. В то же время повышение продукции глюкозы печенью является фактором, непосредственно отвечающим за развитие гипергликемии натощак.
В случае повышения продукции глюкозы печенью до 2,6 мг/кг/мин требуется увеличение ИОЗГ в 2 раза (до величины 1,2 мг/кг/мин), что позволит контролировать распределение глюкозы в тканях равным продукции глюкозы печенью, не изменяя уровень глюкозы натощак.
В норме, для того, чтобы увеличить в 2 раза ИОЗГ, требуется менее, чем двукратное увеличение секреции инсулина. Напротив, при СД2 для того, чтобы повысить ИОЗГ в 2 раза, необходимо увеличить уровень инсулина в 5–6 раз.
В связи с наличием инсулинорезистентности пациенты с СД2 требуют значительно больших количеств инсулина, чтобы повысить ИОЗГ, и в этом случае точка зрения о недостаточной функции b-клеток поджелудочной железы получает свое подтверждение.
При СД2 неспособность к увеличению ИОЗГ, по причине или выраженной инсулинорезистентности, или ограничений в плане секреции инсулина, создает метаболический фундамент, который позволяет даже относительно незначительному повышению продукции глюкозы печенью вызвать прямое и пропорциональное повышение уровня глюкозы натощак.
Известно, что инсулин действует, способствуя организации запасов глюкозы в виде гликогена. Несмотря на то, что бо’льшая часть глюкозы необходима для других тканей, например, тканей головного мозга, этот процесс происходит, в основном, в скелетных мышцах.
Организация запасов глюкозы в первую очередь мышечной тканью частично объясняется тем, что эта ткань способна абсорбировать глюкозу достаточно быстро и в больших количествах, препятствуя развитию постпрандиальной гипергликемии в физиологических условиях. Причем колебания постпрандиального уровня глюкозы являются важной составляющей общей гипергликемии.
В идеале, оценивая функцию b-клеток, мы должны точно определить, какое количество инсулина выделяется в ответ на адекватные стимулы. Таким образом, общее количество выделенного инсулина будет результатом функции определенного количества b-клеток, а также средним показателем секреции инсулина на одну b-клетку. Получить эти данные у человека прямым образом невозможно, так как масса b-клеток определяется только на аутопсии, а инсулин в циркуляции крови не является прямым отражением функции b-клеток в связи с тем, что около 50% секретированного инсулина «очищается» во время его первого прохождения через печень.
В последние годы интерес ученых вновь сконцентрировался на исследованиях, посвященных различным типам секреции инсулина.
Известно, что секреция инсулина у человека в зависимости от физиологического смысла, делится на 3 варианта:
1. Базальная секреция.
2. Двухфазная секреция.
3. Пульсовая секреция.
В физиологических условиях существует постоянная базальная секреция инсулина, имеющая место даже в отсутствие экзогенных стимулов. Базальная секреция выполняет роль фундамента, обеспечивая возможности реализации различных механизмов действия инсулина в плане регуляции гомеостаза глюкозы, и не только. Кроме того, известно, что базальная секреция инсулина обеспечивает баланс между скоростью продукции глюкозы печенью и периферическим захватом глюкозы глюкозозависимыми тканями в течение ночи и в течение длительного периода между приемами пищи.
Группа Lang et al (1979) впервые сообщили о наличии острых осцилляций в секреции инсулина.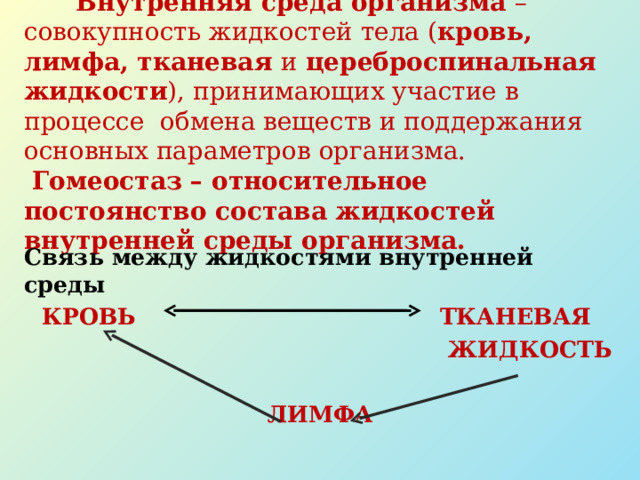 В настоящее время считается, что так называемый пульсовый характер секреции инсулина занимает от 8 до 14 минут, с амплитудой колебаний 1,6 mед/мл, при средних значениях 4,6 mед/мл. Необходимо отметить, что в физиологических условиях пульсовая секреция инсулина четко коррелирует с колебаниями уровней С-пептида, а конкурентные циклы глюкозы в плазме появляются за 2 минуты до начала инсулиновой волны и имеют среднюю амплитуду колебаний в пределах 1 мг%. Было показано, что наряду с циклическим характером секреции инсулина, С-пептида и глюкозы практически таким же образом ведут себя глюкагон и секретин, имеющие также пульсовый характер секреции с периодичностью 10 минут. Считается, что пульсирующий характер секреции инсулина отражает внутреннюю электрическую активность b-клеток и осцилляторные изменения процессов гликолиза в b-клетках.
В настоящее время считается, что так называемый пульсовый характер секреции инсулина занимает от 8 до 14 минут, с амплитудой колебаний 1,6 mед/мл, при средних значениях 4,6 mед/мл. Необходимо отметить, что в физиологических условиях пульсовая секреция инсулина четко коррелирует с колебаниями уровней С-пептида, а конкурентные циклы глюкозы в плазме появляются за 2 минуты до начала инсулиновой волны и имеют среднюю амплитуду колебаний в пределах 1 мг%. Было показано, что наряду с циклическим характером секреции инсулина, С-пептида и глюкозы практически таким же образом ведут себя глюкагон и секретин, имеющие также пульсовый характер секреции с периодичностью 10 минут. Считается, что пульсирующий характер секреции инсулина отражает внутреннюю электрическую активность b-клеток и осцилляторные изменения процессов гликолиза в b-клетках.
Определенный интерес представляют данные о том, что при определении совпадения пиков секреции инсулина с пиками глюкозы в контрольной группе они совпадали в 70% случаев, а у больных СД2 – всего в 46% случаев.
В ряде исследований было показано также, что пульсовый характер секреции более эффективен, чем непрерывное выделение инсулина применительно к подавлению продукции глюкозы печенью или, наоборот, стимуляции утилизации глюкозы тканями.
Особое место в исследованиях занимает информация, касающаяся двухфазности секреции в норме и патологии.
Установлено, что выделение инсулина происходит двухфазным образом, характеризующимся наличием острых пиков, продолжающихся в среднем в течение 10 минут (первая фаза), с последующим постепенным повышением выделения инсулина (вторая фаза).
Существует точка зрения, что эти две фазы в секреции фактически представляют два различных внутриостровковых пула инсулина. Первый пул, или пул немедленного реагирования, представляет собой в количественном отношении около 5–7% внутриостровкового содержания инсулина. Речь идет о гранулах инсулина, находящихся максимально близко к мембране b-клетки и считается, что именно этот быстровыделяемый пул обеспечивает первую, раннюю фазу в секреции инсулина.
Второй пул, или пул инсулина, готовый к употреблению, для выделения которого необходима аденозинтрифосфат-зависимая мобилизация инсулинсодержащих гранул, перемещающихся постепенно в первый пул, с последующим экзоцитозом, фактически представляет 93–95% запасов инсулина, содержащихся в b-клетках.
Несомненно, что обе фазы в секреции инсулина являются важными в поддержании нормального гомеостаза глюкозы. Однако значительно большее внимание в настоящее время уделяется значению именно первой фазы инсулиновой секреции. Предполагается, что это и есть главная детерминанта в «раннем» выделении инсулина в течение первых 30 минут после приема пищи или глюкозы.
Хорошо известно, что в физиологических условиях инсулин является главным гормональным регулятором распределения глюкозы. Доклинические и клинические исследования свидетельствуют, что амилин и инкретины дополняют эффекты инсулина путем регулирования скорости поступления глюкозы в кровоток.
В целом, необходимо особо отметить, что гомеостаз глюкозы представляет собой комплексный процесс, находящийся под контролем многих гормонов, включая инсулин, глюкагон, глюкагоноподобный пептид (ГПП-1) и амилин.
Важно отметить, что противоположно инсулину действует глюкагон, существенно стимулируя повышение продукции глюкозы печенью. При СД2 отмечено увеличение объема a-клеток, выделяющих глюкагон. Более того, в отличие от здоровых лиц, уровень глюкагона в ответ на нагрузку глюкозой остается стабильно повышенным.
Таким образом, при СД2 имеется не только прогрессирующее нарушение инсулиносекреции на уровне b-клеток поджелудочной железы и сниженная чувствительность к инсулину на уровне тканей-мишеней, но и нарушение функции a-клеток поджелудочной железы в плане секреции глюкагона.
Амилин является нейроэндокринным гормоном, состоящим из 37 аминокислот. Амилин секретируется панкреатическими b-клетками параллельно инсулину в ответ на поступление пищи. Интересно отметить, что профиль амилина в циркуляции крови аналогичен секреции инсулина. У здоровых лиц уровень амилина в плазме крови натощак – 4 пикомоль/л, а после еды достигает величины 25 пикомоль/л.
Важное значение имеют данные, свидетельствующие о том, что в постпрандиальном периоде амилин помогает регулировать появление глюкозы в циркуляции путем 3-х основных механизмов (рис. 2):
2):
подавление постпрандиальной секреции глюкагона;
замедление опустошения желудка;
уменьшение поступления пищи.
С учетом того, что амилин является продуктом секреции b-клеток поджелудочной железы, отмечается абсолютный дефицит его при СД1 и относительный или абсолютный дефицит у пациентов с СД2.
Амилин человека имеет такие физико-химические характеристики, которые не позволяют использовать его в качестве фармакологического препарата, в частности, плохую растворимость и склонность к агрегации. Это привело к разработке прамлинтида – препарата, который является аналогом человеческого амилина, созданным путем замены пролина на 25 Ala, 28 Ser и 29 Ser.
Клинические исследования у пациентов с сахарным диабетом убедительно показали, что прамлинтид имеет эффекты, идентичные амилину человека в физиологических условиях: подавление секреции глюкагона, замедление опустошения желудка и уменьшение поступления пищи, что приводит в финале и к снижению веса.
Гормоны желудочно-кишечного тракта. Инкретины
В литературе имеются данные, свидетельствующие о важной роли таких гормонов желудочно-кишечного тракта, как глюкагоноподобный пептид 1 (ГПП-1) и глюкозозависимый инсулинотропный полипептид или желудочный ингибирующий пептид (ГИП). Эти гормоны получили название инкретины. Их действие, приводящее к усилению глюкозозависимой секреции инсулина b-клетками поджелудочной железы, было названо «инкретиновый эффект». «Инкретиновый эффект» был впервые описан в 1960 году, и приписывается пептидным гормонам, которые секретируются К- и L-клетками кишечника в ответ на прием пищи.
Наиболее популярным и наиболее изученным в настоящее время является ГПП-1.
ГПП-1 является посттрансляционным продуктом гена проглюкагона, членом суперсемейства глюкагона, в которое входят такие пептидные гормоны, как глюкагон, глюкагоноподобный пептид 1, глюкагоноподобный пептид 2, желудочный ингибирующий пептид и экзендин-4.
ГПП-1 продуцируется энтеро-эндокринными L-клетками тонкого кишечника, и регуляция его секреции из эндокринных клеток ЖКТ осуществляется с помощью нескольких внутриклеточных сигналов, включая протеинкиназу А, протеинкиназу С и кальций. Многочисленные экспериментальные работы продемонстрировали, что секреция ГПП-1 контролируется нутриентами, а также невральными и эндокринными факторами. Следует отметить, что плазменные базальные уровни ГПП-1 у человека находятся в пределах от 5 до 10 пмоль/л, и повышаются после приема пищи до 50 пмоль/л.
В исследованиях Kieffer T.Y, 1999, Drucker D.J., 1998, Massimo S.P., 1998, было показано, что ГПП-1 секретируется в ответ на прием смешанной пищи и таких отдельных нутриентов, как глюкоза, жирные кислоты и пищевые волокна. Так, пероральный прием глюкозы у человека приводил к двухфазному увеличению ГПП-1 в плазме, тогда как внутривенные инфузии глюкозы имели минимальный эффект. В связи с тем, что большинство L-клеток, продуцирующих ГПП-1, расположены в дистальных отделах тонкого кишечника, быстрое повышение уровня ГПП-1 в плазме, наблюдаемое после приема пищи, может быть обусловлено непрямыми стимулирующими эффектами. В связи с чем было сделано предположение о наличии проксимально-дистальной петли, которая передает нутриент-стимулирующие сигналы из проксимальных отделов кишечника через невральные и эндокринные эффекты к дистальным L-клеткам.
В связи с чем было сделано предположение о наличии проксимально-дистальной петли, которая передает нутриент-стимулирующие сигналы из проксимальных отделов кишечника через невральные и эндокринные эффекты к дистальным L-клеткам.
Таким образом, двухфазная секреция ГПП-1, кажется, может происходить за счет интеграции гормональных и невральных факторов, которые стимулируют раннее выделение ГПП-1 (10–15 мин), а прямой нутриентный контакт с L-клетками стимулирует вторую фазу (30–60 мин) секреции ГПП-1.
Определенный интерес представляют данные о том, что эффект действия ГПП-1 проявляется путем мощного усиления, подобно взрыву (вспышке) секреции инсулина. Однако введение ГПП-1 не влияет на частоту и амплитуду пульсовой секреции инсулина (Porksen W., 1998)
Было установлено, что действие ГПП-1 не ограничивается только усилением экзоцитоза секреторных гранул, содержащих инсулин, из b-клеток, а как следует из данных, представленных в табл. 2, ГПП-1 влияет также и на a-клетки поджелудочной железы, подавляя секрецию глюкагона, что в свою очередь ограничивает постпрандиальное повышение глюкозы.
В физиологических условиях период полужизни циркулирующего биологически активного ГПП-1 меньше, чем 2 минуты. Такой короткий период полужизни ГПП-1 в плазме обусловлен протеазной активностью фермента дипептидилпептидазы IV (ДПП-IV). ДПП-IV широко экспрессируется во многих тканях и органах, включая поджелудочную железу, ЦНС, сосудистую сеть эндотелия тонкого кишечника, находящегося в непосредственной близости к месту секреции ГПП-1.
Говоря о нарушении инкретинового эффекта при СД2, важно подчеркнуть, что при этом заболевании секреция ГПП-1 снижена на 20–30% при сохранении в целом его инсулиностимулирующего действия. В то же время следует подчеркнуть, что секреция ГИП при сахарном диабете не меняется, однако установлено снижение его стимулирующего влияния на b-клетки поджелудочной железы.
Причины этих нарушений окончательно не установлены, хотя большинство исследователей приходит к заключению, что нарушение секреции ГПП-1 очевидно является следствием СД2.
Таким образом, регулирование гомеостаза глюкозы представляет собой комплексный многофакторный и многоуровневый процесс, в котором принимают активное участие целый ряд глюкорегуляторных гормонов (табл. 2).
Возвращаясь к обсуждению роли b-клеток в патогенезе СД2, следует отметить, что в норме b-клетки быстро адаптируются к снижению чувствительности к инсулину на уровне печени или периферических тканей, повышая секрецию инсулина и предотвращая развитие гипергликемии натощак. При СД2 гипергликемия может развиваться тогда, когда скорость поступления глюкозы в циркуляцию крови будет превышать скорость захвата глюкозы тканями. Другими словами, гипергликемия может развиваться или за счет того, что повышено выделение глюкозы, или за счет того, что снижена утилизация глюкозы тканями, и, наконец, гипергликемия может развиваться вследствие комбинации этих дефектов.
Вне всякого сомнения, эти факторы тесно связаны друг с другом, хотя кажется абсолютно ясным, что без нарушенной секреции инсулина не может развиваться гипергликемия и, таким образом, b-клетки и их функция являются «сердцем» данной проблемы.
Те, кто верит в первичность инсулинорезистентности, предполагают, что во время преддиабетического состояния, когда толерантность к глюкозе в норме, уже имеет место снижение чувствительности к инсулину, и компенсаторное увеличение секреции инсулина обеспечивает нормальную толерантность к глюкозе.
Прогрессирование нарушенной толерантности к глюкозе развивается вследствие усиления инсулинорезистентности без соответствующей компенсации в плане повышения секреции инсулина. И, наконец, нарушенная толерантность к глюкозе превращается в развернутую клинику СД2 в результате разрушения b-клеток в связи с имевшей место в течение многих лет гиперинсулинемии. Примером такого возможного развития событий является гестационный диабет.
Напротив, те, кто верит в первичность нарушенной секреции инсулина предполагают, что преддиабетическое состояние связано с субклиническим дефектом b-клеток, но секреция инсулина пока еще достаточна, чтобы поддержать нормальную толерантность к глюкозе. Нарушение толерантности развивается потому, что к этому состоянию присоединяется инсулинорезистентность, а клиника сахарного диабета развивается и в силу усиления дефекта секреции инсулина и/или в случае усиления инсулинорезистентности.
Нарушение толерантности развивается потому, что к этому состоянию присоединяется инсулинорезистентность, а клиника сахарного диабета развивается и в силу усиления дефекта секреции инсулина и/или в случае усиления инсулинорезистентности.
Наиболее очевидной является проблема сохранения достаточной массы b-клеток и функции для того, чтобы справиться со всем тем, что таит в себе инсулинорезистентность. Причем наиболее поразительный дефект, имеющий место при СД2 – это потеря острой (первой) фазы глюкозо-стимулированной секреции инсулина. В этой связи важное значение имеют адаптация и декомпенсация b-клеток в процессе развития сахарного диабета. С одной стороны, существует ряд путей и возможностей к удачной адаптации и это приведет к увеличению массы b-клеток поджелудочной железы и усилению секреции инсулина. С другой стороны, существуют различные данные, предполагающие, что b-клетки, подвергаясь воздействию диабетогенных факторов, теряют свою дифференцировку, что приводит к потере специализированных функций, в частности, это относится к выпадению первой фазы в секреции инсулина в ответ на нагрузку глюкозой.
В связи с вышеизложенным, особый интерес представляет исследование G.C.Weir et al, 2001, в котором представлены 4 гипотетических фазы разрушения b-клеток.
Гипотетическая фаза 1: успешная адаптация к повышенным требованиям
Справляясь с инсулинорезистентностью, масса b-клеток увеличивается, обеспечивая секрецию необходимого количества инсулина для того, чтобы контролировать уровень глюкозы в диапазоне нормы. В этом случае масса b-клеток определяется как равновесие между неогенезом островков, репликацией b-клеток и апоптозом b-клеток. Во время этого периода в связи со способностью b-клеток к адаптации в ответ на воздействие таких факторов как ожирение и/или первичная (генетическая) инсулинорезистентность, функция b-клеток остается абсолютно нормальной. Важно отметить, что наряду с гипертрофией b-клеток в этих случаях имеет место снижение порога чувствительности к глюкозе, что позволяет обеспечивать нормальную секрецию инсулина.
Гипотетическая фаза 2: умеренная декомпенсация
Ранними признаками дисфункции b-клеток поджелудочной железы как при СД1, так и при СД2 являются: повышение уровня глюкозы натощак (выше чем 5,6 ммоль/л) и потеря острой первой фазы в секреции инсулина при уровнях глюкозы в пределах 6,4 ммоль/л (G. C. Weir et al, 2000). Таким образом, выраженные нарушения в секреции инсулина могут быть выявлены ранее, чем установлен диагноз сахарного диабета. Очевидно, что невозможность контролировать уровень инсулина строго в пределах нормы коррелирует с недостаточными возможностями b-клеток к увеличению их массы в соответствии с возросшими требованиями. С учетом того факта, что секреция инсулина не нарушена в ответ на другие стимулы, например, аргинин, можно представить, что в данном случае запасы инсулина хорошо сохраняются и предположительно страдает в большей степени секреторный механизм, а не синтез инсулина.
C. Weir et al, 2000). Таким образом, выраженные нарушения в секреции инсулина могут быть выявлены ранее, чем установлен диагноз сахарного диабета. Очевидно, что невозможность контролировать уровень инсулина строго в пределах нормы коррелирует с недостаточными возможностями b-клеток к увеличению их массы в соответствии с возросшими требованиями. С учетом того факта, что секреция инсулина не нарушена в ответ на другие стимулы, например, аргинин, можно представить, что в данном случае запасы инсулина хорошо сохраняются и предположительно страдает в большей степени секреторный механизм, а не синтез инсулина.
Гипотетическая фаза 3: тяжелая декомпенсация
На этой стадии имеют место повышенные значения глюкозы, полностью соответствующие диабетическим уровням. За исключением гипертрофии b-клеток, как правило, островковые клетки выглядят вполне нормально. Отмечаются тяжелые нарушения в острой фазе секреции инсулина в ответ на нагрузку глюкозой. Необходимо отметить, что секреция инсулина на другие стимулы также нарушена. Отмечается дегрануляция b-клеток, что указывает не только на нарушенную секрецию, но и на нарушения синтеза инсулина.
Отмечается дегрануляция b-клеток, что указывает не только на нарушенную секрецию, но и на нарушения синтеза инсулина.
Несмотря на все эти изменения, функция b-клеток и масса b-клеток могут быть сохранены в течение длительного времени, что позволяет в сумме секретировать инсулин в количествах, достаточных, чтобы предотвращать развитие метаболической декомпенсации с тяжелой гипергликемией и кетозом.
Гипотетическая фаза 4: декомпенсация, сопровождающаяся повреждением структуры b-клеток
Необходимо отметить, что структуральные изменения b-клеток еще окончательно не установлены. Причем возможна ситуация, когда имеются нарушения функции b-клетки при том, что структура еще не нарушена. И, напротив, возможно сочетание нарушенной структуры с нормальной функцией b-клеток. Говоря о нарушениях структуры, наиболее очевидным является откладывание амилоида у больных СД2. Известно, что амилоидные волокна могут деструктивно влиять на b-клетки, но очень мало известно о механизмах, ответственных за их образование. Кроме того, у больных СД2 возможно депонирование гликогена, что может вызывать дегенерацию b-клеток. Жировые включения, обнаруженные в b-клетках, дают возможность говорить о липотоксичности. Также при СД2 обнаруживают фиброз островков, хотя механизм образования фиброза изучен крайне слабо. Так как достаточно сложно сделать количественный перенос этого быстропротекающего процесса на хроническую ситуацию применительно к развитию сахарного диабета. В этой связи, наряду с апоптозом b-клеток, очевидно в плане развития СД2 важную роль играют определенные ограничения в неогенезе и репликации b-клеток поджелудочной железы.
Кроме того, у больных СД2 возможно депонирование гликогена, что может вызывать дегенерацию b-клеток. Жировые включения, обнаруженные в b-клетках, дают возможность говорить о липотоксичности. Также при СД2 обнаруживают фиброз островков, хотя механизм образования фиброза изучен крайне слабо. Так как достаточно сложно сделать количественный перенос этого быстропротекающего процесса на хроническую ситуацию применительно к развитию сахарного диабета. В этой связи, наряду с апоптозом b-клеток, очевидно в плане развития СД2 важную роль играют определенные ограничения в неогенезе и репликации b-клеток поджелудочной железы.
Таким образом, накоплены данные, которые позволяют по-новому оценить роль b-клеток в регуляции гомеостаза глюкозы в норме и при сахарном диабете 2 типа. Остается надеяться на разработку принципиально новых методов и подходов к управлению этим тяжелым прогрессирующим заболеванием.
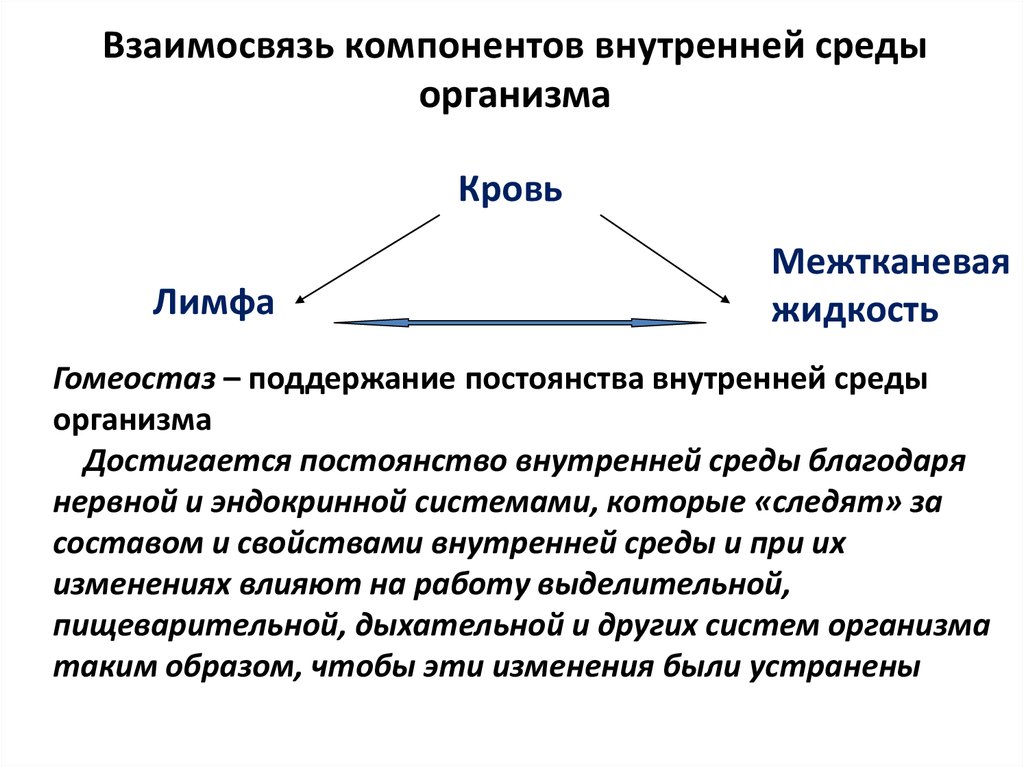
31. Общее понятие о гомеостазе.
Гомеостаз (от
греч. homoios —
подобный, одинаковый и status —
неподвижность) — это способность живых
систем противостоять изменениям и
сохранять постоянство состава и свойств
биологических систем. Явление гомеостаза
наблюдается на разных уровнях организации
биологических систем.
Общие
закономерности гомеостаза. Способность
сохранять гомеостаз — одно из важнейших
свойств живой системы, находящейся в
состоянии динамического равновесия с
условиями внешней среды.
Нормализация
физиологических показателей осуществляется
на основе свойства раздражимости.
Способность к поддержанию гомеостаза
неодинакова у различных видов. По мере
усложнения организмов эта способность
прогрессирует, делая их в большей степени
независимыми от колебаний внешних
условий. Особенно это проявляется у
высших животных и человека, имеющих
сложные нервные, эндокринные и иммунные
механизмы регуляции. Влияние среды на
организм человека в основном является
не прямым, а опосредованным благодаря
созданию им искусственной среды, успехам
техники и цивилизации.
homoios —
подобный, одинаковый и status —
неподвижность) — это способность живых
систем противостоять изменениям и
сохранять постоянство состава и свойств
биологических систем. Явление гомеостаза
наблюдается на разных уровнях организации
биологических систем.
Общие
закономерности гомеостаза. Способность
сохранять гомеостаз — одно из важнейших
свойств живой системы, находящейся в
состоянии динамического равновесия с
условиями внешней среды.
Нормализация
физиологических показателей осуществляется
на основе свойства раздражимости.
Способность к поддержанию гомеостаза
неодинакова у различных видов. По мере
усложнения организмов эта способность
прогрессирует, делая их в большей степени
независимыми от колебаний внешних
условий. Особенно это проявляется у
высших животных и человека, имеющих
сложные нервные, эндокринные и иммунные
механизмы регуляции. Влияние среды на
организм человека в основном является
не прямым, а опосредованным благодаря
созданию им искусственной среды, успехам
техники и цивилизации. В системных
механизмах гомеостаза действует
кибернетический принцип отрицательной
обратной связи: при любом возмущающем
воздействии происходит включение
нервных и эндокринных механизмов,
которые тесно взаимосвязаны.
Генетический
гомеостаз на
молекулярно-генетическом, клеточном и
организменном уровнях направлен на
поддержание сбалансированной системы
генов, содержащей всю биологическую
информацию организма. Механизмы
онтогенетического (организменного)
гомеостаза закреплены в исторически
сложившемся генотипе. На популяционновидовом
уровне генетический гомеостаз — это
способность популяции поддерживать
относительную стабильность и целостность
наследственного материала, которые
обеспечиваются процессами редукционного
деления и свободным скрещиванием особей,
что способствует сохранению генетического
равновесия частот аллелей.
Физиологический
гомеостаз связан
с формированием и непрестанным
поддержанием в клетке специфических
физико-химических условий. Постоянство
внутренней среды многоклеточных
организмов поддерживается системами
дыхания, кровообращения, пищеварения,
выделения и регулируется нервной и
эндокринной системами.
В системных
механизмах гомеостаза действует
кибернетический принцип отрицательной
обратной связи: при любом возмущающем
воздействии происходит включение
нервных и эндокринных механизмов,
которые тесно взаимосвязаны.
Генетический
гомеостаз на
молекулярно-генетическом, клеточном и
организменном уровнях направлен на
поддержание сбалансированной системы
генов, содержащей всю биологическую
информацию организма. Механизмы
онтогенетического (организменного)
гомеостаза закреплены в исторически
сложившемся генотипе. На популяционновидовом
уровне генетический гомеостаз — это
способность популяции поддерживать
относительную стабильность и целостность
наследственного материала, которые
обеспечиваются процессами редукционного
деления и свободным скрещиванием особей,
что способствует сохранению генетического
равновесия частот аллелей.
Физиологический
гомеостаз связан
с формированием и непрестанным
поддержанием в клетке специфических
физико-химических условий. Постоянство
внутренней среды многоклеточных
организмов поддерживается системами
дыхания, кровообращения, пищеварения,
выделения и регулируется нервной и
эндокринной системами. Структурный
гомеостаз основывается
на механизмах регенерации, обеспечивающих
морфологическое постоянство и целостность
биологической системы на разных уровнях
организации. Это выражается в восстановлении
внутриклеточных и органных структур,
путем деления и гипертрофии.
Структурный
гомеостаз основывается
на механизмах регенерации, обеспечивающих
морфологическое постоянство и целостность
биологической системы на разных уровнях
организации. Это выражается в восстановлении
внутриклеточных и органных структур,
путем деления и гипертрофии.
Регенерация
– процесс восстановления организмом
утраченных или поврежденных структур.
Регенерация поддерживает строение и
функции организма, его целостность.
Различают физиологическую и репаративную
регенерация. Восстановление органов,
тканей, клеток и внутриклеточных структур
после разрушения их в процессе
жизнедеятельности называют физиологической.
Восстановление структур после травмы
или действия других повреждающих
факторов называют репаративной
регенерацией. При регенерации происходят
такие процессы, как детерминация,
дифференцировка, рост, интеграция и
другие сходные с процессами, имеющее
место при эмбриогенезе.
Физиологическая
регенерация представляет собой процесс
обновления функционирующих структур
организма. Благодаря физиологической
регенерации поддерживается структурный
гомеостаз и обеспечивается возможность
постоянного выполнения организмом их
функций, т.е. физиологическая регенерация
является самообновлением.
Репаративная
регенерация наступает после повреждения
тканей или органов. Механическая травма,
ожоги, обморожения, голодание и т.д —
это повреждающие факторы. Существует
несколько разновидностей или способов
репаративной регенерации. К ним относят
эпиморфоз, морфаллаксис, заживление
эпителиальных ран, регенерационную
гипертрофию, компенсаторную
гипертрофию.
Эпиморфоз представляет
собой наиболее очевидный способ
регенерации, заключающийся в отрастании
нового органа от ампутационной
поверхности.
Морфаллаксис – это
регенерация путем перестройки
регенерирующего участка.
Регенерационная
гипертрофия относится к внутренним
органам. Это способ регенерации
заключается в увеличении размеров
остатка органа без восстановления
исходной формы.
Компенсаторная
гипертрофия заключается в изменениях
в одном из органов при нарушении в
другом, относящемся к той же системе
органов.
Благодаря физиологической
регенерации поддерживается структурный
гомеостаз и обеспечивается возможность
постоянного выполнения организмом их
функций, т.е. физиологическая регенерация
является самообновлением.
Репаративная
регенерация наступает после повреждения
тканей или органов. Механическая травма,
ожоги, обморожения, голодание и т.д —
это повреждающие факторы. Существует
несколько разновидностей или способов
репаративной регенерации. К ним относят
эпиморфоз, морфаллаксис, заживление
эпителиальных ран, регенерационную
гипертрофию, компенсаторную
гипертрофию.
Эпиморфоз представляет
собой наиболее очевидный способ
регенерации, заключающийся в отрастании
нового органа от ампутационной
поверхности.
Морфаллаксис – это
регенерация путем перестройки
регенерирующего участка.
Регенерационная
гипертрофия относится к внутренним
органам. Это способ регенерации
заключается в увеличении размеров
остатка органа без восстановления
исходной формы.
Компенсаторная
гипертрофия заключается в изменениях
в одном из органов при нарушении в
другом, относящемся к той же системе
органов.
33.Трансплантация
органов и тканей у человека. Трансплантацией
называется пересадка или приживление
органов и тканей. Пересаживаемый участок
органа называется трансплантатном.
Организм, от которого берут ткань для
пересадки, является донором, организм,
которому пересаживают трансплантат –
реципиентом.
Различают аутотрансплантацию,
когда пересадка осуществляется на
другую часть тела того же организма,
аллотрансплантацию, когда производят
пересадку от одной особи другой,
принадлежащей одному и тому же виду, и
ксенотрансплантацию, когда донор и
реципиент относятся к разным видам.
Успех трансплантации зависит от
иммунологической реакции организма.
Аутотрансплантации происходят более
успешно, так как белки трансплантата
не отличаются от белков реципиента.
Иммунологическая реакция не возникает
и возможно истинное приживление. При
аллотрансплантациях донор и реципиент
различаются по антигенам. У высших
животных и у человека не наблюдается
длительного приживления. Исключение
составляют однояйцовые близнецы, генотип
и белковый состав которого одинаковы. Ксенотрансплантация удается у некоторых
беспозвоночных, но у высших животных
трансплантаты от особей других видов
рассасывается.
В тех случаях, когда
орган не может регенерировать, но
необходим, остается один метод – заменить
его таким же естественным или искусственным
органом. При пластических операциях,
проводимых с целью восстановления формы
и функции того или иного органа,
распространена пересадка кожи, хряща,
мышц, сухожилий, кровеносных сосудов и
т.д. Распространено переливание крови
с соблюдением совместимости по группам
АВ0 и резус-фактору.
И все же пересаженные
ткани в большинстве случаев лишь временно
выполняют соотв функции организма. В
дальнейшем они заменяются тканями
организма, но их присутствие способствует
восстановлению утраченных органов
Ксенотрансплантация удается у некоторых
беспозвоночных, но у высших животных
трансплантаты от особей других видов
рассасывается.
В тех случаях, когда
орган не может регенерировать, но
необходим, остается один метод – заменить
его таким же естественным или искусственным
органом. При пластических операциях,
проводимых с целью восстановления формы
и функции того или иного органа,
распространена пересадка кожи, хряща,
мышц, сухожилий, кровеносных сосудов и
т.д. Распространено переливание крови
с соблюдением совместимости по группам
АВ0 и резус-фактору.
И все же пересаженные
ткани в большинстве случаев лишь временно
выполняют соотв функции организма. В
дальнейшем они заменяются тканями
организма, но их присутствие способствует
восстановлению утраченных органов
Гомеостаз Определение и значение | Dictionary.com
- Верхние определения
- Vief
- Связанный контент
- Примеры
- British
- Medical
- Scientific
- Cultural
[HOH-MEE-STEY-SIS]
[HOH-MEE-STEY-SIS]
. sɪs /
sɪs /
Сохрани это слово!
См. синонимы гомеостаза на Thesaurus.com
существительное
тенденция системы, особенно физиологической системы высших животных, сохранять внутреннюю стабильность благодаря скоординированному ответу ее частей на любую ситуацию или стимул, которые могут имеют тенденцию нарушать его нормальное состояние или функцию. Сравните с аллостазом.
Психология. состояние психологического равновесия, достигаемое при уменьшении или устранении напряжения или влечения.
Энтомология. способность членов колонии общественных насекомых вести себя сообща для получения желаемого результата, например, когда пчелы координируют взмах крыльев для охлаждения улья.
ВИКТОРИНА
Сыграем ли мы в «ДОЛЖЕН» ПРОТИВ. «ДОЛЖЕН» ВЫЗОВ?
Следует ли вам пройти этот тест на «должен» или «должен»? Это должно оказаться быстрым вызовом!
Вопрос 1 из 6
Какая форма используется для указания обязательства или обязанности кого-либо?
Происхождение гомеостаза
Впервые зафиксировано в 1925–1930 гг. ; гомео- + стаз
; гомео- + стаз
историческое использование гомеостаза
Гомеостаз — это технический термин, используемый в биологии, физиологии и психологии, означающий «тенденцию организма к поддержанию внутренней стабильности или тенденцию группы организмов, таких как социальные насекомые, такие как пчелы или муравьи, действовать сообща». Гомеостаз состоит из греческого сочетания формы homoio- «подобный, похожий, напоминающий» (от прилагательного hómoios) и stásis, отглагольного существительного, означающего «стоять, стоять на месте, положение, политическое мнение или партия» (от глагола histánai « стоять, ставить, ставить».)
В греческом есть много сложных слов, образованных с помощью омейо-, особенно технических терминов в риторике (homoitéleutos «имеющие сходные окончания или коды во фразах или стихах»), биологии (homiotropos «животных, демонстрирующих сходное поведение») и физике (homoiotachḗs «движение с равная скорость»).
Hómoios является производным от прилагательного homós, «тот же самый, один и тот же», от протоиндоевропейского somós, источника германского samaz, который становится древнескандинавским samr, принятым в английском языке как same. В санскрите есть прилагательное samá- «такой же, похожий»; В славянском (польском) sam «такой же».
В санскрите есть прилагательное samá- «такой же, похожий»; В славянском (польском) sam «такой же».
Stásis образует много составных существительных в греческом языке, таких как stasíarchos «партийный лидер (политический или фракционный), xenóstasis «гостиница для незнакомцев» и anástasis «вставание, удаление, изгнание», также означающие «воскресение» по одному разу в «Эвменидах» Эсхила. и в Послании к Евреям Нового Завета. Анастасис образует греческие имена собственные Анастасий (мужской род) и Анастасия (в позднем латинском Анастасий и Анастасия).
ДРУГИЕ СЛОВА ИЗ ГОМЕОСТАЗА
хо·ме·о·стат·ик [хох-ми-э-э-стат-ик], /ˌхоʊ ми əˈстæт ɪк/, прилагательноехо·ме·о·стат·и·кал·лы, наречиеDictionary.com Полный текст На основе Random House Unabridged Dictionary, © Random House, Inc., 2022
Слова, относящиеся к гомеостазу
равновесие, баланс, равномерность, стабильность, невозмутимость, равновесие
Как использовать гомеостаз в предложении
Старые животные бы ожидается, что у них будет лучший гомеостатический контроль, чем у молодых людей.

Сравнительная экология мышей-пиньонов и оленьих мышей в национальном парке Меса-Верде, Колорадо | Чарльз Л. Дуглас
Британские определения словаря для гомеостаза
гомеостаз
гомеостаз
/ (ˌhəʊmɪəʊˈsteɪsɪs) /
Noun
. внутри социальной группы, человека и т. д.
Производные формы гомеостаза
гомеостатический или гомеостатический (ˌhəʊmɪəʊˈstætɪk), прилагательноеСловарь английского языка Коллинза — полное и полное цифровое издание 2012 г. © William Collins Sons & Co. Ltd., 1979, 1986 © HarperCollins Publishers 1998, 2000, 2003, 2005, 2006, 2007, 2009, 2012
Медицинские определения гомеостаза
гомеостаз
[ hō′mē-ō-stā′sĭs ]
21
21
Способность или склонность организма или клетки поддерживать внутреннее равновесие, регулируя свои физиологические процессы.
Процессы, используемые для поддержания такого телесного равновесия.
Другие слова из слова гомеостаз
го’ме•о•статический (-статик) прил.
Медицинский словарь Стедмана The American Heritage® Copyright © 2002, 2001, 1995, компания Houghton Mifflin. Опубликовано компанией Houghton Mifflin.
Научные определения гомеостаза
гомеостаз
[ hō′mē-ō-stā′sĭs ]
Тенденция организма или клетки регулировать свои внутренние условия, такие как химический состав жидкостей организма, чтобы поддерживать здоровье и работоспособность вне зависимости от внешних условий. Организм или клетка поддерживает гомеостаз, отслеживая свои внутренние условия и реагируя соответствующим образом, когда эти условия отклоняются от их оптимального состояния. Поддержание постоянной температуры тела у теплокровных животных является примером гомеостаза. У человека гомеостатическая регуляция температуры тела включает такие механизмы, как потоотделение, когда внутренняя температура становится чрезмерной, и озноб с выделением тепла, а также выделение тепла посредством метаболических процессов, когда внутренняя температура падает слишком низко.
Научный словарь American Heritage® Авторские права © 2011. Опубликовано издательством Houghton Mifflin Harcourt Publishing Company. Все права защищены.
Культурные определения гомеостаза
гомеостаз
[ (hoh-mee-oh-stay-sis) ]
Склонность тела искать и поддерживать состояние баланса или равновесия в своей внутренней среде, даже когда сталкиваешься с ней с внешними изменениями. Простым примером гомеостаза является способность организма поддерживать внутреннюю температуру около 98,6 градусов по Фаренгейту (см. также Фаренгейт), независимо от температуры на улице.
Новый словарь культурной грамотности, третье издание Авторское право © 2005 г., издательство Houghton Mifflin Harcourt Publishing Company. Опубликовано издательством Houghton Mifflin Harcourt Publishing Company. Все права защищены.
Что такое гомеостаз? — Определение, функции, примеры
В 1865 году французский физиолог по имени Клод Бернар впервые представил теорию гомеостаза . Этот термин был впервые использован в 1962 году Уолтером Брэдфордом Кэнноном. Это слово произошло от греческих слов homoios и histemi, что переводится как подобный и стоящий на месте.
Этот термин был впервые использован в 1962 году Уолтером Брэдфордом Кэнноном. Это слово произошло от греческих слов homoios и histemi, что переводится как подобный и стоящий на месте.
Гомеостаз очень важен для выносливости организмов. Во многих случаях это рассматривается как результат изменений во внешней среде. Более того, гомеостаз — это саморегулирующийся процесс, управляющий внутренними факторами, важными для поддержания жизни. Мы можем просто сказать, что гомеостаз — это механизм, который помогает поддерживать стабильную внутреннюю среду без учета изменений, происходящих во внешней среде. Организм поддерживает гомеостаз, контролируя большую группу факторов, от внутренней температуры тела, рН крови и уровня глюкозы в крови до жидкостного равновесия, концентрации натрия, калия и ионов кальция.
Регуляция гомеостазаДля поддержания регуляции гомеостаза весь процесс должен работать непрерывно. Регуляция гомеостаза основана на трех механизмах:
- Рецептор — Рецептор — сенсорный компонент.
 Рецептор отвечает за проверку и реагирование на изменения во внутренней и внешней среде.
Рецептор отвечает за проверку и реагирование на изменения во внутренней и внешней среде. - Центр управления- Центр управления получает информацию от приемника и обрабатывает информацию через приемник. Центр управления также называют центром интеграции.
- Эффектор — Эффектор отвечает на инструкции/команды центра управления. Эффектор может либо противодействовать раздражителю, либо усиливать его.
Пример для гомеостаза.
Рецептор-Кожные рецепторы кожи.
Центр управления-Мозг.
Эффекторные кровеносные сосуды
Кожа имеет рецепторы, определяющие изменения температуры. Если наружная температура повышается или падает ниже равновесной температуры. Центр управления передает сообщения венам и потовым органам на нашей коже, и они реагируют аналогичным образом. Если температура слишком высокая, вены расширяются (расширение сосудов) и вызывают падение уровня внутреннего тепла. Кроме того, потовые органы производят пот для расширения сосудов. Предполагая, что наружная температура слишком низкая, вены сужаются (вазоконстрикция) и позволяют телу удерживать тепло.
Предполагая, что наружная температура слишком низкая, вены сужаются (вазоконстрикция) и позволяют телу удерживать тепло.
Гомеостаз соответствует идеальным условиям для активности белков во всем организме, а также для всех возможностей клеток. Это поддержание постоянного внутреннего климата, несмотря на изменения внутренних и внешних обстоятельств. В человеческом организме они включают контроль: концентрации глюкозы в крови.
Кровь поддерживает гомеостаз, регулируя рН, температуру и осмотическое давление, а также убивая избыток тепла. Кровь поддерживает развитие, передавая добавки и химические вещества, а также устраняя отходы. Красные тромбоциты содержат гемоглобин, который связывает кислород.
Нарушение гомеостаза
Нарушение функционирования гомеостаза известно как нарушение гомеостаза. Нарушение гомеостаза во внутренней среде вызывает болезнь. В некоторых случаях это также приводит к летальному исходу.
Факторы, влияющие на гомеостаз
Речь идет о трех факторах, влияющих на гомеостаз: жидкости и электролиты, энергия и питание и резистентные посредники реакций. Повреждение клеток вызывает изменения в натриево-калиевом сифоне, которые нарушают гомеостаз жидкости и электролитов, а медицинские процедуры вызывают изменения практической внеклеточной жидкости. Калорические предпосылки расширяются в зависимости от серьезности травмы и в целом более заметны, чем предполагалось. Как парентеральные, так и кишечные препараты восстанавливают уровни аланина и глутамина до нормальных значений. Исследования показывают, что часть неблагоприятного воздействия медицинской процедуры на гомеостаз может быть уменьшена однозначными методами лечения. Важным ключом в настройке реакции давления на медицинскую процедуру может быть контроль безопасных посредников реакции, особенно кахектина, который, как было показано, вызывает последствия, неотличимые от последствий септического шока. Текущие исследования показали, что введение небольших порций явного моноклонального иммунизатора в кахектин может отклонить арбитра всех неблагоприятных воздействий.
Текущие исследования показали, что введение небольших порций явного моноклонального иммунизатора в кахектин может отклонить арбитра всех неблагоприятных воздействий.
- Физическое состояние.
- Диета и питание.
- Яды и токсины.
- Психологическое здоровье.
- Побочные действия лекарств.
Концептуальные вопросы
Вопрос 1: Какие клетки крови отвечают за поддержание гомеостаза?
Ответ:
Эритроциты отвечают за поддержание гомеостаза. Эта клетка помогает системе кровообращения, получая частицы кислорода из легких и доставляя их к телефонам внутри тела, а также передавая часть отработанного углекислого газа обратно в легкие для выброса.
Вопрос 2. Роль гомеостаза в поддержании артериального давления?
Ответ:
В венах есть датчики, называемые барорецепторами, которые распознают чрезмерно высокое или чрезмерно низкое напряжение кровообращения и передают сообщение в нервный центр.
Нервный центр затем, в этот момент, производит впечатление на сердце, вены и почки, которые действуют как эффекторы в руководящих принципах напряжения кровообращения.
Вопрос 3. Почему гомеостаз важен для организма?
Ответ:
Гомеостаз – это автоматическое взаимодействие, которое контролирует внутренние факторы, важные для поддержания жизни.
Вопрос 4. Как наше тело поддерживает гомеостаз?
Ответ:
Регулирование нашего внутреннего состояния осуществляется главным образом посредством прискорбного вклада. Негативная критика — это реакция на улучшение, которое содержит переменную, близкую к набору значений
. Вопрос 5. Какие четыре вещи удается поддерживать гомеостазу в организме?
Ответ:
Стимул, датчик, центр управления и эффектор
гомеостаз — определение и значение
- Дайте определение
- Связать
- Список
- Обсудить
- См.

- Услышать
- и Любовь
Определения
из Словаря английского языка American Heritage®, 5-е издание.
- сущ. Состояние равновесия в организме или клетке, поддерживаемое саморегулирующимися процессами.
из версии GNU Collaborative International Dictionary of English.
- сущ. Способность и склонность некоторых систем поддерживать относительно постоянное внутреннее состояние, несмотря на изменения внешних условий; эта способность достигается наличием механизмов обратной связи, которые могут корректировать состояние системы, чтобы компенсировать изменения состояния, вызванные внешней средой. Примером этого являются гомотермические биологические системы, такие как животные, которые поддерживают относительно постоянную температуру и состав крови, несмотря на изменения внешней температуры или состава съеденной пищи.

- сущ. физиология Способность системы или живого организма приспосабливать свою внутреннюю среду для поддержания устойчивого равновесия; Например, способность теплокровных животных поддерживать постоянную температуру.
- сущ. Такое динамическое равновесие или равновесие.
из WordNet 3.0 Copyright 2006 Принстонского университета. Все права защищены.
- сущ. (физиология) метаболическое равновесие, активно поддерживаемое несколькими сложными биологическими механизмами, которые действуют через вегетативную нервную систему для компенсации разрушительных изменений
Etymologies
от Wiktionary, Creative Commons Attribution/ Allike Allike License
, придуманный из древнегреческого ὅμος (hómos, «аналогичный») + ι ι ι ι ι ι ι ι ὅμος (hómos, «аналогичный») + ιστημι (Histēmi, «Stand Stite»)/ STASIS (от 24242424225) (от , «стоящий на месте»)/ . Уолтер Брэдфорд Кэннон.
Уолтер Брэдфорд Кэннон.
Поддержка
Помогите поддержать Wordnik (и освободите эту страницу от рекламы), приняв слово «гомеостаз».
Примеры
Кэннон (1932) применил термин гомеостаз (придуманный врачом 18-го века Клодом Бернаром) к этой мощной способности к саморегуляции.
Стресс и менеджер
Кэннон (1932) применил термин гомеостаз (придуманный врачом 18-го века Клодом Бернаром) к этой мощной способности к саморегуляции.
Стресс и менеджер
Кэннон (1932) применил термин гомеостаз (придуманный врачом 18-го века Клодом Бернаром) к этой мощной способности к саморегуляции.
Стресс и менеджер
Объясните значение термина гомеостаз и приведите пример типичного гомеостатического механизма.
Недавно загруженные слайд-шоу
Когда обмен веществ снижается, а уровень стресса уменьшается, тогда ваши механизмы самовосстановления, которые являются физическими механизмами в вашей биологии, активируются, потому что стресс мешает механизмам спонтанного самовосстановления, или тому, что мы называем гомеостазом , в тело.

Стенограмма CNN от 13 ноября 2007 г.
Когда обмен веществ снижается и уровень стресса уменьшается, тогда ваши механизмы самовосстановления, которые являются физическими механизмами в вашей биологии, активируются, потому что стресс мешает механизмам спонтанного самовосстановления, или тому, что мы называем гомеостаз , в организме.
Стенограмма CNN от 13 ноября 2007 г.
Говоря простыми словами, гомеостатические системы (термин гомеостаз впервые был использован Уолтером Брэдфордом Кэнноном в начале 20-го века для описания поддержания постоянства в физическом
Недавно загруженные слайд-шоу
Естественная способность организма уравновешивать внутреннее и внешнее напряжение называется гомеостаз .
Д-р Бертран Бабине, доктор философии, LAc.: Травы-адаптогены: ключ к долголетию и оптимальному здоровью
Естественная способность организма уравновешивать внутренние и внешние стрессы называется гомеостазом .


 Рецептор отвечает за проверку и реагирование на изменения во внутренней и внешней среде.
Рецептор отвечает за проверку и реагирование на изменения во внутренней и внешней среде. Нервный центр затем, в этот момент, производит впечатление на сердце, вены и почки, которые действуют как эффекторы в руководящих принципах напряжения кровообращения.
Нервный центр затем, в этот момент, производит впечатление на сердце, вены и почки, которые действуют как эффекторы в руководящих принципах напряжения кровообращения.

