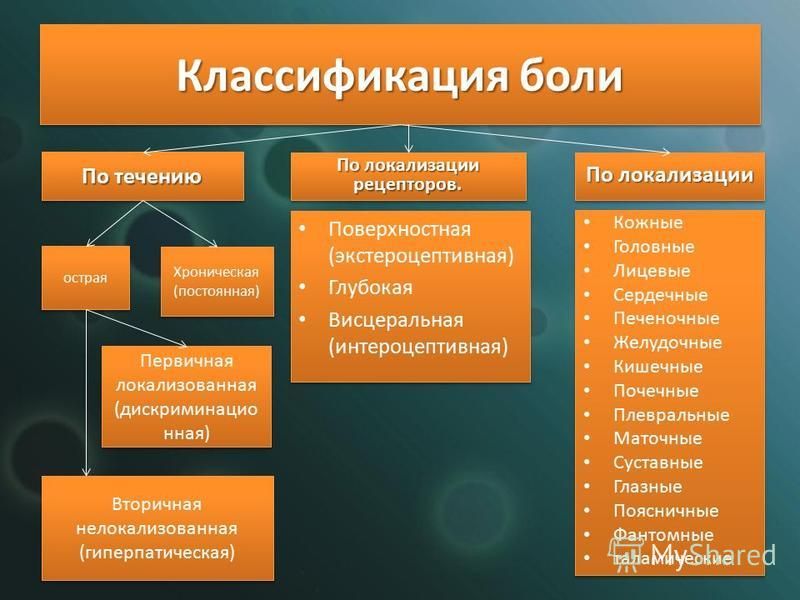
Патофизиологические основы болевого синдрома в родах
Боль как интегративная функция организма мобилизует самые разнообразные функциональные системы для защиты организма от воздействия вредных факторов и включает эмоциональные, моторно-вегетативные и гуморальные проявления, в целом идентичные стресс-реакции на неблагоприятные воздействия [1, 2]. Раскрытие физиологических звеньев, обеспечивающих разнообразие признаков боли, осуществляется через исследование центральных и периферических структур нервной системы, участвующих в восприятии, передаче и анализе болевых раздражителей, а также путем изучения механизмов, регулирующих приток болевых импульсов в мозг [3].
Нейрофизиология родовой боли представлена сложной многонейронной рефлекторной дугой, основные звенья которой, как и любого другого вида боли, можно представить следующей триадой: импульсация, возникающая в результате раздражения периферических ноцицепторов; реакция центральных структур мозга на получение соответствующих импульсов; эфферентный ответ, представляющий собой совокупность эмоциональных, вегетативных и двигательных реакций.
Висцеральная боль возникает в начале первого и во втором периодах родов. Ведущую роль в возникновении висцеральной боли играют сократительная деятельность матки и раскрытие цервикального канала. Имеется свидетельство J. Bonica и H. Chadwick [5] о том, что ручная пальпация тела матки при кесаревом сечении в условиях местной инфильтрационной анестезии не сопровождалась болью, похожей на родовую [5]. В то же время мануальное воздействие на шейку матки у женщин при кесаревом сечении воспроизводило родовую боль.
С каждым сокращением матки давление передается на нижний маточный сегмент и шейку матки, вызывая их растяжение и расширение, одновременно активируя баро- и механорецепторы [11]. Для активной родовой деятельности характерна активация баро- и механорецепторов с высоким порогом возбудимости. Увеличение интенсивности воспринимаемой боли, обычно наблюдаемое при прогрессировании схваток, частично может быть связано со снижением порога реакции ноцицепторов, вызванной повторной стимуляцией в результате сокращений матки. Кроме того, ряд веществ, выделяемых при надрыве клеток миометрия во время повторяющихся сокращений матки, приводит к стимуляции хеморецепторов. К этим высвобождаемым веществам относятся брадикинин, гистамин, серотонин, ацетилхолин, ионы калия и субстанция Р [12]. Ишемия миометрия за счет сокращения артерий матки является еще одним механизмом в этих клеточных реакциях [13, 14].
Увеличение интенсивности воспринимаемой боли, обычно наблюдаемое при прогрессировании схваток, частично может быть связано со снижением порога реакции ноцицепторов, вызванной повторной стимуляцией в результате сокращений матки. Кроме того, ряд веществ, выделяемых при надрыве клеток миометрия во время повторяющихся сокращений матки, приводит к стимуляции хеморецепторов. К этим высвобождаемым веществам относятся брадикинин, гистамин, серотонин, ацетилхолин, ионы калия и субстанция Р [12]. Ишемия миометрия за счет сокращения артерий матки является еще одним механизмом в этих клеточных реакциях [13, 14].
Возникающая афферентная импульсация передается по тонким немиелинизированным С-волокнам, которые в составе симпатических волокон проходят парацервикальную зону, верхнее, среднее и нижнее подчревные нервные сплетения, попадая в нижний торакальный и поясничный симпатический ствол [15, 16]. Болевые волокна от симпатического ствола, проходя через белую соединительную ветвь, связанную со спинномозговыми нервами с Thx по LI, в составе задних корешков направляются в задние рога спинного мозга, заканчиваясь синапсом на клетках вторых нейронов.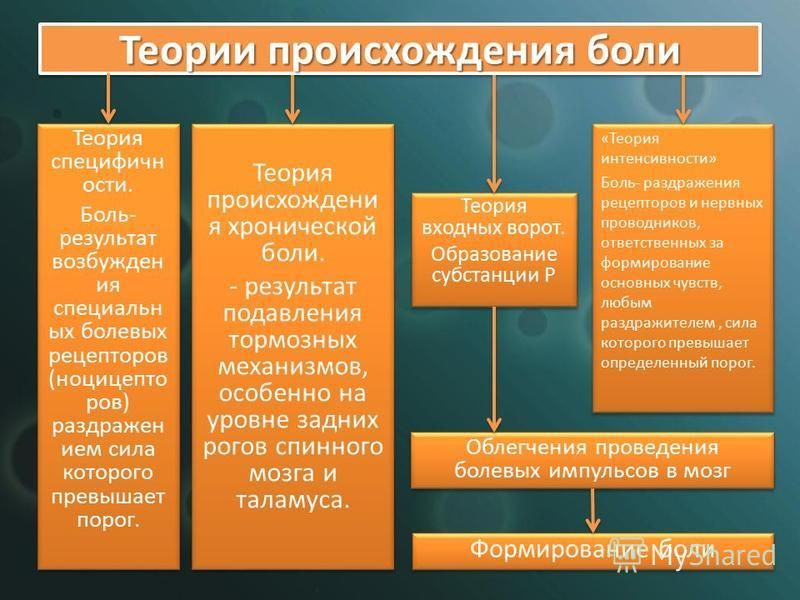 Повторные афферентные импульсы вызывают повышенную чувствительность вторых нейронов в заднем роге, центральную сенситизацию, что приводит к увеличению передачи сигналов в восходящих проводящих путях [17]. Считается, что парасимпатическая иннервация матки не имеет большого значения в передаче маточно-цервикальной боли [11].
Повторные афферентные импульсы вызывают повышенную чувствительность вторых нейронов в заднем роге, центральную сенситизацию, что приводит к увеличению передачи сигналов в восходящих проводящих путях [17]. Считается, что парасимпатическая иннервация матки не имеет большого значения в передаче маточно-цервикальной боли [11].
Иррадиация боли по С-волокнам обеспечивается наличием широкой синаптической связи между самими С-волокнами и возможностью непосредственной передачи возбуждения на соседние аксоны за счет перекрещивания части волокон на уровне заднего рога. Такая широкая диффузия при проведении болевого импульса характерна при поступлении его из висцеральных органов (П.К. Анохин, 1962). Этот феномен объясняет тот факт, что роженицы описывают эту боль как тупую и плохо локализованную (диффузное чувство боли) и не всегда чувствительную к опиоидным средствам.
В начале первого периода родов боль соотносится с дерматомами* ТhXI и ТhXII. К концу первого периода боль распространяется на дерматомы Thx по LI. Таким образом, болевые ощущения локализуются в нижней части живота, крестца и спины.
К концу первого периода боль распространяется на дерматомы Thx по LI. Таким образом, болевые ощущения локализуются в нижней части живота, крестца и спины.
Соматическая боль возникает как дополнение к висцеральной боли в конце первого периода родов, достигая максимума во втором периоде. Она связана с раздражением окончаний афферентных нервов, иннервирующих влагалищную часть шейки матки, промежность и влагалище, в результате натяжения и растяжения маточных связок и брюшины, давления на костные структуры, связки таза, растяжения, ишемии и травмы тазового дна, промежности и влагалища. Кроме того, считается, что сжатие ганглиев, находящихся рядом с шейкой и нижней частью матки, вызывает дополнительный ноцицептивный вход во время окончания первого и начала второго периодов родов [18]. Соматический компонент проявляется во время «опускания» предлежащей части плода на тазовое дно на фоне нарастающей регулярности и интенсивности схваток.
Соматическая боль передается миелиновыми Aδ-волокнами, обеспечивающими высокую скорость проведения нервного импульса. Передача импульсов происходит через срамной нерв и промежностные ветви заднего кожного нерва бедра к спинному мозгу на уровне сегментов SII—SIV. Соматические волокна от кожных ветвей подвздошно-пахового и бедренно-полового нервов также несут афферентные импульсы к сегментам LI и LII.
Во втором периоде родов в дополнение к уже захваченным зонам боль распространяется на верхнюю часть нижних конечностей и ощущается как давление на поясницу и промежность. В конце второго периода родов соматическая боль носит острый и четко локализованный характер во влагалище, прямой кишке и промежности. Она иррадиирует в смежные дерматомы Thx и LI и по сравнению с висцеральной болью является более устойчивой к опиоидам.
Одним их главных субстратов интрацентрального взаимодействия в задних рогах спинного мозга является желатинозная субстанция (II пластина), лежащая на пути прохождения афферентных каналов и получающая коллатерали от большинства афферентных волокон (висцеральных и соматических).
После первичной обработки в желатинозной субстанции стимулы посредством интернейронов спиноталамического тракта передаются в таламус, где все восходящие ноцицептивные пути образуют синапсы по мере продвижения к головному мозгу. В таламусе происходит перераспределение информации в соматосенсорную кору, в которой осуществляется пространственно-временной и сенсорно-описательный анализ боли, учитывающий ее местоположение, интенсивность и продолжительность [20]. Важную роль играет взаимосвязь таламуса с лимбической системой, участвующей в реализации аффективно-эмоционального аспекта боли, и префронтальной корой головного мозга, считающейся наиболее важной областью для когнитивно-рациональной оценки боли (принятие решений, дифференциация противоречивых мыслей и мотивов, дифференциация и интеграция объектов и понятий, концентрация внимания на необходимых объектах) [21, 22].
Базисом изложенной концепции боли служат теории специфичности и режима интенсивности. Тем не менее боль остается сложным явлением, дефиниция и механизмы которой в течение многих лет подвергались в медицине различным изменениям [24].
Теории болиТак, R. Melzack и P. Wall [25] выдвинули теорию «входных ворот», согласно которой важная роль в поступлении в ЦНС болевой импульсации по волокнам различных типов принадлежит механизмам с обратной связью, локализующимся в желатинозной субстанции задних рогов спинного мозга. Возбуждение толстых чувствительных волокон (Аα и Аß) при раздражении закрывает «ворота боли», в то время как воздействие на тонкие волокна (Аδ и С) открывает «ворота» [25].
Впоследствии R. Melzack [26, 27] трансформировал концепцию «входных ворот» в нейроматриксную теорию. Рассматривая мозг как конечный механизм оценки определенных характеристик боли, она учитывает одновременное слияние множества факторов, включая прошлый опыт, культурные особенности, эмоциональное состояние, когнитивную информацию, управление стрессом и иммунную систему в добавление к самому негативному сенсорному входу.
Многочисленные компоненты нейроматрикса, определяющие восприятие боли, производятся тремя параллельными сетями: сенсорно-описательной (соматосенсорные компоненты), аффективно-мотивационной (компоненты лимбической системы) и оценочно-когнитивной (таламокортикальные компоненты) [26]. Моделью также учитываются дополнительное влияние нейроэндокринной, вегетативной нервной системы и модуляция иммунной системы. Синаптические входные сигналы в данные сети могут носить как фазный (короткие резкие сигналы, такие как кожный сенсорный вход или концентрация внимания), так и тонический характер (более длинные модуляционные сигналы, среди которых культурный багаж и прошлый опыт). Суммирование трех параллельных процессов образует личное восприятие боли и «программу действий», включающую осознанные и неосознанные стратегии борьбы с болью, применяемые женщиной в родах.
Суммирование трех параллельных процессов образует личное восприятие боли и «программу действий», включающую осознанные и неосознанные стратегии борьбы с болью, применяемые женщиной в родах.
Следует отметить, что противоречия в механизмах возникновения боли стали предметом исследовательской работы в нескольких направлениях не только патофизиологов, но и клиницистов, постоянно сталкивающихся с проблемой боли в своей повседневной работе. Среди основных направлений можно выделить развитие нейрохимических исследований нейромедиаторных механизмов боли, изучение роли опиоидных рецепторов и эндогенных морфинов, а также центральных структур в реализации болевого ответа.
Механизмы контроля болевой чувствительностиВ настоящее время не вызывает сомнения полинейрохимичность ноцицептивных и антиноцицептивных систем мозга, которая может рассматриваться в качестве одного из ведущих факторов, обеспечивающих надежность целостной болевой интеграции. Важная роль принадлежит при этом нейротрансмиттерам (ацетилхолин, норадреналин, серотонин), а также кальцитонин-ген-родственному пептиду и субстанции Р, каждый из которых связан с обеспечением определенных компонентов психофизиологического феномена боли [28, 29].
Важная роль принадлежит при этом нейротрансмиттерам (ацетилхолин, норадреналин, серотонин), а также кальцитонин-ген-родственному пептиду и субстанции Р, каждый из которых связан с обеспечением определенных компонентов психофизиологического феномена боли [28, 29].
Другая важная структура модуляции боли — центральное периакведуктальное серое вещество ствола мозга (ЦСВМ). Большая часть опиоид-индуцированных антиноцицепторов берет свое начало из этой структуры, и это же место является основным для нисходящих ингибирующих путей [30]. Принимая ноцицептивные импульсы от задних рогов спинного мозга, ЦСВМ двусторонне связано с гипоталамусом, фронтальной корой и миндалевидным телом, областями, отвечающими за контроль эмоций, в частности, тревоги и страха, что может объяснить влияние эмоций на модуляцию восприятия боли [31].
Стимуляция околопроводного серого вещества активирует энкефалин-рилизинг-нейроны, расположенные в ядрах шва ствола головного мозга. Серотонин, высвобождаемый из ядер шва, достигая заднего рога спинного мозга, образует синапсы с «ингибирующими интернейронами», расположенными во II пластине (желатинозной субстанции). При активации эти интернейроны высвобождают эндогенные опиоидные нейротрансмиттеры, которые связываются с µ-опиоидными рецепторами на аксонах С- и Аδ-волокон, несущих болевые сигналы от ноцицепторов, активированных на периферии. Активация µ-опиоидных рецепторов ингибирует высвобождение субстанции Р из нейронов первого порядка и в свою очередь ингибирует активацию вторых нейронов, которые отвечают за передачу болевого сигнала по спиноталамическому тракту к вентральному заднелатеральному ядру таламуса. Таким образом, ноцицептивный сигнал подавляется прежде, чем он может добраться до корковых областей, интерпретирующих сигналы как «боль» [32].
При активации эти интернейроны высвобождают эндогенные опиоидные нейротрансмиттеры, которые связываются с µ-опиоидными рецепторами на аксонах С- и Аδ-волокон, несущих болевые сигналы от ноцицепторов, активированных на периферии. Активация µ-опиоидных рецепторов ингибирует высвобождение субстанции Р из нейронов первого порядка и в свою очередь ингибирует активацию вторых нейронов, которые отвечают за передачу болевого сигнала по спиноталамическому тракту к вентральному заднелатеральному ядру таламуса. Таким образом, ноцицептивный сигнал подавляется прежде, чем он может добраться до корковых областей, интерпретирующих сигналы как «боль» [32].
Необходимо также отметить значительную роль опиоидных рецепторов и эндогенных морфинов в регуляции болевой чувствительности в качестве нейромедиаторов и нейромодуляторов ноцицептивных и антиноцицептивных систем мозга. Согласно проведенным исследованиям [33], рецептивные поля в нейронах заднего рога обладают динамичностью и могут изменять частоту передачи болевого импульса к мозгу в ответ на изменение стимулов, нейротрансмиттеров и нейромодуляторов.
Анальгетические свойства β-эндорфинов при купировании родовой боли были оценены в работе Т. Oyama и соавт. [34]. В исследование были включены 14 рожениц (7 первородящих и 7 повторнородящих), которым при раскрытии шейки матки на 3,5—5 см субдурально на уровне LIII—LIV вводился 1 мг синтетического β-эндорфина. Авторами продемонстрирован быстрый (начало действия через 3,5±0,5 мин) и длительный (средняя продолжительность 18,8±1,6 ч) анальгетический эффект синтетического аналога. При этом его введение не влияло на родовую деятельность и внутриутробное состояние плода.
Результаты исследований показали прогрессивное нарастание концентрации ß-липотрофина, ß-эндорфина и γ-липотрофина в крови матери максимально к 32-й неделе беременности [35]. Увеличение концентрации эндогенных пептидов на фоне беременности может быть одним из факторов, ответственных за снижение чувствительности беременных к местным и общим анестетикам. Минимальные альвеолярные концентрации галотана и изофлурана уменьшаются у беременных на 25 и 40% соответственно [35]. Таким образом, повышение концентрации пептидов необходимо рассматривать как эндогенный защитный механизм, активирующийся на фоне прогрессирующей беременности и оказывающий регулирующее влияние на болевые ощущения в родах.
Таким образом, повышение концентрации пептидов необходимо рассматривать как эндогенный защитный механизм, активирующийся на фоне прогрессирующей беременности и оказывающий регулирующее влияние на болевые ощущения в родах.
В настоящее время все больший научный интерес вызывает способность окситоцина модулировать боль и вызывать аналгезию, что подтверждается рядом клинических исследований [36—38]. S. Gutierrez и соавт. [39] продемонстрировали, что боль и гиперчувствительность, вызванные травмой периферических нервов, регрессируют быстрее у крыс, если это происходит незадолго до родов, а субарахноидальное введение окситоцина (в спинномозговую жидкость) вызывает антигиперсенситизацию, которая может быть нейтрализована антагонистом окситоциновых рецепторов. Рассмотренный защитный механизм отражает задержку передачи сигналов окситоцина на уровне спинного мозга в послеродовом периоде [39].
Воздействуя на центральную и периферическую нервную систему, окситоцин напрямую снижает активность спинномозговых нейронов, получающих сенсорную информацию [40], возбуждает интернейроны в спинном мозге, ингибирующие гамма-аминомасляную кислоту (ГАМК-интернейроны), [41, 42], сокращает Aδ/C-афферентную восходящую ноцицептивную импульсацию [42]. Дополнительные механизмы включают участие эндогенных опиоидов [43] и каннабиноидных [44] систем, модулирующих восприятие боли. Субарахноидальная инъекция окситоцина у крыс с симптомами воспаления вызывала антиноцицептивный эффект путем активации рецепторов окситоцина, а также μ- и κ-опиоидных рецепторов, вовлеченных в окситоцин-индуцированную соматическую аналгезию на спинальном уровне [45]. Помимо соматической аналгезии, субарахноидальное введение окситоцина также может быть эффективным фармакологическим средством лечения висцеральной боли, ингибируя ноцицептивные реакции в ответ на резкое раздражение мочевого пузыря [46].
Дополнительные механизмы включают участие эндогенных опиоидов [43] и каннабиноидных [44] систем, модулирующих восприятие боли. Субарахноидальная инъекция окситоцина у крыс с симптомами воспаления вызывала антиноцицептивный эффект путем активации рецепторов окситоцина, а также μ- и κ-опиоидных рецепторов, вовлеченных в окситоцин-индуцированную соматическую аналгезию на спинальном уровне [45]. Помимо соматической аналгезии, субарахноидальное введение окситоцина также может быть эффективным фармакологическим средством лечения висцеральной боли, ингибируя ноцицептивные реакции в ответ на резкое раздражение мочевого пузыря [46].
Кроме того, в исследовании Z. Tan и соавт. [47] выявлен двухфазный эффект окситоцина: низкие дозы окситоцина усиливают ГАМК-активированные потоки, приводящие к подавлению первичной сенсорной передачи, в то время как его более высокие дозы уменьшают пресинаптическое ингибирование ГАМК-интернейронов. Полученные результаты согласуются с недавним исследованием P. Juif и P. Poisbeau [48], показавшим, что внутривенные инъекции низких доз окситоцина вызывали окситоцин-опосредованную антиноцицепцию, в то время как его более высокие дозы вызывали вазопрессин-V1A-опосредованную ноцицепцию у самцов крыс.
Juif и P. Poisbeau [48], показавшим, что внутривенные инъекции низких доз окситоцина вызывали окситоцин-опосредованную антиноцицепцию, в то время как его более высокие дозы вызывали вазопрессин-V1A-опосредованную ноцицепцию у самцов крыс.
Приведенные новые данные о способности окситоцина модулировать болевую реакцию и вызывать окситоцин-индуцированную аналгезию представляются перспективным научным направлением, требующим дальнейшего изучения конкретных механизмов реализации указанных эффектов как на спинальном, так и на супраспинальном уровнях, что, возможно, откроет новые возможности применения малых доз окситоцина как обезболивающего средства.
Таким образом, современное представление о нейрофизиологических механизмах боли основано на фактах существования в мозге специфических афферентных систем боли, состоящих из определенных типов волокон и специализированных групп нервных клеток в спинном мозге и стволе мозга. В стволе мозга заключены нейронные системы (серотонин-, эндорфин-, дофамин- и норадренергическая), которые синаптическим и нейрогуморальным путем регулируют чувствительность различных уровней афферентных систем боли. Следовательно, понимание патогенеза родовой боли как многомерного процесса обеспечивает основу для дифференцированного пациент-ориентированного подхода к ее управлению, которое включает широкий спектр фармакологических и нефармакологических методов.
Следовательно, понимание патогенеза родовой боли как многомерного процесса обеспечивает основу для дифференцированного пациент-ориентированного подхода к ее управлению, которое включает широкий спектр фармакологических и нефармакологических методов.
Авторы заявляют об отсутствии конфликта интересов.
* дерматом — участок кожи, иннервируемый нервными волокнами одного дорзального нервного корешка.
Межменструальный болевой синдром. Что такое Межменструальный болевой синдром?
ВАЖНО
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Межменструальный болевой синдром — разновидность хронических тазовых болей, при которых болезненные ощущения в области таза наблюдаются во время овуляции и связаны с ней. Проявляется болью разной интенсивности, возникающей внизу живота в середине овуляторного цикла, сопровождается психовегетативными расстройствами. Для постановки диагноза используют метод измерения базальной температуры, фолликулометрию, тесты на овуляцию. Симптоматическое лечение с применением спазмолитиков, анальгетиков, седативных средств назначают только при выраженной симптоматике. По показаниям возможно подавление созревания фолликулов при помощи оральных контрацептивов.
Проявляется болью разной интенсивности, возникающей внизу живота в середине овуляторного цикла, сопровождается психовегетативными расстройствами. Для постановки диагноза используют метод измерения базальной температуры, фолликулометрию, тесты на овуляцию. Симптоматическое лечение с применением спазмолитиков, анальгетиков, седативных средств назначают только при выраженной симптоматике. По показаниям возможно подавление созревания фолликулов при помощи оральных контрацептивов.
- Причины
- Патогенез
- Симптомы
- Осложнения
- Диагностика
- Лечение межменструального болевого синдрома
- Прогноз и профилактика
- Цены на лечение
Общие сведения
О наличии у пациентки межменструального болевого синдрома (синдрома срединных болей, овуляторной боли, синдрома Миттельшмерца) говорят, когда органическая основа для возникновения дискомфортных ощущений не обнаружена или клинические проявления обнаруженных заболеваний способны вызвать либо усилить болезненную овуляцию. Тянущую болезненность в нижней части живота на фоне овуляции хотя бы раз в жизни испытывали не менее 45-50% женщин, приблизительно у 20% пациенток межменструальная боль возникает регулярно. У девочек-подростков и девушек до 20 лет расстройство обычно является функциональным, у пациенток от 20 до 35 лет оно часто связано с воспалением, у женщин старше 35 лет ведущими причинами становятся спаечные процессы и дисгормональные состояния.
Тянущую болезненность в нижней части живота на фоне овуляции хотя бы раз в жизни испытывали не менее 45-50% женщин, приблизительно у 20% пациенток межменструальная боль возникает регулярно. У девочек-подростков и девушек до 20 лет расстройство обычно является функциональным, у пациенток от 20 до 35 лет оно часто связано с воспалением, у женщин старше 35 лет ведущими причинами становятся спаечные процессы и дисгормональные состояния.
Межменструальный болевой синдром
Причины
Овуляторная боль — следствие физиологических изменений, происходящих в женском организме в момент выхода яйцеклетки из яичника. В 85% случаев она периодически или постоянно появляется у гинекологически здоровых женщин, у 14% пациенток свидетельствует о заболеваниях репродуктивных органов. В 1% клинических ситуаций внезапно возникшей болезненностью при овуляции сопровождается экстрагенитальная патология. Непосредственными причинами синдрома межменструальных болей являются:
- Низкий болевой порог.
 В норме выход яйцеклетки не должен ощущаться. Однако при снижении порога болевых ощущений нервные импульсы, возникающие в результате реакции тканей яичника, маточных труб и тазовой брюшины на выход яйцеклетки, воспринимаются головным мозгом как патологические, болезненные. Эта причина играет ведущую роль у впечатлительных или перенесших стресс пациенток.
В норме выход яйцеклетки не должен ощущаться. Однако при снижении порога болевых ощущений нервные импульсы, возникающие в результате реакции тканей яичника, маточных труб и тазовой брюшины на выход яйцеклетки, воспринимаются головным мозгом как патологические, болезненные. Эта причина играет ведущую роль у впечатлительных или перенесших стресс пациенток. - Воспалительные болезни репродуктивных органов. Болезненность овуляции у женщин с хроническими оофоритами, сальпингитами, аднекситами связана с возможным отеком тканей, ограничением подвижности органов и действием медиаторов воспаления, снижающих ноцицептивный порог. Разрыв фолликула воспаленного яичника ощущается более болезненным из-за уплотнения капсулы органа.
- Экстрагенитальный и наружный генитальный эндометриоз. Клетки эндометриоидных очагов, развивающихся в яичниках, фаллопиевых трубах, тазовой брюшине, циклически изменяются в ответ на действие половых гормонов. Межменструальное падение уровня эстрогенов на фоне низкой концентрации прогестерона вызывает в зонах эндометриоза менструальноподобный эффект с раздражением окружающих тканей.

- Спайки в малом тазу. При вовлечении в спаечный процесс придатков матки существенно ограничивается их подвижность. После разрыва фолликула возникают перистальтические движения фаллопиевых труб, сокращаются гладкомышечные волокна связок, поддерживающих яичник. В результате натягиваются спайки, которые окружают эти органы, в головной мозг передается патологическая болевая импульсация.
- Травмы таза. Синдром межменструальной боли наблюдается у 51,8% женщин, перенесших травматические повреждения тазовых костей, особенно крестцово-копчиковой зоны. Появление болезненности при овуляции у таких пациенток связано с нарушением иннервации тазовых органов, уменьшением порога возникновения болевых ощущений, посттравматическими нейроэндокринными расстройствами.
Патогенез
В основе развития синдрома Миттельшмерца лежат естественные физиологические процессы, происходящие при овуляции. Существует пять компонентов овуляции, которые теоретически способны спровоцировать возникновение болевых ощущений: натяжение капсулы яичника при созревании фолликула, ее разрыв для выхода яйцеклетки, раздражение брюшины излившимся фолликулярным содержимым, перистальтика маточных труб, захватывающих ооцит, сокращение гладкомышечных элементов в связках яичника.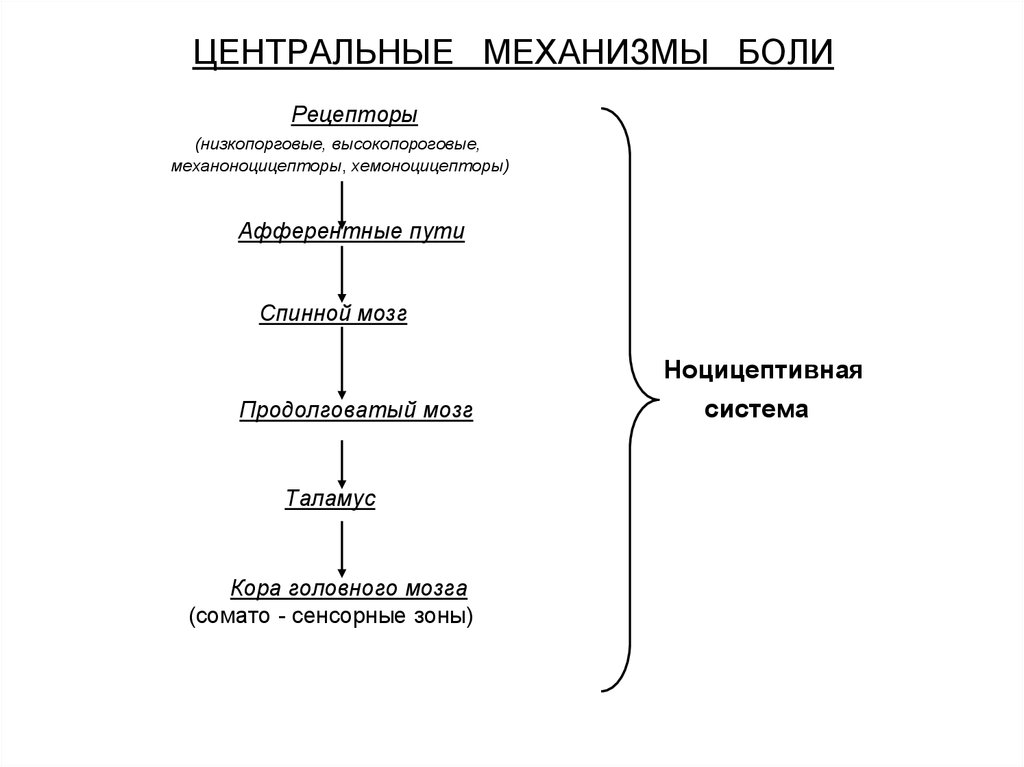
В норме афферентная импульсация при всех этих процессах проходит на подпороговом уровне. Межменструальная боль становится ощутимой при врожденных или приобретенных нарушениях в антиноцицептивной системе, когда порог болевой чувствительности снижен за счет функциональных расстройств (повышенной возбудимости коры мозга, посттравматических изменений в нервных волокнах) или существует органическая основа формирования патологических ощущений (воспаление, патологическая секреция, спаечный процесс).
Симптомы
Ключевым проявлением овуляторной боли считается болезненность и дискомфорт в нижних отделах живота за 13-15 дней до начала очередной менструации. Интенсивность болевого синдрома бывает разной — от тянущего разлитого дискомфорта до острой колющей боли. Возможна иррадиация ощущений в копчик, крестец, поясницу, паховую область, редко — во внутреннюю поверхность бедра. Обычно межменструальная боль односторонняя, локализована на стороне яичника, из которого вышла яйцеклетка.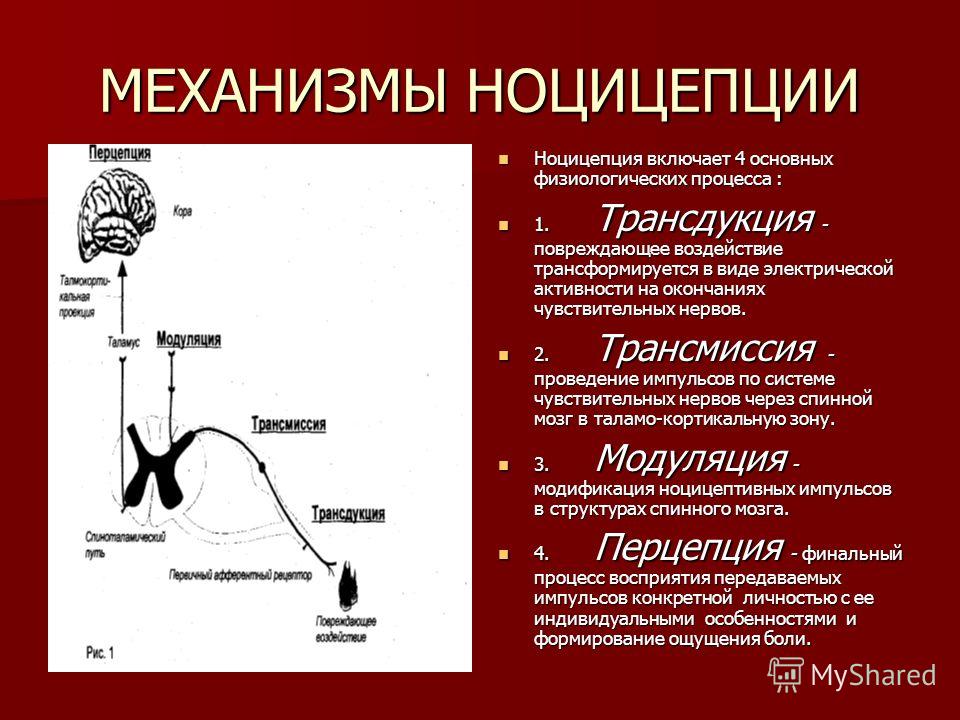 Лишь при созревании двух ооцитов она ощущается с двух сторон. Болевой синдром при овуляции обычно сопровождается жидкими прозрачными выделениями из влагалища, усилением полового влечения, мастодинией, у некоторых пациенток — повышением температуры до 37,0-37,4° С, тошнотой, кратковременной головной болью, головокружением, колебаниями настроения. Возможно появление нескольких капелек крови на белье. Длительность клинических проявлений при синдроме Миттельшмерца обычно не превышает 1-2 дней.
Лишь при созревании двух ооцитов она ощущается с двух сторон. Болевой синдром при овуляции обычно сопровождается жидкими прозрачными выделениями из влагалища, усилением полового влечения, мастодинией, у некоторых пациенток — повышением температуры до 37,0-37,4° С, тошнотой, кратковременной головной болью, головокружением, колебаниями настроения. Возможно появление нескольких капелек крови на белье. Длительность клинических проявлений при синдроме Миттельшмерца обычно не превышает 1-2 дней.
Осложнения
Опасность для здоровья женщины при болевом межменструальном синдроме отсутствует, но выраженная симптоматика ухудшает качество жизни пациентки, приводит к снижению продуктивности и работоспособности. У впечатлительных больных возможно развитие ипохондрии, депрессивного невроза, канцерофобии. Более серьезными являются последствия несвоевременной диагностики заболеваний, на фоне которых возникает межменструальная боль. При отсутствии адекватного лечения патологические процессы хронизируются, осложняются нарушением репродуктивной и эндокринной функций, образованием неоплазий.
Диагностика
Задачами диагностического этапа подозрении на межменструальный болевой синдром являются подтверждение связи ощущений с овуляцией, выявление возможных патологических причин расстройства, исключение других генитальных и экстрагенитальных заболеваний, сопровождающихся болезненностью в тазовой области. При постановке диагноза наиболее эффективны:
- Измерение базальной температуры. Простой бесплатный метод, доступный для самостоятельного контроля в домашних условиях. В день выхода яйцеклетки ректальная или влагалищная температура, измеренная после ночного сна, снижается приблизительно на 0,3° С, после чего поднимается до 37° C и выше.
- Ультразвуковая фолликулометрия. Сонографический мониторинг роста и развития доминантного фолликула позволяет точно определить день выхода зрелого ооцита. Трансвагинальное исследование проводится ежедневно в первой половине месячного цикла, начиная с 5-10 дня после менструации.
- Тест на овуляцию.
 Методика основана на определении уровня лютеинизирующего гормона в моче и адаптирована для простого самостоятельного применения. Уровень ЛГ нарастает до разрыва фолликула, достигает пика при выходе из яичника зрелой яйцеклетки, после чего начинает снижаться.
Методика основана на определении уровня лютеинизирующего гормона в моче и адаптирована для простого самостоятельного применения. Уровень ЛГ нарастает до разрыва фолликула, достигает пика при выходе из яичника зрелой яйцеклетки, после чего начинает снижаться.
Для выявления заболеваний, усиливающих клинику овуляторного болевого синдрома, назначают УЗИ малого таза, КТ и МРТ репродуктивных органов, диагностическую лапароскопию, определение уровня половых гормонов (эстрадиола, прогестерона, ФСГ, ЛГ), проведение фармакологических гормональных проб, другие методики. Дифференциальную диагностику межменструальной боли осуществляют с фолликулярной кистой, аппендицитом, внематочной беременностью, апоплексией яичника, перекрутом ножки его кисты, острым сальпингоофоритом, синдромом гиперстимуляции яичников лекарственными средствами. К постановке диагноза могут привлекаться гинеколог-эндокринолог, абдоминальный хирург.
Лечение межменструального болевого синдрома
Специалисты в сфере акушерства и гинекологии не считают овуляторную боль патологическим явлением и обычно не назначают какую-либо специальную терапию при незначительных или умеренных болезненных ощущениях. В подобных случаях достаточными оказываются исключение физических нагрузок, дополнительный отдых, отказ от сексуальных контактов в период овуляции, если женщина не планирует беременность. При интенсивном болевом синдроме или его возникновении на патологической основе рекомендовано лечение, направленное на:
В подобных случаях достаточными оказываются исключение физических нагрузок, дополнительный отдых, отказ от сексуальных контактов в период овуляции, если женщина не планирует беременность. При интенсивном болевом синдроме или его возникновении на патологической основе рекомендовано лечение, направленное на:
- Купирование боли. В дни овуляции возможно использование спазмолитиков и анальгетиков. Часто применяют нестероидные противовоспалительные средства, которые снижают уровень медиаторов воспаления, эффективно воздействуют на периферические и центральные ноцицептивные механизмы, повышая болевой порог и снижая интенсивность патологической импульсации.
- Уменьшение психовегетативных расстройств. В большинстве случаев для коррекции связанных с овуляцией эмоциональных нарушений достаточно назначения растительных седативных препаратов. При возникновении неврозов на фоне межменструальной боли эффективны мягкие антидепрессанты, аутосуггестия, психотерапевтические техники.
- Подавление овуляции.
 Чтобы временно исключить действие факторов, вызывающих болевой межменструальный синдром, используют оральные контрацептивы. При их приеме прекращается созревание фолликулов, цикл становится ановуляторным. В последующем после восстановления нормального менструального цикла интенсивность симптоматики зачастую уменьшается.
Чтобы временно исключить действие факторов, вызывающих болевой межменструальный синдром, используют оральные контрацептивы. При их приеме прекращается созревание фолликулов, цикл становится ановуляторным. В последующем после восстановления нормального менструального цикла интенсивность симптоматики зачастую уменьшается. - Лечение генитальной и экстрагенитальной патологии. Конкретная терапевтическая схема подбирается с учетом ведущего заболевания, провоцирующего или усиливающего синдром срединных болей. Для лечения могут применяться антибиотики, гормональные препараты, иммуномодуляторы, эубиотики. В ряде случаев при наличии объемных образований показаны хирургические вмешательства.
Прогноз и профилактика
Прогноз болевого межменструального синдрома благоприятный, коррекция образа жизни и обоснованное назначение лекарственных препаратов позволяют уменьшить или полностью устранить болезненные ощущения, повысить качество жизни женщины. Важную роль в прогностическом плане играет своевременное определение причин, вызвавших расстройство, и адекватное лечение выявленной органической патологии. Для профилактики негативных проявлений межменструальной боли пациентке рекомендуется не реже двух раз в год посещать акушера-гинеколога, следить за месячным циклом, чтобы в дни предполагаемого выхода яйцеклетки исключить чрезмерные нагрузки и соблюдать половой покой.
Для профилактики негативных проявлений межменструальной боли пациентке рекомендуется не реже двух раз в год посещать акушера-гинеколога, следить за месячным циклом, чтобы в дни предполагаемого выхода яйцеклетки исключить чрезмерные нагрузки и соблюдать половой покой.
Вы можете поделиться своей историей болезни, что Вам помогло при лечении межменструального болевого синдрома.
Источники
- Настоящая статья подготовлена по материалам сайта: https://www.krasotaimedicina.ru/
ВАЖНО
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Патофизиология боли: практический учебник
. 2014 Октябрь; 134 (4 Приложение 2): 8S-14S.
doi: 10.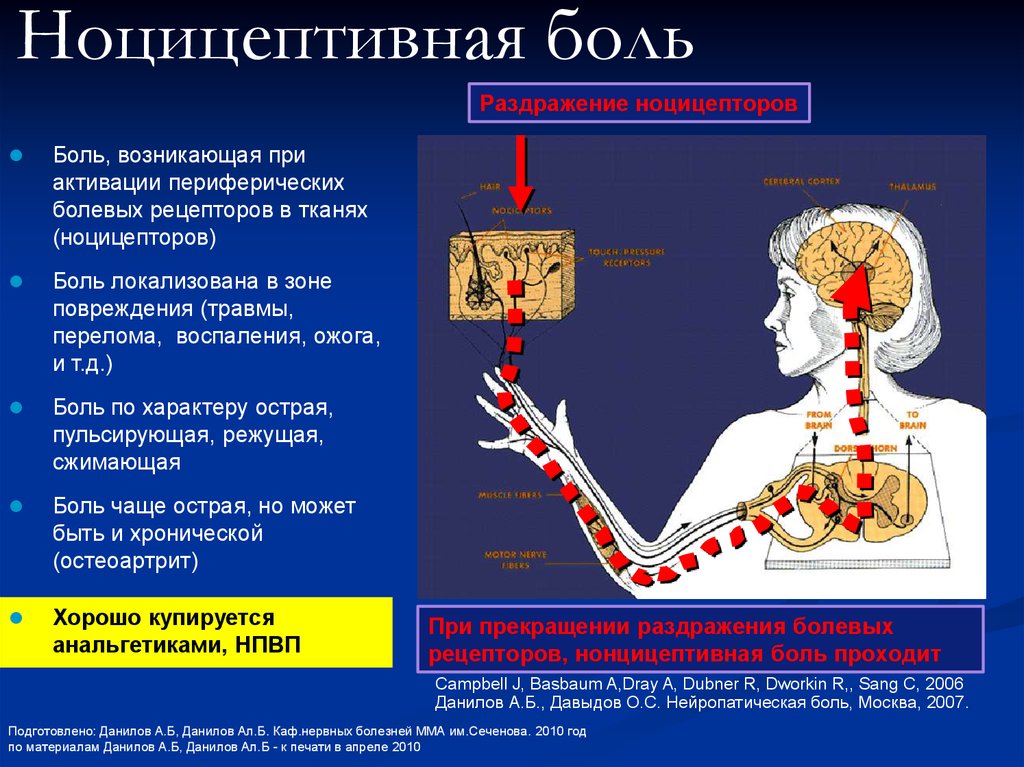 1097/PRS.0000000000000682.
1097/PRS.0000000000000682.
Аделина Фонг 1 , Стефан А. Шуг
принадлежность
- 1 Перт, Австралия Из отделения обезболивания больницы сэра Чарльза Гэрднера; и Отделение фармакологии, фармации и анестезиологии, Школа медицины и фармакологии, Университет Западной Австралии.
- PMID: 25255013
- DOI: 10.1097/PRS.0000000000000682
Аделина Фонг и др. Plast Reconstr Surg. 2014 Октябрь
. 2014 Октябрь; 134 (4 Приложение 2): 8S-14S.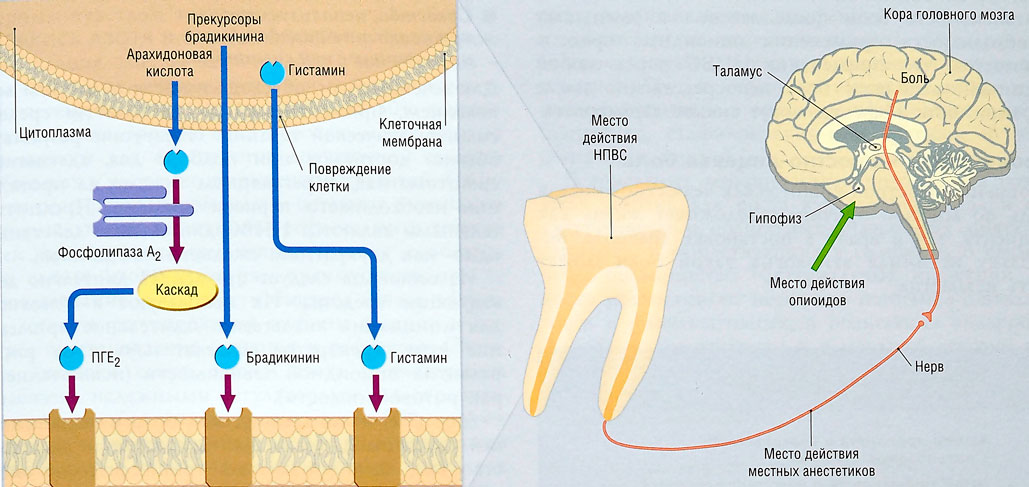
дои: 10.1097/ПРС.0000000000000682.
Авторы
Аделина Фонг 1 , Стефан А. Шуг
принадлежность
- 1 Перт, Австралия Из отделения обезболивания больницы сэра Чарльза Гэрднера; и Отделение фармакологии, фармации и анестезиологии, Школа медицины и фармакологии, Университет Западной Австралии.
- PMID: 25255013
- DOI: 10.1097/PRS.0000000000000682
Абстрактный
Переживание боли субъективно и представляет собой нечто большее, чем просто ощущение. Боль обычно определяют как неприятное сенсорное и эмоциональное переживание, связанное с фактическим или потенциальным повреждением тканей или описываемое в таких терминах. Боль можно разделить на физиологическую и патологическую. Ноцицептивная и воспалительная боль являются физиологическими болевыми состояниями, поскольку они носят защитный и адаптивный характер, тогда как патологическая боль не является защитной и дезадаптирующей. Ноцицепция является результатом надпороговой стимуляции периферических ноцицепторов. Воспалительная боль следует за высвобождением различных химических медиаторов после повреждения тканей, включая хирургическое вмешательство, приводящее к периферической сенсибилизации. Затем ноцицептивный вход передается в спинной мозг через первичные афференты. Модуляция ноцицептивного входа происходит в задних рогах спинного мозга под влиянием нисходящих тормозных систем. Центральная сенсибилизация представляет собой нейромодулирующее изменение, которое приводит к развитию вторичной гипералгезии.
Боль обычно определяют как неприятное сенсорное и эмоциональное переживание, связанное с фактическим или потенциальным повреждением тканей или описываемое в таких терминах. Боль можно разделить на физиологическую и патологическую. Ноцицептивная и воспалительная боль являются физиологическими болевыми состояниями, поскольку они носят защитный и адаптивный характер, тогда как патологическая боль не является защитной и дезадаптирующей. Ноцицепция является результатом надпороговой стимуляции периферических ноцицепторов. Воспалительная боль следует за высвобождением различных химических медиаторов после повреждения тканей, включая хирургическое вмешательство, приводящее к периферической сенсибилизации. Затем ноцицептивный вход передается в спинной мозг через первичные афференты. Модуляция ноцицептивного входа происходит в задних рогах спинного мозга под влиянием нисходящих тормозных систем. Центральная сенсибилизация представляет собой нейромодулирующее изменение, которое приводит к развитию вторичной гипералгезии. Модулированный ноцицептивный вход затем проходит вверх по восходящим путям, в основном через спиноталамический тракт к таламусу и затем к высшим центрам головного мозга. Патологическая боль, такая как невропатическая боль и дисфункциональная боль центральной нервной системы, является результатом нейропластичности периферической и центральной нервной системы. В патогенез этих болевых состояний вовлечены аномальная эктопическая активация нейронов в отсутствие стимула, повышенная гиперчувствительность нейронов, изменения в ионных каналах и даже изменение экспрессии генов и изменения в корковом представительстве. Примером этого сложного процесса является развитие стойкой послеоперационной боли.
Модулированный ноцицептивный вход затем проходит вверх по восходящим путям, в основном через спиноталамический тракт к таламусу и затем к высшим центрам головного мозга. Патологическая боль, такая как невропатическая боль и дисфункциональная боль центральной нервной системы, является результатом нейропластичности периферической и центральной нервной системы. В патогенез этих болевых состояний вовлечены аномальная эктопическая активация нейронов в отсутствие стимула, повышенная гиперчувствительность нейронов, изменения в ионных каналах и даже изменение экспрессии генов и изменения в корковом представительстве. Примером этого сложного процесса является развитие стойкой послеоперационной боли.
Похожие статьи
Патофизиология болей в пояснице и переход в хроническое состояние — экспериментальные данные и новые представления.
Менсе С. Менсе С.
 Шмерц. 2001 г.; 15 (6): 413-7. doi: 10.1007/s004820100002.
Шмерц. 2001.
PMID: 11793144
Немецкий.
Шмерц. 2001 г.; 15 (6): 413-7. doi: 10.1007/s004820100002.
Шмерц. 2001.
PMID: 11793144
Немецкий.Индукция боли: интегративный обзор.
Миллан М.Дж. Миллан МДж. Прог Нейробиол. 1999 г., январь; 57 (1): 1–164. doi: 10.1016/s0301-0082(98)00048-3. Прог Нейробиол. 1999. PMID: 9987804 Обзор.
[Нейробиология висцеральной боли].
Яниг В. Яниг В. Шмерц. 2014 июнь;28(3):233-51. doi: 10.1007/s00482-014-1402-x. Шмерц. 2014. PMID: 24
7
Обзор.
Немецкий.Механизмы болей в пищеводе.
Линн РБ. Линн РБ. Am J Med. 1992 г., 27 мая; 92 (5А): 11S-19S.
 doi: 10.1016/0002-9343(92)80051-z.
Am J Med. 1992.
PMID: 1595755
Обзор.
doi: 10.1016/0002-9343(92)80051-z.
Am J Med. 1992.
PMID: 1595755
Обзор.Усиление котранспорта K-Cl восстанавливает нормальное спиноталамическое сенсорное кодирование в модели невропатической боли.
Лаверту Г., Котэ С.Л., Де Конинк Ю. Лаверту Г. и соавт. Мозг. 2014 март; 137 (часть 3): 724-38. дои: 10.1093/мозг/awt334. Epub 2013 24 декабря. Мозг. 2014. PMID: 24369380
Посмотреть все похожие статьи
Цитируется
Непосредственное влияние одного сеанса нейробиологии боли на боль и вегетативную нервную систему у субъектов с постоянной болью, экспериментальное исследование.
Силлевис Р., Тринкадо Г., Шамус Э. Силевис Р. и соавт. Пир Дж.
 2021 31 мая; 9:e11543. doi: 10.7717/peerj.11543. Электронная коллекция 2021.
Пир Дж. 2021.
PMID: 34131526
Бесплатная статья ЧВК.
2021 31 мая; 9:e11543. doi: 10.7717/peerj.11543. Электронная коллекция 2021.
Пир Дж. 2021.
PMID: 34131526
Бесплатная статья ЧВК.Послеоперационный кеторолак в процедурах контурной пластики груди и тела: общенациональный анализ заявлений.
Келли Б.П., Чанг К.С., Чанг Т.Т., Беннетт К.Г., Сакс Г., Сирс Э.Д., Валджи Дж.Ф. Келли Б.П. и др. Plast Reconstr Surg. 2018 окт.; 142(4):472e-480e. doi: 10.1097/PRS.0000000000004806. Plast Reconstr Surg. 2018. PMID: 30252810 Бесплатная статья ЧВК.
Смертельные случаи от рецептурных опиоидов: изучение того, почему целитель может быть виновником.
Adewumi AD, Staatz CE, Hollingworth SA, Connor JP, Alati R. Адевуми А.Д. и др. Препарат Саф. 2018 ноябрь;41(11):1023-1033.
 doi: 10.1007/s40264-018-0687-6.
Препарат Саф. 2018.
PMID: 29796831
Обзор.
doi: 10.1007/s40264-018-0687-6.
Препарат Саф. 2018.
PMID: 29796831
Обзор.Роль и последствия лечения периферической и центральной обработки боли, зуда и тошноты в повышенном соматическом сознании: обзор.
Spiegel DR, Pattison A, Lyons A, Ansari U, Mccroskey AL, Luehrs E, Barr L, Le S. Шпигель Д.Р. и соавт. Innov Clin Neurosci. 2017 1 июня; 14 (5-6): 11-20. eCollection 2017 май-июнь. Innov Clin Neurosci. 2017. PMID: 28979822 Бесплатная статья ЧВК. Обзор.
Аверсивное поведение нематоды C. elegans модулируется цГМФ и сетью нейронных щелевых соединений.
Кржижановский М.С., Волдемариам С., Вуд Дж. Ф., Чауби А. Х., Брюггеманн С., Боуитч А., Бетке М., Л’Этуаль Н. Д., Ферки Д. М. Krzyzanowski MC, et al.
 Генетика PLoS. 26 июля 2016 г .; 12 (7): e1006153. doi: 10.1371/journal.pgen.1006153. Электронная коллекция 2016 июль.
Генетика PLoS. 2016.
PMID: 27459302
Бесплатная статья ЧВК.
Генетика PLoS. 26 июля 2016 г .; 12 (7): e1006153. doi: 10.1371/journal.pgen.1006153. Электронная коллекция 2016 июль.
Генетика PLoS. 2016.
PMID: 27459302
Бесплатная статья ЧВК.
Рекомендации
- Вульф С.Дж., Ма К. Ноцицепторы – детекторы вредных раздражителей. Нейрон. 2007; 55: 353–364.
- Диб-Хадж С.Д., Биншток А.М., Камминс Т.Р. и др. Потенциалзависимые натриевые каналы при болевых состояниях: роль в патофизиологии и цели лечения. Res Res Rev. 2009 г.;60:65–83
- Диб-Хадж С.Д., Ян Ю., Ваксман С.Г. Генетика и молекулярная патофизиология болевых синдромов, связанных с Na(v)1.7. Ад Генет. 2008; 63: 85–110
- Гирлянда эл.
 Обработка боли в нервной системе человека: выборочный обзор ноцицептивных и биоповеденческих путей. Прим Уход. 2012;39: 561–571
Обработка боли в нервной системе человека: выборочный обзор ноцицептивных и биоповеденческих путей. Прим Уход. 2012;39: 561–571
- Гирлянда эл.
- Мелзак Р., Уолл Д.Д. Болевые механизмы: новая теория. Наука. 1965; 150: 971–979.
Физиология боли | Американское физиологическое общество
Физиология боли Чувство боли включает в себя сложные механизмы, которые исследователи пытаются выяснить, поскольку 50 миллионов человек в США продолжают страдать от хронической боли.Лорен Аркури
Боль — это универсальный человеческий опыт,
тот, который по своей сути является защитным: острая боль предупреждает нас о вреде и предотвращает повреждение нашего тела или ограничивает этот ущерб. Мы воспринимаем боль как нечто неприятное, и обычно она сигнализирует нам о том, что нужно отойти от опасной ситуации или раздражителя. Острый
боль часто исчезает довольно быстро, как только мы оказываемся в безопасности.
Острый
боль часто исчезает довольно быстро, как только мы оказываемся в безопасности.
Но острая боль не всегда проходит должным образом, особенно если она является частью болезненного процесса или начинается с травмы, которую не лечили должным образом и быстро. По оценкам, 20% населения США — 50 миллионов человек — пострадали от хронической боли в 2016 году, по данным Центров по контролю и профилактике заболеваний (CDC). И это число могло увеличиться во время пандемии.
Хроническая боль — одна из наиболее частых причин, по которой взрослые американцы обращаются за медицинской помощью. Отсутствие адекватного лечения хронической боли также является катализатором продолжающейся «эпидемии опиоидов», массового роста зависимости от рецептов. и/или незаконных опиоидов и причиной более 100 000 смертей от передозировки в 2021 году, по данным CDC (см. врезку на странице 33).
Исследователи усердно работают над тем, чтобы понять сложные механизмы, лежащие в основе нашего переживания боли. По данным Международной ассоциации изучения боли, боль определяется как «неприятное сенсорное и эмоциональное переживание, связанное с
с реальным или потенциальным повреждением тканей или напоминающим его». Есть три типа боли, классифицированной по причине.
По данным Международной ассоциации изучения боли, боль определяется как «неприятное сенсорное и эмоциональное переживание, связанное с
с реальным или потенциальным повреждением тканей или напоминающим его». Есть три типа боли, классифицированной по причине.
Боль, которую вы чувствуете, когда ушибаете палец ноги или кладете руку на горячую сковороду, называется ноцицептивной болью. Сенсорный нейрон — или ноцицептор — передает электрический импульс в спинной мозг, а затем в головной, где он воспринимается как боль.
Воспалительная боль возникает в результате инфекции или повреждения тканей, что приводит к активации иммунной системы. Организм вырабатывает молекулы провоспалительных медиаторов, которые включают цитокины, хемокины, факторы роста нервов и многое другое. Оба эти вида боли являются защитными.
Третий тип, патологическая боль, не является защитной и часто возникает в результате повреждения периферических нервов. «В некоторых случаях невропатии нервы начинают спонтанно возбуждаться, что приводит к ощущению боли в отсутствие раздражителя. При других формах дисфункции
боли после повреждения нерва, центральная нервная система передает болевые сигналы в мозг, независимо от входных сигналов от периферических нервов», — говорит Брэдли Тейлор, доктор философии, профессор анестезиологии в Университете Питтсбурга.
При других формах дисфункции
боли после повреждения нерва, центральная нервная система передает болевые сигналы в мозг, независимо от входных сигналов от периферических нервов», — говорит Брэдли Тейлор, доктор философии, профессор анестезиологии в Университете Питтсбурга.
«Одна вещь, которая могла бы помочь, — это найти биомаркер хронической боли. «Если вы хотите лечить, вам нужна конечная точка, на которую вы можете нацелиться».
Аллан Басбаум, доктор философии
Наше ощущение боли часто описывается как состоящее из двух компонентов, говорит Тейлор. Одним из них является сенсорный компонент, при котором вредный раздражитель — от укуса пчелы до удара локтем о дверной косяк — активирует ноцицепторы в коже. Или,
если стимул исходит изнутри тела, рецепторы внутри органа или области повреждения активируются, что приводит к возникновению электрических импульсов, которые сначала проходят в спинной мозг, а затем в головной мозг.
Спинной мозг — это не просто релейная станция для электрического входа. «Действительно, в спинном мозге многое происходит, прежде чем он посылает мозгу сигналы, содержащие богатую информацию», — объясняет Тейлор.
Второй компонент боли носит аффективно-когнитивный характер, когда мозг переживает ощущение боли как нечто неприятное, форму страдания. Хотя этот опыт генерируется в мозгу, на него влияет специфическая природа сообщения, которое он получает от спинного мозга, по словам Стива Прескотта, доктора медицинских наук, профессора Больницы для больных детей и Университета Торонто в Канаде. «Боль — это действительно многомерный опыт, и хотя ваш опыт эмоциональный компонент зависит от корковой обработки, обычно он запускается сенсорным входом с периферии», — говорит он.
Хроническая боль: сбой в работе центральной нервной системы Согласно Международной классификации болезней Всемирной организации здравоохранения, хроническая боль — это боль, которая длится более трех месяцев. Наши болевые системы становятся чувствительными на несколько дней или недель, пока мы заживаем после травмы. «Есть воспаление
вокруг тканей, и они испытывают боль даже от легкого прикосновения или движения», — говорит Тейлор.
Наши болевые системы становятся чувствительными на несколько дней или недель, пока мы заживаем после травмы. «Есть воспаление
вокруг тканей, и они испытывают боль даже от легкого прикосновения или движения», — говорит Тейлор.
Иногда эти процессы сенсибилизации не проходят и человек находится в состоянии хронической болевой гиперчувствительности. Тейлор добавляет, что некоторые люди, страдающие хронической болью, испытывают боль даже при отсутствии прикосновения или движения. Индукция боли в норме безобидный раздражитель является основной проблемой, с которой сталкиваются люди, страдающие хронической болью.
Если боль сохраняется после лечения травмы или инфекции, возможно, произошли изменения в центральной нервной системе. «Это несколько спорно, но я твердо верю, что хроническая боль может существовать исключительно в центральной нервной системе.
системы», — говорит Тейлор. В этих случаях боль вызывается не нервами в месте первоначальной травмы, а патологическими изменениями в головном или спинном мозге.
«Я считаю, что ощущение боли регулируется очень гомеостатическим образом, — говорит Тейлор. «Существуют системы возбуждения, которые управляют начальной реакцией на боль и болевой чувствительностью, а также очень мощные эндогенные тормозные системы. системы организма, препятствующие возникновению боли. Вместе они работают как реостат». Если тормозные системы функционируют должным образом, боль должна исчезнуть. «В моей лаборатории наша всеобъемлющая концепция заключается в том, что патология хронической боли связано не только с застреванием ноги на педали акселератора, но и с дисфункцией тормоза — системы торможения».
Аллан Басбаум, доктор философии, профессор и заведующий кафедрой анатомии Калифорнийского университета в Сан-Франциско, согласен. Он сравнивает хроническую боль — по крайней мере, возникающую после повреждения нерва — с эпилепсией, болезненным процессом, который включает потерю торможения.
в коре, что проявляется в виде судорог. «При невропатической боли происходят сопоставимые изменения», — говорит он. «Происходит потеря торможения на разных уровнях, особенно в спинном мозге. Есть повышенная возбудимость. Есть
устанавливаются новые связи, индуцируются новые гены — все это составляет признаки болезни».
«Происходит потеря торможения на разных уровнях, особенно в спинном мозге. Есть повышенная возбудимость. Есть
устанавливаются новые связи, индуцируются новые гены — все это составляет признаки болезни».
«В моей лаборатории наша всеобъемлющая концепция заключается в том, что патология хронической боли связана не только с застреванием ноги на педали акселератора, но и с дисфункцией тормозной — тормозной системы».
Брэдли Тейлор, доктор философии
Некоторые случаи невропатической боли возникают после поражения центральной нервной системы (например, после травмы спинного мозга, после инсульта и у пациентов с рассеянным склерозом). Здесь «болезнь» боли не зависит от входных данных. В случае невропатии
боль, которая вызвана периферически, например, при диабетической невропатии, когда есть повреждение нерва, все еще есть периферический драйвер боли, но «теперь он затрагивает измененную центральную нервную систему», — говорит Басбаум.
Ру-Ронг Джи, доктор медицинских наук, профессор анестезиологии Медицинской школы Университета Дьюка в Дареме, Северная Каролина, считает, что хроническая боль может быть вызвана нарушением регуляции глиальных клеток, поддерживающих клеток нервной системы, обеспечивающих питание, иммунную систему. поддержка, изоляция и защита нейронов. Глиальные клетки включают микроглию и астроциты, которые обнаруживаются по всему спинному и головному мозгу и помогают поддерживать гомеостаз нервной системы.
Ji и другие исследователи обнаружили, что на стадии перехода от острой боли к хронической происходит активация определенных путей передачи сигнала, в которых участвуют глиальные клетки. Эта активация переключает их с противовоспалительного и поддерживающего действия. роль к провоспалительной. Затем глиальные клетки вырабатывают медиаторы воспаления, цитокины и хемокины, которые увеличивают интенсивность и амплитуду боли и увеличивают ее продолжительность, говорит Цзи.
«Это серьезный сдвиг в представлении о том, что глия может быть причиной хронической боли», — говорит он. Глия в центральной нервной системе может лежать в основе особого типа воспаления центральной нервной системы, называемого нейровоспалением.
Глия в центральной нервной системе может лежать в основе особого типа воспаления центральной нервной системы, называемого нейровоспалением.
Те же самые глиальные клетки, по-видимому, также содержат потенциал для устранения хронической боли. Резолвины представляют собой особое семейство молекул-медиаторов, входящих в состав «тормозной» или тормозной системы. Образуется ферментативно в глии из полиненасыщенных жирные кислоты эйкозапентаеновая кислота (ЭПК) и докозагексаеновая кислота (ДГК) в рыбьем жире, как полагают, участвуют в активной фазе разрешения воспаления. «Резолвины — очень интересные потенциальные медиаторы, — говорит Джи. «Они производят очень мощный обезболивающий эффект в гораздо меньших дозах, чем морфин, и без каких-либо побочных эффектов».
Новые подходы к лечению хронической боли Хроническая боль — это не просто продолжение острой боли. Механизмы, лежащие в его основе, различны. Таким образом, лечение требует другого подхода: вместо того, чтобы лечить боль как симптом, блокируя путь передачи боли от периферии к мозгу, исследователи
надеются обратиться к основному болезненному процессу, который поддерживает ощущение боли. «Мы знаем, что некоторые методы лечения, такие как нестероидные противовоспалительные препараты и опиоиды, которые эффективны при острой боли, дают лишь временное легкое облегчение при острой боли.
хроническая боль, если она вообще есть, а в некоторых случаях может даже усугубить ее», — говорит Джи. Стероиды могут временно уменьшить боль, вызванную воспалением, но они имеют сильные побочные эффекты и не могут безопасно использоваться в течение длительного времени. Стероиды также были показаны
для замедления разрешения воспаления.
«Мы знаем, что некоторые методы лечения, такие как нестероидные противовоспалительные препараты и опиоиды, которые эффективны при острой боли, дают лишь временное легкое облегчение при острой боли.
хроническая боль, если она вообще есть, а в некоторых случаях может даже усугубить ее», — говорит Джи. Стероиды могут временно уменьшить боль, вызванную воспалением, но они имеют сильные побочные эффекты и не могут безопасно использоваться в течение длительного времени. Стероиды также были показаны
для замедления разрешения воспаления.
Чем дольше продолжается хронический болевой процесс, тем труднее его разрешить. «Мы начали задаваться вопросом: как мы можем способствовать разрешению проблемы выздоровления?» — говорит Джи. «Нейромодуляция и стимуляция спинного мозга используются годами.
но обычно в крайнем случае. Но нейромодуляцию можно распространить на разные области — не только на спинной мозг, но и на ганглии задних корешков и периферические нервы. Стимуляция блуждающего нерва может помочь контролировать воспаление в масштабах всей системы. может помочь модулировать симпатический тон».
может помочь модулировать симпатический тон».
Джи считает, что рыбий жир, содержащий предшественники резолвинов, в сочетании с нейромодуляцией или физическими упражнениями может помочь организму вырабатывать резолвины и приблизиться к состоянию разрешения хронической боли. Такие методы лечения, как иглоукалывание, давно работают чтобы помочь избавиться от хронической боли, но теперь, по словам Джи, мы лучше понимаем, почему: они могут уменьшить воспаление в организме.
Басбаум соглашается с тем, что нейромодуляция имеет потенциал для лечения хронической боли в ее корне, даже несмотря на то, что исследователи еще не до конца понимают механизмы, с помощью которых она работает. «Трудно проводить плацебо-контролируемое исследование, потому что пациенты
часто могут сказать, когда их стимулируют. Но некоторые из этих подходов, в частности стимуляция спинномозговых ганглиев, оказались замечательными для некоторых пациентов», — говорит он. Также работает транскраниальная магнитная стимуляция моторной коры. во многих случаях. «Зачем вам стимулировать моторную кору, чтобы облегчить боль? Стимуляция соматосенсорной коры не работает, но работает моторная кора. Как это работает? Мы действительно не знаем», — говорит он.
во многих случаях. «Зачем вам стимулировать моторную кору, чтобы облегчить боль? Стимуляция соматосенсорной коры не работает, но работает моторная кора. Как это работает? Мы действительно не знаем», — говорит он.
Эти подходы могут не только облегчить непрекращающуюся боль, но также обратить вспять дисрегуляцию и способствовать устранению боли.
«Глиальные клетки вырабатывают медиаторы воспаления, цитокины и хемокины, которые увеличивают интенсивность и амплитуду боли и увеличивают ее продолжительность».
Ру-Ронг Цзи, доктор философии
Лаборатория Тейлора изучает, как взаимосвязи между интернейронами в задних рогах спинного мозга могут измениться после травмы. «Изменения в схеме могут объяснить переход от острой боли к хронической», — говорит он. В лаборатории есть
сосредоточены на системе нейропептидных рецепторов, которые, по их мнению, могут быть потенциальной мишенью для хронической боли. Он называется нейропептид Y (NPY). «Уже 25 лет мы обнаруживаем, что применение NPY к спинному мозгу может подавлять боль.
передачи у грызунов», — говорит он. И попутно «мы начали понимать, что то, что мы делаем, было имитацией естественной эндогенной системы подавления боли».
«Уже 25 лет мы обнаруживаем, что применение NPY к спинному мозгу может подавлять боль.
передачи у грызунов», — говорит он. И попутно «мы начали понимать, что то, что мы делаем, было имитацией естественной эндогенной системы подавления боли».
Чтобы лучше понять механизмы действия NPY, лаборатория Тейлора использует хемогенетику и оптогенетику для управления активностью нейронов, которые экспрессируют определенные типы рецепторов NPY, обнаруженных в задних рогах спинного мозга, в первую очередь типа Y1R. Когда они выборочно удаляли интернейроны Y1R у грызунов, интенсивность болевого поведения после повреждения периферического нерва снижалась. Они пришли к выводу, что интернейроны спинного мозга Y1R могут способствовать возникновению патологической боли. потенциальной мишенью для лечения хронической невропатической боли.
«После травмы связи между нейронами спинного мозга изменяются таким образом, что информация о прикосновении становится перекрестной и поступает в болевые пути, так что даже легкое прикосновение активирует нейроны, экспрессирующие Y1R, вызывая боль», — говорит Тейлор. Есть некоторые проблемы с превращением NPY в терапевтическое средство для людей, поскольку он может оказывать нецелевое воздействие на голод и кровяное давление, но его лаборатория ищет решение. «Сейчас мы проводим исследования, чтобы понять, как эндогенные
Механизмы опиоидных и NPY-рецепторов могут взаимодействовать для предотвращения хронической боли».
Есть некоторые проблемы с превращением NPY в терапевтическое средство для людей, поскольку он может оказывать нецелевое воздействие на голод и кровяное давление, но его лаборатория ищет решение. «Сейчас мы проводим исследования, чтобы понять, как эндогенные
Механизмы опиоидных и NPY-рецепторов могут взаимодействовать для предотвращения хронической боли».
Лаборатория Тейлора также заинтересована в перепрофилировании существующих лекарств, чтобы проверить, работают ли они при хронической боли. Они изучают особый класс препаратов, нацеленных на рецепторы, активирующие пролиферацию пероксисом (PPAR), которые в настоящее время используются для лечения диабета.
показывает перспективы в качестве анальгетика для хронической боли. Класс тиазолидиндионов, одобренных Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США, включает розиглитазон и пиоглитазон и нацелен на конкретную изоформу PPAR, называемую PPARγ. Лаборатория обнаружила
что мРНК и белок PPARγ экспрессируются в дорсальных рогах спинного мозга и что агонисты PPARγ уменьшают воспалительную и невропатическую боль, вероятно, за счет действия на спинномозговую глию. «Мы надеемся перенести эти исследования
к клиническим испытаниям», — говорит Тейлор.
«Мы надеемся перенести эти исследования
к клиническим испытаниям», — говорит Тейлор.
В то время как продолжаются поиски потенциальных терапевтических методов лечения, одна вещь, которая может помочь, говорит Басбаум, это найти биомаркер хронической боли. «Если вы хотите лечить, вам нужна конечная точка, на которую вы можете нацелиться», — говорит он. В идеале это биомаркер возник бы благодаря более полному пониманию механизмов, вызывающих хроническую боль в организме, — пониманию, к которому исследователи приближаются день ото дня.
Эта статья была первоначально опубликована в мартовском номере 9 2022 г.0265 Журнал «Физиолог».
The Physiologist Magazine
- November 2022
- September 2022
- July 2022
- May 2022
- March 2022
- January 2022
- November 2021
- September 2021
- July 2021
- May 2021
- March 2021
- январь 2021 г.
- ноябрь 2020 г.

- сентябрь 2020 г.
- июль 2020 г.
- май 2020 г.
- март 2020 г.
- Январь 2020
- Ноябрь 2019
- Сентябрь 2019
- Июль 2019
Нужна помощь? Контакт: Отдел коммуникаций
Жизнь с хронической болью во время опиоидной «эпидемии»Чрезмерное назначение опиоидных препаратов за последние несколько десятилетий привело к консенсусу против их рутинного использования при хронической боли. «Сейчас все согласны с тем, что если к вам приходит пациент, у которого диагностирована хроническая боль или боль, длящаяся более от трех до шести месяцев, вы не хотите начинать их с опиоидов», — говорит Брэдли Тейлор, доктор медицинских наук, профессор анестезиологии Питтсбургского университета.
Хотя такой подход кажется разумным, как насчет пациентов с хронической болью, которые долгое время использовали опиоидные препараты для контроля боли и не злоупотребляют ими? Келли Хиллс, биоэтик из Бостона, — одна из таких пациенток. У нее была сложная региональная боль
синдром в течение 17 лет после нескольких серьезных автомобильных аварий.
У нее была сложная региональная боль
синдром в течение 17 лет после нескольких серьезных автомобильных аварий.
Боль Хиллс контролировалась относительно низкой дозой опиоидов, но ей приходится прыгать через трудоемкие обручи, чтобы продолжить лечение по рецепту, даже несмотря на то, что ее лечащая команда соглашается, что это лучший и единственный вариант для нее. Она пробовала другие подходящие возможности, включая физиотерапию, водную терапию и блокаду звездчатого узла, при которой местный анестетик вводится в нерв звездчатого узла на шее.
Чтобы продолжить обезболивание, Хиллс должна встречаться со своим лечащим врачом каждые три месяца, психиатром по боли два раза в год и отдельным специалистом по хронической боли один раз в год. И ее пополнение не происходит автоматически даже спустя почти два десятилетия: каждый месяц.
она должна попросить своего лечащего врача пополнить запас лекарства и надеяться, что в ее аптеке либо есть рецепты на складе, либо они могут получить их вовремя, чтобы она могла получить их без пропусков доз.
Чтобы ограничить чрезмерное назначение опиоидов, врачи теперь должны участвовать в плане мониторинга данных о рецептах, или PDMP, где все их назначения опиоидов должны ежемесячно сравниваться с другими врачами. Если у врача слишком много хронических пациентам с болью, им, возможно, придется обосновать свое назначение.
Тейлор говорит, что для некоторых пациентов с хронической болью, принимающих опиоиды, важно осознавать значительный ущерб, который может быть нанесен, если заставить их отказаться от лекарств. «Хотя все согласны с тем, что вы не хотите запускать пациентов на опиоидах, если пациент с установленной хронической болью ответственно принимает опиоидные препараты в течение длительного времени, то, возможно, лучше просто оставить их в покое», — говорит он. «В отсутствие крупномасштабных исследовательских испытаний, указывающих на обратное, мы не можем исключить возможность того, что опиоиды могут снимать боль в течение длительного периода времени».
Хиллс считает, что термин «опиоидная эпидемия» является неправильным.
 В норме выход яйцеклетки не должен ощущаться. Однако при снижении порога болевых ощущений нервные импульсы, возникающие в результате реакции тканей яичника, маточных труб и тазовой брюшины на выход яйцеклетки, воспринимаются головным мозгом как патологические, болезненные. Эта причина играет ведущую роль у впечатлительных или перенесших стресс пациенток.
В норме выход яйцеклетки не должен ощущаться. Однако при снижении порога болевых ощущений нервные импульсы, возникающие в результате реакции тканей яичника, маточных труб и тазовой брюшины на выход яйцеклетки, воспринимаются головным мозгом как патологические, болезненные. Эта причина играет ведущую роль у впечатлительных или перенесших стресс пациенток.
 Методика основана на определении уровня лютеинизирующего гормона в моче и адаптирована для простого самостоятельного применения. Уровень ЛГ нарастает до разрыва фолликула, достигает пика при выходе из яичника зрелой яйцеклетки, после чего начинает снижаться.
Методика основана на определении уровня лютеинизирующего гормона в моче и адаптирована для простого самостоятельного применения. Уровень ЛГ нарастает до разрыва фолликула, достигает пика при выходе из яичника зрелой яйцеклетки, после чего начинает снижаться.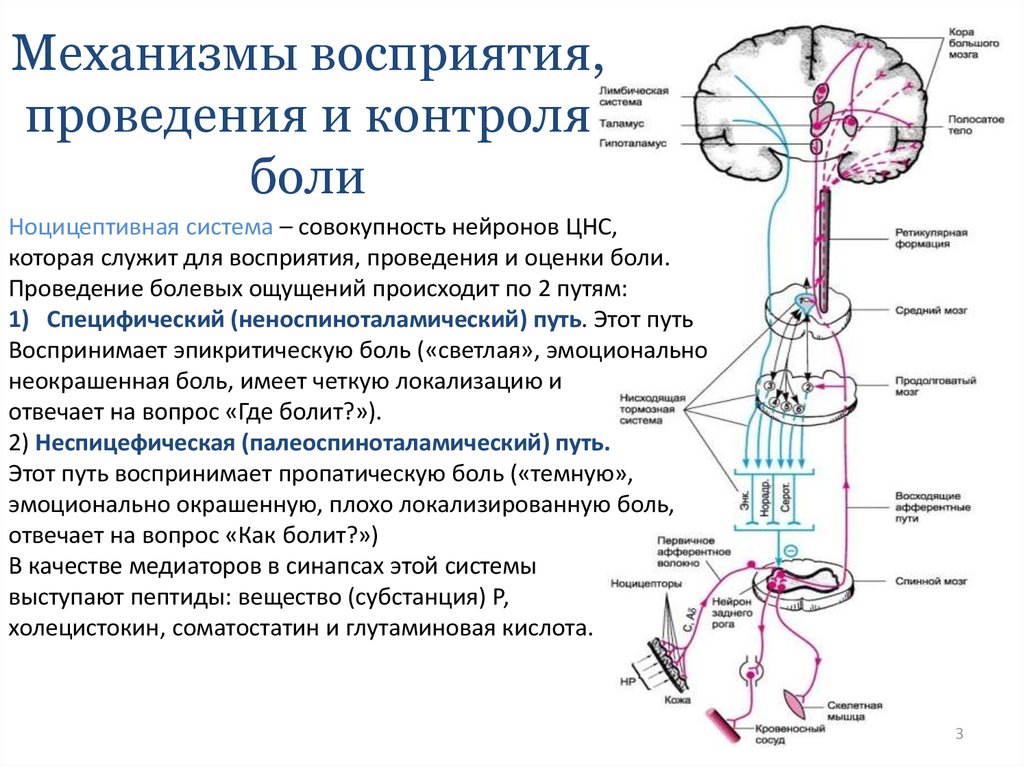 Чтобы временно исключить действие факторов, вызывающих болевой межменструальный синдром, используют оральные контрацептивы. При их приеме прекращается созревание фолликулов, цикл становится ановуляторным. В последующем после восстановления нормального менструального цикла интенсивность симптоматики зачастую уменьшается.
Чтобы временно исключить действие факторов, вызывающих болевой межменструальный синдром, используют оральные контрацептивы. При их приеме прекращается созревание фолликулов, цикл становится ановуляторным. В последующем после восстановления нормального менструального цикла интенсивность симптоматики зачастую уменьшается. Шмерц. 2001 г.; 15 (6): 413-7. doi: 10.1007/s004820100002.
Шмерц. 2001.
PMID: 11793144
Немецкий.
Шмерц. 2001 г.; 15 (6): 413-7. doi: 10.1007/s004820100002.
Шмерц. 2001.
PMID: 11793144
Немецкий. doi: 10.1016/0002-9343(92)80051-z.
Am J Med. 1992.
PMID: 1595755
Обзор.
doi: 10.1016/0002-9343(92)80051-z.
Am J Med. 1992.
PMID: 1595755
Обзор. 2021 31 мая; 9:e11543. doi: 10.7717/peerj.11543. Электронная коллекция 2021.
Пир Дж. 2021.
PMID: 34131526
Бесплатная статья ЧВК.
2021 31 мая; 9:e11543. doi: 10.7717/peerj.11543. Электронная коллекция 2021.
Пир Дж. 2021.
PMID: 34131526
Бесплатная статья ЧВК. doi: 10.1007/s40264-018-0687-6.
Препарат Саф. 2018.
PMID: 29796831
Обзор.
doi: 10.1007/s40264-018-0687-6.
Препарат Саф. 2018.
PMID: 29796831
Обзор. Генетика PLoS. 26 июля 2016 г .; 12 (7): e1006153. doi: 10.1371/journal.pgen.1006153. Электронная коллекция 2016 июль.
Генетика PLoS. 2016.
PMID: 27459302
Бесплатная статья ЧВК.
Генетика PLoS. 26 июля 2016 г .; 12 (7): e1006153. doi: 10.1371/journal.pgen.1006153. Электронная коллекция 2016 июль.
Генетика PLoS. 2016.
PMID: 27459302
Бесплатная статья ЧВК. Обработка боли в нервной системе человека: выборочный обзор ноцицептивных и биоповеденческих путей. Прим Уход. 2012;39: 561–571
Обработка боли в нервной системе человека: выборочный обзор ноцицептивных и биоповеденческих путей. Прим Уход. 2012;39: 561–571