Физиологические механизмы стресса
3.10.2014
Допустим, произошла ссора или какое-то неприятное событие: человек возбужден, не может найти себе места, его гложет несправедливая обида, досада из-за того, что не сумел себя правильно Повести, не нашел слов. Он и рад бы отвлечься от этих мыслей, но снова и снова перед глазами встают сцены случившегося; и опять накатывает волна обиды, негодования. Можно выделить три физиологических механизма подобного стресса.
Во-первых, в коре головного мозга сформировался интенсивный стойкий очаг возбуждения, так называемая доминанта, которая подчиняет себе всю деятельность организма, все поступки и помыслы человека. Значит, для успокоения надо ликвидировать, разрядить эту доминанту или же создать новую, конкурирующую. Все отвлекающие приемы (чтение захватывающего романа, просмотр кинофильма, переключение на занятие любимым делом) фактически направлены на формирование конкурирующей доминанты.
Во-вторых, вслед за появлением доминанты развивается особая цепная реакция — возбуждается одна из глубинных структур мозга — гипоталамус, который заставляет близлежащую особую железу — гипофиз — выделить в кровь большую порцию адренокортикотропного гормона (АКТГ). Под влиянием АКТГ надпочечники выделяют адреналин и другие физиологически активные вещества (гормоны стресса), которые вызывают многосторонний эффект: сердце начинает сокращаться чаще и сильнее (вспомним, как оно «выскакивает» из груди при страхе, волнении, гневе), кровяное давление повышается (вот почему может разболеться голова, возникнуть сердечный приступ, становится чаще дыхание). В эту фазу подготавливаются условия для интенсивной мышечной нагрузки. Но современный человек, в отличие от первобытного, вслед за стрессом обычно не пускает в ход скопившуюся мышечную энергию, поэтому у него в крови еще долго циркулируют биологически активные вещества, которые не дают успокоиться ни нервной системе, ни внутренним органам.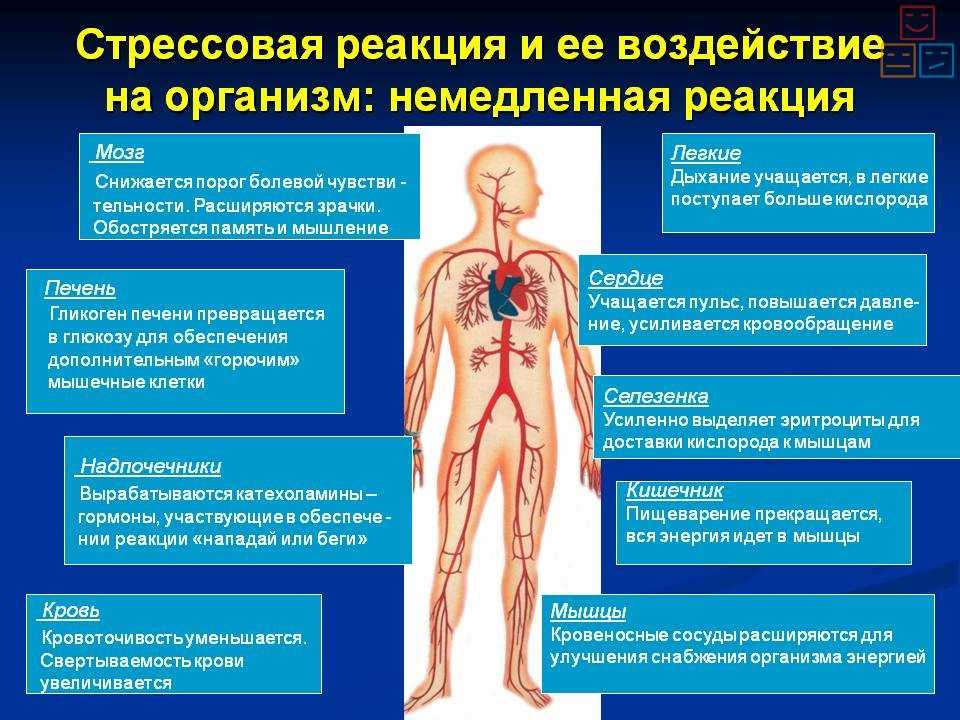
В-третьих, из-за того, что стрессовая ситуация сохраняет свою актуальность (конфликт ведь не разрешился благополучно и какая-то потребность так и осталась неудовлетворенной, иначе не было бы отрицательных эмоций), в кору головного мозга вновь и вновь поступают импульсы, поддерживающие активность доминанты, а в кровь продолжают выделяться гормоны стресса. Следовательно, надо снизить для себя значимость этого несбывшегося желания или же отыскать путь для его реализации. Оптимальный способ избавления от затянувшегося стресса — полностью разрешить конфликт, устранить разногласия, помириться. Если сделать это невозможно, следует логически переоценить значимость конфликта, например, поискать оправдания для своего обидчика. Можно выделить различные способы снижения значимости конфликта. Первый из них можно охарактеризовать словом «зато». Суть его — суметь извлечь пользу, что-то положительное даже из неудачи.
Один из лучших способов успокоения — это общение с близким человеком, когда можно, во-первых, как говорят «излить душу», т. е. разрядить очаг возбуждения; во-вторых, переключиться на интересную тему; в-третьих, совместно отыскать путь к благополучному разрешению конфликта или хотя бы к снижению его значимости.
Ключевые слова: Стресс
Источник: Столяренко Л.Д., Основы психологии
| Материалы по теме |
|---|
Острая реакция на стресс . |
Источники стрессов и конфликтов в организации Викулина О.В., Теория и практика психологии управления |
Методика и методология изучения стресса Мандель Б.Р., Психология стресса |
Эмоции, переживаемые при фрустрации и стрессе Фрустрация, психологическая самозащита и характер. Том 1. Защитные психологические механизмы… |
Стресс: понятие, фазы, виды Занковский А.Н., Психология деловых отношений |
Основные способы борьбы со стрессом Полин А.В., Медицинская психология |
Стресс и болезни Мандель Б.Р., Психология стресса |
Непосредственные физиологические реакции на стресс и фрустрацию Фрустрация, психологическая самозащита и характер. |
Физиологические механизмы стресса
стадии тревоги, резистентности, истощения
синтоксическая и кататоксическая реакция
эрготрофные и трофотрофные механизмы
стресс-реализующие и стресс-лимитирующие системы
Центральное
место в реализации стресс-реакции
принадлежит нейроэндокринной системе
потому, что эта система благодаря
разнообразию гормонов и многочисленности
их эффектов способна: 1) мобилизовать
энергетические ресурсы (вместе с нервной)
2) перераспределить их в зоны, работающие
с максимальной нагрузкой в данной
ситуации (вместе с системой кровообращения)
и 3) способствовать изменению функциональной
мощности и структуры системы органов,
работающих с нагрузкой (совершенно
самостоятельно, потому, что способна
воздействовать на активность уже
имеющихся ферментных систем и имеет
доступ к генетическому аппарату,
следовательно, способствует синтезу
новых ферментов и изменению структуры
тканей).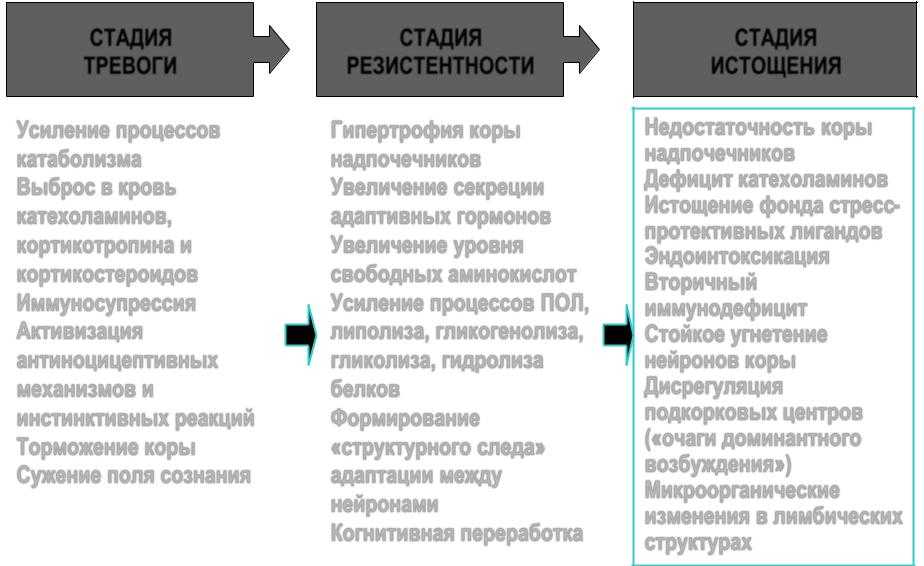
Секреция гормонов
нейронами гипофизотропной зоны
гипоталамуса в портальную систему
гипофиза регулируется по принципу
обратной связи содержанием в крови
гормонов периферических эндокринных
желез (рис.1). Общий принцип такой регуляции
заключается в том, что при повышении
содержания в плазме гормонов периферических
эндокринных желез уменьшается выброс
соответствующего рилизинг-гормона в
кровеносные сосуды медиальной области
гипоталамуса. Обратная связь в этой
системе может быть опосредована также
самими гормонами гипоталамуса и
аденогипофиза (штриховые стрелки).
Регуляция по принципу обратной связи,
в которой участвует медиальный
гипоталамус, гипофиз и эндокринные
железы, действует даже в отсутствие
влияний со стороны ЦНС. Роль ЦНС
заключается в приспособлении этой
регуляции к внутренним и внешним
потребностям организма. Примером влияния
ЦНС на эндокринную систему
служат циркадные ритмы высвобождения
АКТГ, регуляция выброса гормонов яичника
и ходе менструального цикла.
Рис.1 Связь между нервными и эндокринными механизмами в гипоталамо-гипофизарной системе
Рис.2 Нейрон гипофизарной зоны гипоталамуса, образующий рилизинг-гормон (РГ). Такие нейроны служат главным элементом нейроэндокринного сопряжения в гипоталамусе. АГ – аденогипофиз.
В тесном взаимодействии
нервных и эндокринных структур
гипоталамуса можно убедиться на примере
связи нейронов гипофизотропной зоны.
На нейрон, секретирующий какой-либо
рилизинг-гормон, могут оказывать влияние
афферентные нейроны лимбической системы
(миндалины и гиппокампа, преоптической
области и передней части гипоталамуса).
Аксоны этого нейрона отдают коллатерали
к самым разным отделам головного мозга
(рис. 2 справа). Такие нейроны обладают
свойствами саморегуляции по принципу
возвратного торможения (рис.2 слева). Во
всех двигательных отростках подобных
нейронов медиатором, очевидно, служит
рилизинг-гормон. Таким образом, эти
клетки гипофизарной зоны являются, с
одной стороны, конечными интегрирующими
нейронами, а с другой
эндокринными клетками продуцирующими
гормоны.
В развитии стресса принято выделять несколько стадий в соответствии с уровнем резистентности организма. Неспецифическая резистентность организма, т.е. способность его сопротивляться любым повреждающим факторам, понятие весьма не конкретное, поскольку его невозможно оценить, как, например специфическую резистентность к определенному фактору, и в определенной степени условное. Однако поскольку литература пока не предлагает нам ничего другого, будем пользоваться этим традиционным, введенным еще Г. Селье термином, понимая под ним способность организма выжить, жить и активно функционировать.
Рис.3
На стрелкой обозначено начало действия стрессора, цифрами стадии стресса, а толстой линией изменение резистентности организма:
Первичный шок во время шока в организме развивается состояние, угрожающее жизни в ответ на тяжелое для данного организма повреждающее воздействие.
 Большинство исследователей
не относит эту стадию к стрессу, с этим
нужно согласиться, т.к. никакой реакции
в это время пока нет.
Большинство исследователей
не относит эту стадию к стрессу, с этим
нужно согласиться, т.к. никакой реакции
в это время пока нет.Стадия тревоги характеризуется активной мобилизацией энергетических и структурных резервов организма. В это время резистентность организма быстро возрастает.
Стадия резистентности
Стадия истощения наступает в том случае, если стресс слишком сильный или длительный. В этом случае защитно-приспособительные механизмы организма истощаются, резистентность снижается как к данному стрессору, так и к другим видам стрессорных воздействий. Эту стадию иногда называют вторичным шоком.
Необходимо отметить,
что наиболее изучена в настоящее время
оказалась стадия тревоги, стадия
резистентности изучена значительно
хуже, многие исследователи даже не
относят ее к стрессу. С этим утверждением
трудно согласиться, потому что известно,
что в случае прекращения воздействия
повреждающего фактора наступает
реадаптация и резистентность организма
возвращается к норме. Следовательно,
повышенная резистентность держится в
течение всего времени воздействия
стрессора, и стадию резистентности мы
рассматриваем как стадию стресса.
Наступление стадии истощения
не единственный исход стресса. В том
случае, если стрессирующее воздействие
умеренно по силе или длительности,
например, является одним из факторов
внешней среды (холод, низкое давление),
или образа жизни
умеренные физические нагрузки, стадия
резистентности может длиться неограниченное
время
организм адаптирован к новому фактору
и вполне жизнеспособен в новых условиях.
На этом фоне возможно действие
дополнительного стрессора и дальнейшее
повышение резистентности организма.
С этим утверждением
трудно согласиться, потому что известно,
что в случае прекращения воздействия
повреждающего фактора наступает
реадаптация и резистентность организма
возвращается к норме. Следовательно,
повышенная резистентность держится в
течение всего времени воздействия
стрессора, и стадию резистентности мы
рассматриваем как стадию стресса.
Наступление стадии истощения
не единственный исход стресса. В том
случае, если стрессирующее воздействие
умеренно по силе или длительности,
например, является одним из факторов
внешней среды (холод, низкое давление),
или образа жизни
умеренные физические нагрузки, стадия
резистентности может длиться неограниченное
время
организм адаптирован к новому фактору
и вполне жизнеспособен в новых условиях.
На этом фоне возможно действие
дополнительного стрессора и дальнейшее
повышение резистентности организма.
Состояние, которое
называется первичный шок, мы уже однажды
обозначили
это такая ситуация, когда исчерпаны все
готовые, генетически детерминированные
программы.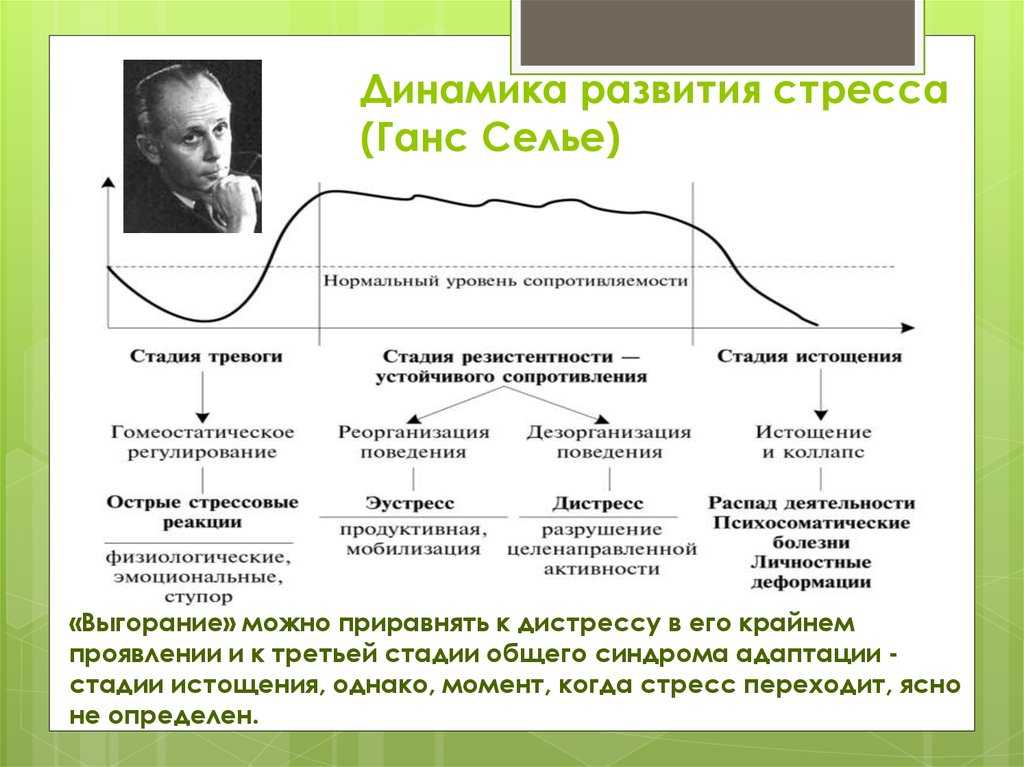 Можно считать, что самая
низкая точка на графике, минимальная
резистентность организма к любому
воздействию, соответствует ситуации,
когда задействована вся многоконтурная
и иерархически соподчиненная система
регуляции той функции, которая оказалась
ответственной за поддержание определенного
параметра внутренней среды. Например,
за поддержание температуры при воздействии
тепла или холода, за поддержание
осмотической концентрации при дефиците
воды, за напряжение кислорода и углекислого
газа при гипоксии или физической работе.
Несостоятельность регуляторных систем
приводит к тому, что поток афферентных
импульсов от рецепторов поступает в
головной мозг и достигает структуры,
которая является высшим центром регуляции
вегетативных функций гипоталамусу.
Можно считать, что самая
низкая точка на графике, минимальная
резистентность организма к любому
воздействию, соответствует ситуации,
когда задействована вся многоконтурная
и иерархически соподчиненная система
регуляции той функции, которая оказалась
ответственной за поддержание определенного
параметра внутренней среды. Например,
за поддержание температуры при воздействии
тепла или холода, за поддержание
осмотической концентрации при дефиците
воды, за напряжение кислорода и углекислого
газа при гипоксии или физической работе.
Несостоятельность регуляторных систем
приводит к тому, что поток афферентных
импульсов от рецепторов поступает в
головной мозг и достигает структуры,
которая является высшим центром регуляции
вегетативных функций гипоталамусу.
В тех примерах,
которые мы привели, информация к
гипоталамусу поступает от интерорецепторов,
по восходящим путям, главным из которых
считается массивный мезенцефало-гипоталамический
тракт. Кроме того, связь гипоталамуса
со спинным, продолговатым и средним
мозгом осуществляется через ретикулярную
формацию и переднее серое вещество
среднего мозга. Однако анатомическое
положение гипоталамуса таково, что эта
зона получает информацию не только по
восходящим путям. Имеются прямые
двусторонние связи гипоталамуса с
таламусом, гипоталамус связан афферентными
путями с новой корой, с гиппокампом
(старая кора), с миндалиной и другими
образованиями лимбической системы
мозга. Таким образом, по прямым и непрямым
нервным связям гипоталамус получает
информацию «сверху» от всех отделов
головного мозга и «снизу» от интеро- и
экстерорецепторов (см. рис. 1-2).
Однако анатомическое
положение гипоталамуса таково, что эта
зона получает информацию не только по
восходящим путям. Имеются прямые
двусторонние связи гипоталамуса с
таламусом, гипоталамус связан афферентными
путями с новой корой, с гиппокампом
(старая кора), с миндалиной и другими
образованиями лимбической системы
мозга. Таким образом, по прямым и непрямым
нервным связям гипоталамус получает
информацию «сверху» от всех отделов
головного мозга и «снизу» от интеро- и
экстерорецепторов (см. рис. 1-2).
Гипоталамус получает информацию не только нервным путем. Среди нейронов этой структуры выделены нейроны, которые возбуждаются при изменении осмотической концентрации внутренней среды, при изменении уровней глюкозы, аминокислот, при изменении температуры внутренней среды, снижении или повышении концентраций гормонов, уровень которых регулируется гипоталамическими либеринами и статинами. Эта информация к гипоталамусу поступает гуморальным путем.
Эфферентные пути
от гипоталамуса тоже многочисленны и
разнообразны: связи с новой корой,
лимбической системой, таламусом,
продолговатым и спинным мозгом. Чрезвычайно важно, что влияние гипоталамуса
на функции организма происходит не
только нервным путем
«быстро и точно, но кратковременно»,
но и гуморальным
«медленнее, но к большому числу структур
и долговременно». Именно в гипоталамусе
происходит трансформация нервного
импульса и специфический эндокринный
процесс, который начинается секрецией
либеринов.
Чрезвычайно важно, что влияние гипоталамуса
на функции организма происходит не
только нервным путем
«быстро и точно, но кратковременно»,
но и гуморальным
«медленнее, но к большому числу структур
и долговременно». Именно в гипоталамусе
происходит трансформация нервного
импульса и специфический эндокринный
процесс, который начинается секрецией
либеринов.
Рассматривая
эфферентные нервные и гуморальные
влияние гипоталамуса на организм,
следует вспомнить о том, что в гипоталамусе
принято условно выделять две реактивные
зоны, которые вызывают комплекс
антагонистических реакций. Эти зоны
получили название эрготропных
и трофотропных.
При раздражении эрготропных зон, которые
преимущественно связаны с задними
областями гипоталамуса, наблюдаются
все признаки активации симпатической
нервной системы
расширение зрачков, повышение давления,
учащение и углубление дыхания, повышение
двигательной и поисковой активности,
реакции ярости. Раздражение трофотропных
зон, которые преимущественно связаны
с передними отделами, вызывает снижение
АД, вазодилатацию, усиление перистальтики
кишечника, дремотное состояние, адинамию.
Многочисленными
исследованиями, начиная с Г. Селье,
установлено, что в реализации стресса
ведущая роль принадлежит гипоталамусу.
Итогом возбуждения структур гипоталамуса
является 1) возбуждение симпатических
центров, которое передается симпатическим
нейронам спинного мозга и надпочечнику
через чревный узел, запуская выброс
катехоламинов и 2) происходит трансформация
нервного импульса в специфический
эндокринный процесс, который начинается
секрецией кортиколиберина. Этот момент,
правда весьма условно, можно считать
началом первой стадии собственно стресса
реакцией тревоги. Понятно, что эта стадия
начинается только в том случае, если
организм остался жив. Стадия тревоги
характеризуется активной мобилизацией
энергетических и структурных резервов
организма. В это время резистентность
организма быстро возрастает. Мобилизация
энергетических ресурсов организма
обусловлена совместным взаимодополняющим
и взаимопотенциирующим действием
симпато-адреналовой и
гипоталамо-гипофизарно-надпочечниковой
систем.
Рассмотрим эффекты возбуждения симпато-адреналовой системы и выделения адреналина и норадреналина мозговым веществом надпочечников и для удобства сведем их в таблицу. (Повторите симпатические эффекты на стр. 125, 181-183 и регуляцию симпатического синапса на стр.121, 1 том учебника под ред. Ткаченко)
Таблица 1
Системы | Эффекты |
нервная система | повышение возбудимости нейронов ЦНС, ускорении ответных реакций стимуляция выделения кортиколиберина |
сердечно-сосудистая и дыхательная | расширение коронарных сосудов увеличение силы и частоты сердечных сокращений сужение периферических сосудов и повышение системного АД расширение бронхов и усиление вентиляции легких перераспределение кровотока сужение сосудов кожи, почек |
метаболизм | активация гликогенолиза в печени гипергликемия активация липолизаповышение концентрации свободных жирных кислот повышение интенсивности тканевого дыхания и температуры тела повышение утилизации глюкозы скелетными мышцами, активация гликогенолиза в мышцах и повышение работоспособности скелетной мускулатуры активация секреции глюкагона подавление секреции инсулина |
Таким образом,
интенсивный выброс катехоламинов
надпочечниками и норадреналина
симпатическими нервными окончаниями
приводит организм в состояние общей
повышенной активности, что повышает
резистентность организма в начальную
фазу стресса. Остановимся подробнее
на эффектах катехоламинов в центральной
нервной системе. Повышение концентрации
норадреналина и дофамина в структурах
головного мозга отмечается в первые
секунды в ответ на действие стрессора.
Мы знаем, что катехоламины способны
увеличивать продолжительность потенциала
действия нейронов за счет накопления
внутриклеточного кальция, активировать
метаболизм клеток и повышать интенсивность
гликолиза. Следовая деполяризация
приводит к тому, что нейроны, воспринимающие
получаемую информацию, перерабатывающие
ее, и формирующие ответную реакцию
остаются возбужденными длительное
время, поэтому увеличивается эффективность
синаптической передачи импульса.
Остановимся подробнее
на эффектах катехоламинов в центральной
нервной системе. Повышение концентрации
норадреналина и дофамина в структурах
головного мозга отмечается в первые
секунды в ответ на действие стрессора.
Мы знаем, что катехоламины способны
увеличивать продолжительность потенциала
действия нейронов за счет накопления
внутриклеточного кальция, активировать
метаболизм клеток и повышать интенсивность
гликолиза. Следовая деполяризация
приводит к тому, что нейроны, воспринимающие
получаемую информацию, перерабатывающие
ее, и формирующие ответную реакцию
остаются возбужденными длительное
время, поэтому увеличивается эффективность
синаптической передачи импульса.
Мобилизация
адреналином энергетических запасов и
увеличение использования жирных кислот
и ацетоуксусной кислоты как источников
энергии в сердечной мышце и коре почек,
использование жирных кислот скелетными
мышцами направлены на обеспечение
энергией и кровоснабжением интенсивно
работающих систем
доминирующей функциональной системы.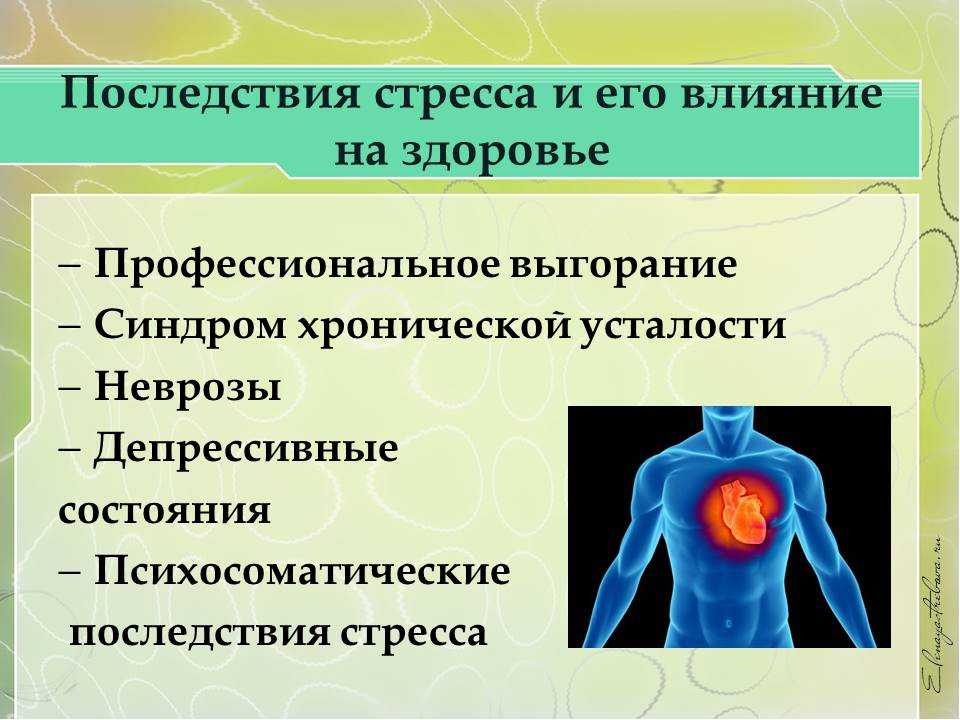
Реакции различных
органов на норадреналин и адреналин,
также как на ацетилхолин и другие
медиаторы, осуществляются благодаря
взаимодействию катехоламинов с
рецепторами в составе клеточных мембран.
На основании чисто фармакологических
критериев были выделены -
и -адренорецепторы.
В физиологических условиях реакция
какого-либо органа на адреналин и
норадреналин, поступающие с кровью,
либо выделяющиеся при возбуждении
симпатических нервов, зависит от
преобладания -
либо -адренергического
эффекта, что наглядно проявляется в
условиях стресса. Норадреналин в большей
степени чем адреналин активирует
-адренорецепторы,
в то время как эффект адреналина зависит
от его концентрации в крови. Это наглядно
видно на следующем примере. Так, в гладкой
мускулатуре сосудов скелетных мышц
содержится оба типа рецепторов.
Возбуждение -рецепторов
приводит к сужению сосудов, а возбуждение
-рецепторов
к их расширению. В физиологических
условиях при достаточно низком уровне
адреналина в крови он оказывает
расширяющее действие на мышечные
артерии, поскольку преобладает эффект
-рецепторов. При высоком уровне адреналина в крови,
что характерно для стресса, мышечные
сосуды суживаются в результате
преобладания -адренергического
действия. Следовательно, физиологические
эффекты стресса опосредуются указанными
рецепторами, топография распределения
которых в органах представлена на рис.4.
Такое разнообразие видов рецепторов
объясняет высокую специфичность действия
катехоламинов на определенные органы.
Так, например, сужение сосудов в брюшной
полости опосредовано -рецепторами,
тогда как метаболические эффекты и
расширение сосудов, снабжающих мышцы,
-рецепторами.
Угнетение секреции инсулина происходит
с участием -рецепторов,
а липолитическое действие и влияние на
сердечную мышцу – с участием -рецепторов.
Действие катехоламинов, опосредуемое
-рецепторами,
связано с активацией аденилатциклазы
и образованием ц-АМФ – второго
внутриклеточного посредника, а
-рецепторами
преимущественно активацией фосфолипазы
С. Существование различных типов
рецепторов имеет важное значение для
клиники, так как многие вещества,
блокирующие эти рецепторы, используются
для лечения сердечно-сосудистых
заболеваний, артериальной гипертензии,
нарушений кровоснабжения органов.
При высоком уровне адреналина в крови,
что характерно для стресса, мышечные
сосуды суживаются в результате
преобладания -адренергического
действия. Следовательно, физиологические
эффекты стресса опосредуются указанными
рецепторами, топография распределения
которых в органах представлена на рис.4.
Такое разнообразие видов рецепторов
объясняет высокую специфичность действия
катехоламинов на определенные органы.
Так, например, сужение сосудов в брюшной
полости опосредовано -рецепторами,
тогда как метаболические эффекты и
расширение сосудов, снабжающих мышцы,
-рецепторами.
Угнетение секреции инсулина происходит
с участием -рецепторов,
а липолитическое действие и влияние на
сердечную мышцу – с участием -рецепторов.
Действие катехоламинов, опосредуемое
-рецепторами,
связано с активацией аденилатциклазы
и образованием ц-АМФ – второго
внутриклеточного посредника, а
-рецепторами
преимущественно активацией фосфолипазы
С. Существование различных типов
рецепторов имеет важное значение для
клиники, так как многие вещества,
блокирующие эти рецепторы, используются
для лечения сердечно-сосудистых
заболеваний, артериальной гипертензии,
нарушений кровоснабжения органов.
Суммируем основные эффекты катехоламинов:
-адренорецепторы, преимущественно активируются норадреналином | -адренорецепторы, преимущественно активируются адреналином |
1сужение сосудов расслабление гладкой мускулатуры желудочно-кишечного тракта сокращение матки | 1увеличение возбудимости, проводимости и сократимости сердечной мышцы липолиз в жировой ткани гликогенолиз расслабление гладкой мускулатуры желудочно-кишечного тракта стимуляция секреции ренина клетками ЮГА почек |
2агрегация тромбоцитов подавление освобождения норадреналина синаптическими окончаниями | 2расширение бронхов расслабление сосудов расслабление матки |
Считается, что в
надпочечнике содержится около 70%
адреналина и только 30% норадреналина,
хотя у различных лиц возможно преобладание
выделения того или иного катехоламина,
что сказывается на характере поведенческой
реакции человека и свойствах его психики. Так, лица с преобладанием адреналина
относятся к категории кроликов, и лица
с преобладанием норадреналина – львов.
Так, лица с преобладанием адреналина
относятся к категории кроликов, и лица
с преобладанием норадреналина – львов.
Наряду с активацией САС на стадии тревоги в организме всегда отмечается быстрое нарастание концентрации кортизола основного глюкокортикоида у человека, который синтезируется в пучковой зоне надпочечника при участии цитохрома Р-450. В наружной клубочковой зоне надпочечников синтезируется такой важный минералокортикоид как альдостерон. Возбуждение эрготропных зон гипоталамуса приводит к усилению секреции кортикотропин-рилизинг фактора (КРФ, кортиколиберин), который выделяется в кровь через особые аксо-вазальные синапсы и стимулирует базофильные кортикотрофы гипофиза. Секреция КРФ поддерживается и высоким уровнем адреналина в крови.
Рис.4 Влияние адреналина – гормона мозгового вещества надпочечников — на различные органы.
В ответ на действие
КРФ в гипофизе секретируется
адренокортикотропный гормон (АКТГ) и
выделяется в кровь. Известно, что основным
эффектом АКТГ является стимуляция
синтеза и секреции глюкокортикоидов в
пучковой зоне коры надпочечников, однако
этот гормон обладает и собственными
эффектами. АКТГ обладает липотропным
действием, выражающемся в активации
липазы жировой ткани и повышении выхода
свободных жирных кислот из жировых депо
в кровь. Этот эффект гормона невелик и
непродолжителен, однако наступает
быстро.
Известно, что основным
эффектом АКТГ является стимуляция
синтеза и секреции глюкокортикоидов в
пучковой зоне коры надпочечников, однако
этот гормон обладает и собственными
эффектами. АКТГ обладает липотропным
действием, выражающемся в активации
липазы жировой ткани и повышении выхода
свободных жирных кислот из жировых депо
в кровь. Этот эффект гормона невелик и
непродолжителен, однако наступает
быстро.
Собственные эффекты
кортизола чрезвычайно разнообразны и
осуществляются несколькими путями: это
влияние на тимико-лимфоидную ткань,
метаболизм, ЦНС и сердечно-сосудистую
систему. Кортизол вызывает лизис
тимико-лимфоидной ткани и быстрый выброс
в кровь антител из разрушающихся
лимфоидных клеток. Этот эффект обеспечивает
срочную защиту от проникающих бактерий
и чужеродных белков, однако образование
иммунных антител тормозится. Эффекты
кортизола в ЦНС и сердечно- сосудистой
системе в большой степени являются
косвенными
кортизол повышает возбудимость нейронов,
гладких и сердечной мышцы, потому что
способствует накоплению ионов кальция
в клетках. Следовательно, эти структуры
становятся более возбудимыми и легче
отвечают на воздействие, например
адреналина. Такие эффекты глюкокортикоидов
называются пермиссивными. Кортизол,
обладая незначительным минералокортикоидным
эффектом, вызывает задержку натрия и
повышение объема циркулирующей крови.
Остановимся подробнее на метаболических
эффектах кортизола.
Следовательно, эти структуры
становятся более возбудимыми и легче
отвечают на воздействие, например
адреналина. Такие эффекты глюкокортикоидов
называются пермиссивными. Кортизол,
обладая незначительным минералокортикоидным
эффектом, вызывает задержку натрия и
повышение объема циркулирующей крови.
Остановимся подробнее на метаболических
эффектах кортизола.
Таблица 2
Влияние глюкокортикоидов на обмен белков, жиров и углеводов
белковый обмен | Мобилизация белков из мышечной, костной, эпителиальной и лимфоидной тканей, распад белков, торможение их синтеза, поступление аминокислот в кровь и печень, дезаминирование аминокислот. Уменьшение мышечной массы, в костях уменьшение белковой матрицы. Синтез ферментов и некоторых белков в печени. |
углеводный обмен | Активация
глюкозо-6-фосфатазы приводит к
освобождению глюкозы печенью,
ингибирование гексокиназы тормозит
метаболизм глюкозы в тканях эти процессы приводят кповышению
уровня глюкозы в крови. |
Жировой обмен | Увеличение распада жиров, обусловленное собственным и пермиссивным по отношению к адреналину и соматотропину действием. Повышение активности процессов липогенеза, обусловленное увеличением количества субстрата (уровень глюкозы в крови). Повышение в крови уровня свободных жирных кислот, холестерина.В результате, если жир не используется для работы, происходит его перераспределение с отложением на лице и туловище. |
Как видно из этой
таблицы, метаболические эффекты кортизола
во многом сходны с эффектами адреналина
и направлены на мобилизацию запасов
энергии. В эффектах этих двух гормонов
есть и различия: глюкокортикоиды
активируют процессы глюконеогенеза
синтеза глюкозы в печени. Субстратным
источником этого процесса являются
дезаминированные аминокислоты, полученные
при распаде белков под действием
глюкокортикоидов. Следует обратить
внимание на то, что глюкокортикоиды не
столько стимулируют распад белков,
сколько блокируют захват тканями
аминокислот и синтез новых белков. Лишь
длительный стресс действительно приводит
к деструкции белкового матрикса
организма.
В эффектах этих двух гормонов
есть и различия: глюкокортикоиды
активируют процессы глюконеогенеза
синтеза глюкозы в печени. Субстратным
источником этого процесса являются
дезаминированные аминокислоты, полученные
при распаде белков под действием
глюкокортикоидов. Следует обратить
внимание на то, что глюкокортикоиды не
столько стимулируют распад белков,
сколько блокируют захват тканями
аминокислот и синтез новых белков. Лишь
длительный стресс действительно приводит
к деструкции белкового матрикса
организма.
Еще одна гормональная система неизбежно включается в реализацию стрессорной реакции. Возбуждение эрготропных зон гипоталамуса, повышение уровней кортизола и адреналина стимулируют выделение гипоталамусом соматолиберина и, соответственно, соматотропного (СТГ) гормона ацидофильными клетками гипофиза (рис.5).
Обратим внимание
на то, что дополнительными специфическими
стимуляторами выделения соматотропина
являются гипогликемия и повышение
концентрации аминокислот в крови, а это
возможно при эффективном использовании
глюкозы на фоне высокой концентрации
кортизола. Эффекты соматотропина во
много сходны с эффектами кортизола, но
во многих отношениях этот гормон является
его антагонистом. СТГ, как и кортизол,
стимулирует липолиз в жировой ткани,
глюконеогенез в печени и повышает уровни
глюкозы и липидов в крови
это катаболические эффекты гормона.
Гипергликемия под действием СТГ
поддерживается и его способностью
стимулировать секрецию глюкагона, и
активацией инсулиназы печени.
Эффекты соматотропина во
много сходны с эффектами кортизола, но
во многих отношениях этот гормон является
его антагонистом. СТГ, как и кортизол,
стимулирует липолиз в жировой ткани,
глюконеогенез в печени и повышает уровни
глюкозы и липидов в крови
это катаболические эффекты гормона.
Гипергликемия под действием СТГ
поддерживается и его способностью
стимулировать секрецию глюкагона, и
активацией инсулиназы печени.
Рис.5 Действие гормона роста и регуляция его секреции соматотропин-рилизинг-гормоном и соматостатином. Гормон роста непосредственно стимулирует гликогенолиз и липолиз, а также образование соматомединов в печени. Действуя по механизму обатной связи на гипоталамус, соматомедины замыкают цепь. На периферии они стимулируют рост хрящей и костей, а также синтез белка и деление клеток.
Вместе с тем,
основные эффекты СТГ являются анаболическими и связаны со стимуляцией синтеза белка.
СТГ, в отличие от кортизола, стимулирует
синтез белка не только в печени, но и в
других органах. Увеличение синтеза
белка под действием СТГ происходит в
два этапа: первый (30 минут) обусловлен
активацией транспорта аминокислот и
глюкозы через клеточную мембрану, второй
(10-18 часов)
увеличением синтеза рибосомальной РНК
и формированием ансамблей полисом,
активацией процессов трансляции в
рибосомах. СТГ стимулирует синтез белка
в мышцах, мягких соединительных тканях,
паренхиматозных органах не только в
растущем организме, но и у взрослых.
Однако, если у детей анаболический
эффект гормона сочетается с выраженным
митогенным эффектом
гормон усиливает пролиферацию клеток,
способствуя их переходу из периода
G1в
период S
(синтез ДНК), то у взрослых анаболический
эффект преобладает над митогенным и
приводит к гипертрофии клеток.
Увеличение синтеза
белка под действием СТГ происходит в
два этапа: первый (30 минут) обусловлен
активацией транспорта аминокислот и
глюкозы через клеточную мембрану, второй
(10-18 часов)
увеличением синтеза рибосомальной РНК
и формированием ансамблей полисом,
активацией процессов трансляции в
рибосомах. СТГ стимулирует синтез белка
в мышцах, мягких соединительных тканях,
паренхиматозных органах не только в
растущем организме, но и у взрослых.
Однако, если у детей анаболический
эффект гормона сочетается с выраженным
митогенным эффектом
гормон усиливает пролиферацию клеток,
способствуя их переходу из периода
G1в
период S
(синтез ДНК), то у взрослых анаболический
эффект преобладает над митогенным и
приводит к гипертрофии клеток.
Известно, что
транспорт аминокислот в клетки печени
происходит преимущественно по градиенту
концентрации и не лимитирован специальными
мембранными факторами. Поэтому эффекты
СТГ на клетки печени не связаны с
транспортом аминокислот. Усиление
синтеза белка в печени под действием
СТГ имеет свои принципиальные особенности
это стимуляция синтеза особых гормональных
соединений
соматомединов, опосредующих многие
эффекты гормона.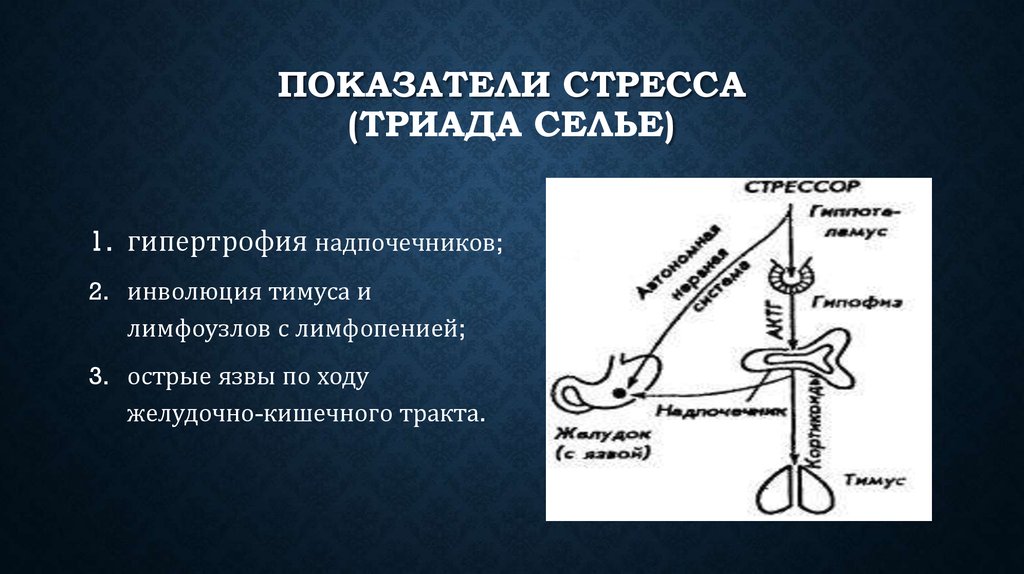 Главным соматомедином
является соматомедин С, который называется
еще инсулиноподобным ростовым фактором
1 (ИРФ-1). В этом названии отражена суть
эффектов ИРФ
усиление транспорта в клетку глюкозы
и аминокислот (подобно инсулину),
липолитическая активность и ростовые
эффекты. Кроме того, под действием СТГ
в тканях стимулируется выработка
специальных факторов роста
факторы роста нервов, эпидермиса,
тромбоцитов. Важно отметить, что все
эти факторы не только опосредуют эффекты
СТГ, но и существенно усиливают их,
именно поэтому действие СТГ продолжается
очень длительно.
Главным соматомедином
является соматомедин С, который называется
еще инсулиноподобным ростовым фактором
1 (ИРФ-1). В этом названии отражена суть
эффектов ИРФ
усиление транспорта в клетку глюкозы
и аминокислот (подобно инсулину),
липолитическая активность и ростовые
эффекты. Кроме того, под действием СТГ
в тканях стимулируется выработка
специальных факторов роста
факторы роста нервов, эпидермиса,
тромбоцитов. Важно отметить, что все
эти факторы не только опосредуют эффекты
СТГ, но и существенно усиливают их,
именно поэтому действие СТГ продолжается
очень длительно.
Одним из важных
свойств СТГ является его действие на
тимус. В тот период, когда эта железа
еще не начала подвергаться инволюции,
гормон вызывает гиперплазию и гипертрофию
лимфоидной ткани железы и стимулирует
иммуногенез. Однако, усиливающее действие
СТГ на процессы иммуногенеза сохраняются
и у взрослых, гормон способен усиливать
рост лимфатических желез, процессы
лимфопоэза и антителообразования.
Установлено, что СТГ не только стимулятор
иммуногенеза, но и провоспалительный гормон. Таким образом, и в отношении
иммуногенеза и процессов воспаления
СТГ является антагонистом кортизола.
Таким образом, и в отношении
иммуногенеза и процессов воспаления
СТГ является антагонистом кортизола.
Отметим, в заключении,
что не только соматотропный гормон
ускоряет и активирует процессы синтеза
белка в организме. Катехоламины способны
активировать фосфорилирование гистонов
и увеличивать скорость синтеза РНК. Это
свойство катехоламинов играет важную
роль в ЦНС, потому что способствует
консолидации следа памяти и переходу
кратковременной памяти в долговременную.
АКТГ тоже обладает способностью
активировать синтез РНК. Для обеспечения
процессов синтеза структурным и
энергетическим материалом необходим
нормальный уровень инсулина, потому
что этот гормон способствует транспорту
глюкозы в клетки и включению ее в
метаболические процессы. Гормоны
щитовидной железы тоже являются
необходимыми для процессов синтеза и
восстановления структур организма. Эти
гормоны повышают темп метаболических
процессов, увеличивают поглощение
кислорода и использование его в процессах
окисления и фосфорилирования,
следовательно, обеспечивают энергией
и усиленно функционирующую систему, и
процессы синтеза в ней.
Суммируем совместные эффекты гормонов в реализации стресса:
Таблица 3
САС | ГГНС | СТГ | |
нервная система | Повышение возбудимости структур ЦНС, увеличение скорости распространения возбуждения | Повышение возбудимости ЦНС. Собственный эффект АКТГ повышение скорости образования условных рефлексов | |
сердечно-сосудистая | Расширение коронарных сосудов увеличение силы и частоты сердечных сокращений, сужение периферических сосудов и повышение системного АД, расширение бронхов и усиление вентиляции легких | Повышение
возбудимости сердечно-сосудистой
системы связанное с увеличением
чувствительности адренорецепторов
к норадреналину и адреналину. | |
метаболизм | активация гликогенолиза в печени, активация липолиза повышение интенсивности тканевого дыхания повышение работоспособности скелетной мускулатуры | лизис тимико-лимфоидной системы, выброс антител и торможение синтеза новых, торможение воспалительных и аллергических реакций активация глюконеогенеза в печени снижение утилизации глюкозы мышцами активация липолиза задержка натрия в организме, что может привести к повышению АД и нарушению кровоснабжения тканей. Торможение половой функции активация синтеза адреналина надпочечниками | увеличение поступления глюкозы и аминокислот в мышцы и паренхиматозные органы активация гликогенолиза в печени активация липолиза активация синтеза белка во всех тканях, синтез антител, увеличение интенсивности воспалительных реакций |
Таким образом, в
реализации стресса параллельно протекают
две цепи событий: первая
это мобилизация системы, которая
доминирует при адаптации к конкретному
повреждающему фактору, и вторая, совершенно
не специфическая, которая активируется
при действии любого сильного или нового
раздражителя. Эта
вторая цепь событий выполняет три
важнейшие и необходимые для адаптации
функции: 1. Мобилизация
энергетических и структурных ресурсов организма, которая проявляется в
повышении уровней глюкозы, аминокислот
и жирных кислот в крови и их доступности
для тканей. 2. Перераспределение
ресурсов и направление их в доминирующую
систему. Перераспределение происходит в результате
избирательного расширения сосудов
работающих мышц, активных центров,
активно работающих органов. Такое
расширение сосудов обеспечивается не
только гормональными влияниями, но и
местными механизмами, прежде всего
расширением капиллярных сфинктеров
под влиянием углекислоты, накапливающейся
в интенсивно работающих клетках. Кроме
того, такие метаболиты как молочная
кислота, АДФ, оксид азота тоже обладают
вазодилататорными эффектами. 3. Активация
совместно с метаболитами-регуляторами
процессов синтеза нуклеиновых кислот
и белка в системе, ответственной за
адаптацию приводит
к формированию системного структурного
следа и повышению мощности и эффективности
в доминирующей системе.
Эта
вторая цепь событий выполняет три
важнейшие и необходимые для адаптации
функции: 1. Мобилизация
энергетических и структурных ресурсов организма, которая проявляется в
повышении уровней глюкозы, аминокислот
и жирных кислот в крови и их доступности
для тканей. 2. Перераспределение
ресурсов и направление их в доминирующую
систему. Перераспределение происходит в результате
избирательного расширения сосудов
работающих мышц, активных центров,
активно работающих органов. Такое
расширение сосудов обеспечивается не
только гормональными влияниями, но и
местными механизмами, прежде всего
расширением капиллярных сфинктеров
под влиянием углекислоты, накапливающейся
в интенсивно работающих клетках. Кроме
того, такие метаболиты как молочная
кислота, АДФ, оксид азота тоже обладают
вазодилататорными эффектами. 3. Активация
совместно с метаболитами-регуляторами
процессов синтеза нуклеиновых кислот
и белка в системе, ответственной за
адаптацию приводит
к формированию системного структурного
следа и повышению мощности и эффективности
в доминирующей системе.
Все эти три приводящие к адаптации функции возможны при активации симпато-адреналовой, гипоталамо-гипофизарно-надпочечниковой систем и системы соматолиберин-соматотропин-соматомедины. Поэтому эти системы получили название стресс-реализующих систем.
Обратим внимание
на то, что активация стресс-реализующих
систем происходит при любом напряжении
систем регуляции, вызванном как
эндогенными, так и экзогенными причинами.
Под влиянием гормонов происходит
увеличение работоспособности
сердечно-сосудистой системы, мобилизация
энергетических и структурных ресурсов,
более эффективное включение их в клетки
и поддержка активности генома клеток.
Перераспределение же кровотока и
активация генома метаболитами-регуляторами
происходит только в зависимости от
интенсивности работы системы, ответственной
за адаптацию, и в соответствии с этой
интенсивностью. Получается, что
стресс-реализующие системы создают
условия для эффективного преобразования
доминирующей системы, совершенно не
зависимо от того какая система доминирует
и какие изменения ее структуры и функции
происходят при адаптации. Создание
таких условий совершенно необходимо и
для срочной адаптации, и для завершения
адаптации и перехода ее в долговременную. На фоне
активации стресс-реализующих систем
адаптация идет успешнее, поэтому эти
системы рассматривают как системы
повышения неспецифической резистентности
организма, они создают необходимые
условия для повышения специфической
резистентности увеличение функциональной мощности
доминирующей системы. В соответствии с Г. Селье, все реакции,
повышающие неспецифическую резистентность
организма называют синтоксическими.
Синтоксические реакции обусловлены в
первую очередь глюкокортикоидами и
формируют состояние пассивной
толерантности к повреждающему фактору
состояние готовности систем мобилизации,
транспорта и включения в клетку
энергетических и структурных ресурсов.
В противоположность синтоксическим,
кататоксическими Г. Селье считал реакции
повышающие метаболическое разрушение
патогенного фактора путем активации
микросомальных ферментов гепатоцитов.
Создание
таких условий совершенно необходимо и
для срочной адаптации, и для завершения
адаптации и перехода ее в долговременную. На фоне
активации стресс-реализующих систем
адаптация идет успешнее, поэтому эти
системы рассматривают как системы
повышения неспецифической резистентности
организма, они создают необходимые
условия для повышения специфической
резистентности увеличение функциональной мощности
доминирующей системы. В соответствии с Г. Селье, все реакции,
повышающие неспецифическую резистентность
организма называют синтоксическими.
Синтоксические реакции обусловлены в
первую очередь глюкокортикоидами и
формируют состояние пассивной
толерантности к повреждающему фактору
состояние готовности систем мобилизации,
транспорта и включения в клетку
энергетических и структурных ресурсов.
В противоположность синтоксическим,
кататоксическими Г. Селье считал реакции
повышающие метаболическое разрушение
патогенного фактора путем активации
микросомальных ферментов гепатоцитов. Таким образом, повышается резистентность
к конкретному повреждающему фактору,
специфическая резистентность.
Фундаментальная стратегия реагирования
организма, направленная на использование
либо кататоксического, либо синтоксического
варианта реагирования проявляется и в
кросс-адаптации. Первый вариант
подразумевает максимально «закрытый»
способ выживания организма при действии
новых средовых факторов. Второй вариант
направлен на формирование механизмов
изменения внутренней среды таким
образом, чтобы максимально уменьшить
уровень энерготрат и величину цены
адаптации за счет изменения структуры
и функции биологических мембран. Приведем
еще один пример: при исследовании
действия на организм некоторых металлов
выяснилось, что у части лиц эти металлы
накапливаются в структурах соединительной
ткани, например в сосудах – синтоксическая
реакция. У части же людей металлы не
накапливались, следовательно, появились
структуры, способные связывать и выводить
эти чужеродные элементы из организма
– кататоксическая реакция.
Таким образом, повышается резистентность
к конкретному повреждающему фактору,
специфическая резистентность.
Фундаментальная стратегия реагирования
организма, направленная на использование
либо кататоксического, либо синтоксического
варианта реагирования проявляется и в
кросс-адаптации. Первый вариант
подразумевает максимально «закрытый»
способ выживания организма при действии
новых средовых факторов. Второй вариант
направлен на формирование механизмов
изменения внутренней среды таким
образом, чтобы максимально уменьшить
уровень энерготрат и величину цены
адаптации за счет изменения структуры
и функции биологических мембран. Приведем
еще один пример: при исследовании
действия на организм некоторых металлов
выяснилось, что у части лиц эти металлы
накапливаются в структурах соединительной
ткани, например в сосудах – синтоксическая
реакция. У части же людей металлы не
накапливались, следовательно, появились
структуры, способные связывать и выводить
эти чужеродные элементы из организма
– кататоксическая реакция.
Попытаемся схематически представить соотношение специфических и неспецифических компонент в процессе адаптации (схема 2).
Формирование системного структурного следа соответствует стадии резистентности в таком состоянии организм может функционировать в новых условиях. Следующая стадия стадия истощения. Это стадия изнашивания и функциональной недостаточности не является обязательной и развивается лишь при чрезмерно напряженной адаптации. Эта стадия характеризуется тем, что нагрузка на системы, доминирующие в процессе адаптации, приводит к гипертрофии и нарушению их функции. Это может произойти за счет двух механизмов: 1) при выраженной гипертрофии формируется отставание структур, ответственных за восприятие информации (рецепторы, синапсы), за ионный транспорт (ионные каналы, белки-переносчики), энергообеспечение; 2) после длительной гипертрофии наступает снижение синтеза нуклеиновых кислот и белков, гибнет часть клеток.
Физиологические механизмы стресса — Клиника АТОС
В любом здоровом организме присутствуют механизмы, которые запускают свое действие в ответ на стрессовый раздражитель. Эти механизмы в медицинской науке принято называть стресс-реализующими системами. Они призваны бороться с теми негативными факторами, которые могут повлечь смерть организма. Эти механизмы адаптации к стрессовым воздействиям являются неспецифичными и потому общими для стресса любого характера.
Эти механизмы в медицинской науке принято называть стресс-реализующими системами. Они призваны бороться с теми негативными факторами, которые могут повлечь смерть организма. Эти механизмы адаптации к стрессовым воздействиям являются неспецифичными и потому общими для стресса любого характера.
Это в своих научных трудах доказал основоположник теории стресса Г. Селье и назвал их совокупность общим адаптационным синдромом.
Селье выделил три этапа развития стресса.
Первый этап — этап тревоги (аларм-стадия).
На первом этапе происходит немедленная мобилизация всех защитных резервов организма и одновременное подавление тех задач, которые имеют наименьшее значение для выживания в условиях воздействия стрессовой ситуации. Как правило, это функции регенерации тканей и роста, пищеварительная и репродуктивная функция, лактация. Вот почему часто у женщин в стрессовых ситуациях пропадает молоко или существенно снижается его выработка. А молодым здоровым парам, пытающимся долгое время зачать, врачи рекомендуют избегать негативного воздействия стресса.
Эта стадия характеризуется сильным напряжением многих функций всех систем за счет мобилизации имеющихся ресурсов. И если этих ресурсов достаточно, организм быстро справляется со стресс-фактором и развивает к нему адаптацию.
Важнейшую роль в образовании общего адаптационного синдрома играет гипоталамус, который всегда активизируется в момент воздействия стрессора. Именно он включает работу всей стресс-реализующей системы, то есть физиологические механизмы стресса. А также координирует поведенческие, эмоциональные и метаболические реакции на проявление факторов стресса.
Всю цепочку механизма первого этапа развития стресса можно обозначить следующим образом: работа гипоталамуса – гипофиз – надпочечники. То есть здесь задействованы как симпатическая, так и парасимпатическая часть ВНС.
Активация парасимпатического звена ВНС обеспечивает высокую эффективность регенеративных процессов, которые должны сохранить гомеостаз (внутреннее равновесие организма).
Изменения на физиологическом уровне в организме, которые могут наблюдаться на этом этапе развития:
- увеличение выработки глюкозы;
учащенный пульс;
сердечные сокращения начинают усиливаться;
увеличивается сила скелетных мышц, может наблюдаться гипертонус;
расширение глазных зрачков;
брюшные сосуды сужаются, а сердечные, наоборот, — расширяются;
обмен веществ начинает ускоряться;
мыслительная деятельность увеличивает свою продуктивность;
начинают расширяться бронхиальные трубки.

Аларм-стадия может длиться еще в течение двух суток после воздействия стресс-фактора. А её выраженность напрямую зависит от интенсивности и продолжительности стрессора.
Этап тревоги в свою очередь ещё делится на два подэтапа:
Этап шока – в фазе глубокого потрясения появляется угроза всем жизненно необходимыми функциями организма. Она может характеризоваться такими проявлениями, как снижение артериального давления, мышечный гипотонус (снижение мышечного напряжения), гипоксия, гипогликемия (снижение глюкозы происходит из-за торможения секреции инсулина кахетоламинами). Чем опасна фаза шока, так это тем, что защитные реакции организма сильно снижаются, и если воздействие стресс-фактора выходит за рамки восполнительных возможностей организма, то может наступить смерть. Если адаптивные возможности превышают, то наступает следующая фаза контршока.
Этап контршока – он характеризуется включением всех компенсаторных резервов организма в виде повышенной секреции гормонов эндокринной системы и активации автономной симпатической нервной системы. Под воздействием всех гормонов и нужных медиаторов происходит восстановление тех функций организма, которые были нарушены. Если же на этапе контршока будут пересилены симптомы действия шока, то организм перейдет на следующий этап – этап резистентности.
Под воздействием всех гормонов и нужных медиаторов происходит восстановление тех функций организма, которые были нарушены. Если же на этапе контршока будут пересилены симптомы действия шока, то организм перейдет на следующий этап – этап резистентности.
Второй этап — этап резистентности (или сопротивления).
Этот этап именуются еще как «битва-бегство», которое в точности раскрывает его суть. Механизмы, которые включаются на этой стадии, позволяют организму либо бороться с опасностью, либо бежать от неё.
На этом этапе начинается перестройка всех защитных механизмов по той причине, что возможности симпатической системы ограничены, и они не позволяют больше противодействовать факторам стресса.
Такой ответ организма может рассматриваться как мобилизация всех резервов организма для подготовки к активности или адаптации к стрессовому фактору.
На этом этапе появляются новые гормональные и медиаторные взаимоотношения. Повышенная секреция адреналина и норадреналина – адаптивных гормонов – приводит к развитию артериальной гипертензии, сердечной сокращаемости, снижению притока крови к нежизненно важным органам, резко возрастет уровень холестерина и других жирных кислот.
В этот период возможности сопротивляемости организма находятся на своей пиковой точке. Именно поэтому в чрезвычайной ситуации человек может действовать на грани своих физических или умственных способностей, он может совершить те поступки, на которые раньше и не подозревал, что способен. Например, человек в экстремальной и опасной ситуации может проявлять неслыханную физическую выносливость.
Эти физиологические изменения, которые наблюдаются на стадии резистентности при условии кратковременного воздействия фактор-стресса, не носят патологического характера. Организм восстановит гормональный баланс и вернется в расслабленное состояние после того, как минует угроза.
Третий этап — этап истощения.
Когда же стресс-раздражитель имеет сильное продолжительное воздействие или многократно повторяется, приспособительные возможности организма существенно снижаются и могут оказаться недееспособными. Это вызывает потерю сопротивляемости и развитие тех механизмов общего адаптационного синдрома, который называют фазой истощения.
На данном этапе запускаются новые процессы, связанные с работой симпатической нервной системой. Усиливается выработка глюкокортикоидов. Именно они повышают энергетический запас организма, повышая уровень глюкозы и жирных кислот, для дальнейшей борьбы со стрессом. Но это в свою очередь ведет к негативным последствиям – так называемая плата за приспособление. Снижаются защитные функции организма, в том числе и выработка лимфоцитов, которые напрямую влияют на механизмы человеческого иммунитета. Также возможно развитие инфаркта миокарда, который может наступить вследствие длительного спазма сосудов. Истощается пучковая зона надпочечников, многократно увеличивается артериальное давление.
Если первых два этапа механизма развития стресса имеют именно адаптивный характер, то есть нормальный, не несущей вреда организму, то фаза истощения носит патологический характер и может существенно навредить организму, а в некоторых, особо критических ситуациях, вызвать смерть. Также современные исследования механизмов развития стресса направлены на изучение того, может ли длительное воздействие стресса привести к необратимым изменениям в головном мозгу.
В процессе сотен лет эволюции в организме человека начали зарождаться и развиваться те механизмы, действие которых направлено на воспрепятствование развитию стрессовых реакций или на снижение негативных побочных последствий в органах-мишенях, которые могут проявиться вследствие значительного повышения артериального давления.
Гармоничная работа механизмов парасимпатической и симпатической системы ВНС ведет к нормальному адекватному реагированию на стресс-фактор. Как показывает практика, короткий, но даже сильный стресс не несет угрозы ни психологическому, ни физическому здоровью. А в некоторых случаях оказывает положительное воздействие. По-настоящему сильную угрозу несет хронический стресс, те мелкие, но многократно повторяющиеся неурядицы, которые снижают адаптационные возможности и ведут к истощению организма.
Источник: http://vseostresse.ru
Физиологические механизмы развития стресса | Образовательная социальная сеть
Слайд 1
Презентация на тему: «Физиологические механизмы развития стресса» Выполнил: студент группы ПСЗ -30114c Шахтаров Сергей Сергеевич Министерство образования и науки Российской Федерации Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования Курганский государственный университет (КГУ) г . Курган 2015
Курган 2015
Слайд 2
Что такое стресс?
Слайд 3
Понятие стресс Стресс — совокупность всех неспецифических изменений, возникающих под влиянием любых сильных воздействий (стрессоров) и сопровождающихся перестройкой защитных систем организма; при длительном действии стрессоров развивается адаптационный синдром, характеризующийся увеличенной продукцией гормонов гипофиза и коры надпочечников . В переводе с английского языка слово «стресс» означает «нажим, давление, напряжение Стрессор (-ы) — факторы, вызывающие стресс: тяжёлая работа, охлаждение, перегревание, боль, недостаток кислорода во вдыхаемом воздухе, лишение пищи, воды, переживание угрозы безопасности, межличностные конфликты, утрата близкого человека и т.п.
Слайд 4
Виды стресса Эустресс — Понятие имеет два значения — «стресс, вызванный положительными эмоциями» и «несильный стресс, мобилизующий организм». Дистресс — негативный тип стресса, с которым организм не в силах справиться. Он подрывает здоровье человека и может привести к тяжелым заболеваниям. От стресса страдает иммунная система. В стрессовом состоянии люди чаще оказываются жертвами инфекции, поскольку продукция иммунных клеток заметно падает в период физического или психического стресса. Эмоциональный стресс — эмоциональным стрессом называют эмоциональные процессы, сопровождающие стресс, и ведущие к неблагоприятным изменениям в организме. Во время стресса, эмоциональная реакция развивается раньше других, активизируя вегетативную нервную систему и её эндокринное обеспечение. При длительном или многократно повторяющемся стрессе эмоциональное возбуждение может застаиваться, а функционирование организма — разлаживаться. Психологический стресс , как вид стресса, понимается разными авторами по-разному, но многие авторы определяют его как стресс, обусловленный социальными факторами
От стресса страдает иммунная система. В стрессовом состоянии люди чаще оказываются жертвами инфекции, поскольку продукция иммунных клеток заметно падает в период физического или психического стресса. Эмоциональный стресс — эмоциональным стрессом называют эмоциональные процессы, сопровождающие стресс, и ведущие к неблагоприятным изменениям в организме. Во время стресса, эмоциональная реакция развивается раньше других, активизируя вегетативную нервную систему и её эндокринное обеспечение. При длительном или многократно повторяющемся стрессе эмоциональное возбуждение может застаиваться, а функционирование организма — разлаживаться. Психологический стресс , как вид стресса, понимается разными авторами по-разному, но многие авторы определяют его как стресс, обусловленный социальными факторами
Слайд 5
Стресс двигатель прогресса и эволюции?
Слайд 6
Механизмы стресса Исследования показывают, что к физиологическим признакам стресса относятся язвы, мигрень, гипертония, боль в спине, артрит, астма и боли в сердце.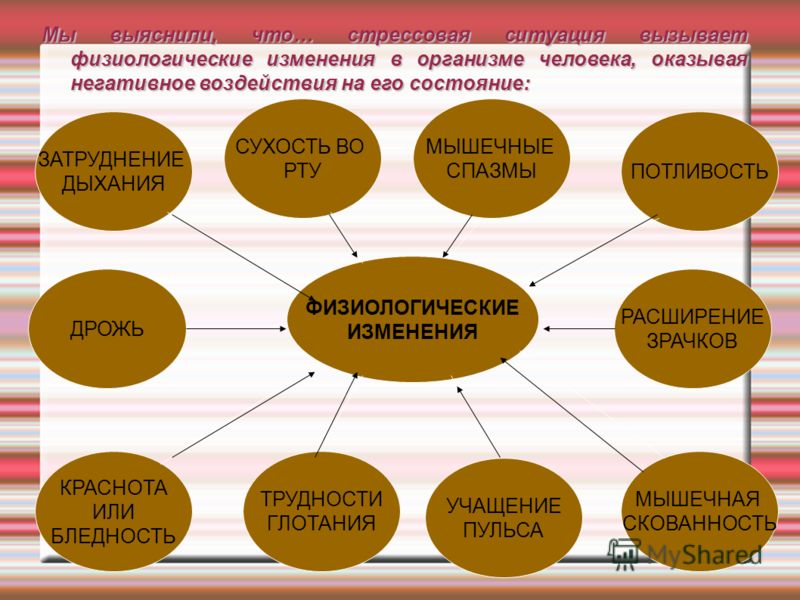 Психологические проявления включают раздражительность, потерю аппетита, депрессию и пониженный интерес к межличным и сексуальным отношениям и другое
Психологические проявления включают раздражительность, потерю аппетита, депрессию и пониженный интерес к межличным и сексуальным отношениям и другое
Слайд 7
Сергеевич
Слайд 8
Физиологические механизмы стресса Во-первых , в коре головного мозга сформировался интенсивный стойкий очаг возбуждения, так называемая доминанта, которая подчиняет себе всю деятельность организма, все поступки и помыслы человека. Во-вторых , вслед за появлением доминанты развивается особая цепная реакция – возбуждается одна из глубинных структур мозга – гипоталамус, который заставляет близлежащую особую железу – гипофиз – выделить в кровь большую порцию адренокортикотропного гормона (АКТГ). В-третьих , из-за того, что стрессовая ситуация сохраняет свою актуальность, в кору головного мозга вновь и вновь поступают импульсы, поддерживающие активность доминанты, а в кровь продолжают выделяться гормоны стресса.
Слайд 9
Признаки стрессового напряжения 1. Невозможность сосредоточиться на чем-то. 2. Слишком частые ошибки в работе. 3. Ухудшается память. 4. Слишком часто возникает чувство усталости. 5. Очень быстрая речь. 6. Мысли часто улетучиваются. 7. Довольно часто появляются боли (голова, спина, область желудка). 8. Повышенная возбудимость. 9. Работа не доставляет прежней радости. 10. Потеря чувства юмора. 11. Резко возрастает количество выкуриваемых сигарет. 12. Пристрастие к алкогольным напиткам. 13. Постоянное ощущение недоедания. 14. Пропадает аппетит – вообще потерян вкус к еде. 15. Невозможность вовремя закончить работу
2. Слишком частые ошибки в работе. 3. Ухудшается память. 4. Слишком часто возникает чувство усталости. 5. Очень быстрая речь. 6. Мысли часто улетучиваются. 7. Довольно часто появляются боли (голова, спина, область желудка). 8. Повышенная возбудимость. 9. Работа не доставляет прежней радости. 10. Потеря чувства юмора. 11. Резко возрастает количество выкуриваемых сигарет. 12. Пристрастие к алкогольным напиткам. 13. Постоянное ощущение недоедания. 14. Пропадает аппетит – вообще потерян вкус к еде. 15. Невозможность вовремя закончить работу
Слайд 10
Что может быть противопоставлено стрессу? Обратимся к активным способам повышения общей устойчивости человеческого организма. Их можно попытаться разделить на три группы: Первая группа – включает способы, использующие физические факторы воздействия – это физическая культура, закаливание организма, бег трусцой и т.д. Вторая группа – аутогенная тренировка, психотерапия, гипноз. Третья группа способов повышения общей устойчивости организма связана с биологически активными веществами
Слайд 11
Заключение Состояние стресса у человека так же старо, как и сам человек. Стрессу подвержены все – от новорожденного до немощного старика. Стресс не только зло, не только беда, на и великое благо, ибо без стрессов различного характера наша жизнь стала бы похожа на какое-то бесцветное и безрадостное прозябание. Активность – единственная возможность покончить со стрессом: его не пересидишь и не перележишь . Юмор – всегда есть смысл взглянуть на проблему не так глубоко и трагично.
Стрессу подвержены все – от новорожденного до немощного старика. Стресс не только зло, не только беда, на и великое благо, ибо без стрессов различного характера наша жизнь стала бы похожа на какое-то бесцветное и безрадостное прозябание. Активность – единственная возможность покончить со стрессом: его не пересидишь и не перележишь . Юмор – всегда есть смысл взглянуть на проблему не так глубоко и трагично.
Слайд 12
И это твоя группа ?
Слайд 13
Благодарю за внимание!
Метаболические механизмы развития и компенсации осмотического стресса в головном мозге | Пигарова
Введение
Внеклеточная жидкость (ВЖ) головного мозга, состоящая из цереброспинальной жидкости (ЦСЖ) и интерстициальной жидкости (ИСЖ), в норме изотонична плазме крови. Проблемы возникают при быстром изменении осмоляльности или циркулирующей крови, или жидкостей головного мозга. Проницаемость гематоэнцефалического барьера ниже, чем периферических капиллярах, но эта проницаемость все равно в несколько раз больше, чем пассивная проницаемость для электролитов или глюкозы. Вследствие этой разницы считается, что мозг подобен осмометру: отекает при снижении осмоляльности плазмы и сжимается (дегидратируется), когда плазма становится гипертоничной. Оба состояния крайне неблагоприятно сказываются на функционировании клеток головного мозга.
Вследствие этой разницы считается, что мозг подобен осмометру: отекает при снижении осмоляльности плазмы и сжимается (дегидратируется), когда плазма становится гипертоничной. Оба состояния крайне неблагоприятно сказываются на функционировании клеток головного мозга.
В настоящей лекции будут рассмотрены основные физиологические механизмы поддержания водно-солевого гомеостаза головного мозга, а также причины и последствия их нарушения.
Основные определения, вспоминаемые из курса физиологии
Осмотическая концентрация – сумма растворенных частиц в растворе, определяемая как сложение молярных концентраций неэлектролитов и ионных концентраций растворимых веществ. Осмотическая концентрация 1 моль (М) сукрозы равна 1 осмоль, но для 1М NaCl равна 2 осмолям.
Осмоляльность (осмотическая активность) также измеряется в осмолях, но не эквивалентна осмотической концентрации, поскольку соотносится с суммарным осмотическим коэффициентом, который различен для различных электролитов и их концентраций.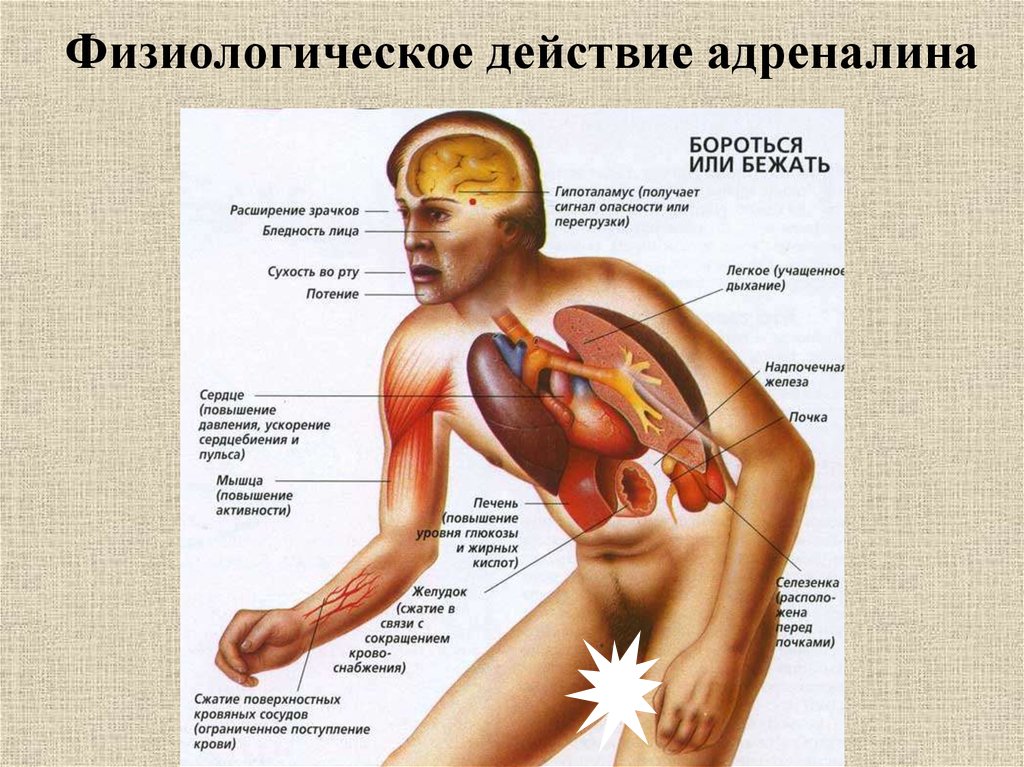 Для солей осмотический коэффициент обычно менее 1, а для некоторых сахаров – немного больше 1. Осмоляльность не только определяет осмотическое давление, но также и такие свойства растворов, как точки замерзания и кипения. Большинство лабораторных осмометров измеряют точку замерзания раствора, а не само осмотическое давление, делая перерасчет на осмоляльность в осмоль/кг по установленным константам.
Для солей осмотический коэффициент обычно менее 1, а для некоторых сахаров – немного больше 1. Осмоляльность не только определяет осмотическое давление, но также и такие свойства растворов, как точки замерзания и кипения. Большинство лабораторных осмометров измеряют точку замерзания раствора, а не само осмотическое давление, делая перерасчет на осмоляльность в осмоль/кг по установленным константам.
Осмолярность – практически синоним осмоляльности, но это расчетная величина, определяемая по формуле:
2Na (ммоль/л)+2K (ммоль/л)+мочевина (ммоль/л) + глюкоза (ммоль/л) + 0,033 белок (г/л).
Референсные диапазоны: для осмоляльности крови – 290–300 мОсм/кг, натрия плазмы крови – 135–145 ммоль/л.
NaCl – самый главный внеклеточный осмоль, отвечающий, как и видно из формулы, за практически всю осмоляльность плазмы крови и интерстициальной жидкости.
Тоничность – осмотическое давление через полупроницаемую мембрану (непроницаемая для осмолей, но проницаемая для воды). При сравнении двух растворов один может быть назван гипо- или гиперосмоляльным по отношению к другому.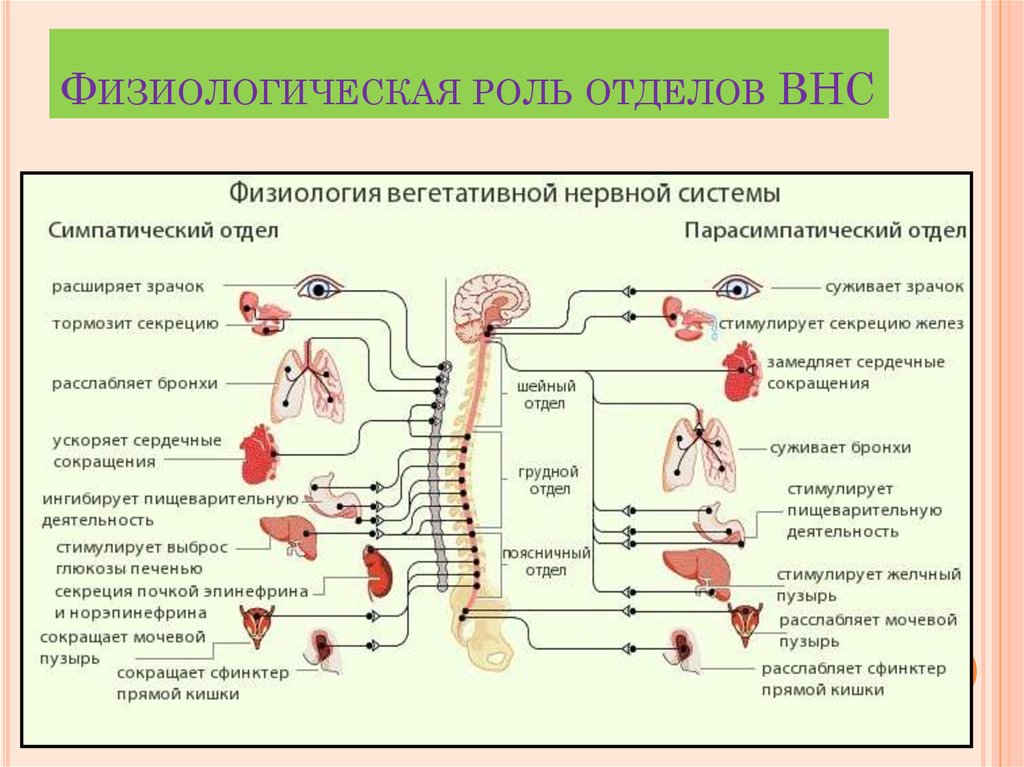
Важно понимать, что несмотря на то, что осмоляльность выражается в единицах концентрации осмолей, давление генерируется кинетической энергией молекул воды, проходящей через полунепроницаемую мембрану, а не растворенных веществ. Где меньше растворимого вещества, там больше воды, и таким образом вода будет стремиться двигаться из гипотонического раствора в гипертонический. В результате давление будет сформировано в гипертонической части.
Важные факты из курса физиологии
Большую часть времени большинство клеток млекопитающих живут в изотоническом окружении и, таким образом, не испытывают никакого осмотического давления сквозь плазматическую мембрану, но это не всегда так, и примером могут служить почки.
Изотоничность клеток не всегда результат равновесия, чаще это напряженная работа насосов и других транспортных систем в плазматической мембране, которые обеспечивают осмотический баланс между цитозолем и интерстициальной жидкостью. Если помпы останавливаются, клетки отекают.
Биологические мембраны в реальности не полностью полунепроницаемые. Различные электролиты жидкостей тела имеют широкий диапазон коэффициентов осмоляльности.
Проницаемость для воды плазматической мембраны различается у клеток организма. В некоторых клетках она может контролироваться физиологическими механизмами, такими как встраивание в мембрану аквапориновых каналов в ответ на специфические сигналы.
Плазматические мембраны до некоторой степени могут растягиваться, и эта способность различается между клетками организма. В результате клетки могут увеличиваться и уменьшаться в размере под действием осмотических изменений. Увеличение клеток ограничивается цитоскелетом, который крепится к плазматической мембране. Клетки ограничены окружающими клетками и волокнами соединительной ткани, а также архитектурой органа в целом, который может иметь неэластичную капсулу или, в случае головного мозга, твердый череп [1, 2].
Регуляция объема клеток головного мозга
Регуляция объема клеток требует активного транспорта, поэтому клетки, которые лишены метаболической энергии отекают. Осмоляльность цитозоля поддерживается равной таковой внеклеточного окружения активным мембранным транспортом осмолей, и при его отсутствии клетка приобретает избыток осмолей, за которыми приходит вода. Причина – наличие непроходимых через мембрану анионов внутри клетки и большого количества проходимых через мембрану анионов вне цитозоля, которые свободно проникают в клетку и по химическому градиенту за собой ведут еще и проходимые через мембрану катионы, что формирует осмотический градиент и тянет за собой воду в клетки. В здоровых клетках этим процессам противодействует работа активных ионных помп, выводящих анионы. Основной такой помпой является 3Na+/2K+-АТФазная помпа, поддерживающая осмотический баланс за счет постоянной работы. При остановке этой помпы клетка отекает, мембрана лопается, и происходит лизис клетки, означающий ее смерть [2].
Осмоляльность цитозоля поддерживается равной таковой внеклеточного окружения активным мембранным транспортом осмолей, и при его отсутствии клетка приобретает избыток осмолей, за которыми приходит вода. Причина – наличие непроходимых через мембрану анионов внутри клетки и большого количества проходимых через мембрану анионов вне цитозоля, которые свободно проникают в клетку и по химическому градиенту за собой ведут еще и проходимые через мембрану катионы, что формирует осмотический градиент и тянет за собой воду в клетки. В здоровых клетках этим процессам противодействует работа активных ионных помп, выводящих анионы. Основной такой помпой является 3Na+/2K+-АТФазная помпа, поддерживающая осмотический баланс за счет постоянной работы. При остановке этой помпы клетка отекает, мембрана лопается, и происходит лизис клетки, означающий ее смерть [2].
Клетки, помещенные в гипо- или гипертонические условия, изменяют объем, но если изменение тоничности неэкстремального характера со временем клетки могут приспособиться к новым условиям с восстановлением исходного объема. Эти компенсаторные изменения объема достигаются транспортом электролитов через плазматическую мембрану. Чаще всего ионы калия и хлорида высвобождаются из цитозоля в течение первой фазы гипотонического регуляторного снижения объема, позже выводятся из клетки ионы калия в сочетании с органическими анионами (таурин и другие аминокислоты). Среди аминокислот много активирующих веществ, таких как глютамат и аспартат, и это приводит к существенным последствиям в работе клеток. При возвращении клеток в прежние условия существования, они проходят транзиторное повторное изменение объемов, поскольку эта среда уже не является для них нормотонической. Так, клетка, приспособившаяся к гипертоничности, восстановившая свой малый объем процессами компенсации, транзиторно повторно отекает до возвращения в нормальные размеры [3, 4].
Эти компенсаторные изменения объема достигаются транспортом электролитов через плазматическую мембрану. Чаще всего ионы калия и хлорида высвобождаются из цитозоля в течение первой фазы гипотонического регуляторного снижения объема, позже выводятся из клетки ионы калия в сочетании с органическими анионами (таурин и другие аминокислоты). Среди аминокислот много активирующих веществ, таких как глютамат и аспартат, и это приводит к существенным последствиям в работе клеток. При возвращении клеток в прежние условия существования, они проходят транзиторное повторное изменение объемов, поскольку эта среда уже не является для них нормотонической. Так, клетка, приспособившаяся к гипертоничности, восстановившая свой малый объем процессами компенсации, транзиторно повторно отекает до возвращения в нормальные размеры [3, 4].
Среди клеток головного мозга астроциты испытывают выраженные изменения объема при осмотическом воздействии. В их плазматической мембране широко представлены аквапорины, а также транспортеры для органических анионов, ионов калия и хлоридов [4, 5]. Для регуляции объема наиболее важными каналами являются чувствительные к растяжению мембранные каналы, которые открываются при отеке клетки и позволяют выходить электролитам [6]. Для нейронов данные не однозначные, но их приспособительные реакции могут быть более отсроченными и менее эффективными, чем у астроцитов. Отек дендритов нейронов – это выраженные изменения, наблюдаемые при электронной микроскопии. Исследования показывают, что тело нейронов изменяет свои размеры очень медленно, тогда как глиальные отростки и дендриты нейронов очень активны в данном процессе. Медленное изменение размеров нейронов может объясняться отсутствием в них аквапоринов, но наличием их большого количества на мембранах глиальных клеток [4].
Для регуляции объема наиболее важными каналами являются чувствительные к растяжению мембранные каналы, которые открываются при отеке клетки и позволяют выходить электролитам [6]. Для нейронов данные не однозначные, но их приспособительные реакции могут быть более отсроченными и менее эффективными, чем у астроцитов. Отек дендритов нейронов – это выраженные изменения, наблюдаемые при электронной микроскопии. Исследования показывают, что тело нейронов изменяет свои размеры очень медленно, тогда как глиальные отростки и дендриты нейронов очень активны в данном процессе. Медленное изменение размеров нейронов может объясняться отсутствием в них аквапоринов, но наличием их большого количества на мембранах глиальных клеток [4].
Головной мозг как единое целое проходит регуляторные изменения объема при изменении осмоляльности крови [7]. Это служит защитой, хотя и не самой лучшей, против отека головного мозга. В течение системной гипотонии (водная интоксикация) у крыс интерстициальный объем головного мозга оставался относительно стабильным, тогда как объем клеток головного мозга возрастал, но не настолько, насколько можно было бы предположить его изменение при отсутствии компенсаторных механизмов. И наоборот, в течение выраженной системной гипертонии у анестезированных крыс церебральная интерстициальная жидкость уменьшалась со сравнительно минимальным изменением объема головного мозга. Механизм регуляции объема головного мозга задействует транспорт через гематоэнцефалический барьер, предположительно через астроцит-эндотелиальную систему [4].
И наоборот, в течение выраженной системной гипертонии у анестезированных крыс церебральная интерстициальная жидкость уменьшалась со сравнительно минимальным изменением объема головного мозга. Механизм регуляции объема головного мозга задействует транспорт через гематоэнцефалический барьер, предположительно через астроцит-эндотелиальную систему [4].
Механизмы регуляции церебрального объема еще до конца не изучены, но знание имеющихся патофизиологических процессов позволяет понимать общую патологию нарушения осмотических состояний.
Водная интоксикация
В жарком влажном климате потовые железы предохраняют организм от перегревания. Потеря тепла через испарение жидкости с кожи особенно важна при тяжелой работе в тропическом климате или при марафонском беге. Когда мы потеем, мы теряем соль и воду. В сравнении с жидкостями организма пот состоит больше из воды, чем соли. По мере того как теряется вода, повышается осмоляльность жидкостей организма, сокращается объем циркулирующей жидкости. При этом индивидуум испытывает выраженную жажду и, при возможности, будет страстно пить воду. Восполнение потерянного пота, содержащего соль, водой, превращает гиперосмоляльность в гипоосмоляльность.
При этом индивидуум испытывает выраженную жажду и, при возможности, будет страстно пить воду. Восполнение потерянного пота, содержащего соль, водой, превращает гиперосмоляльность в гипоосмоляльность.
Основной опасностью длительного физического истощения в жарком климате является перегрев с последующим коллапсом циркуляции. Прием большого количества воды после профузного потения может привести к судорогам и делирию, которые исторически наблюдались у работников шахт. Добавление к воде соли способно предотвращать эти нежелательные эффекты [4].
Патологи различают вазогенный (внеклеточный) отек головного мозга и цитогенный (внутриклеточный) отек головного мозга.
При вазогенном отеке капиллярный эндотелий повреждается и становится проницаемым для различных электролитов, включая белки плазмы. По своей сути, это нарушение гематоэнцефалического барьера. В норме концентрация белка в интерстициальной жидкости головного мозга очень низкая. Экстравазация альбумина после повреждения гематоэнцефалического барьера повышает коллоидное осмотическое (син. онкотическое) давление в интерстициальной жидкости, что вытягивает воду из капилляров и приводит к вазогенному отеку [8, 9].
онкотическое) давление в интерстициальной жидкости, что вытягивает воду из капилляров и приводит к вазогенному отеку [8, 9].
При цитотоксическом отеке первичной причиной выступает аккумуляция избытка метаболитов, которые повышают осмотическое давление в клеточной цитоплазме и привлекают воду внутрь клеток. Это может быть результатом нарушения трансмембранного транспорта (как пример – недостаток кислорода) или нарушенного метаболизма. Тканевой ацидоз при повышении калия и внеклеточное накопление глютамата приводят к отеку клеток, особенно астроцитов, меньше дендритов нейронов и меньше всего – клеточных тел нейронов. При гипоксии все эти три метаболических фактора вносят свой вклад в дополнение снижения выведения натрия из клеток сниженной активностью АТФ-азы [10].
У отека головного мозга можно выделить два аспекта. Это аккумуляция избыточной воды в интерстициальном пространстве и захват воды клетками. Важно понимать, что даже в случае, когда при вазогенном отеке вода накапливается вначале в интерстиции, и только после этого внутри клеток, а при цитотоксическом отеке процесс начинается с клеток, в конечном итоге избыток воды формируется и внутри клеток, и в межклеточном пространстве.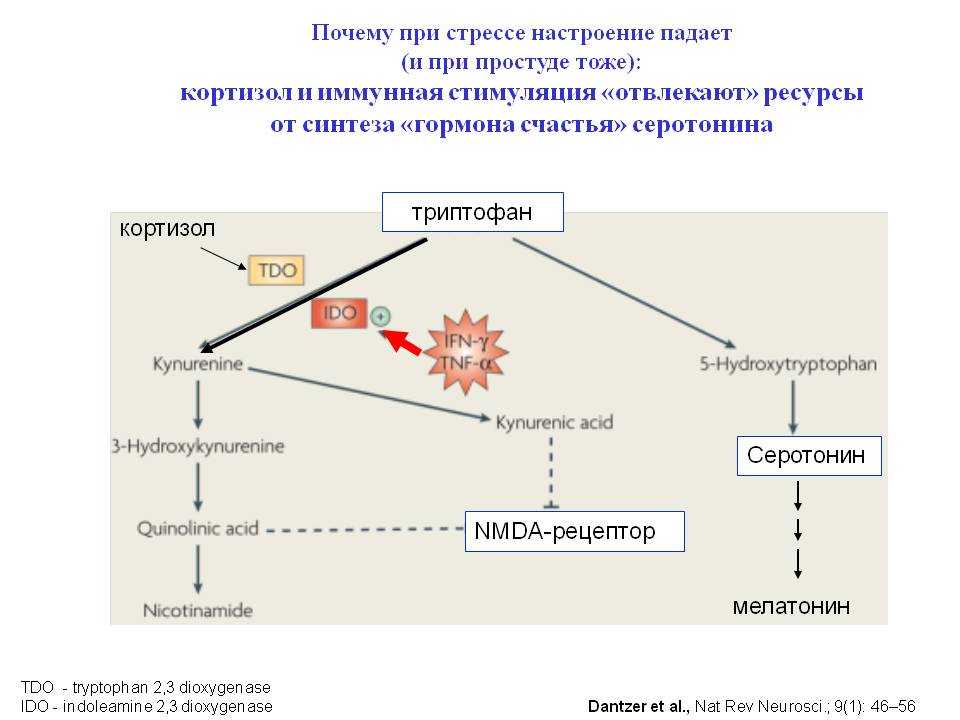
Перемещение большей части воды, электролитов и других биоактивных веществ проходит через эндотелиальные клетки, которые хорошо оснащены водными каналами-аквапоринами. Примечательно, что генетически модифицированные мыши с дефектом экспрессии аквапорина защищены от отека мозга вследствие повреждения гематоэнцефалического барьера после интенсивных судорог, что является редким примером, когда генетический дефект дает некоторое преимущество, хотя и за счет снижения других функций [11].
В биологии нет обратного осмоса. Не существует водных помп, которые могут транспортировать воду против осмотического градиента через биологические мембраны. Тем не менее, железы и почки могут секретировать жидкости, тоничность которых значимо отличается от таковой внеклеточной жидкости, хотя именно внеклеточная жидкость послужила основой для этой секреции. Для этого процесс разделен на два этапа. Вначале производится изотоническая жидкость, из которой на втором этапе активными транспортными системами убираются растворимые вещества, оставляя гипоосмоляльную жидкость [1, 4].
Помимо влияния на возбудимость ЦНС, отек головного мозга также вызывает механический эффект, который может быть жизнеугрожающим. Отек может иметь смертельные последствия из-за того, что череп твердый и не может подстроиться под значимые изменения размеров головного мозга. Компрессия сосудов повышает резистентность к току крови, нарушая церебральное кровоснабжение. Более опасно то, что повышение внутричерепного давления может вытолкнуть основание мозга в большое затылочное отверстие и нарушить дренаж ЦСЖ из желудочков головного мозга. При сохранении секреции ЦСЖ без возможности ее дренажа, внутричерепное давление еще больше повышается [12].
Гипотоничность и гипонатриемия способствуют синаптической трансмиссии, что отражается на повышении рефлекторной активности и судорожной готовности, а повышение осмоляльности и гипернатриемия ее снижают.
При водной интоксикации изменения ЦНС проявляются как снижение уровня сознания в виде делирия, ступора или комы, конвульсии центрального генеза; при отсутствии лечения наступает смерть. Клиническим правилом считается, что снижение натрия менее 120 ммоль/л опасно для жизни и должно быть скорректировано.
Клиническим правилом считается, что снижение натрия менее 120 ммоль/л опасно для жизни и должно быть скорректировано.
Обезвоживание
Гипернатриемия является основной клинической причиной уменьшения размеров головного мозга. Причиной ее является потеря воды или избыток натрия, а в большинстве случаев их сочетание с сравнительно большим вкладом недостатка воды. Недостаток жидкости может быть, как результатом повышенных потерь (например, несахарный диабет, интенсивная мочегонная терапия), а также неадекватного потребления вследствие повреждения гипоталамического центра жажды или осознавания жажды в лобной доле, сниженного уровня сознания/умственных способностей и невозможности выразить потребность в питье (кома или ступор, пожилые люди), фактического отсутствия доступа к воде.
При гипернатриемии и сопутствующей гиперосмоляльности плазмы вода из клеток головного мозга выходит по направлению осмотического градиента, объем клеток уменьшается. Адаптивный ответ клеток состоит из аккумулирования осмотически активных внутриклеточных электролитов, при этом повышается захват ионов калия, хлоридов, натрия, а также некоторых органических молекул [13]. Вклад органических осмолей очень важен при хронической гипернатриемии. Внутриклеточно образовываются для этих целей полиолы, триметиламины, аминокислоты и их производные. Миоинозитол, бетаин, глицерофосфорилхолин образуются при гипернатриемии средней степени, тогда как бетаин – только при тяжелой форме патологии [14].
Вклад органических осмолей очень важен при хронической гипернатриемии. Внутриклеточно образовываются для этих целей полиолы, триметиламины, аминокислоты и их производные. Миоинозитол, бетаин, глицерофосфорилхолин образуются при гипернатриемии средней степени, тогда как бетаин – только при тяжелой форме патологии [14].
Уменьшение объема головного мозга отрицательно сказывается на его функции, что клинически проявляется сомноленцией и снижением рефлекторной активности вплоть до комы. Гипернатриемия провоцирует развитие инсулинорезистентности и гипергликемии, что еще больше усугубляет гиперосмоляльность. При сжимании мозга отмечается подтягивание диплоических вен, разрыв стенок которых может приводить к субарахноидальным кровотечениям. Повышение гипернатриемии до 160 ммоль/л и более ассоциировано с риском смерти на 50% [15, 16].
Таким образом, осмотический стресс оказывает непосредственное влияние на функционирование головного мозга и запускает физиологические компенсаторные механизмы, при недостаточности которых вследствие интенсивности или продолжительности стресса могут развиться необратимые тяжелые осложнения. Знание и понимание этих процессов являются основой для предупреждения их развития и лечения.
Знание и понимание этих процессов являются основой для предупреждения их развития и лечения.
1. Kaneshiro E. Cell Physiology Source Book: Essentials of Membrane Biophysics: Academic Press; 2011.
2. Somjen GG. Ions in the brain: normal function, seizures, and stroke: Oxford University Press; 2004.
3. Pardridge WM. CSF, blood-brain barrier, and brain drug delivery. Expert Opinion on Drug Delivery. 2016;13(7):963-975. doi: 10.1517/17425247.2016.1171315.
4. Laming PR, Kimelberg H, Robinson S, et al. Neuronal-glial interactions and behaviour. Neurosci Biobehav Rev. 2000;24(3):295-340.
5. Knepper MA, Verbalis JG, Nielsen S. Role of aquaporins in water balance disorders. Curr Opin Nephrol Hypertens. 1997;6(4):367-371.
6. Walz W. Chloride/anion channels in glial cell membranes. Glia. 2002;40(1):1-10. doi: 10.1002/glia.10125.
7. Gullans SR, Verbalis JG. Control of Brain Volume During Hyperosmolar and Hypoosmolar Conditions. Annu Rev Med. 1993;44(1):289-301. doi: 10.1146/annurev.me.44.020193.001445.
doi: 10.1146/annurev.me.44.020193.001445.
8. Thomas SA, Davson H, Segal MB. Quantification of efflux into the blood and brain of intraventricularly perfused [3H]thymidine in the anaesthetized rabbit. Exp Physiol. 1997;82(1):139-148. doi: 10.1113/expphysiol.1997.sp004003.
9. Theodorakis PE, Müller EA, Craster RV, Matar OK. Physical insights into the blood–brain barrier translocation mechanisms. Phys Biol. 2017;14(4):041001. doi: 10.1088/1478-3975/aa708a.
10. Kimelberg HK, Schools GP, Cai Z, Zhou M. Mini-Review-Freshly Isolated Astrocyte (FIA) Preparations: A Useful Single Cell System for Studying Astrocyte Properties. J Neurosci Res. 2000;61(6):577-587.
11. Nico B, Frigeri A, Nicchia GP, et al. Role of aquaporin-4 water channel in the development and integrity of the blood-brain barrier. J Cell Sci. 2001;114(7):1297-1307.
12. Oja SS, Schousbore A, Saransaari P. Handbook of neurochemistry and molecular neurobiology. Springer, New York; 2007. doi: 10.1007/978-0-387-30373-4.
13. Heilig CW, Stromski ME, Blumenfeld JD, et al. Characterization of the major brain osmolytes that accumulate in salt-loaded rats. Am J Physiol. 1989;257(6 Pt 2):F1108-1116. doi: 10.1152/ajprenal.1989.257.6.F1108.
14. Lien YH, Shapiro JI, Chan L. Effects of hypernatremia on organic brain osmoles. J Clin Invest. 1990;85(5):1427-1435. doi: 10.1172/jci114587.
15. Naganathan S, Al-Dhahir M. Hypernatremia. StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2017.
16. Campbell N, Train E. A Systematic Review of Fatalities Related to Acute Ingestion of Salt. A Need for Warning Labels? Nutrients. 2017;9(7):648. doi: 10.3390/nu9070648.
Физиологические механизмы стресса — Студопедия
Поделись
Стресс и фрустрация
Теории эмоций
Эмоциональные процессы
План
Лекция. Эмоциональные процессы и управление эмоциями
Познавая действительность, человек так или иначе относится к предметам, явлениям, событиям, к другим людям, к своей личности.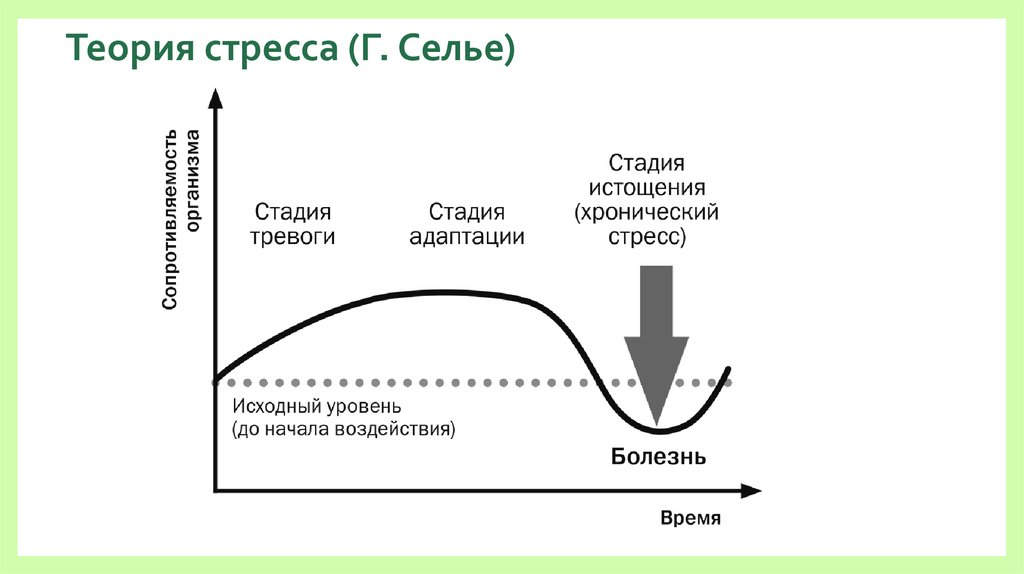 Одни явления действительности радуют его, другие — печалят, третьи — возмущают и т. д. Радость, печаль, восхищение, возмущение, гнев, страх и др. — все это различные виды субъективного отношения человека к действительности. В психологии эмоциями называют процессы, отражающие личную значимость и оценку внешних и внутренних ситуаций для жизнедеятельности человека в форме переживаний. Эмоции, чувства служат для отражения субъективного отношения человека ксамому себе и- к окружающему его миру.
Одни явления действительности радуют его, другие — печалят, третьи — возмущают и т. д. Радость, печаль, восхищение, возмущение, гнев, страх и др. — все это различные виды субъективного отношения человека к действительности. В психологии эмоциями называют процессы, отражающие личную значимость и оценку внешних и внутренних ситуаций для жизнедеятельности человека в форме переживаний. Эмоции, чувства служат для отражения субъективного отношения человека ксамому себе и- к окружающему его миру.
Эмоции — особый класс субъективных психологических состояний, отражающих в форме непосредственных переживаний приятного процесс и результаты практической деятельности, направленной на удовлетворение его актуальных потребностей. Поскольку все то, что делает человек, в конечном счете служит цели удовлетворения его разнообразных потребностей, постольку любые проявления активности человека сопровождаются эмоциональными переживаниями.
Эмоции, утверждал Ч.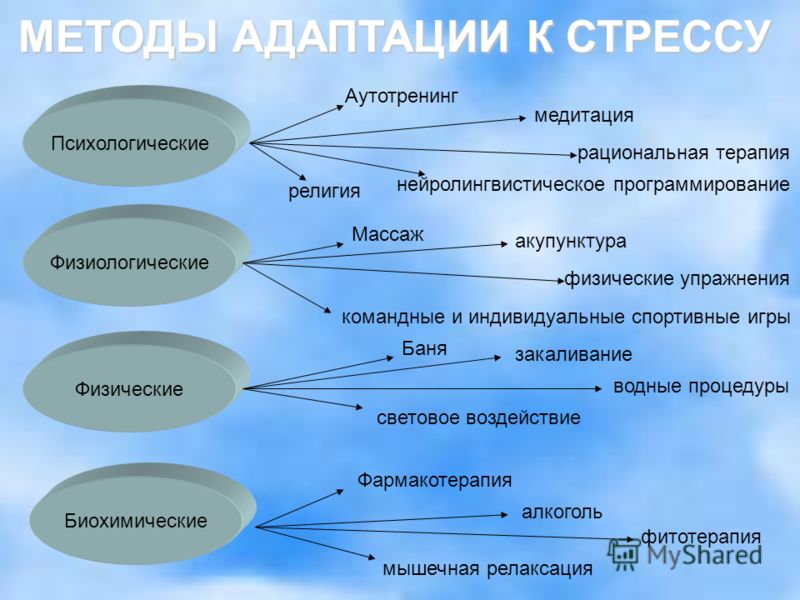 Дарвин, возникли в процессе эволюции как средство, при помощи которого живые существа устанавливают значимость тех или иных условий для удовлетворения актуальных для них потребностей.
Дарвин, возникли в процессе эволюции как средство, при помощи которого живые существа устанавливают значимость тех или иных условий для удовлетворения актуальных для них потребностей.
Эмоциональные ощущения биологически в процессе эволюции закрепились как своеобразный способ поддержания жизненного процесса в его оптимальных границах и предупреждают о разрушающем характере недостатка или избытка каких-либо факторов.
Самая старая по происхождению, простейшая и наиболее распространенная у живых существ форма эмоциональных переживаний — это удовольствие,получаемое от удовлетворения органических потребностей, и неудовольствие, связанное с невозможностью это сделать при обострении соответствующей потребности.
Многообразные проявления эмоциональной жизни человека делятся на аффекты, собственно эмоции, чувства, настроения и стресс.
Наиболее мощная эмоциональная реакция — аффект — сильное, бурное и относительно кратковременное эмоциональное переживание, полностью захватывающее психику человека и предопределяющее единую реакцию на ситуацию в целом (порой эта реакция ивоздействующие раздражители осознаются недостаточно — и это одна из причин практической неуправляемости этим состоянием).
Развитие аффекта подчиняется следующему закону: чем более сильным является исходный мотивационный стимул поведения, и чем больше усилий пришлось затратить на то, чтобы его реализовать, чем меньше итог, полученный в результате всего этого, тем сильнее возникающий аффект. В отличие от эмоций и чувств аффекты протекают бурно, быстро, сопровождаются резко выраженными органическими изменениями и двигательными реакциями.
Аффекты, как правило, препятствуют нормальной организации поведения, его разумности. Они способны оставлять сильные и устойчивые следы в долговременной памяти. В отличие от аффектов работа эмоций и чувств связана по преимуществу с кратковременной и оперативной памятью. Эмоциональная напряженность, накапливаемая в результате возникновения аффектогенных ситуаций, может накапливаться и, если ей во-время не дать выхода, привести к сильной и бурной эмоциональной разрядке, которая, снимая возникшее напряжение, часто сопровождается чувством усталости, подавленности, депрессией.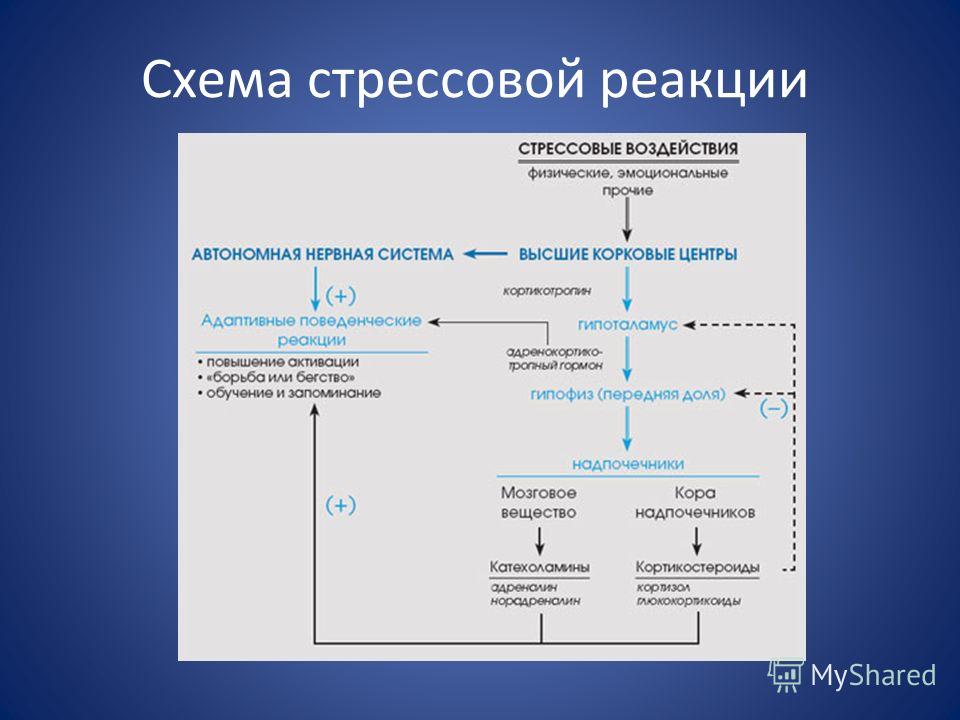
Собственно эмоции, вотличие от аффектов, — более длительные состояния. Они — реакция не только на события совершившиеся, но ина вероятные или вспоминаемые. Если аффекты возникают к концу действия и отражают суммарную итоговую оценку ситуации, то эмоции смещаются к началу действия и предвосхищают результат. Они носят опережающий характер, отражая события в форме обобщенной субъективной оценки личностью определенной ситуации, связанной с удовлетворением потребностей человека.
Эмоции и чувства предвосхищают процесс, направленный на удовлетворение потребности. Эмоции и чувства выражают смысл ситуации для человека с точки зрения актуальной в данный момент потребности, значения для ее удовлетворения предстоящего действия или деятельности. Эмоции могут вызываться как реальными, так и воображаемыми ситуациями. Они, как и чувства, воспринимаются человеком как его собственные внутренние переживания, коммуницируются, т. е. передаются другим людям, сопереживаются.
Чувства— высший продукт культурно-эмоционального развития человека.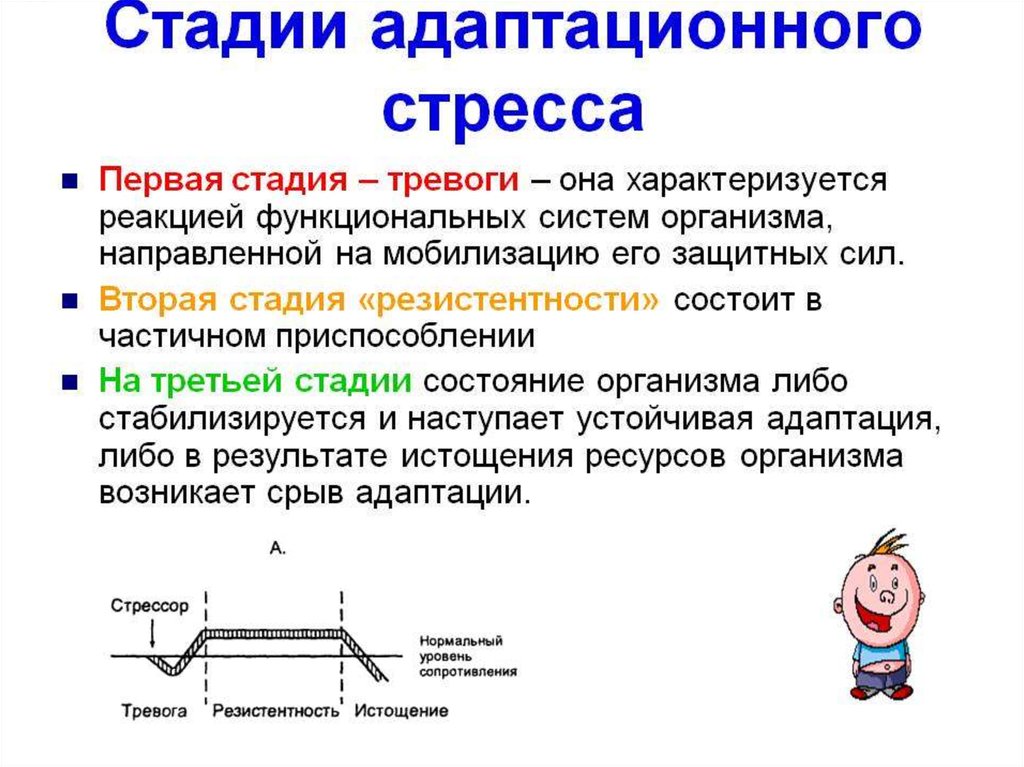 Они связаны с определенными, входящими в сферу культуры предметами, видами деятельности и людьми, окружающими человека.
Они связаны с определенными, входящими в сферу культуры предметами, видами деятельности и людьми, окружающими человека.
Чувства— еще более, чем эмоции, устойчивые психические состояния, имеющие четко выраженный предметный характер: они выражают устойчивое отношение к каким-либо объектам (реальным или воображаемым). Человек не может переживать чувство вообще, безотносительно, а только к кому-нибудь или чему-нибудь. Например, человек не в состоянии испытывать чувство любви, если у него нет объекта привязанности. В зависимости от направленности чувства делятся на моральные(переживание человеком его отношения к другим людям), интеллектуальные(чувства, связанные с познавательной деятельностью), эстетические(чувства красоты при восприятии искусства, явлений природы), практические (чувства, связанные с деятельностью человека)».
Чувства выполняют в жизни и деятельности человека, в его общении с окружающими людьми мотивирующую роль. В отношении окружающего его мира человек стремится действовать так, чтобы подкрепить и усилить свои положительные чувства. Они всегда связаны с работой сознания, могут произвольно регулироваться. Проявление сильного и устойчивого положительного чувства к чему-либо или к кому-либо называется страстью. Устойчивые чувства умеренной или слабой силы, действующие в течение длительного времени, именуются настроениями.
В отношении окружающего его мира человек стремится действовать так, чтобы подкрепить и усилить свои положительные чувства. Они всегда связаны с работой сознания, могут произвольно регулироваться. Проявление сильного и устойчивого положительного чувства к чему-либо или к кому-либо называется страстью. Устойчивые чувства умеренной или слабой силы, действующие в течение длительного времени, именуются настроениями.
Настроение— самое длительное эмоциональное состояние, окрашивающее все поведение человека.
Эмоциональные состояния, возникшие в процессе деятельности, могут повышать или понижать жизнедеятельность человека. Первые называются стеническими, вторые — астеническими. Возникновение и проявление эмоций, чувств связано со сложной комплексной работой коры, подкорки мозга и вегетативной нервной системы, регулирующей работу внутренних органов. Этим определяется тесная связь эмоций и чувств с деятельностью сердца, дыхания, с изменениями в деятельности скелетных мышц (пантомимика) и лицевых мышц (мимика).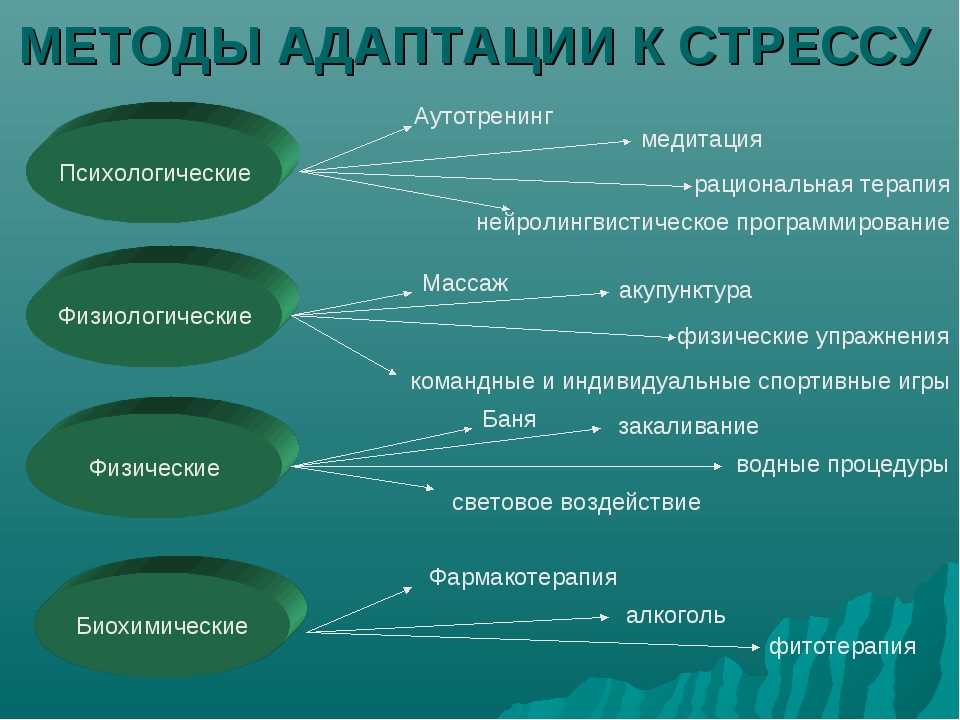 Специальные эксперименты обнаружили в глубине мозга, в лимбической системе существование центров положительных и отрицательных эмоций, получивших название центров «наслаждения, рая» и «страдания, ада».
Специальные эксперименты обнаружили в глубине мозга, в лимбической системе существование центров положительных и отрицательных эмоций, получивших название центров «наслаждения, рая» и «страдания, ада».
Страсть— еще один вид сложных, качественно своеобразных и встречающихся только у человека эмоциональных состояний. Страсть представляет собой сплав эмоций, мотивов и чувств, сконцентрированных вокруг определенного вида деятельности или предмета (человека).
С. Л. Рубинштейн считал, что в эмоциональных проявлениях личностиможно выделить три сферы:
— ее органическую жизнь;
— ее интересы материального порядка;
— ее духовные, нравственные потребности.
Он обозначил их соответственно как органическую (аффективно-эмоциональную) чувствительность, предметные чувства и обобщенные мировоззренческие чувства.
К аффективно-эмоциональнойчувствительности относятся, по его мнению, элементарные удовольствия и неудовольствия, преимущественно связанные с удовлетворением органических потребностей.
Предметные чувствасвязаны с обладанием определенными предметами и занятиями отдельными видами деятельности. Эти чувства соответственно их предметам подразделяются на материальные, интеллектуальные и эстетические. Они проявляются в восхищении одними предметами, людьми и видами деятельности и в отвращении к другим.
Мировоззренческие чувствасвязаны с моралью и отношениями человека к миру, социальным событиям, нравственным категориям и ценностям.
2. Впервые эмоциональные выразительные движения стали предметом изучения Ч. Дарвина. На основе сравнительных исследований эмоциональных движений млекопитающих Дарвин создал биологическую концепцию эмоций,согласно которой выразительные эмоциональные движения рассматривались как рудимент целесообразных инстинктивных действий, сохраняющих в какой-то степени свой биологический смысл и вместе с тем выступающих в качестве биологически значимых сигналов для особей не только своего, но и других видов.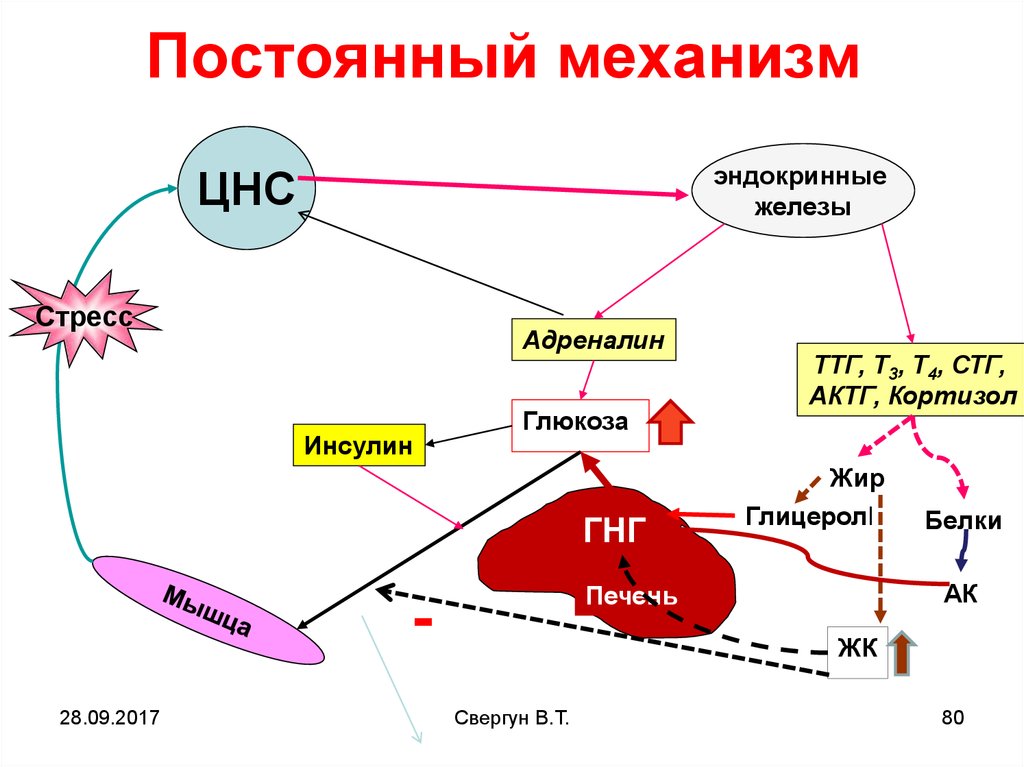
Результатом глубокой теоретической мысли является биологическая теория эмоций П. К. Анохина. Эта теория рассматривает эмоции как продукт эволюции, как приспособительный фактор в жизни животного мира.
Рассмотрение эмоций с биологической точки зрения (П. К. Анохин) позволяет признать, что эмоции закрепились в эволюции как механизм, удерживающий жизненные процессы в оптимальных границах ипредупреждающий разрушительный характер недостатка или избытка каких-либо факторов жизни данного организма. Положительные эмоции возникают, когда реальный результат совершенного поведенческого акта совпадает или превышает ожидаемый полезный результат, и наоборот, недостаток реального результата, несовпадение с ожидаемым ведет к отрицательным эмоциям.
Эмоция выступает как своеобразный инструмент, оптимизирующий жизненный процесс и тем самым способствующий сохранению как отдельной особи, так и всего вида.
Неоднократное удовлетворение потребностей, окрашенное положительной эмоцией, способствует обучению соответствующей деятельности, а повторные неудачи в получении запрограммированного результата вызывают торможение неэффективной деятельности и поиски новых более успешных способов достижения цели.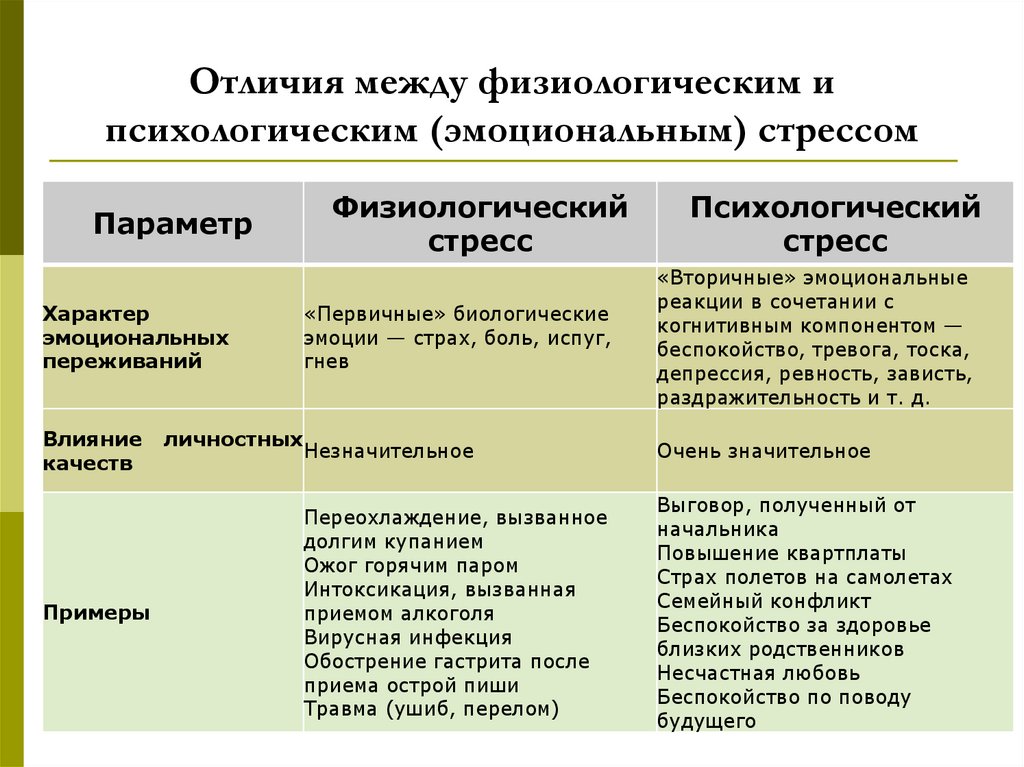
Хотя наличие потребности — обязательное условие возникновения эмоции, оно вряд ли является единственным и достаточным. Это положение было отправной точкой для построения П. В. Симоновым информационной теории эмоций. Согласно П. В. Симонову, эмоция есть отражение мозгом высших животных и человека величины потребности и вероятности ее удовлетворения в данный момент.
П. В. Симоновым сформулировано правило, согласно которому отношение между эмоцией (Э), потребностью (П), информацией, прогностически необходимой для организации действий по удовлетворению данной потребности (Н), и наличной информацией, которая может быть использована для целенаправленного поведения (С), выражается формулой Э = П (Н — С).
Из данной формулы следует, что:
1) эмоция невозникает, если потребность отсутствует или удовлетворена, а при наличии потребности — если система вполне информирована;
2) при дефиците наличной информации появляется отрицательная эмоция, достигающая максимума в случае полного отсутствия информации;
3) положительная эмоция возникает, когда наличная информация превышает информацию, прогностически необходимую для удовлетворения данной потребности.
Таким образом, формула эмоций отражает количественную зависимость интенсивности эмоциональной реакции от силы потребности и размеров дефицита или прироста прагматической информации, необходимой для достижения цели (удовлетворения потребности).
П. В. Симонов показал, что эмоции возникают при рассогласованиимежду жизненной потребностью и возможностью ее удовлетворения,т. е. при недостатке или избытке актуальных сведений, необходимых для достижения цели, а степень эмоционального напряжения определяется потребностью и дефицитом информации, необходимой для удовлетворения этой потребности. Таким образом, в ряде случаев знания, информированность личности снимают эмоции, изменяют эмоциональный настрой и поведение личности.
Эмоцияможет рассматриваться как обобщенная оценка ситуации.Так, эмоция страха развивается при недостатке сведений, необходимых для защиты, как ожидание и предсказание неудачи при совершении действия, которое должно быть выполнено в данных условиях.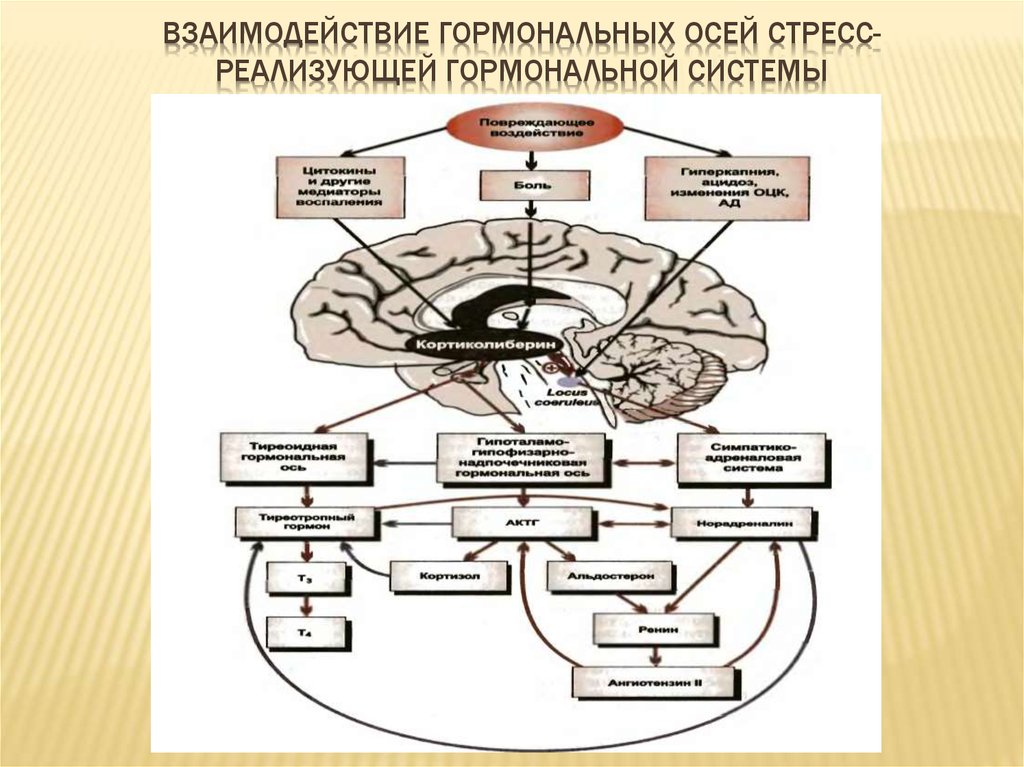 Очень часто страх, возникающий в ситуациях неожиданных и неизвестных, достигает такой силы, что человек погибает. Понимание того, что страх может быть следствием недостатка информации, позволяет его преодолеть. Реакцию удивления можно рассматривать как своеобразную форму страха, которая пропорциональна разнице между предвидимой и фактически полученной дозой информации. При удивлении внимание сосредоточивается на причинах необычного, а при страхе — на предвосхищении угрозы. Понимание родства удивления и страха позволяет преодолеть страх, если перенести акцент с результатов события на анализ его причин.
Очень часто страх, возникающий в ситуациях неожиданных и неизвестных, достигает такой силы, что человек погибает. Понимание того, что страх может быть следствием недостатка информации, позволяет его преодолеть. Реакцию удивления можно рассматривать как своеобразную форму страха, которая пропорциональна разнице между предвидимой и фактически полученной дозой информации. При удивлении внимание сосредоточивается на причинах необычного, а при страхе — на предвосхищении угрозы. Понимание родства удивления и страха позволяет преодолеть страх, если перенести акцент с результатов события на анализ его причин.
Согласно теории американского психолога Джеймса, тот факт, что эмоции характеризуются ярко выраженными изменениями в деятельности внутренних органов, в состоянии мышц (мимика), позволяет предположить, что эмоции представляютсобой суммутолько органических ощущений,вызываемых этими изменениями. Согласно этой теории, человеку грустно, потому что он плачет, а никак не наоборот. Если человек примет зажатую скованную позу с опущенными плечами и головой, то вскоре у него появится и чувство неуверенности, подавленности, грусти. И наоборот, поза с развернутыми плечами, поднятой головой, улыбкой на губах вскоре вызовет и чувство уверенности, бодрости, хорошее настроение. Частично эти наблюдения справедливы, но все же физиологические проявления не исчерпывают существа эмоций. Ученые пришли к заключению (Э. Гельгорн), что эмоции осуществляют энергетическую мобилизацию организма,так, например, радость сопровождается усилением иннервации в мышцах, при этом мелкие артерии расширяются, усиливается приток крови к коже, кожа делается теплее, ускоренное кровообращение облегчает питание тканей испособствует улучшению физиологических процессов. Радость молодит, т. к. создаются оптимальные условия питания всех тканей тела. Напротив, физиологические проявления печали характеризуются парализующим действием на мышцы, движения в результате медленные ислабые, сосуды сжимаются, ткани обескровливаются, появляется озноб, недостаток воздуха и тяжесть в груди.
Если человек примет зажатую скованную позу с опущенными плечами и головой, то вскоре у него появится и чувство неуверенности, подавленности, грусти. И наоборот, поза с развернутыми плечами, поднятой головой, улыбкой на губах вскоре вызовет и чувство уверенности, бодрости, хорошее настроение. Частично эти наблюдения справедливы, но все же физиологические проявления не исчерпывают существа эмоций. Ученые пришли к заключению (Э. Гельгорн), что эмоции осуществляют энергетическую мобилизацию организма,так, например, радость сопровождается усилением иннервации в мышцах, при этом мелкие артерии расширяются, усиливается приток крови к коже, кожа делается теплее, ускоренное кровообращение облегчает питание тканей испособствует улучшению физиологических процессов. Радость молодит, т. к. создаются оптимальные условия питания всех тканей тела. Напротив, физиологические проявления печали характеризуются парализующим действием на мышцы, движения в результате медленные ислабые, сосуды сжимаются, ткани обескровливаются, появляется озноб, недостаток воздуха и тяжесть в груди. Огорчения очень старят, поскольку они сопровождаются изменениями кожи, волос, ногтей, зубов ипр.
Огорчения очень старят, поскольку они сопровождаются изменениями кожи, волос, ногтей, зубов ипр.
Итак, если вы хотите подольше сохранить молодость, то не выходите из душевного равновесия по пустякам, чаще радуйтесь и стремитесь удержать хорошее настроение.
Таким образом, Джеймс инезависимо от него Ланге предложили «периферическую» теорию эмоций, согласно которой эмоция является вторичным явлением — осознанием приходящих в мозг сигналов об изменениях в мышцах, сосудах и внутренних органах в момент реализации поведенческого акта, вызванного эмоциогенным раздражителем. Другими словами, эмоциогенный сигнал, действуя на мозг, включает определенное поведение, а обратная соматосенсорная и висцеросенсорная афферентация вызывает эмоцию. Суть своей теории Джеймс выразил парадоксом: «Мы чувствуем печаль, потому что плачем, мы боимся, потому что дрожим».
В данном аспекте представляет интерес концепция Арнольда, согласно которой интуитивная оценка ситуации (например, угрозы) вызывает тенденцию действовать, что, будучи выраженным в различных телесных изменениях, переживается как эмоция и может привести к действию.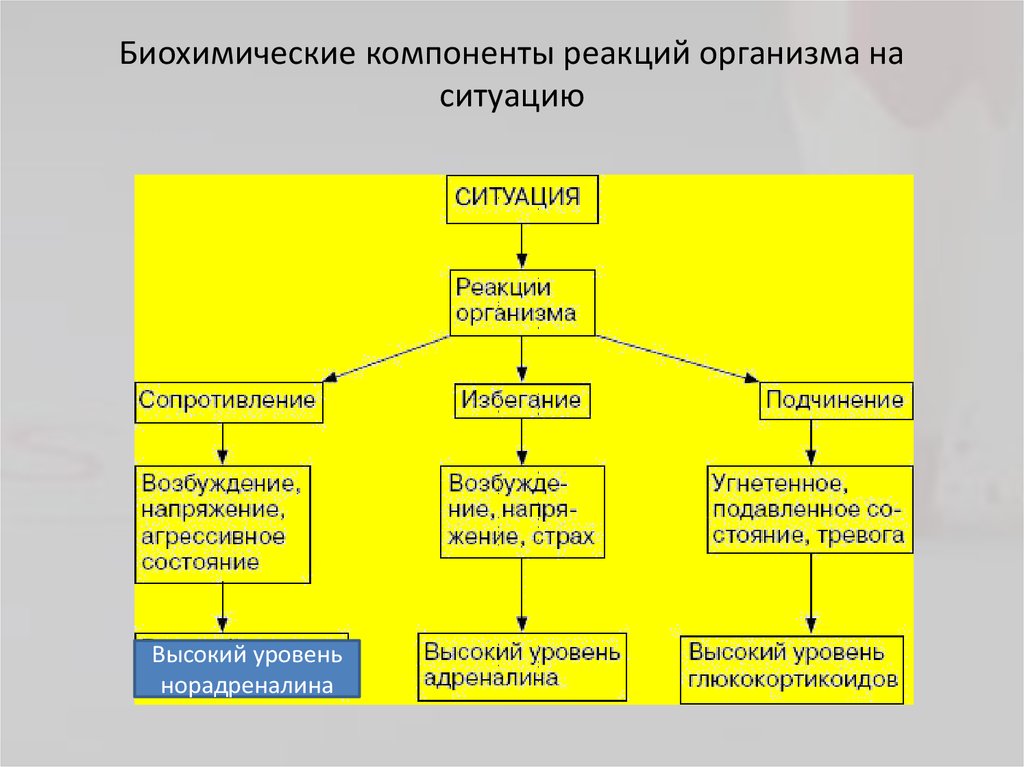 Если Джеймс говорил «мы боимся, потому что мы дрожим», то из концепции Арнольда следует, что мы боимся потому, что решили, будто нам угрожают.
Если Джеймс говорил «мы боимся, потому что мы дрожим», то из концепции Арнольда следует, что мы боимся потому, что решили, будто нам угрожают.
Теория Джеймса—Ланге сыграла положительную роль, указав на связь трех событий: внешнего раздражителя, поведенческого акта и эмоционального переживания. Ее уязвимым местом остается сведение эмоций лишь к осознанию ощущений, возникающих в результате периферических реакций. Ощущение выступает здесь как первичное явление по отношению к эмоции, которая рассматривается как ее прямое производное.
Далибор Биндра после критического анализа существующих теорий эмоций пришел к выводу, что нельзя провести жесткое разграничение между эмоцией и мотивацией, между соответствующими типично видовыми действиями. Нет доказательств, что эмоции вызываются только стимулами внешней среды, а мотивации — только изменениями внутренней среды организма. Нет оснований признавать существование какого-либо единого специфического церебрального процесса в качестве «эмоционального процесса», постулируемого рядом теорий.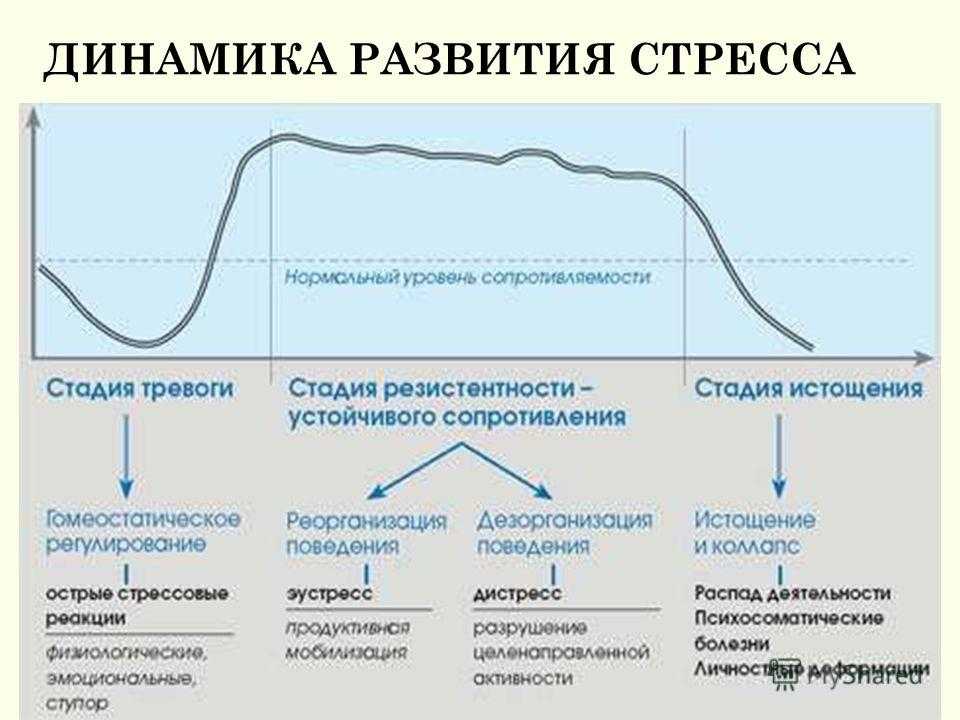 Эмоция не существует ни как единый процесс, ни как отдельный класс поведенческих реакций, и она не может быть полностью отделена от других явлений — ощущения, восприятия, мотивации и т. п. Она не является также «промежуточной переменной», связывающей отдельные компоненты поведенческой реакции в целостный акт.
Эмоция не существует ни как единый процесс, ни как отдельный класс поведенческих реакций, и она не может быть полностью отделена от других явлений — ощущения, восприятия, мотивации и т. п. Она не является также «промежуточной переменной», связывающей отдельные компоненты поведенческой реакции в целостный акт.
Биндра выдвигает собственную концепцию о «центральном мотивационном состоянии» — комплексе нервных процессов, возникающем в результате действия комбинации побудительных стимулов определенного типа. Развитие «центрального мотивационного состояния» создает избирательное внимание к определенному классу побудительных стимулов и реактивную склонность в пользу определенного класса типично видовых действий.
3. Одним из наиболее распространенных в наши дни видов аффектов является стресс. Он представляет собой состояние чрезмерно сильного и длительного психологического напряжения, которое возникает у человека, когда его нервная система получает эмоциональную перегрузку. Стресс дезорганизует деятельность человека, нарушает нормальный ход его поведения. Стрессы, особенно если они часты и длительны, оказывают отрицательное влияние не только на психологическое состояние, но и на физическое здоровье человека. Они представляют собой главные «факторы риска» при проявлении и обострении таких заболеваний, как сердечно-сосудистые и заболевания желудочно-кишечного тракта.
Стресс дезорганизует деятельность человека, нарушает нормальный ход его поведения. Стрессы, особенно если они часты и длительны, оказывают отрицательное влияние не только на психологическое состояние, но и на физическое здоровье человека. Они представляют собой главные «факторы риска» при проявлении и обострении таких заболеваний, как сердечно-сосудистые и заболевания желудочно-кишечного тракта.
В переводе с английского стресс — это давление, нажим, напряжение, а дистресс — горе, несчастье, недомогание, нужда. По словам Г. Селье, стресс есть неспецифический(т. е. один и тот же на различные воздействия) ответ организма на любое предъявленное ему требование,который помогает ему приспособиться к возникшей трудности, справиться с ней. Всякая неожиданность, которая нарушает привычное течение жизни, может быть причиной стресса. При этом, как отмечает Г. Селье, не имеет значения, приятна или неприятна ситуация, с которой мы столкнулись. Имеет значение лишь интенсивность потребности в перестройкеили в адаптации. В качестве примера ученый приводит волнующую ситуацию: мать, которой сообщили о гибели в бою ее единственного сына, испытывает страшное душевное потрясение. Если много лет спустя окажется, что сообщение было ложным и сын неожиданно войдет в комнату целым и невредимым, она почувствует сильнейшую радость.
В качестве примера ученый приводит волнующую ситуацию: мать, которой сообщили о гибели в бою ее единственного сына, испытывает страшное душевное потрясение. Если много лет спустя окажется, что сообщение было ложным и сын неожиданно войдет в комнату целым и невредимым, она почувствует сильнейшую радость.
Специфические результаты двух событий — горе и радость — совершенно различны, даже противоположны, но их стрессовое действие — неспецифическое требование приспособления к новой ситуации — может быть одинаковым.
Деятельность, связанная со стрессом, может быть приятной или неприятной. Любое событие, факт или сообщение может вызвать стресс, т. е. стать стрессором.При этом, выступит та или иная ситуация причиной стресса или нет, зависит не только от самой ситуации, но и от личности, ее опыта, ожиданий, уверенности в себе и т. д. Особенно большое значение имеет, конечно, оценка угрозы, ожидание опасных последствий, которую содержит в себе ситуация.
Значит, само возникновение и переживание стресса зависит не столько от объективных, сколько от субъективных факторов, от особенностей самого человека: оценки им ситуации, сопоставления своих сил и способностей стем, что от него требуется, и т. д.
К понятию и состоянию стресса близко и понятие фрустрации. Сам термин в переводе с латинского означает обман, тщетное ожидание. Фрустрация переживается как напряжение, тревога, отчаяние, гнев, которые охватывают человека, когда на пути к достижению цели он встречается с неожиданными помехами, которые мешают удовлетворению потребности.
Фрустрация создает, таким образом, наряду с исходной мотивацией новую, защитную мотивацию, направленную на преодоление возникшего препятствия. Прежняя и новая мотивация реализуются в эмоциональных реакциях.
Самой распространенной реакцией на фрустрацию является возникновение генерализованной агрессивности, направленной чаще всего на препятствия. Адекватная реакция на препятствие состоит в том, чтобы преодолеть или обойти его, если это возможно; агрессивность, быстро переходящая в гнев, проявляется в бурных и неадекватных реакциях: оскорбление, физические нападки на человека (щипать, бить, толкать) или объект (сломать его).
Отступление иуход. В некоторых случаях субъект реагирует на фрустрацию уходом (например, выходит из комнаты), сопровождаемый агрессивностью, которая не проявляется открыто.
Фрустрация влечет за собой эмоциональные нарушения лишь тогда, когда возникает препятствие для сильной мотивации.Если у ребенка, начавшего пить, отнять соску, он реагирует гневом, однако в конце сосания — никаких эмоциональных проявлений.
4. Допустим, произошла ссора или какое-то неприятное событие: человек возбужден, не может найти себе места, его гложет несправедливая обида, досада из-за того, что не сумел себя правильно повести, не нашел слов. Он и рад бы отвлечься от этих мыслей, но снова и снова перед глазами встают сцены случившегося; и опять накатывает волна обиды, негодования. Можно выделить три физиологических механизмаподобного стресса.
Во-первых, в коре головного мозга сформировался интенсивный стойкий очаг возбуждения, так называемая доминанта, которая подчиняет себе всю деятельность организма, все поступки и помыслы человека. Значит, для успокоения надо ликвидировать, разрядить эту доминанту или же создать новую, конкурирующую. Все отвлекающие приемы (чтение захватывающего романа, просмотр кинофильма, переключение на занятие любимым делом) фактически направлены на формирование конкурирующей доминанты. Чем увлекательнее дело, на которое пытается переключиться расстроенный человек, тем ему легче создать конкурирующую доминанту. Вот почему каждому из нас не помешает иметь какое-то хобби, которое открывает путь положительным эмоциям.
Значит, для успокоения надо ликвидировать, разрядить эту доминанту или же создать новую, конкурирующую. Все отвлекающие приемы (чтение захватывающего романа, просмотр кинофильма, переключение на занятие любимым делом) фактически направлены на формирование конкурирующей доминанты. Чем увлекательнее дело, на которое пытается переключиться расстроенный человек, тем ему легче создать конкурирующую доминанту. Вот почему каждому из нас не помешает иметь какое-то хобби, которое открывает путь положительным эмоциям.
Во-вторых, вслед за появлением доминанты развивается особая цепная реакция — возбуждается одна из глубинных структур мозга — гипоталамус, который заставляет близлежащую особую железу — гипофиз — выделить в кровь большую порцию адренокортикотропного гормона (АКТГ). Под влиянием АКТГ надпочечники выделяют адреналин и другие физиологически активные вещества (гормоны стресса), которые вызывают многосторонний эффект: сердце начинает сокращаться чаще и сильнее (вспомним, как оно «выскакивает» из груди при страхе, волнении, гневе), кровяное давление повышается (вот почему может разболеться голова, возникнуть сердечный приступ, становится чаще дыхание). В эту фазу подготавливаются условия для интенсивной мышечной нагрузки. Но современный человек, в отличие от первобытного, вслед за стрессом обычно не пускает в ход скопившуюся мышечную энергию, поэтому у него в крови еще долго циркулируют биологически активные вещества, которые не дают успокоиться ни нервной системе, ни внутренним органам. Необходимо нейтрализовать гормоны стресса, и лучший помощник здесь — физкультура, интенсивная мышечная нагрузка.
В эту фазу подготавливаются условия для интенсивной мышечной нагрузки. Но современный человек, в отличие от первобытного, вслед за стрессом обычно не пускает в ход скопившуюся мышечную энергию, поэтому у него в крови еще долго циркулируют биологически активные вещества, которые не дают успокоиться ни нервной системе, ни внутренним органам. Необходимо нейтрализовать гормоны стресса, и лучший помощник здесь — физкультура, интенсивная мышечная нагрузка.
В-третьих, из-за того, что стрессовая ситуация сохраняет свою актуальность (конфликт ведь не разрешился благополучно и какая-то потребность так и осталась неудовлетворенной, иначе не было бы отрицательных эмоций), в кору головного мозга вновь и вновь поступают импульсы, поддерживающие активность доминанты, а в кровь продолжают выделяться гормоны стресса. Следовательно, надо снизить для себя значимость этого несбывшегося желания или же отыскать путь для его реализации. Оптимальный способ избавления от затянувшегося стресса — полностью разрешить конфликт, устранить разногласия, помириться. Если сделать это невозможно, следует логически переоценить значимость конфликта, например, поискать оправдания для своего обидчика. Можно выделить различные способы снижения значимости конфликта. Первый из них можно охарактеризовать словом «зато». Суть его — суметь извлечь пользу, что-то положительное даже из неудачи. Второй прием успокоения — доказать себе, что «могло быть и хуже». Сравнение собственных невзгод с чужим еще большим горем («а другому гораздо хуже») позволяет стойко и спокойно отреагировать на неудачу. Интересный способ успокоения по типу «зелен виноград»: подобно лисице из басни сказать себе, что «то, к чему только что безуспешно стремился, не так уж хорошо, как казалось, и потому этого мне не надо».
Если сделать это невозможно, следует логически переоценить значимость конфликта, например, поискать оправдания для своего обидчика. Можно выделить различные способы снижения значимости конфликта. Первый из них можно охарактеризовать словом «зато». Суть его — суметь извлечь пользу, что-то положительное даже из неудачи. Второй прием успокоения — доказать себе, что «могло быть и хуже». Сравнение собственных невзгод с чужим еще большим горем («а другому гораздо хуже») позволяет стойко и спокойно отреагировать на неудачу. Интересный способ успокоения по типу «зелен виноград»: подобно лисице из басни сказать себе, что «то, к чему только что безуспешно стремился, не так уж хорошо, как казалось, и потому этого мне не надо».
Один из лучших способов успокоения — это общение с близким человеком, когда можно, во-первых, как говорят, «излить душу», т. е. разрядить очаг возбуждения; во-вторых, переключиться на интересную тему; в-третьих, совместно отыскать путь к благополучному разрешению конфликта или хотя бы к снижению его значимости.
Иногда однажды пережитый сильный страх в какой-либо ситуации закрепляется, становится хроническим, навязчивым — возникает фобия на определенный круг ситуаций или объектов. Для устранения фобий разработаны специальные психологические приемы (в рамках нейролингвистического программирования).
Эмоционально окрашенное отношение к делу способствует его результативности, но при слишком сильной заинтересованности в результатах человек испытывает волнение, тревогу, излишнее возбуждение, неприятные вегетативные реакции. Для достижения оптимального эффекта в деятельности и для исключения неблагоприятных последствий перевозбуждения желательно снять эмоциональную напряженность на основе концентрации внимания не на значимости результата, а на анализе причин, технических деталях задания и тактических приемах.
Для создания оптимального эмоционального состояния нужны:
1) правильная оценка значимости события;
2) достаточная информированность (разноплановая) по данному вопросу, событию;
3) запасные отступные стратегии — это снижает излишнее возбуждение, уменьшает страх получить неблагоприятное решение, создает оптимальный фон для решения проблемы. В случае поражения можно произвести общую переоценку значимости ситуации по типу «не очень-то и хотелось». Понижение субъективной значимости события помогает отойти на заранее подготовленные позиции и готовиться к следующему штурму без значительных потерь здоровья. Не случайно в глубокой древности на Востоке люди просили в своей молитве: «Господи, дай мне мужество, чтобы справиться с тем, что я могу сделать, дай мне силы, чтобы смириться с тем, что я не могу сделать, и дай мне мудрость, чтобы отличить одно от другого».
В случае поражения можно произвести общую переоценку значимости ситуации по типу «не очень-то и хотелось». Понижение субъективной значимости события помогает отойти на заранее подготовленные позиции и готовиться к следующему штурму без значительных потерь здоровья. Не случайно в глубокой древности на Востоке люди просили в своей молитве: «Господи, дай мне мужество, чтобы справиться с тем, что я могу сделать, дай мне силы, чтобы смириться с тем, что я не могу сделать, и дай мне мудрость, чтобы отличить одно от другого».
Когда человек находится в состоянии сильного возбуждения, успокаивать его бывает бесполезно, лучше помочь ему разрядить эмоцию, дать ему выговориться до конца.
Когда человек выговорится, его возбуждение снижается, и в этот момент появляется возможность разъяснить ему что-либо, успокоить, направить его. Потребность разрядить эмоциональную напряженность в движении иногда проявляется в том, что человек мечется по комнате, рвет что-то. Для того, чтобы быстрее нормализовать свое состояние после неприятностей, полезно дать себе усиленную физическую нагрузку. Для экстренного понижения уровня напряжения может быть использовано общее расслабление мускулатуры; мышечное расслабление несовместимо с ощущением беспокойства. Методы релаксации, аутогенной тренировки очень полезны, когда нужно быстро, за 5—10 минут, привести себя в спокойное хорошее состояние. Эмоциями можно управлять и путем регуляции внешнего их проявления: если хотите легче переносись боль, старайтесь ее не демонстрировать.
Для экстренного понижения уровня напряжения может быть использовано общее расслабление мускулатуры; мышечное расслабление несовместимо с ощущением беспокойства. Методы релаксации, аутогенной тренировки очень полезны, когда нужно быстро, за 5—10 минут, привести себя в спокойное хорошее состояние. Эмоциями можно управлять и путем регуляции внешнего их проявления: если хотите легче переносись боль, старайтесь ее не демонстрировать.
Важный способ снятия психического напряжения — это активизация чувства юмора. Как считал С. Л. — Рубинштейн, суть чувства юмора не в том, чтобы видеть и чувствовать комическое там, где оно есть, а в том, чтобы воспринимать как комическое то, что претендует быть серьезным, т.е. суметь отнестись к чему-то волнующему как малозначащему и недостойному серьезного внимания, суметь улыбнуться или рассмеяться в трудной ситуации. Спех приводит к падению тревожности; когда человек отсмеялся, то его мышцы менее напряжены (релаксация) и сердцебиение нормализовано. По своей функциональной значимости смех так могущественен, что Франк называл его даже «стационарным бегом трусцой».
По своей функциональной значимости смех так могущественен, что Франк называл его даже «стационарным бегом трусцой».
Физиология стресса и управление им
Физиология стресса и управление им- Душьянт Кумар Шарма 1*
- 1 Факультет зоологии Государственного модельного научного колледжа, Гвалиор, Мадхья-Прадеш, Индия
Душьянт Кумар Шарма
Кафедра зоологии, Государственный модельный научный колледж, Гвалиор, Мадхья-Прадеш, Индия
Тел.: +91 70641,
Электронная почта: [email protected]
Дата получения : 23 февраля 2018 г.
Дата принятия : 26 апреля 2018 г.
Дата публикации : 10 мая 2018 г.
DOI: 10. 24966/MSR-5657/100001
24966/MSR-5657/100001
Abstract
Сегодня стресс стал серьезной проблемой. Большинство людей можно увидеть в состоянии стресса. Даже маленькие дети не являются исключением. Важно понимать физиологию стресса, если мы хотим справиться со стрессом. Реакция на стресс включает в себя участие как нервной, так и эндокринной систем. Хотя исследования стресса дали бесценную информацию и расширили наше понимание физиологических и метаболических осложнений стресса. Стресс влияет на большинство систем организма. Хотя управление стрессом по-прежнему остается большой проблемой, мы можем справиться со стрессом, внеся небольшие изменения в свой образ жизни.
Ключевые слова
АКТГ; Кортикоиды; ось HPA; стресс; стрессор; Гормоны стресса
Введение
Слово «стресс» известно каждому. Мы часто используем этот термин в повседневной жизни. Стресс – это не ситуация или состояние во время неблагоприятного состояния, как это принято считать.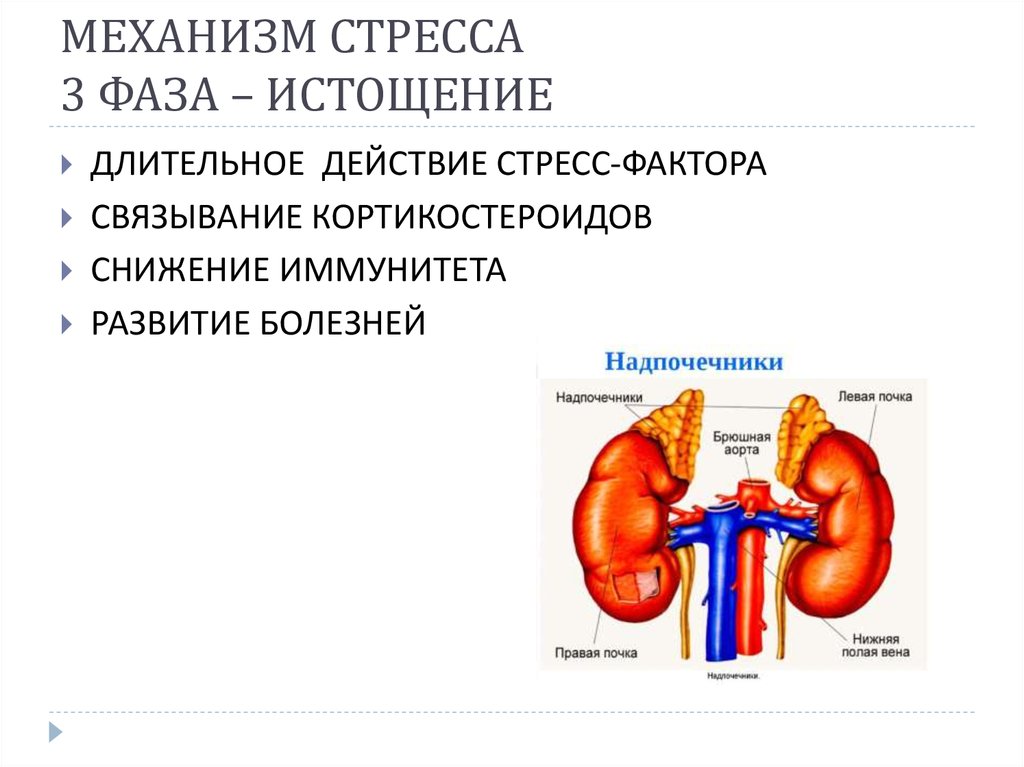 На самом деле это способ, с помощью которого тело преодолевает сложную или нежелательную ситуацию. Всякий раз, когда мы находимся в каком-то неблагоприятном состоянии (физическом или психическом), наше тело пытается сохранить гомеостаз (внутреннюю среду) и защитить себя от таких событий, принимая некоторые «изменения». Стресс — это серия событий, которым следует наше тело, чтобы справиться с такими ситуациями. Селье использовал термин «стресс» для обозначения последствий всего, что серьезно угрожает гомеостазу организма [1]. На гомеостаз организма влияют как внешние, так и внутренние факторы.
На самом деле это способ, с помощью которого тело преодолевает сложную или нежелательную ситуацию. Всякий раз, когда мы находимся в каком-то неблагоприятном состоянии (физическом или психическом), наше тело пытается сохранить гомеостаз (внутреннюю среду) и защитить себя от таких событий, принимая некоторые «изменения». Стресс — это серия событий, которым следует наше тело, чтобы справиться с такими ситуациями. Селье использовал термин «стресс» для обозначения последствий всего, что серьезно угрожает гомеостазу организма [1]. На гомеостаз организма влияют как внешние, так и внутренние факторы.
Хотя стресс обычно ассоциируется с неприятными состояниями и переживаниями, это не всегда так. Стресс — это просто реакция на физические и эмоциональные потребности. Всякий раз, когда мы чувствуем стресс, это обычно означает, что требования ситуации превышают все наши доступные ресурсы. Обычно, когда мы говорим о стрессе в нашей жизни, мы имеем в виду «стрессоры».
Любой фактор или событие, вызывающее стресс, называется стрессором.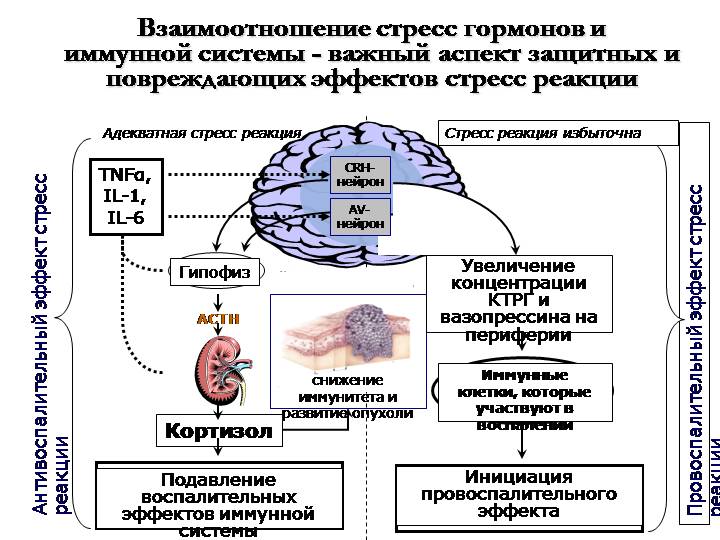 Стрессоры могут быть разных типов: физические или физиологические изменения в организме, изменения в окружающей среде, жизненные события или поведение. Даже нереальная (воображаемая) ситуация может выступать стрессором и быть причиной стресса. На самом деле в большинстве случаев именно воображение является причиной стресса. Следовательно, очень важно, как мы воспринимаем событие или ситуацию.
Стрессоры могут быть разных типов: физические или физиологические изменения в организме, изменения в окружающей среде, жизненные события или поведение. Даже нереальная (воображаемая) ситуация может выступать стрессором и быть причиной стресса. На самом деле в большинстве случаев именно воображение является причиной стресса. Следовательно, очень важно, как мы воспринимаем событие или ситуацию.
ВИДЫ СТРЕССА
В зависимости от характера, продолжительности и воздействия на организм стресс можно разделить на несколько категорий:
- Хороший и плохой стресс
- Все ли виды стресса вредны или негативно влияют на организм. Ответ — нет». Все виды стресса не вредны. Есть стрессоры, которые могут быть веселыми, захватывающими и мотивирующими. Такие стрессы, обычно называемые хорошим стрессом или эустрессом, не только помогают восстановить нашу энергию, но также улучшают работу сердца и повышают нашу выносливость и силу. Они обостряют наше мышление и повышают умственные способности.
 С другой стороны, дистресс — это стресс, который оказывает негативное или плохое воздействие на организм. Именно стресс вызывает тревогу или чувство неудовольствия. Стресс обычно негативно влияет на нашу работоспособность и может привести к психическим и физическим проблемам.
С другой стороны, дистресс — это стресс, который оказывает негативное или плохое воздействие на организм. Именно стресс вызывает тревогу или чувство неудовольствия. Стресс обычно негативно влияет на нашу работоспособность и может привести к психическим и физическим проблемам. - Острый стресс, эпизодический стресс и хронический стресс
- Острый стресс — это стресс, возникающий в течение короткого периода времени. Он быстро появляется и также быстро проходит. Обычно он недолговечен. Острый стресс обычно проявляется такими симптомами, как гнев, тревога, раздражительность и острые периоды депрессии. Некоторое время это может принести острые ощущения, удовольствие и волнение в нашей жизни. Когда острый стресс ощущается слишком часто, его называют эпизодическим стрессом. Эпизодический острый стресс у некоторых людей возникает из-за череды стрессовых ситуаций, возникающих одно за другим в их жизни. Когда стресс сохраняется в течение длительного времени, его называют хроническим стрессом.
 Хронический стресс возникает в результате длительного воздействия стрессоров. Хронические стрессоры могут быть не такими сильными, как острые стрессоры, но они более вредны, чем острые стрессоры. Это связано с тем, что следствием хронического стресса является накопленное воздействие стрессора в течение длительного времени. Хронический стресс влияет не только на физическое здоровье, но и на психическое здоровье. Эффекты возникают из-за накопленного стресса.
Хронический стресс возникает в результате длительного воздействия стрессоров. Хронические стрессоры могут быть не такими сильными, как острые стрессоры, но они более вредны, чем острые стрессоры. Это связано с тем, что следствием хронического стресса является накопленное воздействие стрессора в течение длительного времени. Хронический стресс влияет не только на физическое здоровье, но и на психическое здоровье. Эффекты возникают из-за накопленного стресса.
РЕАКЦИЯ НА СТРЕСС
Всякий раз, когда организм подвергается воздействию стрессора, который может быть реальным или только воображаемым, возникает реакция, направленная на его преодоление. Реакция не одинакова у всех людей. Помимо интенсивности и продолжительности стрессора, на реакцию на стресс также влияют несколько других факторов, таких как возраст, пол, личность, физическое и психическое здоровье и прошлый опыт человека. Ганс Селье разработал общий адаптационный синдром (GAS) — характеристику того, как организмы реагируют на стресс [1]. В реакции на стресс выделяют три стадии: 1. Тревога, 2. Адаптация и 3. Истощение или восстановление. Тревога — это первая стадия, которая включает в себя реакцию «бей или беги». Это этап, который позволяет нам справляться с трудными (неблагоприятными) ситуациями. Тело готово либо столкнуться с предполагаемой угрозой, либо убежать от нее. Эта стадия вызывает различные реакции в организме, такие как выброс гормонов стресса: кортизола, ни адреналина, ни адреналина из надпочечников, учащение пульса, повышение уровня сахара в крови, повышение артериального давления и т. д.
В реакции на стресс выделяют три стадии: 1. Тревога, 2. Адаптация и 3. Истощение или восстановление. Тревога — это первая стадия, которая включает в себя реакцию «бей или беги». Это этап, который позволяет нам справляться с трудными (неблагоприятными) ситуациями. Тело готово либо столкнуться с предполагаемой угрозой, либо убежать от нее. Эта стадия вызывает различные реакции в организме, такие как выброс гормонов стресса: кортизола, ни адреналина, ни адреналина из надпочечников, учащение пульса, повышение уровня сахара в крови, повышение артериального давления и т. д.
Если стрессовая ситуация не разрешена, организм использует все свои ресурсы (например, непрерывную секрецию гормонов стресса для обеспечения энергией, необходимой для преодоления ситуации), чтобы адаптироваться к стрессовой ситуации. Это этап адаптации. Это приводит к различным типам физических (проблемы со сном, общая усталость, мышечные боли, несварение желудка, аллергии, легкие инфекции, такие как простуда и т.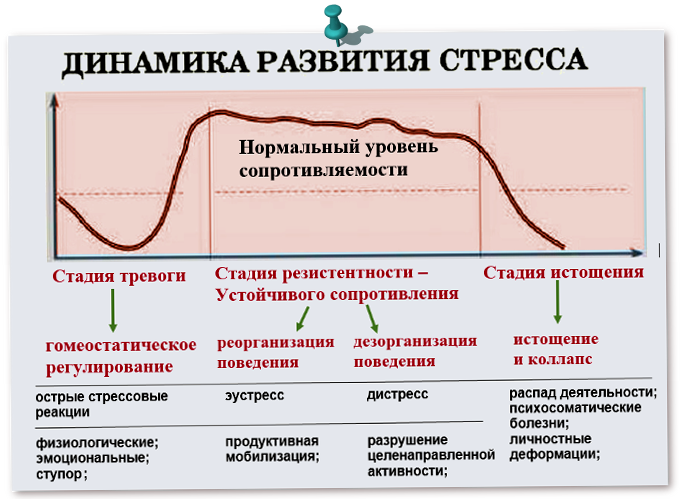 д.), психических (отсутствие концентрации внимания), эмоциональных (нетерпеливость и раздражительность) и поведенческих проблем (курение и питьевой).
д.), психических (отсутствие концентрации внимания), эмоциональных (нетерпеливость и раздражительность) и поведенческих проблем (курение и питьевой).
Если компенсаторным механизмам организма удалось преодолеть воздействие стрессора, наступает стадия восстановления. Но если организм исчерпал свои ресурсы и не в состоянии поддерживать нормальную функцию, это приводит к стадии истощения. Если стадия истощения сохраняется в течение длительного времени, это может привести к долгосрочным последствиям, когда человек рискует пострадать от более серьезных заболеваний. Это может привести к депрессии, гипертонии и коронарным заболеваниям.
МЕХАНИЗМ СТРЕССА
После стрессового события организм действует на разных уровнях, чтобы справиться со стрессором. Это достигается за счет двух основных изменений в теле: 1. изменение характера/объема высвобождения энергии и 2. изменение распределения энергии. Происходит несколько событий, которые приводят к этим изменениям. Все такие события в совокупности называются стрессом или реакцией на стресс. Стресс является многомерным явлением, затрагивающим как нервную, так и эндокринную системы.
Стресс является многомерным явлением, затрагивающим как нервную, так и эндокринную системы.
Первым шагом в реакции на стресс является восприятие угрозы (стрессора). Всякий раз, когда есть какой-то стресс — реальный или воображаемый, он действует на уровне мозга. В мозгу именно гипоталамус воспринимает стрессор. Когда гипоталамус сталкивается с угрозой, он выполняет некоторые специфические функции: 1. активирует вегетативную нервную систему (ВНС) 2. стимулирует ось гипоталамо-гипофизарно-надпочечниковая (ГГН) путем высвобождения кортикотропин-рилизинг-гормона (КРГ) и 3. секретирует аргинин-вазопрессин (антидиуретический гормон АДГ) . Вегетативная нервная система состоит из симпатической (возбужденной) и парасимпатической (расслабленной) нервной системы. ВНС регулирует внутреннюю деятельность, такую как кровообращение, пищеварение, дыхание, регулирование температуры и некоторые жизненно важные органы.
Симпатическая система отвечает за реакцию бегства или бегства. В ответ на стрессор в различных нервных синапсах высвобождаются катехоламины: адреналин (адреналин) и норэпинефрин (норадреналин).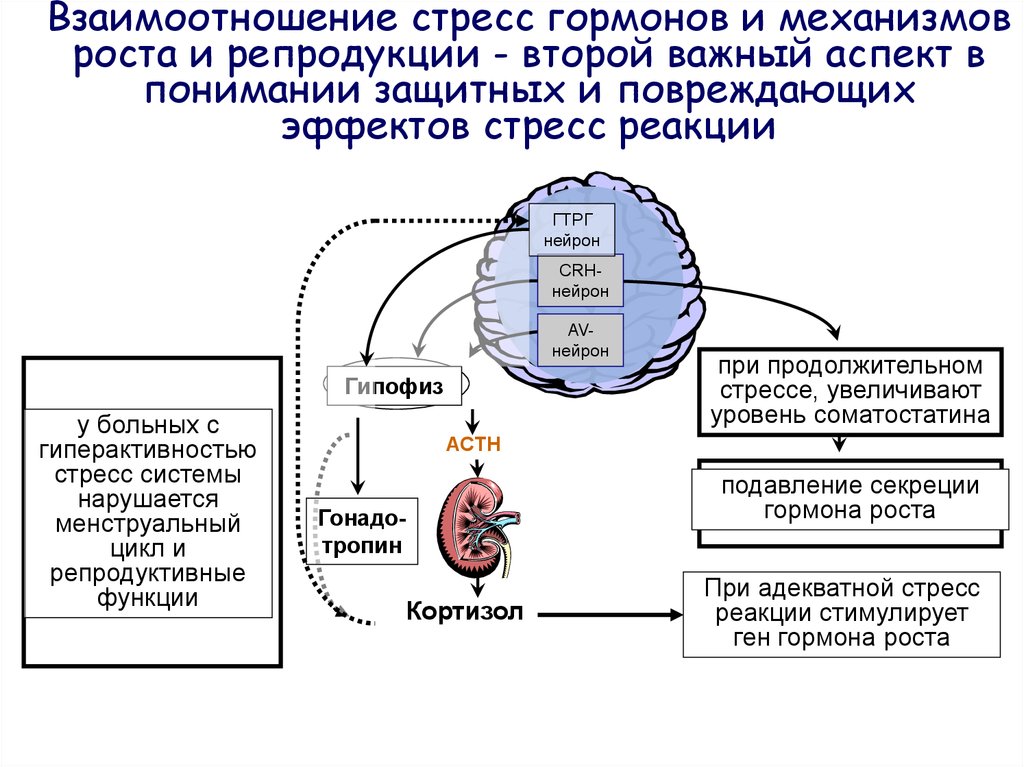 Высвобождение этих катехоламинов вызывает несколько изменений, таких как увеличение частоты сердечных сокращений и силы сокращения миокарда, вазодилатацию артерий во всех работающих мышцах и сужение артерий в неработающих мышцах; расширение зрачка и бронхов и снижение пищеварительной деятельности в организме. Все эти изменения необходимы для подготовки организма к реакции «бей или беги». Эффекты этих гормонов — эпинефрина и норэпинефрина длятся несколько секунд. Функции парасимпатической нервной системы противоположны функциям симпатической нервной системы и способствуют сохранению энергии и расслаблению.
Высвобождение этих катехоламинов вызывает несколько изменений, таких как увеличение частоты сердечных сокращений и силы сокращения миокарда, вазодилатацию артерий во всех работающих мышцах и сужение артерий в неработающих мышцах; расширение зрачка и бронхов и снижение пищеварительной деятельности в организме. Все эти изменения необходимы для подготовки организма к реакции «бей или беги». Эффекты этих гормонов — эпинефрина и норэпинефрина длятся несколько секунд. Функции парасимпатической нервной системы противоположны функциям симпатической нервной системы и способствуют сохранению энергии и расслаблению.
CRH действует на переднюю долю гипофиза, эндокринную железу, расположенную в головном мозге. Гипофиз также называют «главной железой», так как он контролирует секрецию других эндокринных желез в организме. При стимуляции КРГ передняя доля гипофиза секретирует адренокортикотропный гормон (АКТГ). Согласно Scantamburlo et al., аргинин-вазопрессин модулирует действие КРГ на секрецию АКТГ [2].
АКТГ, высвобождаемый передней долей гипофиза в ответ на КРГ, стимулирует надпочечники, расположенные в почках. Есть две части надпочечников — внешняя часть, называемая корой, и внутренняя часть, известная как мозговое вещество.
АКТГ стимулирует кору надпочечников к высвобождению кортикоидов (глюкокортикоидов и минералокортикоидов). Основная функция глюкокортикоидов заключается в высвобождении энергии, необходимой для борьбы с неблагоприятными последствиями стрессора. Энергия высвобождается при превращении гликогена в глюкозу (гликогенолиз), а также при расщеплении жиров на жирные кислоты и глицерин (липолиз). В дополнение к этому кортикоиды имеют несколько других функций, таких как: увеличение выработки мочевины, подавление аппетита, подавление иммунной системы, обострение раздражения желудка, связанное с ним чувство депрессии и потеря контроля. Эти симптомы обычно наблюдаются у человека, находящегося в состоянии стресса. Минералокортикоиды (альдостерон) способствуют задержке Na+ и выведению K+.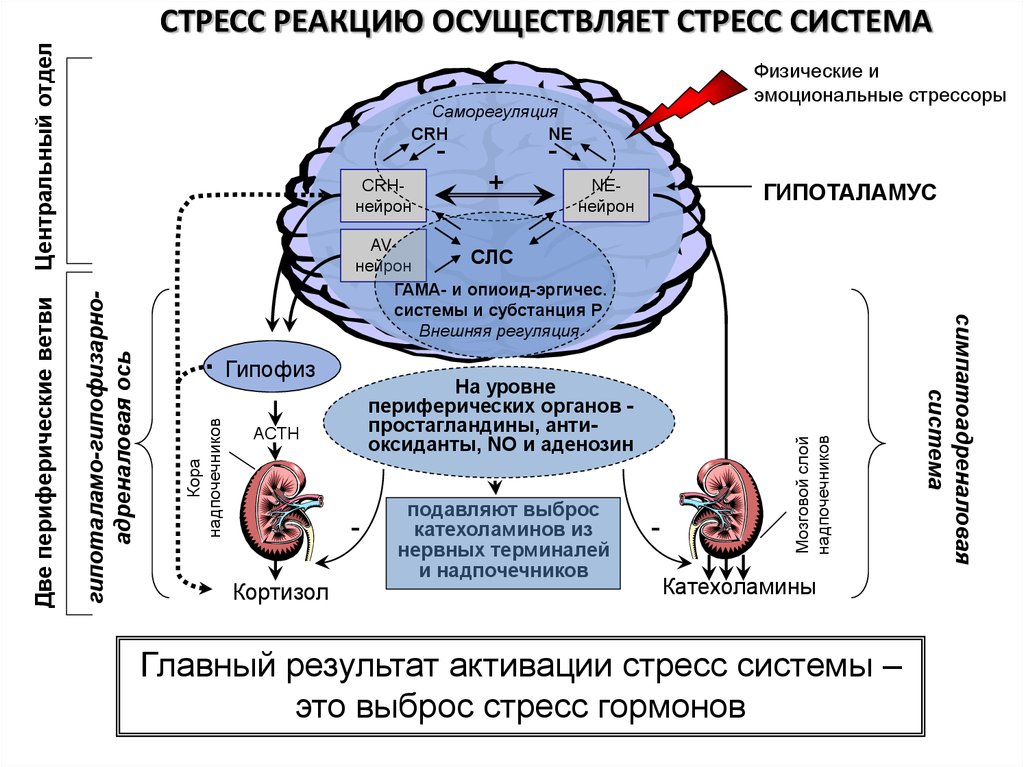 Он повышает кровяное давление за счет увеличения объема крови. Мозговое вещество надпочечников секретирует адреналин и норадреналин. Функции этих гормонов такие же, как у гормонов, выделяемых нервными окончаниями симпатической нервной системы. Эти гормоны, выделяемые мозговым веществом надпочечников, усиливают функции симпатической нервной системы. Высвобождение этих гормонов из мозгового вещества надпочечников действует как резервная система, обеспечивающая наиболее эффективные средства физического выживания. Эффекты, вызываемые адреналином и норэпинефрином в симпатической нервной системе, можно назвать немедленными эффектами, а эффекты, вызываемые эффектами мозгового вещества надпочечников, — промежуточными эффектами.
Он повышает кровяное давление за счет увеличения объема крови. Мозговое вещество надпочечников секретирует адреналин и норадреналин. Функции этих гормонов такие же, как у гормонов, выделяемых нервными окончаниями симпатической нервной системы. Эти гормоны, выделяемые мозговым веществом надпочечников, усиливают функции симпатической нервной системы. Высвобождение этих гормонов из мозгового вещества надпочечников действует как резервная система, обеспечивающая наиболее эффективные средства физического выживания. Эффекты, вызываемые адреналином и норэпинефрином в симпатической нервной системе, можно назвать немедленными эффектами, а эффекты, вызываемые эффектами мозгового вещества надпочечников, — промежуточными эффектами.
Основная функция вазопрессина или АДГ, синтезируемого гипоталамусом и высвобождаемого задней долей гипофиза, заключается в регулировании потери жидкости через мочевыводящие пути. Это достигается реабсорбцией воды. Кроме того, АДГ также играет заметную роль в регуляции кровяного давления во время стресса, когда нарушается гомеостаз организма. В дополнение к высвобождению энергии вторым важным изменением, происходящим во время стресса, является распределение энергии к определенному органу, который больше всего в ней нуждается. Это достигается повышением артериального давления. Это происходит либо за счет увеличения сердечного выброса, либо за счет сужения кровеносных сосудов.
В дополнение к высвобождению энергии вторым важным изменением, происходящим во время стресса, является распределение энергии к определенному органу, который больше всего в ней нуждается. Это достигается повышением артериального давления. Это происходит либо за счет увеличения сердечного выброса, либо за счет сужения кровеносных сосудов.
В дополнение к оси HPA некоторые другие гормоны, такие как гормон роста (GH) и гормоны щитовидной железы, также играют важную роль в стрессе. Гормон роста представляет собой пептидный гормон, выделяемый передней долей гипофиза. ГР — гормон стресса, повышающий концентрацию глюкозы и свободных жирных кислот [3]. Было замечено, что у людей психологические стимулы повышают концентрацию гормонов щитовидной железы [4,5]. Щитовидная железа выделяет тироксин и трийодтиронин. Эти гормоны также играют важную роль при стрессе [4]. Основная функция гормонов щитовидной железы заключается в повышении общей скорости метаболизма или базовой скорости метаболизма (BMR). Тироксин также увеличивает частоту сердечных сокращений, а также чувствительность некоторых тканей к катехоламинам.
Тироксин также увеличивает частоту сердечных сокращений, а также чувствительность некоторых тканей к катехоламинам.
Хотя серотонин и мелатонин не считаются гормонами стресса, они связаны с настроением. Считается, что снижение уровня этих гормонов связано с депрессией.
ВОЗДЕЙСТВИЕ СТРЕССА НА ОРГАНИЗМ
- Когда организм не в состоянии справиться со стрессом или если стресс сохраняется в течение длительного времени (хронический стресс), он влияет на организм несколькими способами. Последствия стресса не ограничиваются одним или двумя органами или системами. Стресс влияет на организм разными способами. Стресс влияет как на физическое, так и на психическое здоровье. Воздействие стресса на организм может быть не одинаковым у всех людей. Это может варьироваться в зависимости от таких факторов, как генотип, пол, возраст, физиологические состояния и прошлый опыт человека. Но некоторые из этих эффектов являются общими для каждого человека. Большинство эффектов связано с повышением концентрации кортикоидов и адреналина.
 Некоторые основные эффекты на системы организма:
Некоторые основные эффекты на системы организма: - Влияние на пищеварительную систему
- Нарушение пищевых привычек, кислотный рефлюкс, диарея или запор — общие симптомы, наблюдаемые у людей, подвергающихся стрессу. Стресс также может быть связан с ожирением, которое связано с множеством других проблем со здоровьем. Хотя нет четких доказательств того, что стрессовые жизненные события способствуют развитию диабета у детей или взрослых, гормональные изменения, происходящие при остром и хроническом стрессе, могут влиять на гомеостаз глюкозы как у здоровых людей, так и у больных диабетом. В нескольких исследованиях сообщалось об отрицательном влиянии острого стресса на поддержание концентрации глюкозы в крови у больных сахарным диабетом 1 и 2 типа [6].
- Экстремальный стресс также может быть связан с диабетом. Это связано с тем, что чрезмерный кортизол может влиять на активность инсулина. Организм также может стать устойчивым к инсулину. Это может привести к диабету.

- Влияние на нарушения кровообращения
- Несколько исследований показали сильную связь между стрессом и сердечно-сосудистыми заболеваниями [7-10]. По данным Esch et al., стресс играет значительную роль в прогрессировании восприимчивости и исходе сердечно-сосудистых заболеваний [8]. Психологические стрессы связаны с сердечно-сосудистыми заболеваниями настолько, что сердечно-сосудистые заболевания относятся к важнейшей группе психосоматических заболеваний [10]. Сердечно-сосудистые заболевания, вызванные стресс-индуцированными механизмами, опосредованы, прежде всего, усилением адренергической стимуляции [11]. И адреналин, и кортизол (увеличение во время стресса) влияют на сердце и кровяное давление. Слишком много адреналина повышает кровяное давление, что, в свою очередь, влияет на работу сердца, так как сердце должно работать сильнее и быстрее. Это может привести к ишемической болезни сердца, инсультам и внезапной остановке сердца. Сообщалось, что стресс является предиктором случаев ишемической болезни сердца (ИБС) и гипертонии как у мужчин, так и у женщин [12,13].
 По данным Tropy и соавт., стресс может вызывать повышение потребности организма в кислороде, спазм коронарных (сердечных) сосудов и электрическую нестабильность в проводящей системе сердца [14]. Хронический стресс также приводит к повышению уровня холестерина в крови. Постоянно высокий уровень холестерина и других жировых веществ в крови может вызвать атеросклероз, а иногда и стать причиной сердечного приступа. Кортизол также играет роль в накоплении брюшного жира, что приводит к ожирению. Профессиональный стресс также оказывает существенное влияние на возникновение ИБС [15].
По данным Tropy и соавт., стресс может вызывать повышение потребности организма в кислороде, спазм коронарных (сердечных) сосудов и электрическую нестабильность в проводящей системе сердца [14]. Хронический стресс также приводит к повышению уровня холестерина в крови. Постоянно высокий уровень холестерина и других жировых веществ в крови может вызвать атеросклероз, а иногда и стать причиной сердечного приступа. Кортизол также играет роль в накоплении брюшного жира, что приводит к ожирению. Профессиональный стресс также оказывает существенное влияние на возникновение ИБС [15]. - Подавление иммунной системы
- Постоянная активация оси гипоталамо-гипофизарно-надпочечниковая (ГГН) в ответ на хронический стресс, вероятно, ослабляет иммунный ответ, приводя к нескольким типам инфекций. Исследования показали, что люди, находящиеся в состоянии хронического стресса, более восприимчивы к вирусным заболеваниям, таким как грипп и простуда, а также к другим инфекциям [16].

- Высокий уровень гормонов стресса подавляет высвобождение химических цитокинов, секретируемых Th-клетками (Т-хелперные клетки – разновидность Т-лимфоцитов). Цитокины регулируют как клеточный, так и гуморальный иммунный ответ в организме. Два типа цитокинов высвобождаются из Th-клеток. Цитокины Th2 стимулируют цитотоксические Т-клетки и клетки-естественные киллеры, клетки, которые участвуют в непосредственном уничтожении внутриклеточных патогенов-мишеней (клеточно-опосредованный иммунный ответ), в то время как цитокины Th3 стимулируют В-клетки к выработке антител (гуморальный иммунный ответ). Хронический стресс может нарушить регуляцию цитокинов Th2 и Th3, что может привести к подавлению как клеточно-опосредованного, так и гуморального иммунного ответа [17]. В дополнение к Th2 и Th3 хронический стресс также влияет на провоспалительные цитокины, цитокины, участвующие в воспалительном процессе. Согласно Миллеру, стресс может продолжать стимулировать продукцию провоспалительных цитокинов на неопределенный срок.
 Провоспалительные цитокины возвращаются в ЦНС и вызывают симптомы усталости, недомогания, снижения аппетита и вялости, которые обычно ассоциируются с депрессией [18].
Провоспалительные цитокины возвращаются в ЦНС и вызывают симптомы усталости, недомогания, снижения аппетита и вялости, которые обычно ассоциируются с депрессией [18]. - Были также проведены исследования по изучению связи стресса со СПИДом. Leserman et al. обнаружили, что более быстрое прогрессирование СПИДа было связано с более высоким кумулятивным жизненным стрессом, использованием отрицания в качестве механизма выживания, более низкой удовлетворенностью социальной поддержкой и повышенным уровнем кортизола в сыворотке [19]. Согласно Ko?odzie, стресс или стрессовые жизненные события считаются важными с точки зрения воздействия на ключевые биологические маркеры вирусной нагрузки заболевания и количество клеток CD4 [20].
- Некоторые другие эффекты гормонов стресса
- В дополнение к вышеупомянутым эффектам кортизол также изменяет минеральную плотность костей, тем самым влияя на развитие новых костей в организме. У маленьких детей стресс может замедлить их рост.
 В некоторых случаях стресс также может быть причиной рака. Постоянная активация гипоталамо-гипофизарно-надпочечниковой системы (ГГН) при хроническом стрессе и депрессии, вероятно, ослабляет иммунный ответ и способствует развитию и прогрессированию некоторых видов рака [21]. Исследования показали, что стресс может способствовать колонизации костей клетками рака молочной железы.
В некоторых случаях стресс также может быть причиной рака. Постоянная активация гипоталамо-гипофизарно-надпочечниковой системы (ГГН) при хроническом стрессе и депрессии, вероятно, ослабляет иммунный ответ и способствует развитию и прогрессированию некоторых видов рака [21]. Исследования показали, что стресс может способствовать колонизации костей клетками рака молочной железы. - Стресс также влияет на репродуктивную систему как мужчин, так и женщин. Поскольку сексуальная жизнь зависит от состояния как тела, так и разума, хронический стресс может снизить либидо и даже вызвать эректильную дисфункцию или импотенцию у мужчин. В случае хронического стресса уровень тестостерона может упасть до такой степени, что это может повлиять на сперматогенез (выработку спермы). У женщин стресс может повлиять на менструальный цикл. Это может привести к нерегулярным, обильным или болезненным менструациям.
- Помимо прямого воздействия на здоровье, стресс также вызывает некоторые изменения в поведении.
 Люди, живущие в стрессовых условиях, более склонны к курению, что может привести к респираторным заболеваниям и даже к раку. Люди с аналогичным стрессом более уязвимы к употреблению алкоголя, что имеет свои последствия.
Люди, живущие в стрессовых условиях, более склонны к курению, что может привести к респираторным заболеваниям и даже к раку. Люди с аналогичным стрессом более уязвимы к употреблению алкоголя, что имеет свои последствия.
УПРАВЛЕНИЕ СТРЕССОМ
- Хотя полностью исключить стресс из жизни невозможно, но с ним можно справиться, выполнив несколько простых шагов.
- Первым шагом в борьбе со стрессом является выявление факторов, вызывающих стресс. Факторы не одинаковы у всех людей, но варьируются от человека к человеку. Например, «планирование новой работы» может вызывать стресс у одних людей, но не у других. Для большинства студентов экзамены сопровождаются большим стрессом. Некоторые люди имеют привычку очень серьезно относиться к вещам, и это может быть причиной стресса в их жизни. Семейные конфликты являются основной причиной стресса. Точно так же многие люди очень боятся столкнуться с любыми жизненными проблемами и попадают в беду всякий раз, когда им дают какую-либо сложную задачу.
 Некоторым людям трудно, когда им нужно путешествовать или даже когда им нужно посетить какую-то вечеринку или мероприятие. Поэтому очень важно знать, что вызывает стресс в вашей жизни. Как только вы определите источники, вы сможете планировать управление ими. Вы можете управлять своим уровнем стресса, внося небольшие изменения в свой распорядок дня и уделяя время себе. Вот некоторые изменения образа жизни:
Некоторым людям трудно, когда им нужно путешествовать или даже когда им нужно посетить какую-то вечеринку или мероприятие. Поэтому очень важно знать, что вызывает стресс в вашей жизни. Как только вы определите источники, вы сможете планировать управление ими. Вы можете управлять своим уровнем стресса, внося небольшие изменения в свой распорядок дня и уделяя время себе. Вот некоторые изменения образа жизни: - Проверьте свой рацион
- Правильное питание необходимо для поддержания психического и физического здоровья. Во время стресса ваши привычки в еде очень сильно нарушаются, и это может вызвать дефицит питательных веществ, который может еще больше нагрузить ваше тело. Стресс заставляет организм использовать больше питательных веществ, чем обычно, поэтому во время стресса требуется хорошая диета, потому что плохое питание может вызвать дефицит, ведущий к большему стрессу и проблемам со здоровьем. Сбалансированная диета с низким гликемическим индексом (ГИ) может поддерживать стабильный уровень сахара в крови и может помочь вам лучше справляться со стрессовыми ситуациями.
 Диета с низким гликемическим индексом помогает поддерживать стабильный уровень глюкозы, который необходим вашему мозгу, чтобы он мог эффективно работать и справляться с повседневной жизнью. Во время стресса гормон стресса снижает иммунитет, и организм становится более восприимчивым к простуде и другим инфекциям. Продукты, богатые витаминами и антиоксидантами, могут помочь вам укрепить вашу иммунную систему. Витамины B и D необходимы для здоровой иммунной системы во время стресса. Следовательно, сбалансированная диета, включающая молочные продукты с низким содержанием жира, свежие фрукты и овощи, бобовые, орехи, семена и достаточное количество воды, может помочь вам справиться с негативными последствиями стресса. Следует избегать «фаст-фудов», таких как пицца, гамбургер, выпечка и т. д., поскольку они не только повышают уровень холестерина в организме, но также могут привести к ожирению и различным заболеваниям.
Диета с низким гликемическим индексом помогает поддерживать стабильный уровень глюкозы, который необходим вашему мозгу, чтобы он мог эффективно работать и справляться с повседневной жизнью. Во время стресса гормон стресса снижает иммунитет, и организм становится более восприимчивым к простуде и другим инфекциям. Продукты, богатые витаминами и антиоксидантами, могут помочь вам укрепить вашу иммунную систему. Витамины B и D необходимы для здоровой иммунной системы во время стресса. Следовательно, сбалансированная диета, включающая молочные продукты с низким содержанием жира, свежие фрукты и овощи, бобовые, орехи, семена и достаточное количество воды, может помочь вам справиться с негативными последствиями стресса. Следует избегать «фаст-фудов», таких как пицца, гамбургер, выпечка и т. д., поскольку они не только повышают уровень холестерина в организме, но также могут привести к ожирению и различным заболеваниям. - Сделайте регулярные физические упражнения частью своей жизни
- Активный образ жизни не только снижает уровень стресса, но и помогает ослабить его.
 Есть несколько способов, которыми упражнения помогают. Упражнения — один из самых распространенных и самых простых способов снижения стресса. Регулярные физические упражнения — это способ оставаться физически и умственно активным и здоровым. Физические упражнения не только снижают уровень гормонов стресса — адреналина и кортизола, высвобождаемых во время реакции на стресс, но также стимулируют выработку серотонина и эндорфинов, которые помогают снять стресс и улучшить настроение. Физические упражнения расслабляют напряженные мышцы и расслабляют тело. Улучшает дыхание и помогает расслабиться. Для хорошего здоровья очень необходим крепкий сон. Когда вы занимаетесь физическими упражнениями, это утомляет вас физически, что приводит к крепкому сну. Хороший сон — это ключ к тому, чтобы избавиться от беспокойства и сохранять спокойствие. Упражнения делают вас активными, а активность — это способ расслабиться. Он избавляет от стрессов и напряжения повседневной жизни. Установлено, что люди, регулярно занимающиеся физическими упражнениями, менее подвержены стрессу.
Есть несколько способов, которыми упражнения помогают. Упражнения — один из самых распространенных и самых простых способов снижения стресса. Регулярные физические упражнения — это способ оставаться физически и умственно активным и здоровым. Физические упражнения не только снижают уровень гормонов стресса — адреналина и кортизола, высвобождаемых во время реакции на стресс, но также стимулируют выработку серотонина и эндорфинов, которые помогают снять стресс и улучшить настроение. Физические упражнения расслабляют напряженные мышцы и расслабляют тело. Улучшает дыхание и помогает расслабиться. Для хорошего здоровья очень необходим крепкий сон. Когда вы занимаетесь физическими упражнениями, это утомляет вас физически, что приводит к крепкому сну. Хороший сон — это ключ к тому, чтобы избавиться от беспокойства и сохранять спокойствие. Упражнения делают вас активными, а активность — это способ расслабиться. Он избавляет от стрессов и напряжения повседневной жизни. Установлено, что люди, регулярно занимающиеся физическими упражнениями, менее подвержены стрессу. Не всегда нужно ходить в спортзал для упражнений; даже ходьба — отличный способ улучшить свое психическое здоровье и общую физическую форму. Упражнения также снижают уровень холестерина и укрепляют иммунную систему. Регулярные физические упражнения улучшают работу сердца, легких и кровообращение.
Не всегда нужно ходить в спортзал для упражнений; даже ходьба — отличный способ улучшить свое психическое здоровье и общую физическую форму. Упражнения также снижают уровень холестерина и укрепляют иммунную систему. Регулярные физические упражнения улучшают работу сердца, легких и кровообращение. - Немного времени для медитации и йоги
- Медитация — это тренировка, направленная на то, чтобы сосредоточить свой разум на определенной мысли или объекте, что улучшает концентрацию и осознанность. Это очень мощный инструмент для борьбы со стрессом. Регулярная медитация вызывает глубокое физическое и умственное расслабление, тем самым обращая вспять последствия реакции организма на стресс, направленной на борьбу или бегство. Медитация помогает несколькими способами. Польза медитации широка и разнообразна. Он помогает замедлить сердечный ритм, расслабить мышцы, снять напряжение и активирует выброс серотонина и дофамина, так называемых «гормонов счастья». Сосредоточившись на своем дыхании, простая форма медитации помогает отвлечься от забот.
 Когда ваш разум отключается от ваших проблем, вы чувствуете себя расслабленным. Медитация может помочь вам освежить и перезарядить свое тело и позволит лучше контролировать свои мысли, заботы и тревоги.
Когда ваш разум отключается от ваших проблем, вы чувствуете себя расслабленным. Медитация может помочь вам освежить и перезарядить свое тело и позволит лучше контролировать свои мысли, заботы и тревоги. - Йога — важный метод совершенствования тела и разума. Регулярная практика йоги снимает мышечное напряжение, снижает кровяное давление и снижает уровень холестерина. Это отличная практика снятия стресса. Вы можете заниматься йогой, когда и где у вас есть время.
- Приятного общения в социальных сетях
- Сидеть наедине со своими проблемами никогда не поможет решить ваши проблемы. Это всегда будет увеличивать стресс в вашей жизни. С другой стороны, когда вы разговариваете с другими людьми, это не только отвлекает вас от ваших проблем, но и помогает вам найти решения. Всегда хорошо иметь хорошую социальную сеть семьи и друзей. У хороших друзей не всегда есть решение всех ваших проблем, но они определенно могут уберечь вас от ваших проблем. Хорошее общение, особенно между партнерами по жизни и членами семьи, очень важно для здоровых отношений, потому что плохое общение или разрыв в общении являются основной причиной конфликтов в семьях
- Всегда будь позитивным
- Именно ваше отношение определяет уровень стресса в вашей жизни.
 Это не событие, а то, как вы его интерпретируете, вызывает стресс. Позитивный настрой — лучший способ уменьшить стресс. В любой плохой ситуации всегда есть что-то хорошее. Важно то, что мы можем это обнаружить и сделать частью своей жизни. Если у вас есть эта способность, вы никогда не будете чувствовать стресс. Доказано, что смех снижает уровень гормонов стресса кортизола и адреналина, повышает уровень серотонина (гормона счастья) и высвобождает обезболивающие эндорфины. Он также расслабляет мышцы, снижает кровяное давление и укрепляет иммунную систему. Смех — это простой способ снять стресс.
Это не событие, а то, как вы его интерпретируете, вызывает стресс. Позитивный настрой — лучший способ уменьшить стресс. В любой плохой ситуации всегда есть что-то хорошее. Важно то, что мы можем это обнаружить и сделать частью своей жизни. Если у вас есть эта способность, вы никогда не будете чувствовать стресс. Доказано, что смех снижает уровень гормонов стресса кортизола и адреналина, повышает уровень серотонина (гормона счастья) и высвобождает обезболивающие эндорфины. Он также расслабляет мышцы, снижает кровяное давление и укрепляет иммунную систему. Смех — это простой способ снять стресс.
Заключение
Мы подвергаемся воздействию многих типов стрессоров, таких как физические, экологические, физиологические и психологические. Эти стрессоры вызывают различные типы стрессовых реакций в организме, включая психологические реакции, физиологические реакции и поведенческие реакции. Если такой стресс существует в течение длительного времени, он вызывает множество проблем со здоровьем, затрагивающих большинство систем организма. Хотя полностью избежать стресса в нашей жизни невозможно, с ним можно справиться, внеся небольшие изменения в свое отношение и образ жизни.
Хотя полностью избежать стресса в нашей жизни невозможно, с ним можно справиться, внеся небольшие изменения в свое отношение и образ жизни.
Ссылки
- Selye H (1956) Жизненный стресс. Американская психологическая ассоциация, Нью-Йорк, США.
- Scantamburlo G, Ansseau M, Legros JJ (2001) Роль нейрогипофиза в психологическом стрессе. Энцефал 27: 245-259.
- Ранабир С., Риту К. (2011) Стресс и гормоны. Indian J Endocrinol Metab 15: 18-22.
- Леви Л. (1972) 1 Введение: Психосоциальные стимулы, психофизиологические реакции и болезни. В: Готтфредссон М. (ред.). Лечение как профилактика гепатита С (TraP Hep C): общенациональная программа ликвидации в Исландии. Джей Стажер Мед 191: 11-27.
- Selye H (1980) Руководство Селье по исследованию стресса. Ван Ностранд Рейнхольд, Нью-Йорк, США.
- Markovecchio ML, Chiarelli F (2012) Влияние острого и хронического стресса на контроль диабета. Научный сигнал 5: 10.
- Cranny CJ, Smith PC, Stone EF (1992) Удовлетворенность работой: как люди относятся к своей работе и как это влияет на их производительность.
 Lexington Books, Лэнхем, Мэриленд, США.
Lexington Books, Лэнхем, Мэриленд, США. - Esch T, Stefano GB, Fricchione GL, Benson H (2002) Стресс при сердечно-сосудистых заболеваниях. Мед Наука Монит 8: 93-101.
- Бобко Н.А. (2007) Влияние стресса на деятельность сердечно-сосудистой системы у операторов преимущественно умственного труда в разное время суток и рабочей недели. Hum Physiol 33: 302-308.
- Golbidi S, Frisbee JC, Laher I (2015) Хронический стресс влияет на сердечно-сосудистую систему: модели животных и клинические результаты. Am J Physiol Heart Circ Physiol 308: 1476-1498.
- Энглер М.Б., Энглер М.М. (1995) Оценка влияния стресса на сердечно-сосудистую систему. J Cardiovasc Nurs 10: 51-63.
- Schnall PL, Landsbergis PA, Baker D (1994) Напряжение на работе и сердечно-сосудистые заболевания. Annu Rev Общественное здравоохранение 15: 381-411.
- Eaker ED (1998) Психосоциальные факторы риска ишемической болезни сердца у женщин. Кардиол Клин 16: 103-111.
- Torpy JM, Cassio L, Glass RM (2007) Хронический стресс и сердце.
 ДЖАМА 298: 1722.
ДЖАМА 298: 1722. - Fumio K (2004) Стресс на работе, инсульт и ишемическая болезнь сердца. JMAJ 47: 222-226.
- Коэн С., Дойл В.Дж., Сконер Д.П., Рабин Б.С., Гуолтни Дж.М. мл. (1997). Социальные связи и восприимчивость к простуде. ДЖАМА 277: 1940-1944 гг.
- Segerstrom SC, Miller GE (2004) Психологический стресс и иммунная система человека: метааналитическое исследование 30-летнего исследования. Psychol Bull 130: 601-630.
- Нил С., Айронсон Г., Сигел С.Д. (2008) Стресс и здоровье: психологические, поведенческие и биологические детерминанты. Annu Rev Clin Psychol 1: 607-628.
- Leserman J, Petitto JM, Golden RN, Gaynes BN, Gu H, et al. (2000) Влияние стрессовых жизненных событий, депрессии, социальной поддержки, преодоления трудностей и кортизола на развитие СПИДа. Am J Psychiatry 157: 1221-1228.
- Яцек К. (2016) Влияние стресса на прогрессирование ВИЧ-инфекции. Обзор ВИЧ и СПИДа 15: 13-16.
- Reiche EM, Nunes SO, Morimoto HK (2004)Стресс, депрессия, иммунная система и рак.
 Ланцет Онкол 5: 617-625.
Ланцет Онкол 5: 617-625.
© 2022, Copyrights Herald Scholarly Open Access. Все права защищены!
Нейрональные реакции на физиологический стресс
Введение
Стресс является неотъемлемым компонентом мира природы, который применим практически ко всем биологическим системам. Биологический стресс означает любое состояние, которое вынуждает живые системы отходить от физиологического устойчивого состояния, и его воздействие тесно связано с природой элементов, формирующих живые организмы. Поскольку стресс может применяться ко многим различным уровням биологической организации, этот термин до сих пор использовался во многих различных контекстах. «Физиологический стресс» называется первичным биологическим стрессом и может быть определен как любое внешнее или внутреннее состояние, которое нарушает гомеостаз клетки или организма. Принимая во внимание различные возможные источники биологического стресса, мы можем представить себе три различных аспекта физиологического стресса: стресс окружающей среды, внутренний стресс развития и старение (рис. 1).
1).
Рисунок 1. Различные аспекты физиологического стресса . Старение и стресс окружающей среды присутствуют на протяжении всей жизни, тогда как внутренний стресс развития проявляется только во время эмбрионального и постэмбрионального развития.
Экологический стресс
Биологические системы предназначены для развития и жизни в различных меняющихся условиях окружающей среды. В ходе эволюции было выработано множество различных приспособлений, обеспечивающих организмам способность не только выживать, но и размножаться в различных, часто враждебных условиях. Такие адаптации связаны с определенными структурами и поведением, адаптированным к конкретной среде. На молекулярном уровне существуют различные стратегии, которые используются клетками и системами для реагирования и адаптации к изменениям окружающей среды, таким как изменения доступности кислорода и колебания температуры. Изменения окружающей среды, превышающие определенные уровни, определяют «экологический стресс».
Внутренний стресс развития
Дополнительная причина физиологического стресса может быть связана с событиями развития. По мере развития живых организмов они сталкиваются с множеством проблем, связанных с морфогенезом и изменениями внутренней химии. Действительно, быстрое развитие зародышей вызывает массовые внутренние изменения организма по мере его роста и изменения морфологии. Различные события развития могут вызывать различные стрессовые состояния, причем некоторые из них более суровые, чем другие. Следовательно, адаптация к стрессу развития одинаково важна для выживания особей и видов.
Старение
Когда развитие завершается и достигается созревание организма, стресс окружающей среды является лишь одним из аспектов физиологического стресса, который бросает вызов людям. Старение представляет собой еще одно бремя, с которым живые организмы должны справляться в течение своей жизни. Несмотря на то, что старение часто рассматривается как неблагоприятный результат различных стрессов, его также можно рассматривать как дополнительный уровень стресса на протяжении всей жизни из-за термодинамических свойств биологических материалов, которые со временем приводят к стохастическому накоплению молекулярных повреждений.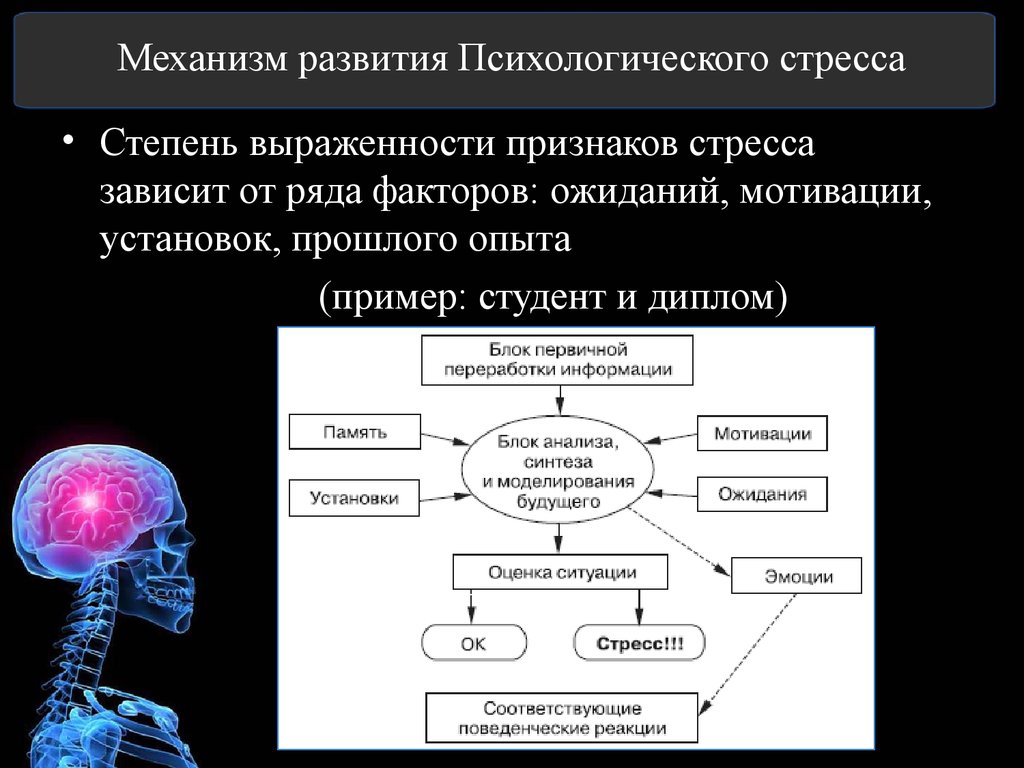 Способность каждого организма справляться со старением и другими стрессами определяет его долголетие. Таким образом, функциональное снижение в результате старения, происходящее даже в физиологически совершенных условиях окружающей среды, может частично являться следствием воздействия энтропии на организмы и выявлять возможные несовершенства гомеостатических механизмов.
Способность каждого организма справляться со старением и другими стрессами определяет его долголетие. Таким образом, функциональное снижение в результате старения, происходящее даже в физиологически совершенных условиях окружающей среды, может частично являться следствием воздействия энтропии на организмы и выявлять возможные несовершенства гомеостатических механизмов.
Роль нейронов
Многолетние исследования показали, что нейроны играют главную роль в реакциях на стресс. Нейроны не только получают и обрабатывают информацию из окружающей среды, но и оказывают важное непосредственное влияние на различные аспекты реакции на стресс (рис. 2). Для того чтобы нейроны выполняли свои роли в реакциях на стресс, определенные молекулы регулируются во времени в ответ на изменения внутренних или внешних условий.
Рисунок 2. Стресс запускает биологические реакции на разных уровнях организации . Различные вовлеченные молекулы диктуют изменения, необходимые для адаптации и, следовательно, для выживания и размножения. ТФ, факторы транскрипции.
ТФ, факторы транскрипции.
Цель обзора
Целью этого обзора является предоставление примеров, демонстрирующих важную роль нейронов в реакциях на физиологический стресс, а также влияние физиологического стресса на нейроны на межклеточном, клеточном и молекулярном уровне.
Нейрональные реакции
Стресс окружающей среды и нейронные цепи
Гипоксия
Сенсорные нейроны образуют клеточные сети, через которые обрабатывается информация из окружающей среды. У низших организмов эти сети относительно просты и стереотипны, и поэтому они представляют собой привлекательные модели для изучения влияния физиологического стресса на обработку нейронной информации. Из исследований C. elegans , в которых была картирована вся нейронная схема (White et al., 1986), было обнаружено, что стресс может изменять обработку сенсорной информации. В частности, при гипоксии латентный контур занимается обработкой вкусовой информации, которая обычно не используется в нормоксических условиях (Pocock, Hobert, 2010). Напротив, нейронная цепь аэротаксиса становится упрощенной и менее гибкой после гипоксического инсульта в том же организме (Chang and Bargmann, 2008). Интересно, что пищевое зондирование и O 2 -сенсорные цепи у C. elegans могут быть изменены естественной генной вариацией, подчеркивающей специфическую адаптацию нейронных цепей различных штаммов в разнообразных локальных условиях (Cheung et al., 2005). Описанная здесь пластичность изменяет поведенческие реакции, которые могут дать организму преимущества в условиях стресса. У высших организмов, где нейронные сети чрезвычайно сложны, отсутствует информация о том, может ли стресс аналогичным образом изменить поток информации через альтернативные нейронные сети. Однако у крыс и других животных наблюдался так называемый «перекрестно-диафрагмальный феномен», когда латентный дыхательный двигательный путь активируется гипоксией, что способствует более быстрому восстановлению после травмы позвоночника (Zhou et al., 2001). Вместе эти примеры показывают функциональную пластичность нейронных цепей и то, как они могут изменять обработку информации в ответ на стресс окружающей среды.
Напротив, нейронная цепь аэротаксиса становится упрощенной и менее гибкой после гипоксического инсульта в том же организме (Chang and Bargmann, 2008). Интересно, что пищевое зондирование и O 2 -сенсорные цепи у C. elegans могут быть изменены естественной генной вариацией, подчеркивающей специфическую адаптацию нейронных цепей различных штаммов в разнообразных локальных условиях (Cheung et al., 2005). Описанная здесь пластичность изменяет поведенческие реакции, которые могут дать организму преимущества в условиях стресса. У высших организмов, где нейронные сети чрезвычайно сложны, отсутствует информация о том, может ли стресс аналогичным образом изменить поток информации через альтернативные нейронные сети. Однако у крыс и других животных наблюдался так называемый «перекрестно-диафрагмальный феномен», когда латентный дыхательный двигательный путь активируется гипоксией, что способствует более быстрому восстановлению после травмы позвоночника (Zhou et al., 2001). Вместе эти примеры показывают функциональную пластичность нейронных цепей и то, как они могут изменять обработку информации в ответ на стресс окружающей среды.
Предварительное кондиционирование
Функциональность нейронных цепей в неблагоприятных условиях окружающей среды также может зависеть от предшествующего воздействия различных стрессов (Robertson, 2004). Нейроны, которые ранее подвергались острому сублетальному стрессу, по-видимому, сохраняют память, которая позволяет им выживать и реагировать на более высокие дозы этого стресса, чем до их первоначального воздействия. Это явление называется «прекондиционирования» или «нейрогормезис» (Mattson and Cheng, 2006). Характерными примерами являются повышенная термотолерантность нейронов при предшествующем тепловом шоке у Drosophila (Karunanithi et al., 1999), у саранчовых (Dawson-Scully and Meldrum Robertson, 1998; Wu et al., 2001) и у C. elegans (Kourtis et al., 2012). Другие примеры включают нейропротекцию за счет предшествующего гипоксического воздействия на последующие ишемические состояния у мышей (Miller et al., 2001), песчанок (Kitagawa et al., 1991) и в культуре нейронов (Bruer et al. , 1997). Недавно было показано, что у поросят ишемическое прекондиционирование отдаленной устойчивой к ишемии ткани защищает мозг от ишемического повреждения, явление, которое называется «дистанционное ишемическое прекондиционирование» и подчеркивает сложность механизмов прекондиционирования (Jensen et al., 2011). Интересно, что прекондиционирование нейронов также может быть достигнуто низкими дозами токсинов, естественным образом присутствующих во фруктах и овощах (Mattson and Cheng, 2006). Кроме того, воздействие стресса может вызвать толерантность к другому стрессу, явление, которое называется «перекрестной толерантностью». Например, у саранчи предварительное воздействие аноксии индуцирует термотолерантность в нейронах, контролирующих полет (Wu et al., 2002). У крыс предварительное воздействие высокой температуры повышает толерантность к ишемии спинного мозга (Zhang et al., 2000). Наконец, тепловой стресс в культурах клеток коры головного мозга мышей повышает толерантность к комбинированному лишению кислорода и глюкозы (Snider et al.
, 1997). Недавно было показано, что у поросят ишемическое прекондиционирование отдаленной устойчивой к ишемии ткани защищает мозг от ишемического повреждения, явление, которое называется «дистанционное ишемическое прекондиционирование» и подчеркивает сложность механизмов прекондиционирования (Jensen et al., 2011). Интересно, что прекондиционирование нейронов также может быть достигнуто низкими дозами токсинов, естественным образом присутствующих во фруктах и овощах (Mattson and Cheng, 2006). Кроме того, воздействие стресса может вызвать толерантность к другому стрессу, явление, которое называется «перекрестной толерантностью». Например, у саранчи предварительное воздействие аноксии индуцирует термотолерантность в нейронах, контролирующих полет (Wu et al., 2002). У крыс предварительное воздействие высокой температуры повышает толерантность к ишемии спинного мозга (Zhang et al., 2000). Наконец, тепловой стресс в культурах клеток коры головного мозга мышей повышает толерантность к комбинированному лишению кислорода и глюкозы (Snider et al. , 19).98). Прекондиционирования нейронных цепей состоит из адаптивного механизма, который использует предыдущий опыт, чтобы лучше противостоять враждебным условиям. Кроме того, перекрестная толерантность к стрессу является естественной демонстрацией существования общих механизмов реакции на различные стрессы, такие как высокая температура и недостаток кислорода.
, 19).98). Прекондиционирования нейронных цепей состоит из адаптивного механизма, который использует предыдущий опыт, чтобы лучше противостоять враждебным условиям. Кроме того, перекрестная толерантность к стрессу является естественной демонстрацией существования общих механизмов реакции на различные стрессы, такие как высокая температура и недостаток кислорода.
Ремоделирование/пластичность синаптической и нейронной сети
Еще один способ, которым нейроны реагируют на физиологический стресс, заключается в изменении их синаптической силы (функциональная пластичность) и/или характера связности (структурная пластичность) таким образом, который способствует адаптации. В отличие от таких организмов, как C. elegans , где связь нейронов между отдельными особями представляется стереотипной (White et al., 1986), мозг взрослых высших животных демонстрирует замечательный уровень пластичности, а нейронные сети определенных областей могут изменяться в различных условиях в течение жизни.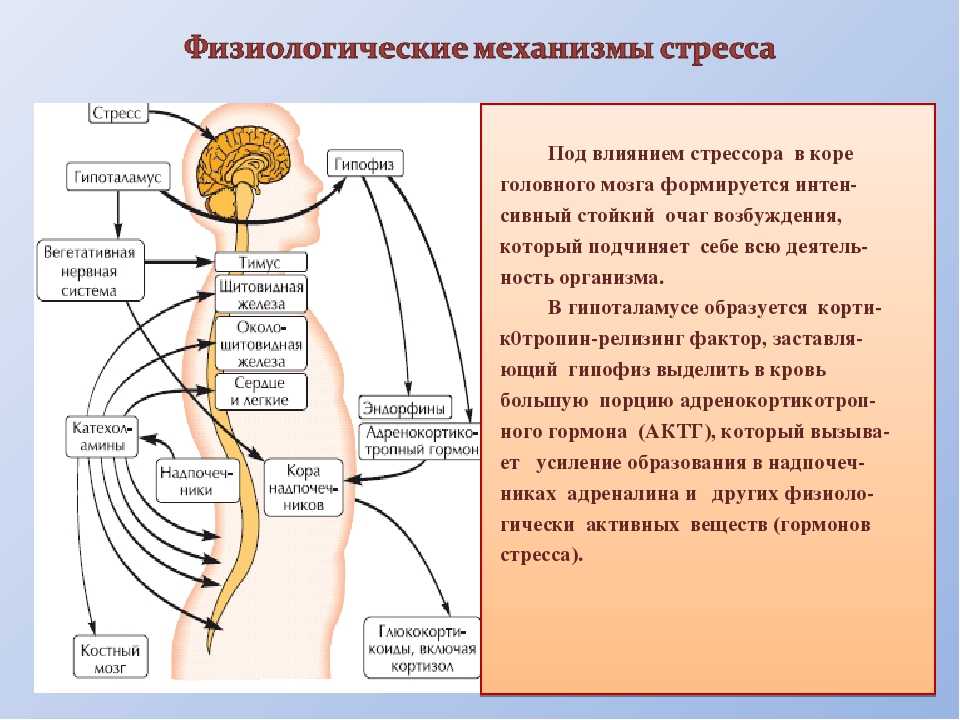 и после их развития (Pascual-Leone et al., 2011). Хотя это явление в основном связано с обучением и памятью, оно также может возникать как реакция на внешние раздражители и способствовать гомеостазу нервной системы. Например, сенсорный опыт способствует синаптической интеграции новых нейронов в обонятельные цепи у мышей (Arenkiel et al., 2011). Более того, хроническая перемежающаяся гипоксия изменяет синаптические свойства центральной сенсорной цепи у крыс (Kline et al., 2007) и периферических хеморецепторных клеток у моллюсков Lymnaea stagnalis развивают синапсы in vitro , которые проявляют форму кратковременной синаптической пластичности в ответ на гипоксию (Bell et al., 2007). Наконец, характерно и то, что кратковременная пластичность синапсов сильно зависит от температуры (Клячко, Стивенс, 2006). Эти примеры показывают функциональную и структурную пластичность нервной системы в ответ на внешние раздражители.
и после их развития (Pascual-Leone et al., 2011). Хотя это явление в основном связано с обучением и памятью, оно также может возникать как реакция на внешние раздражители и способствовать гомеостазу нервной системы. Например, сенсорный опыт способствует синаптической интеграции новых нейронов в обонятельные цепи у мышей (Arenkiel et al., 2011). Более того, хроническая перемежающаяся гипоксия изменяет синаптические свойства центральной сенсорной цепи у крыс (Kline et al., 2007) и периферических хеморецепторных клеток у моллюсков Lymnaea stagnalis развивают синапсы in vitro , которые проявляют форму кратковременной синаптической пластичности в ответ на гипоксию (Bell et al., 2007). Наконец, характерно и то, что кратковременная пластичность синапсов сильно зависит от температуры (Клячко, Стивенс, 2006). Эти примеры показывают функциональную и структурную пластичность нервной системы в ответ на внешние раздражители.
Экологический стресс и отдельные нейроны
Гипоксия
В дополнение к различным реакциям, которые нейроны проявляют при определенных стрессах, они также демонстрируют различные фенотипы, связанные со стрессом. Поскольку нейроны являются высокоактивными клетками, им требуется большое количество кислорода, чтобы выжить и функционировать. Таким образом, гипоксия может иметь огромное влияние на физиологию мозга животных. Ограниченная доступность кислорода во время развития (Lipton, 1999), при рождении (Arpino et al., 2005; Gozzo et al., 2009) и в более позднем возрасте (Lipton, 1999) может вызвать необратимое повреждение нейронной ткани. Гипоксия также может влиять на разрастание аксонов в линии нейронов крысы (O’Driscoll and Gorman, 2005). Кроме того, конкретные in vivo дефекты развития отдельных нейронов, вызванные гипоксией, были продемонстрированы у C. elegans . В этой модели ведение аксонов и миграция нейронов нарушены в специфических типах нейронов в условиях гипоксии в результате стабилизации фактора, индуцируемого гипоксией-1 (HIF)-1 (Pocock and Hobert, 2008). Недавнее исследование также показало, что сходные дефекты наблюдаются в центральной нервной системе рыбок данио по сходному пути, что дает убедительные доказательства того, что этот механизм консервативен (Stevenson et al.
Поскольку нейроны являются высокоактивными клетками, им требуется большое количество кислорода, чтобы выжить и функционировать. Таким образом, гипоксия может иметь огромное влияние на физиологию мозга животных. Ограниченная доступность кислорода во время развития (Lipton, 1999), при рождении (Arpino et al., 2005; Gozzo et al., 2009) и в более позднем возрасте (Lipton, 1999) может вызвать необратимое повреждение нейронной ткани. Гипоксия также может влиять на разрастание аксонов в линии нейронов крысы (O’Driscoll and Gorman, 2005). Кроме того, конкретные in vivo дефекты развития отдельных нейронов, вызванные гипоксией, были продемонстрированы у C. elegans . В этой модели ведение аксонов и миграция нейронов нарушены в специфических типах нейронов в условиях гипоксии в результате стабилизации фактора, индуцируемого гипоксией-1 (HIF)-1 (Pocock and Hobert, 2008). Недавнее исследование также показало, что сходные дефекты наблюдаются в центральной нервной системе рыбок данио по сходному пути, что дает убедительные доказательства того, что этот механизм консервативен (Stevenson et al. , 2012). Таким образом, гипоксия может оказывать плейотропное воздействие на разные нейроны разных организмов.
, 2012). Таким образом, гипоксия может оказывать плейотропное воздействие на разные нейроны разных организмов.
Реакция на тепловой шок
Известно также, что повышение температуры (гипертермия) влияет на многие типы клеток. Однако нейроны особенно чувствительны к повышению температуры, и гибель организма при высокой температуре может быть результатом нарушения работы нейронов до того, как другие клетки откажут (Robertson, 2004). Высокая температура в основном вызывает неправильный фолдинг белков, что запускает клеточные автономные и клеточно-неавтономные ответы (Ramirez et al., 1999). Определенные сенсорные нейроны отвечают за определение оптимальной температуры у свободно движущихся животных, а также за опосредование термоноцицепции (Clark et al., 2007; Liu et al., 2012). Интересное исследование в C. elegans показал, что такие сенсорные нейроны играют критическую роль в неавтономной клеточной реакции соматических клеток на тепловой шок (Prahlad et al., 2008). Кроме того, было показано, что эти нейроны регулируют ответ на хронический стресс, вызванный внутриклеточным накоплением белков с неправильной укладкой в отдаленных соматических клетках (Prahlad and Morimoto, 2011).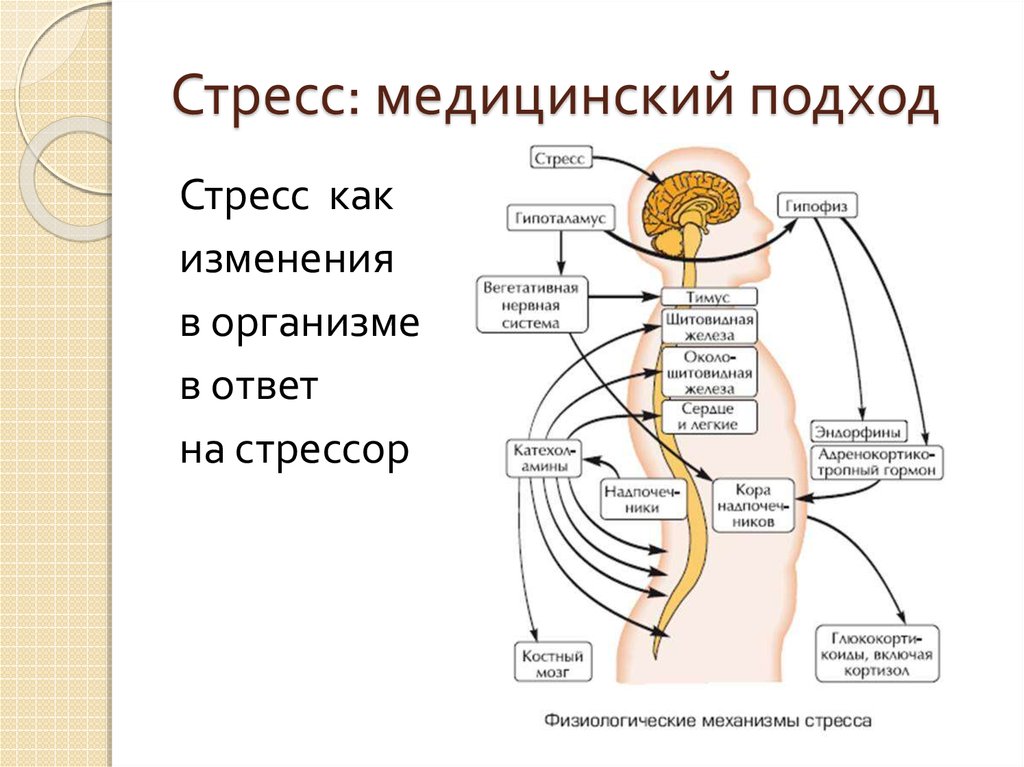 Наконец, реснитчатые хемосенсорные нейроны ASI в том же самом организме дистанционно регулируют решение о пролиферации или дифференцировке в гонадах путем секреции DAF-7/TGFβ при благоприятных условиях окружающей среды (Dalfo et al., 2012). Таким образом, сенсорные нейроны регулируют системный стресс неклеточно автономно, интегрируя входные данные из окружающей среды.
Наконец, реснитчатые хемосенсорные нейроны ASI в том же самом организме дистанционно регулируют решение о пролиферации или дифференцировке в гонадах путем секреции DAF-7/TGFβ при благоприятных условиях окружающей среды (Dalfo et al., 2012). Таким образом, сенсорные нейроны регулируют системный стресс неклеточно автономно, интегрируя входные данные из окружающей среды.
Реакция на повреждение ДНК
Генотоксические факторы, такие как УФ и другие электромагнитные излучения, также могут вызывать серьезные повреждения нейронов, повреждая как их ядерную (Ide et al., 2000), так и митохондриальную ДНК (LeDoux et al., 2007). В отличие от других типов клеток, которые подвергаются остановке контрольных точек клеточного цикла при повреждении ДНК, нейроны, по-видимому, задействуют компоненты механизма клеточного цикла в ответ на такие повреждения (Park et al., 1997), а также в ответ на другие стрессы, такие как ишемическая гипоксия (Li et al., 1997; Тимсит и др., 1999). Такое вступление нейронов в клеточный цикл при стрессе коррелирует с апоптотической гибелью после обширного повреждения ДНК (Park et al.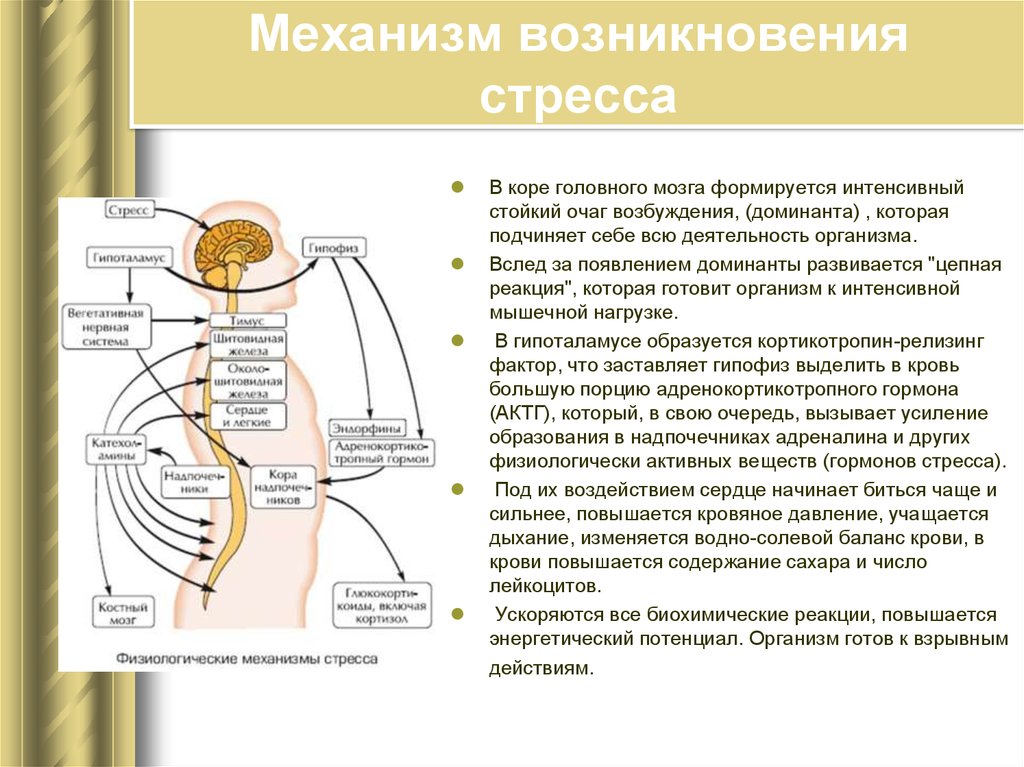 , 1998; Herrup et al., 2004; Kruman et al., 2004). Более того, вступление нейронов в клеточный цикл также коррелирует с гибелью нейронов как ранним процессом, связанным с заболеванием (Herrup, 2012).
, 1998; Herrup et al., 2004; Kruman et al., 2004). Более того, вступление нейронов в клеточный цикл также коррелирует с гибелью нейронов как ранним процессом, связанным с заболеванием (Herrup, 2012).
Большая часть информации о различных механизмах репарации ДНК, доступных в клетках, получена в результате исследований ненейрональных клеточных систем млекопитающих. Несмотря на существование различных путей репарации ДНК, эксцизионная репарация оснований (BER) и эксцизионная репарация нуклеотидов (NER) являются основными механизмами, ответственными за восстановление индуцированных окислением и УФ-индуцированных повреждений, соответственно, как в ядерной, так и в митохондриальной ДНК (Seeberg et al. , 1995; Лагерверф и др., 2011). Детали путей NER (Lagerwerf et al., 2011) и BER (Robertson et al., 2009) были недавно рассмотрены. О постепенном созревании таких механизмов восстановления в нейронах свидетельствует тот факт, что зрелые нейроны оказываются более устойчивыми к повреждению ДНК, вызванному УФ- и ИК-излучением, чем их более молодые аналоги (Romero et al. , 2003; Shirai et al., 2006). . Нейроны также более устойчивы к апоптозу, индуцированному ИР, по сравнению с клетками-предшественниками нейронов (Kameyama and Inouye, 1994) и другими типами клеток (Li et al., 19).96). Это подчеркивает важность эффективных механизмов ответа на повреждение ДНК (DDR) для поддержания зрелых постмитотических клеток, таких как нейроны, которые не могут быть восполнены (Romero et al., 2003). ИК-облучение также влияет на множественные поведенческие реакции разных видов, воздействуя на нейроны (Sakashita et al., 2010 и ссылки здесь). В частности, у C. elegans IR по-разному влияет на подтипы нейронов (Sakashita et al., 2010), что также может свидетельствовать о том, что эффективность репарации ДНК различается между типами нейронов. Эндогенное повреждение ДНК также происходит в нейронах. Нейроны представляют собой высокоактивные клетки, продуцирующие высокие уровни активных форм кислорода (АФК), что приводит к повышенному повреждению ядерной и митохондриальной ДНК (LeDoux et al.
, 2003; Shirai et al., 2006). . Нейроны также более устойчивы к апоптозу, индуцированному ИР, по сравнению с клетками-предшественниками нейронов (Kameyama and Inouye, 1994) и другими типами клеток (Li et al., 19).96). Это подчеркивает важность эффективных механизмов ответа на повреждение ДНК (DDR) для поддержания зрелых постмитотических клеток, таких как нейроны, которые не могут быть восполнены (Romero et al., 2003). ИК-облучение также влияет на множественные поведенческие реакции разных видов, воздействуя на нейроны (Sakashita et al., 2010 и ссылки здесь). В частности, у C. elegans IR по-разному влияет на подтипы нейронов (Sakashita et al., 2010), что также может свидетельствовать о том, что эффективность репарации ДНК различается между типами нейронов. Эндогенное повреждение ДНК также происходит в нейронах. Нейроны представляют собой высокоактивные клетки, продуцирующие высокие уровни активных форм кислорода (АФК), что приводит к повышенному повреждению ядерной и митохондриальной ДНК (LeDoux et al. , 2007; Barzilai et al., 2008). Ответы на повреждение эндогенной ДНК имеют решающее значение для обеспечения правильного развития нейронов и последующего поддержания нейронов (LeDoux et al., 2007; Lee and McKinnon, 2007; Barzilai et al., 2008). Важность DDR в отсутствие внешних мутагенных факторов также подтверждается генетическими условиями у людей, вызывающими дефекты развития (O’Driscoll, Jeggo, 2006; Barzilai et al., 2008). Наконец, нейроны могут удаленно защищать другие ткани от повреждений, таких как ионизирующее облучение. Ярким примером является C. elegans , где апоптоз, вызванный повреждением ДНК в гонаде червя, отрицательно регулируется путем, включающим HIF-1. В частности, HIF-1 действует в сенсорных нейронах амфид ASJ, активируя члена семейства тирозиназ TYR-2. TYR-2 впоследствии секретируется из этих нейронов и подавляет CEP-1, гомолог p53, в гонадах, тем самым подавляя радиационно-индуцированный апоптоз (Sendoel et al., 2010). Таким образом, ясно, что нейроны особенно восприимчивы как к экзогенным, так и к эндогенным генотоксическим реагентам, и клетки могут реагировать как автономно, так и неклеточно автономно, чтобы способствовать выживанию.
, 2007; Barzilai et al., 2008). Ответы на повреждение эндогенной ДНК имеют решающее значение для обеспечения правильного развития нейронов и последующего поддержания нейронов (LeDoux et al., 2007; Lee and McKinnon, 2007; Barzilai et al., 2008). Важность DDR в отсутствие внешних мутагенных факторов также подтверждается генетическими условиями у людей, вызывающими дефекты развития (O’Driscoll, Jeggo, 2006; Barzilai et al., 2008). Наконец, нейроны могут удаленно защищать другие ткани от повреждений, таких как ионизирующее облучение. Ярким примером является C. elegans , где апоптоз, вызванный повреждением ДНК в гонаде червя, отрицательно регулируется путем, включающим HIF-1. В частности, HIF-1 действует в сенсорных нейронах амфид ASJ, активируя члена семейства тирозиназ TYR-2. TYR-2 впоследствии секретируется из этих нейронов и подавляет CEP-1, гомолог p53, в гонадах, тем самым подавляя радиационно-индуцированный апоптоз (Sendoel et al., 2010). Таким образом, ясно, что нейроны особенно восприимчивы как к экзогенным, так и к эндогенным генотоксическим реагентам, и клетки могут реагировать как автономно, так и неклеточно автономно, чтобы способствовать выживанию.
Внутренний стресс развития и нервная система
Стрессовые состояния во внутренней соматической микросреде организма могут быть вызваны развитием (Simon and Keith, 2008). Несмотря на то, что развитие было признано дополнительным уровнем стресса, сведения о том, как оно влияет на нервную систему, ограничены. Стресс развития уникален по своей природе, будучи стереотипным во время эмбриональной и постэмбриональной жизни. Следовательно, ответы на этот стресс должны быть встроены в нейроны и в некоторых случаях могут служить необходимой частью их развития. Наиболее хорошо изученным стрессором во время развития является внутренняя гипоксия. В развивающемся эмбрионе гипоксические области естественным образом возникают в результате ограниченного содержания О 2 (Simon and Keith, 2008), где основной регулятор гипоксии, HIF-1, играет важную роль (Dunwoodie, 2009). Интересно, что низкие уровни кислорода во время развития важны для дифференцировки многих клеток и тканей (Morriss and New, 1979; Maltepe and Simon, 1998; Simon et al. , 2002), и исследования в культуре нейронов предполагают, что это также может быть верно для нейроны (Morrison et al., 2000; Studer et al., 2000). Следовательно, кажется, что развитие использует врожденное стрессовое состояние, такое как эмбриональная гипоксия, в качестве сигнала для формирования различных структур. Таким образом, было высказано предположение, что O 2 функционирует как морфоген развития (Simon and Keith, 2008). Кроме того, наблюдаемая толерантность к гипоксии незрелых в развитии нейронов по сравнению со зрелыми нейронами указывает на адаптацию нейронов к гипоксии, обусловленной развитием (Bickler and Buck, 1998).
, 2002), и исследования в культуре нейронов предполагают, что это также может быть верно для нейроны (Morrison et al., 2000; Studer et al., 2000). Следовательно, кажется, что развитие использует врожденное стрессовое состояние, такое как эмбриональная гипоксия, в качестве сигнала для формирования различных структур. Таким образом, было высказано предположение, что O 2 функционирует как морфоген развития (Simon and Keith, 2008). Кроме того, наблюдаемая толерантность к гипоксии незрелых в развитии нейронов по сравнению со зрелыми нейронами указывает на адаптацию нейронов к гипоксии, обусловленной развитием (Bickler and Buck, 1998).
Нейроны также могут помочь эмбриону преодолеть стресс, связанный с развитием, на поведенческом уровне. У прудовой улитки Helisoma trivolvis вращательное поведение ранних эмбрионов, управляемое ресничками, облегчает газообмен с окружающей жидкостью и регулируется парой серотонинергических сенсорно-моторных клеток, которые воспринимают уровни кислорода (Kuang and Goldberg, 2001; Kuang et al.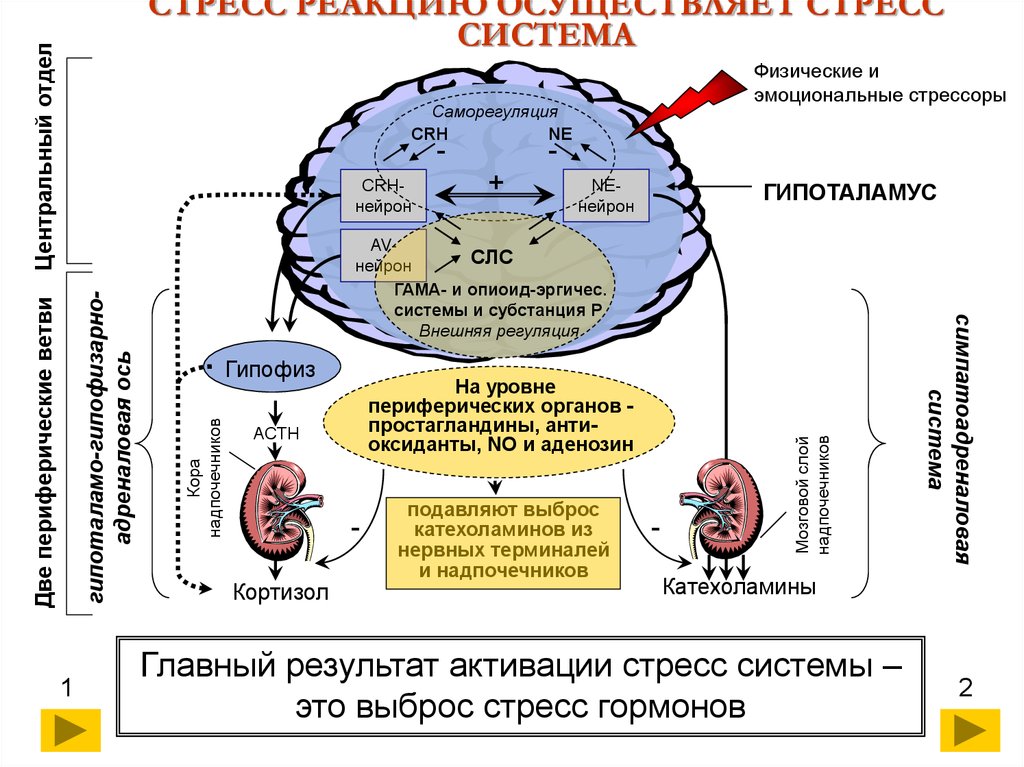 ., 2002). Такое эмбриональное поведение наблюдалось и у других видов, например, у прудовика 9.0282 Lymnaea stagnalis (Byrne et al., 2009). Во время развития могут присутствовать и другие стрессоры. Например, окислительный стресс возникает в результате рутинного нейрогенеза у взрослых (Walton et al., 2012). Развивающийся мозг применяет множество различных способов защиты от оксидативного стресса, вызванного развитием (Ikonomidou and Kaindl, 2011), например, дифференциальную экспрессию антиоксидантных систем во время развития мозга (Aspberg and Tottmar, 1992). Наконец, нервная система подвергается механическому стрессу из-за движения и увеличения массы мозга в процессе развития (Van Essen, 19).97; Бенард и Хоберт, 2009). Этот вызванный развитием механический стресс приводит к разнообразным реакциям нейронов на разных уровнях (Benard and Hobert, 2009). Приведенные выше примеры описывают существование стресса развития как важного аспекта биологии развития и стресса. Нейроны не только адаптируются к стрессу, но и требуют специфических стрессоров для правильного развития.
., 2002). Такое эмбриональное поведение наблюдалось и у других видов, например, у прудовика 9.0282 Lymnaea stagnalis (Byrne et al., 2009). Во время развития могут присутствовать и другие стрессоры. Например, окислительный стресс возникает в результате рутинного нейрогенеза у взрослых (Walton et al., 2012). Развивающийся мозг применяет множество различных способов защиты от оксидативного стресса, вызванного развитием (Ikonomidou and Kaindl, 2011), например, дифференциальную экспрессию антиоксидантных систем во время развития мозга (Aspberg and Tottmar, 1992). Наконец, нервная система подвергается механическому стрессу из-за движения и увеличения массы мозга в процессе развития (Van Essen, 19).97; Бенард и Хоберт, 2009). Этот вызванный развитием механический стресс приводит к разнообразным реакциям нейронов на разных уровнях (Benard and Hobert, 2009). Приведенные выше примеры описывают существование стресса развития как важного аспекта биологии развития и стресса. Нейроны не только адаптируются к стрессу, но и требуют специфических стрессоров для правильного развития.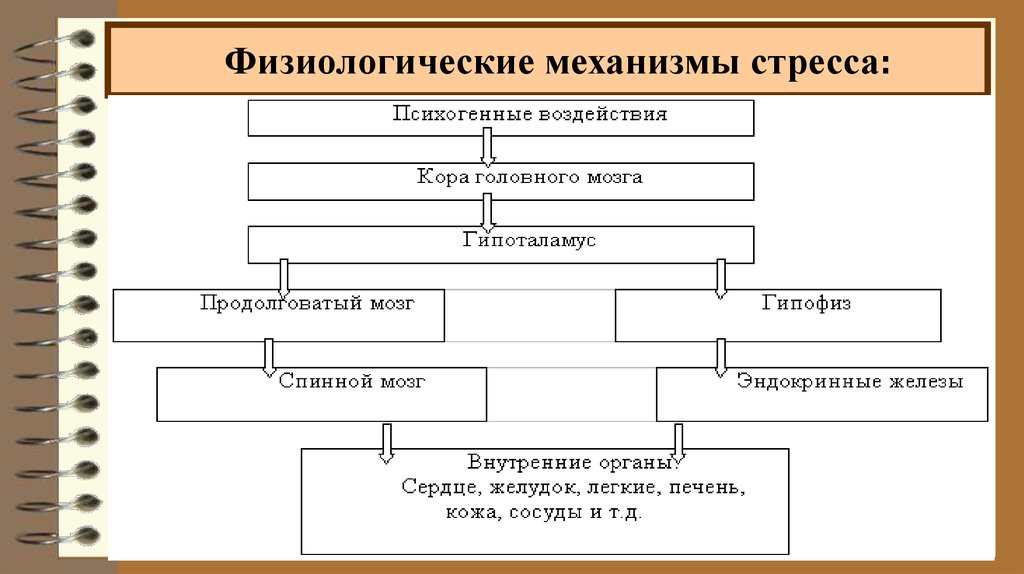
Старение и нервная система
Старение воспринимается как разрушительное воздействие времени на различные структуры живых организмов, и на сегодняшний день разработано множество теорий, объясняющих, как старение развивалось у разных организмов (Kirkwood and Austad, 2000). Ранние исследования показали связь между сенсорными нейронами и продолжительностью жизни (Apfeld and Kenyon, 19).99). Было обнаружено, что различные типы сенсорных нейронов регулируют продолжительность жизни C. elegans как положительным, так и отрицательным образом, что подчеркивает сложность, лежащую в основе такой регуляции (Alcedo and Kenyon, 2004; Bishop and Guarente, 2007; Lee and Kenyon, 2009; Shen). и др., 2010а,б). Нейроны могут влиять на продолжительность жизни не клеточно-автономным образом. Например, при специфичном для нейронов митохондриальном стрессе сигнал от нервной системы у C. elegans индуцирует митохондриально-специфический ответ развернутого белка в клетках кишечника, тем самым увеличивая продолжительность жизни животных (Durieux et al. , 2011). Кроме того, нейропротекция играет решающую роль в долголетии и старении (Murakami, 2007), а регуляция старения с помощью нейронов, по-видимому, консервативна в Drosophila (Parkes et al., 1999; Libert et al., 2007). Эта связь между сенсорными нейронами и долголетием показывает внеклеточное автономное влияние сигналов окружающей среды на старение организма.
, 2011). Кроме того, нейропротекция играет решающую роль в долголетии и старении (Murakami, 2007), а регуляция старения с помощью нейронов, по-видимому, консервативна в Drosophila (Parkes et al., 1999; Libert et al., 2007). Эта связь между сенсорными нейронами и долголетием показывает внеклеточное автономное влияние сигналов окружающей среды на старение организма.
Также известно, что старение влияет на отдельные нейроны. Помимо патологических состояний, таких как болезнь Альцгеймера и болезнь Паркинсона, которые были хорошо задокументированы на протяжении многих лет (Yankner et al., 2008; Hung et al., 2010), нейроны претерпевают важные морфологические и функциональные изменения при нормальном старении. Модели беспозвоночных широко использовались и выявили ряд возрастных нейронных событий. Например, C. elegans сенсорный рецептор и холинергические нейроны обнаруживают зависящие от возраста морфологические дефекты, такие как дезорганизация цитоскелета, утолщение аксонов и дефасцикуляция (Pan et al. , 2011). Более того, неожиданное эктопическое ветвление нейритов недавно наблюдалось в нейронах C. elegans в результате старения (Tank et al., 2011). Хотя это ветвление было связано с нарушением механосенсорного восприятия и снижением подвижности, оно, по-видимому, регулируется независимо от продолжительности жизни организма (Tank et al., 2011). Основываясь на этом представлении, мы могли бы предположить, что ветвление нейронов играет роль выживания старых червей в дикой природе, но не в лабораторных условиях, и что это не просто результат старения. Эта гипотеза также объясняет, почему ветвление регулируется возрастными путями, такими как Jun kinase и пути инсулина/IGF-1 (Tank et al., 2011). Поскольку известно, что эти пути влияют на пластичность нейронов у разных видов (Sherrin et al., 2011; Antoniou and Borsello, 2012; Fernandez and Torres-Aleman, 2012), неудивительно, что они также влияют на C. elegans Ветвление нейритов. Наконец, защита нейронов от старения в значительной степени зависит от общего образа жизни людей, например от диеты и физических упражнений, что еще больше подчеркивает сложность механизмов старения (Stranahan and Mattson, 2012).
, 2011). Более того, неожиданное эктопическое ветвление нейритов недавно наблюдалось в нейронах C. elegans в результате старения (Tank et al., 2011). Хотя это ветвление было связано с нарушением механосенсорного восприятия и снижением подвижности, оно, по-видимому, регулируется независимо от продолжительности жизни организма (Tank et al., 2011). Основываясь на этом представлении, мы могли бы предположить, что ветвление нейронов играет роль выживания старых червей в дикой природе, но не в лабораторных условиях, и что это не просто результат старения. Эта гипотеза также объясняет, почему ветвление регулируется возрастными путями, такими как Jun kinase и пути инсулина/IGF-1 (Tank et al., 2011). Поскольку известно, что эти пути влияют на пластичность нейронов у разных видов (Sherrin et al., 2011; Antoniou and Borsello, 2012; Fernandez and Torres-Aleman, 2012), неудивительно, что они также влияют на C. elegans Ветвление нейритов. Наконец, защита нейронов от старения в значительной степени зависит от общего образа жизни людей, например от диеты и физических упражнений, что еще больше подчеркивает сложность механизмов старения (Stranahan and Mattson, 2012).
У высших организмов нормальное старение влияет на разные части мозга с разной скоростью (Woodruff-Pak et al., 2010) и влияет на синаптическую связность определенных областей мозга. Например, в обонятельной луковице у мышей синаптическая плотность обонятельных сенсорных нейронов уменьшается с возрастом в клубочковом слое, но не во внешнем плексиформном слое (Richard et al., 2010). Интересно, что другие характеристики нейронов, а также популяции нейронов в той же области не изменяются при старении (Richard et al., 2010). Такой избирательный эффект старения на разные синаптические популяции изучен недостаточно. Тем не менее, синаптическая дисфункция при старении сохраняется и наблюдалась у разных видов обезьян (Page et al., 2002; Duan et al., 2003) и у крыс, у которых исследование показало снижение числа аксодендритических синапсов на 27 %. средний молекулярный слой зубчатой извилины у 25-месячных особей по сравнению с 3-месячными (Бондарефф и Гейнисман, 1976). Связь между фенотипами нейронов, связанными со старением, и когнитивными нарушениями также не ясна. Интересное исследование Drosophila недавно установило функциональную связь между потерей памяти и нарушением в определенных нейронах при нормальном старении (Tonoki and Davis, 2012). Авторы также смогли восстановить утраченные из-за старения воспоминания путем предварительной стимуляции этих нейронов (Tonoki and Davis, 2012). Несмотря на большое количество различных дефектов нейронов, связанных со старением, при нормальном старении погибает относительно небольшое количество нейронов (Herndon et al., 2002; Burke and Barnes, 2006). Однако недавнее исследование показало, что при старении в коре головного мозга нормального человеческого мозга происходит значительная и специфическая потеря гиперплоидных нейронов (нейронов, содержащих более чем диплоидное число хромосом) (Fischer et al., 2012). Такая специфическая потеря нейронов еще не показала, способствует ли она возрастным нарушениям. В целом, упадок нейронов, а не потеря нейронов, по-видимому, ответственен за негативные проявления нормального старения, такие как потеря памяти.
Интересное исследование Drosophila недавно установило функциональную связь между потерей памяти и нарушением в определенных нейронах при нормальном старении (Tonoki and Davis, 2012). Авторы также смогли восстановить утраченные из-за старения воспоминания путем предварительной стимуляции этих нейронов (Tonoki and Davis, 2012). Несмотря на большое количество различных дефектов нейронов, связанных со старением, при нормальном старении погибает относительно небольшое количество нейронов (Herndon et al., 2002; Burke and Barnes, 2006). Однако недавнее исследование показало, что при старении в коре головного мозга нормального человеческого мозга происходит значительная и специфическая потеря гиперплоидных нейронов (нейронов, содержащих более чем диплоидное число хромосом) (Fischer et al., 2012). Такая специфическая потеря нейронов еще не показала, способствует ли она возрастным нарушениям. В целом, упадок нейронов, а не потеря нейронов, по-видимому, ответственен за негативные проявления нормального старения, такие как потеря памяти.
Причина изменений нейронов при старении до конца не изучена. Общим подозрением является повышенный окислительный стресс, что соответствует «теории старения окислительного стресса» (Gerschman et al., 1954; Harman, 1956; Cadet, 1988). Окислительный стресс представляет собой негативное влияние АФК на различные аспекты клеточной функции и может привести к молекулярным дефектам, таким как повреждение ДНК и митохондрий. Характерно, что гены, связанные с реакцией на стресс и репарацией ДНК, активируются в стареющем человеческом мозге (Lu et al., 2004). При нормальном старении образование АФК повышено из-за изменений в нейрональной обработке кальция и изменений в перекисном окислении липидов (Stranahan and Mattson, 2012). Эти молекулярные события могут приводить к подавлению нейрогенеза у взрослых и реализации альтернативных механизмов пластичности для компенсации поврежденной ткани (Stranahan and Mattson, 2012). Нейроны особенно уязвимы к окислительному стрессу, который может привести к гибели нейронных клеток, связанной со многими возрастными нейродегенеративными заболеваниями (Coyle and Puttfarcken, 19). 93; Андерсен, 2004). Тем не менее, недавние исследования ставят под сомнение роль окислительного стресса в старении (Doonan et al., 2008; Yen et al., 2009; Van Raamsdonk and Hekimi, 2010, 2012; Hekimi et al., 2011). Кроме того, хотя неизвестно, вовлечены ли какие-либо нейроны, умеренное повышение АФК может способствовать увеличению продолжительности жизни у C. elegans (Lee et al., 2010).
93; Андерсен, 2004). Тем не менее, недавние исследования ставят под сомнение роль окислительного стресса в старении (Doonan et al., 2008; Yen et al., 2009; Van Raamsdonk and Hekimi, 2010, 2012; Hekimi et al., 2011). Кроме того, хотя неизвестно, вовлечены ли какие-либо нейроны, умеренное повышение АФК может способствовать увеличению продолжительности жизни у C. elegans (Lee et al., 2010).
Таким образом, в целом старение активно регулируется нервной системой, а старение, в свою очередь, влияет на свойства нейронов. Природа старения как стрессора, по-видимому, выходит за рамки стресса окружающей среды и может распространяться на неизбежное снижение механизмов репарации, возможно, из-за физической энтропии.
Нейрональный гомеостаз
Способность нервной системы выполнять свою роль во многом зависит от ее гомеостатической способности. Этот процесс известен как «гомеостаз» и определяется как «поддержание постоянства внутренней среды» (Turrigiano and Nelson, 2004). Независимо от изменений в окружающей среде структурная и функциональная целостность нейронов должна сохраняться на протяжении всей жизни. Когда гомеостатические механизмы выходят из строя, нейроны угасают и становятся неспособными реагировать на внешние возмущения. Это приводит ко многим возрастным нейродегенеративным заболеваниям, а также к другим дефектам нейронов (Ramocki and Zoghbi, 2008). Во время развития нейроны и нейронные сети задействуют множество регуляторных механизмов, чтобы поддерживать свою функцию, несмотря на изменения в их микроокружении (Turrigiano and Nelson, 2004). Нервная система также подвергается различным физическим нагрузкам на протяжении всей жизни. Например, добавление новых клеток во взрослые нейронные цепи во время нейрогенеза имеет тенденцию дестабилизировать функциональность цепей и диктует гомеостатическую адаптацию на разных уровнях (Meltzer et al., 2005). Нейроны также могут подвергаться воздействию физических движений тела, мышечных сокращений и травм, и всем этим должны противостоять гомеостатические механизмы (Benard and Hobert, 2009).
Независимо от изменений в окружающей среде структурная и функциональная целостность нейронов должна сохраняться на протяжении всей жизни. Когда гомеостатические механизмы выходят из строя, нейроны угасают и становятся неспособными реагировать на внешние возмущения. Это приводит ко многим возрастным нейродегенеративным заболеваниям, а также к другим дефектам нейронов (Ramocki and Zoghbi, 2008). Во время развития нейроны и нейронные сети задействуют множество регуляторных механизмов, чтобы поддерживать свою функцию, несмотря на изменения в их микроокружении (Turrigiano and Nelson, 2004). Нервная система также подвергается различным физическим нагрузкам на протяжении всей жизни. Например, добавление новых клеток во взрослые нейронные цепи во время нейрогенеза имеет тенденцию дестабилизировать функциональность цепей и диктует гомеостатическую адаптацию на разных уровнях (Meltzer et al., 2005). Нейроны также могут подвергаться воздействию физических движений тела, мышечных сокращений и травм, и всем этим должны противостоять гомеостатические механизмы (Benard and Hobert, 2009). ). С этой целью нейроны используют компоненты внеклеточного матрикса, молекулы клеточной адгезии и белки цитоскелета для поддержания архитектурной целостности (Benard and Hobert, 2009). Таким образом, гомеостатические механизмы, по-видимому, действуют в направлении, противоположном старению и болезням, сложным и динамичным образом.
). С этой целью нейроны используют компоненты внеклеточного матрикса, молекулы клеточной адгезии и белки цитоскелета для поддержания архитектурной целостности (Benard and Hobert, 2009). Таким образом, гомеостатические механизмы, по-видимому, действуют в направлении, противоположном старению и болезням, сложным и динамичным образом.
Ключевые задействованные молекулы
Регуляция экспрессии белка в условиях стресса является сложной и включает такие механизмы, как регуляция эпигенетического гена, регуляция транскрипции и посттранскрипционная регуляция. Сообщалось, что многие молекулы у многих различных видов опосредуют клеточные реакции на стресс. Однако лишь часть из них играет специфическую роль в нейронах во время этих ответов (таблица 1). Мы суммируем здесь исследования некоторых ключевых молекул, участвующих в реакции нейронов на стресс.
Таблица 1 . Молекулы, участвующие в реакциях нейронов на различные стрессы у различных организмов .
Факторы транскрипции
Факторы, индуцируемые гипоксией
Факторы, индуцируемые гипоксией, являются ключевыми модуляторами реакций на гипоксический стресс. Они функционируют как гетеродимеры, состоящие из регулируемой кислородом α-субъединицы и стабильной β-субъединицы. Гетеродимер HIF связывается с промотором генов-мишеней через элементы ответа на гипоксию (HRE) с консенсусной последовательностью G/ACGTG (рис. 3А; Majmundar et al., 2010). Эти гены-мишени регулируют широкий спектр процессов, обеспечивающих клеточную адаптацию к гипоксии. HIFα в первую очередь регулируется кислородзависимыми ферментами домена пролилгидроксилазы (PHD), которые приводят к его деградации с помощью белка-супрессора опухоли фон Хиппеля-Линдау (VHL) в условиях нормоксии (Epstein et al., 2001). В условиях гипоксии активность PHD снижается, а HIFα стабилизируется (рис. 3А; Epstein et al., 2001; Majmundar et al., 2010). Недавнее исследование в C. elegans также вовлекает гомолог сульфгидрилаз/цистеина (CYSL-1) в стабилизацию HIF-1α в нейронах посредством EGL-9, гомолога PHD червей, в ответ на внутриклеточный сероводород, полученный в результате гипоксии (H 2 S; рис. 3А; Ma et al., 2012).
3А; Ma et al., 2012).
Рисунок 3. Схематическое представление различных основных молекулярных путей, участвующих в реакции нейронов на стресс . Подробное описание смотрите в тексте. (A) Роль HIF в реакции на гипоксию. (B) Роль HSF-1 в реакции на стресс. (C) Биогенез микроРНК. (D) Основные сигнальные пути, опосредующие реакцию нейронов на различные стрессы. Легенда: стрелки указывают путь потока и/или положительное влияние одного элемента на другой. Тупые стрелки указывают на ингибирование. Знак вопроса означает отсутствие информации. Ub, убиквитин; ТФ, факторы транскрипции.
Различные исследования показали особую роль HIF-1 в нейронах. Истощение HIF-1α в мозге мышей и в культурах нейрональных клеток вызывает повышенное повреждение клеток и снижение выживаемости после церебральной ишемии (Baranova et al., 2007). В нейронах коры головного мозга крыс HIF-1α, по-видимому, играет защитную роль на ранних стадиях реакции на умеренную гипоксию (Lopez-Hernandez et al. , 2012). Недавно было показано, что HIF-1α регулирует экспрессию прионного белка в нейрональных клетках гиппокампа для защиты от повреждения клеток (Jeong et al., 2012). Кроме того, неясно, играет ли HIF-1α центральную роль в гипоксическом прекондиционировании, как утверждают различные исследования (Grimm et al., 2005; Shao et al., 2007; Ara et al., 2011) или против (Li et al. ., 2011) такую роль. Хотя HIF-1 сохраняет нейропротекторные и антиапоптотические свойства, существуют экспериментальные данные, указывающие на неблагоприятное воздействие стабилизированного HIF-1α на нейрональную ткань. Например, стабилизация HIF-1 вызывает дефекты направления аксонов и миграции нейронов в C. elegans (Pocock and Hobert, 2008) и способствует нейродегенерации в мозге новорожденных крыс (Jiang et al., 2012). Кроме того, HIF-1 в C. elegans отрицательно регулирует увеличение продолжительности жизни за счет диетических ограничений, действуя на серотонинергические нейроны ADF и NSM (Chen et al.
, 2012). Недавно было показано, что HIF-1α регулирует экспрессию прионного белка в нейрональных клетках гиппокампа для защиты от повреждения клеток (Jeong et al., 2012). Кроме того, неясно, играет ли HIF-1α центральную роль в гипоксическом прекондиционировании, как утверждают различные исследования (Grimm et al., 2005; Shao et al., 2007; Ara et al., 2011) или против (Li et al. ., 2011) такую роль. Хотя HIF-1 сохраняет нейропротекторные и антиапоптотические свойства, существуют экспериментальные данные, указывающие на неблагоприятное воздействие стабилизированного HIF-1α на нейрональную ткань. Например, стабилизация HIF-1 вызывает дефекты направления аксонов и миграции нейронов в C. elegans (Pocock and Hobert, 2008) и способствует нейродегенерации в мозге новорожденных крыс (Jiang et al., 2012). Кроме того, HIF-1 в C. elegans отрицательно регулирует увеличение продолжительности жизни за счет диетических ограничений, действуя на серотонинергические нейроны ADF и NSM (Chen et al. , 2009). Однако исследования других групп сообщают, что в одном и том же организме HIF-1 способствует долголетию (Mehta et al., 2009; Zhang et al., 2009; Lee et al., 2010). Это несоответствие было рассмотрено в двух более поздних исследованиях, где было показано, что HIF-1 регулирует продолжительность жизни в зависимости от температуры (Hwang and Lee, 2011; Leiser et al., 2011). Таким образом, возможно, что роль HIF-1 в долголетии зависит от контекста и может вовлекать разные нейроны или другие клетки в разных условиях. Пока Недавно было обнаружено, что нейроны C. elegans воспринимают гипоксию и реагируют на нее независимым от HIF образом (Park et al., 2012). эффекторы. И это несмотря на то, что нейропротекторные свойства HIF могут вызывать побочные эффекты в других аспектах физиологии нейронов.
, 2009). Однако исследования других групп сообщают, что в одном и том же организме HIF-1 способствует долголетию (Mehta et al., 2009; Zhang et al., 2009; Lee et al., 2010). Это несоответствие было рассмотрено в двух более поздних исследованиях, где было показано, что HIF-1 регулирует продолжительность жизни в зависимости от температуры (Hwang and Lee, 2011; Leiser et al., 2011). Таким образом, возможно, что роль HIF-1 в долголетии зависит от контекста и может вовлекать разные нейроны или другие клетки в разных условиях. Пока Недавно было обнаружено, что нейроны C. elegans воспринимают гипоксию и реагируют на нее независимым от HIF образом (Park et al., 2012). эффекторы. И это несмотря на то, что нейропротекторные свойства HIF могут вызывать побочные эффекты в других аспектах физиологии нейронов.
Факторы теплового шока и белки теплового шока
Факторы теплового шока (HSF) представляют собой индуцируемые стрессом факторы транскрипции, которые при индукции положительно регулируют экспрессию белков теплового шока (HSP) посредством прямого связывания со своими промоторами, содержащими элементы теплового шока (HSEs; НГААН; Шамовский, Нудлер, 2008). Главным регулятором реакции на тепловой шок является HSF-1, который в нормальных условиях находится в мономерной неактивной форме (Shamovsky and Nudler, 2008). При различных стрессовых условиях HSF-1 образует активный тример, который проникает в ядро, чтобы активировать HSP (рис. 3В; Shamovsky and Nudler, 2008). Регуляция HSP с помощью HSF высококонсервативна от дрожжей до млекопитающих (Liu et al., 19).97). HSP функционируют как молекулярные шапероны, облегчающие правильное сворачивание других клеточных белков. Неправильный фолдинг белка может возникать в нормальных клеточных условиях и при различных стрессах. Также было показано, что чрезмерное возбуждение двигательных нейронов может вызывать неправильный фолдинг белков в постсинаптических мышечных клетках у C. elegans (Garcia et al., 2007). Индукция HSF в нейронах и других типах клеток стимулируется не только гипертермией, как следует из ее названия, но и другими стрессами, такими как гипоксия, изменения внутриклеточной окислительно-восстановительной среды и воздействие тяжелых металлов и аналогов аминокислот.
Главным регулятором реакции на тепловой шок является HSF-1, который в нормальных условиях находится в мономерной неактивной форме (Shamovsky and Nudler, 2008). При различных стрессовых условиях HSF-1 образует активный тример, который проникает в ядро, чтобы активировать HSP (рис. 3В; Shamovsky and Nudler, 2008). Регуляция HSP с помощью HSF высококонсервативна от дрожжей до млекопитающих (Liu et al., 19).97). HSP функционируют как молекулярные шапероны, облегчающие правильное сворачивание других клеточных белков. Неправильный фолдинг белка может возникать в нормальных клеточных условиях и при различных стрессах. Также было показано, что чрезмерное возбуждение двигательных нейронов может вызывать неправильный фолдинг белков в постсинаптических мышечных клетках у C. elegans (Garcia et al., 2007). Индукция HSF в нейронах и других типах клеток стимулируется не только гипертермией, как следует из ее названия, но и другими стрессами, такими как гипоксия, изменения внутриклеточной окислительно-восстановительной среды и воздействие тяжелых металлов и аналогов аминокислот. Моримото и др., 1997). Также было показано, что HSP активируются при ишемическом прекондиционировании (Liu et al., 1993; Kato et al., 1995). Нейропротекторные свойства HSF-1, основного регулятора реакции теплового шока у C. elegans , были продемонстрированы в двух недавних исследованиях, в которых активация HSF-1 подавляла дефектные фенотипы нейронов мутантной модели болезни Мачадо-Джозефа (Teixeira -Castro et al., 2011) и HSF-1, а также небольшой белок теплового шока HSP-16.1 опосредуют цитопротекцию путем термического прекондиционирования (Kourtis et al., 2012). Помимо HSPs, HSFs могут индуцировать транскрипцию др. белков с различными функциями (Akerfelt et al., 2010). Некоторые из них обладают нейропротекторными функциями при стрессе. Например, при тепловом шоке в Drosophila , HSFs индуцируют экспрессию фермента синтеза NAD, никотинамидмононуклеотидаденилилтрансферазы (NMNAT), который имеет решающее значение для поддержания нейронов в условиях стресса (Ali et al., 2011).
Моримото и др., 1997). Также было показано, что HSP активируются при ишемическом прекондиционировании (Liu et al., 1993; Kato et al., 1995). Нейропротекторные свойства HSF-1, основного регулятора реакции теплового шока у C. elegans , были продемонстрированы в двух недавних исследованиях, в которых активация HSF-1 подавляла дефектные фенотипы нейронов мутантной модели болезни Мачадо-Джозефа (Teixeira -Castro et al., 2011) и HSF-1, а также небольшой белок теплового шока HSP-16.1 опосредуют цитопротекцию путем термического прекондиционирования (Kourtis et al., 2012). Помимо HSPs, HSFs могут индуцировать транскрипцию др. белков с различными функциями (Akerfelt et al., 2010). Некоторые из них обладают нейропротекторными функциями при стрессе. Например, при тепловом шоке в Drosophila , HSFs индуцируют экспрессию фермента синтеза NAD, никотинамидмононуклеотидаденилилтрансферазы (NMNAT), который имеет решающее значение для поддержания нейронов в условиях стресса (Ali et al., 2011).
Экспрессия HSF-1 в нейронах строго контролируется (Dirks et al., 2010), а повышенная восприимчивость нейронов к воздействию теплового шока связана с отсроченным началом экспрессии HSF-1 (Batulan et al., 2003; Керн и др., 2010). Однако HSP могут играть более специфичную для нейронов роль в нормальных условиях, поскольку некоторые HSP конститутивно более сильно экспрессируются в нейронах, чем в других клетках (Chen and Brown, 2007). Недавно была признана полезная роль экспрессии HSP (Rordorf et al., 19).91) и может индуцироваться химическими соединениями, служащими лекарственными средствами против различных дегенеративных заболеваний (Katsuno et al., 2005; Chow, Brown, 2007). Многие HSFs и HSP также регулируются вверх и вниз во время нормального развития разных видов (Akerfelt et al., 2010), что может свидетельствовать о защитной роли этих белков в отношении внутреннего стресса развития. Более того, HSP связаны с нормальным и аномальным эмбриональным развитием (Evans et al., 2005; Brown et al. , 2007), и было показано, что экспрессия HSP зависит от фазы и ткани (Loones et al., 19).97; Масуда и др., 1998). HSF и HSP также участвуют в старении. Было показано, что при сверхэкспрессии Hsp22 в моторных нейронах продолжительность жизни Drosophila увеличивается на 30% (Morrow et al., 2004), а мухи дольше сохраняют свою двигательную активность и становятся более устойчивыми к окислительному стрессу и гипертермии (Morrow et al. др., 2004). У C. elegans HSF-1 способствует долголетию, действуя на нейроны и другие ткани (Lithgow et al., 1995; Hsu et al., 2003; Morley and Morimoto, 2004). Наконец, реакция теплового шока термосенсорных нейронов AFD и AIY в C. elegans включает активацию белка Hsp70 (Prahlad et al., 2008). Таким образом, очевидно, что HSF и HSP участвуют в основных механизмах ответа на множество различных стрессов, имеющих особое значение для функции нервных клеток.
, 2007), и было показано, что экспрессия HSP зависит от фазы и ткани (Loones et al., 19).97; Масуда и др., 1998). HSF и HSP также участвуют в старении. Было показано, что при сверхэкспрессии Hsp22 в моторных нейронах продолжительность жизни Drosophila увеличивается на 30% (Morrow et al., 2004), а мухи дольше сохраняют свою двигательную активность и становятся более устойчивыми к окислительному стрессу и гипертермии (Morrow et al. др., 2004). У C. elegans HSF-1 способствует долголетию, действуя на нейроны и другие ткани (Lithgow et al., 1995; Hsu et al., 2003; Morley and Morimoto, 2004). Наконец, реакция теплового шока термосенсорных нейронов AFD и AIY в C. elegans включает активацию белка Hsp70 (Prahlad et al., 2008). Таким образом, очевидно, что HSF и HSP участвуют в основных механизмах ответа на множество различных стрессов, имеющих особое значение для функции нервных клеток.
Сигнальные молекулы
Митоген-активируемые протеинкиназы
Митоген-активированные протеинкиназы (MAP) являются важными молекулами передачи сигнала, которые опосредуют ответ на сигналы окружающей среды практически во всех типах клеток и играют ключевые роли в клеточных функциях, таких как дифференцировка, клеточная выживаемость и апоптоз (Gehart et al. , 2010). Эта и другие общие роли некоторых МАР-киназ в нейронах были продемонстрированы несколько лет назад (Fukunaga and Miyamoto, 19).98). На сегодняшний день известны подсемейства МАРК, такие как киназы, регулируемые внеклеточными сигналами (ERK1/2), ERK5 (также известные как BMK1 или MAPK7), амино-концевые киназы Jun (JNK) 1–3 и p38. киназы (p38α, β, γ и δ; Gehart et al., 2010). Точное содержание и особенности различных путей MAPK описаны в другом месте (Dhillon et al., 2007). Однако общая схема передачи сигналов MAPK следует последовательности «стимул — G-белок — MAPKKK — MAPKK — MAPK-конечный ответ» (Dhillon et al., 2007). Пути MAPK, активируемые стрессом, по существу представляют собой киназы JNK и p38 (Fig. 3D; Dhillon et al., 2007).
, 2010). Эта и другие общие роли некоторых МАР-киназ в нейронах были продемонстрированы несколько лет назад (Fukunaga and Miyamoto, 19).98). На сегодняшний день известны подсемейства МАРК, такие как киназы, регулируемые внеклеточными сигналами (ERK1/2), ERK5 (также известные как BMK1 или MAPK7), амино-концевые киназы Jun (JNK) 1–3 и p38. киназы (p38α, β, γ и δ; Gehart et al., 2010). Точное содержание и особенности различных путей MAPK описаны в другом месте (Dhillon et al., 2007). Однако общая схема передачи сигналов MAPK следует последовательности «стимул — G-белок — MAPKKK — MAPKK — MAPK-конечный ответ» (Dhillon et al., 2007). Пути MAPK, активируемые стрессом, по существу представляют собой киназы JNK и p38 (Fig. 3D; Dhillon et al., 2007).
Путь JNK может индуцироваться окислительным и осмотическим стрессом, УФ-излучением и другими агентами, повреждающими ДНК, для модуляции белка-активатора-1 (AP1) и других факторов транскрипции, таких как HSF-1 и HIF-1 (Park and Liu, 2001; Antoniou and Borsello, 2012) для регуляции клеточных реакций на стресс. Апоптоз нейронов после стресса положительно регулируется путем JNK (Weston and Davis, 2002; Biteau et al., 2011), и передача сигналов JNK/MAPK также участвует в регенерации аксонов после повреждения в C. elegans (Hammarlund et al., 2009; Yan et al., 2009; Li et al., 2012). Кроме того, путь JNK в нейронах способствует долголетию организма за счет активации нейропротекторных механизмов у Drosophila (Lee et al., 2009; Biteau et al., 2011; Takahama et al., 2012) и у C. elegans (Oh и др., 2005). Наконец, путь JNK может действовать, модулируя факторы транскрипции FOXO и противодействуя факторам инсулина/ИФР-1, чтобы регулировать различные аспекты стрессоустойчивости и старения (Wang et al., 2005; Neumann-Haefelin et al., 2008).
Апоптоз нейронов после стресса положительно регулируется путем JNK (Weston and Davis, 2002; Biteau et al., 2011), и передача сигналов JNK/MAPK также участвует в регенерации аксонов после повреждения в C. elegans (Hammarlund et al., 2009; Yan et al., 2009; Li et al., 2012). Кроме того, путь JNK в нейронах способствует долголетию организма за счет активации нейропротекторных механизмов у Drosophila (Lee et al., 2009; Biteau et al., 2011; Takahama et al., 2012) и у C. elegans (Oh и др., 2005). Наконец, путь JNK может действовать, модулируя факторы транскрипции FOXO и противодействуя факторам инсулина/ИФР-1, чтобы регулировать различные аспекты стрессоустойчивости и старения (Wang et al., 2005; Neumann-Haefelin et al., 2008).
Киназный путь р38 может индуцироваться стрессами, такими как гипоксия, окислительный стресс, ИК- и УФ-облучение, и он в основном участвует в индукции апоптоза нейронов при различных стрессах (Horstmann et al., 1998; Namgung and Xia, 2000; Чой и др. , 2004; Го и Бхат, 2007). Путь p38, по-видимому, также играет роль в нейропротекции против ишемии после прекондиционирования изофлураном (Zheng and Zuo, 2004). Однако путь р38 играет в нейронах другие роли, помимо реакции на стресс (Takeda and Ichijo, 2002).
, 2004; Го и Бхат, 2007). Путь p38, по-видимому, также играет роль в нейропротекции против ишемии после прекондиционирования изофлураном (Zheng and Zuo, 2004). Однако путь р38 играет в нейронах другие роли, помимо реакции на стресс (Takeda and Ichijo, 2002).
Мишень рапамицина
Мишень рапамицина (TOR) представляет собой эволюционно консервативную серин/треонинкиназу, играющую важную роль преимущественно в регуляции роста и пролиферации клеток, с последствиями во многих различных аспектах развития, старения и заболеваний (Wullschleger et al., 2006). ). TOR функционирует как датчик внеклеточных сигналов, включая стрессоры, такие как гипоксия и лишение питательных веществ, и обнаруживается в двух функционально различных комплексах, а именно TORC1 и TORC2 (рис. 3D). Ингибирование передачи сигналов TOR увеличивает продолжительность жизни многих организмов, включая мышей и Drosophila , частично за счет снижения трансляции мРНК (Harrison et al., 2009; Bjedov et al., 2010). Несмотря на то, что TOR млекопитающих экспрессируется повсеместно, он играет обширную роль в развитии и пластичности нейронов (Jaworski and Sheng, 2006; Chong et al., 2010; Hoeffer and Klann, 2010). Также недавно было обнаружено, что TOR важен для синаптического гомеостаза у Drosophila (Penney et al., 2012) и для синаптической пластичности после ишемии у крыс (Ghiglieri et al., 2010). mTOR может также участвовать в регуляции HIF-1alpha в развивающемся мозге крыс с гипоксией-ишемией (Chen et al., 2012). Однако роль передачи сигналов TOR в опосредовании стрессовых реакций в нейронах до конца не выяснена.
Несмотря на то, что TOR млекопитающих экспрессируется повсеместно, он играет обширную роль в развитии и пластичности нейронов (Jaworski and Sheng, 2006; Chong et al., 2010; Hoeffer and Klann, 2010). Также недавно было обнаружено, что TOR важен для синаптического гомеостаза у Drosophila (Penney et al., 2012) и для синаптической пластичности после ишемии у крыс (Ghiglieri et al., 2010). mTOR может также участвовать в регуляции HIF-1alpha в развивающемся мозге крыс с гипоксией-ишемией (Chen et al., 2012). Однако роль передачи сигналов TOR в опосредовании стрессовых реакций в нейронах до конца не выяснена.
Передача сигналов инсулина/ИФР-1. Путь инсулина/ИФР-1 — это хорошо изученный путь, который регулирует старение и продолжительность жизни у многих различных видов (van Heemst et al., 2005). Сложность пути передачи сигналов Insulin/IGF-1 (IIS) сильно возросла в ходе эволюции (van Heemst et al., 2005). У нематоды C. elegans , у которой участие этого пути в старении было впервые обнаружено и широко изучено, рецептор инсулиноподобного фактора роста DAF-2 активируется инсулиноподобными пептидами (ILP; 40 кодируется в геноме червя). которые в основном экспрессируются в нейронах (Pierce et al., 2001; Li et al., 2003; Husson et al., 2007; Cornils et al., 2011). После связывания лиганда сигнал передается непосредственно или через белок-1, гомолог субстрата инсулинового рецептора (IST-1), на фосфатидилинозитол-3-киназу (PI-3K), состоящую из каталитической субъединицы AGE-1 (изменение старения-1) и регуляторная субъединица ААР-1 (субъединица фосфоинозитидкиназы AdAPter), которая превращает фосфатидилинозитол-4,5-бисфосфат (PIP 2 ) в фосфатидилинозитол 3,4,5-трифосфат (PIP 3 ; van Heemst, 2010). PIP 3 активирует 3-фосфоинозитид-зависимую протеинкиназу-1 (PDK1) и протеинкиназы B (известную как AKT-1/2), что приводит к фосфорилированию DAF-16, гомолога семейства FoxO млекопитающих факторы транскрипции (van Heemst, 2010). Фосфорилированный DAF-16 остается в цитоплазме, в то время как нефосфорилированный DAF-16 проникает в ядро, чтобы регулировать набор генов реакции на стресс (рис. 3D; Lin et al.
которые в основном экспрессируются в нейронах (Pierce et al., 2001; Li et al., 2003; Husson et al., 2007; Cornils et al., 2011). После связывания лиганда сигнал передается непосредственно или через белок-1, гомолог субстрата инсулинового рецептора (IST-1), на фосфатидилинозитол-3-киназу (PI-3K), состоящую из каталитической субъединицы AGE-1 (изменение старения-1) и регуляторная субъединица ААР-1 (субъединица фосфоинозитидкиназы AdAPter), которая превращает фосфатидилинозитол-4,5-бисфосфат (PIP 2 ) в фосфатидилинозитол 3,4,5-трифосфат (PIP 3 ; van Heemst, 2010). PIP 3 активирует 3-фосфоинозитид-зависимую протеинкиназу-1 (PDK1) и протеинкиназы B (известную как AKT-1/2), что приводит к фосфорилированию DAF-16, гомолога семейства FoxO млекопитающих факторы транскрипции (van Heemst, 2010). Фосфорилированный DAF-16 остается в цитоплазме, в то время как нефосфорилированный DAF-16 проникает в ядро, чтобы регулировать набор генов реакции на стресс (рис. 3D; Lin et al. , 2001; Lee et al., 2003a; Murphy et al., 2003). .
, 2001; Lee et al., 2003a; Murphy et al., 2003). .
Хотя было обнаружено, что рецептор инсулина экспрессируется в нейронной ткани (Havrankova et al., 1978; Unger et al., 1989), и его распределение, по-видимому, повышено в определенных областях мозга (Schulingkamp et al., 2000), его роль в нейронах не ясно. Поскольку нейроны могут поглощать глюкозу без участия инсулина или рецептора инсулина, эти клетки считались «нечувствительными к инсулину». Клайн и его коллеги предоставили первые 90 282 in vivo 90 283 доказательства того, что инсулиновый путь регулирует функцию нейронной цепи и поддержание синапсов в центральной нервной системе 9.0282 головастиков Xenopus (Chiu et al., 2008). Предыдущие исследования также продемонстрировали роль передачи сигналов инсулина в регуляции продолжительности жизни в нейронах C. elegans (Kenyon et al., 1993; Kimura et al., 1997; Apfeld and Kenyon, 1998; Wolkow et al., 2000). , в нейроэндокринных клетках дрозофилы (Tatar et al., 2001) и в мозге млекопитающих (Kappeler et al. , 2008). Ряд других исследований выявил роль нейронального инсулинового пути в энергетическом гомеостазе (Konner et al., 2011; Freude et al., 2012), синаптической пластичности (Oda et al., 2011; Costello et al., 2012), и апоптоз нейронов после гипоксического инсульта (Liu et al., 2011). Интересно, что IIS также регулирует обучение хемотаксису солей у C. elegans (Tomioka et al., 2006). Инсулиновый путь может также автономно действовать на неклеточные нейроны, чтобы регулировать старение нейронов (Pan et al., 2011), а также было показано, что он действует на нейроны, подавляя выживание организма в условиях гипоксии (Scott et al., 2002). В целом, роль инсулинового пути в нейронных тканях многих организмов может варьироваться от регуляции старения до чувствительности к гипоксии.
, 2008). Ряд других исследований выявил роль нейронального инсулинового пути в энергетическом гомеостазе (Konner et al., 2011; Freude et al., 2012), синаптической пластичности (Oda et al., 2011; Costello et al., 2012), и апоптоз нейронов после гипоксического инсульта (Liu et al., 2011). Интересно, что IIS также регулирует обучение хемотаксису солей у C. elegans (Tomioka et al., 2006). Инсулиновый путь может также автономно действовать на неклеточные нейроны, чтобы регулировать старение нейронов (Pan et al., 2011), а также было показано, что он действует на нейроны, подавляя выживание организма в условиях гипоксии (Scott et al., 2002). В целом, роль инсулинового пути в нейронных тканях многих организмов может варьироваться от регуляции старения до чувствительности к гипоксии.
Оксид азота
Оксид азота (NO) представляет собой свободный радикал, важный для клеточной передачи сигналов и выполняющий ряд физиологических функций, таких как синаптическая пластичность и нейротрансмиссия. Фермент, ответственный за продукцию NO в нейронах, представляет собой нейрональную синтазу оксида азота (nNOS), которая опосредует генерацию L -цитруллин из L -аргинина (рис. 3D; Zhou and Zhu, 2009). nNOS реагирует на уровни кислорода и активируется гипоксией в различных нейронах (AbuSoud et al., 1996; Prabhakar et al., 1996). NO регулирует различные факторы транскрипции, связанные со стрессом, такие как HIF-1 и NF-kB (Contestabile, 2008; Keswani et al., 2011), и может приводить к гибели нейронов при различных стрессовых условиях (Brown, 2010). Интересно, что NO в нейронах также может индуцироваться крайне низкочастотными магнитными полями (ELF-MF) в мозгу крыс, обычным стрессором, исходящим от электрических устройств (Cho et al., 2012). Таким образом, NO, по-видимому, является важной неорганической молекулой для реакции нейронов на стресс.
Фермент, ответственный за продукцию NO в нейронах, представляет собой нейрональную синтазу оксида азота (nNOS), которая опосредует генерацию L -цитруллин из L -аргинина (рис. 3D; Zhou and Zhu, 2009). nNOS реагирует на уровни кислорода и активируется гипоксией в различных нейронах (AbuSoud et al., 1996; Prabhakar et al., 1996). NO регулирует различные факторы транскрипции, связанные со стрессом, такие как HIF-1 и NF-kB (Contestabile, 2008; Keswani et al., 2011), и может приводить к гибели нейронов при различных стрессовых условиях (Brown, 2010). Интересно, что NO в нейронах также может индуцироваться крайне низкочастотными магнитными полями (ELF-MF) в мозгу крыс, обычным стрессором, исходящим от электрических устройств (Cho et al., 2012). Таким образом, NO, по-видимому, является важной неорганической молекулой для реакции нейронов на стресс.
МикроРНК
МикроРНК (миРНК) представляют собой небольшие некодирующие молекулы РНК длиной примерно 22 нуклеотида, которые действуют как посттранскрипционные регуляторы экспрессии генов (Ebert and Sharp, 2012). Они обладают способностью точно настраивать экспрессию, чтобы гарантировать стабильность при внезапных внешних или внутренних возмущениях или, при необходимости, обеспечивать выполнение новой программы экспрессии генов, позволяющей организму выдерживать новую среду (Ebert and Sharp, 2012). miRNAs транскрибируются, в основном, РНК-полимеразой II (Pol II) в виде кэпированных и полиаденилированных первичных miRNAs (pri-miRNAs), которые складываются в удлиненные шпилечные структуры. pri-miRNAs расщепляются в ядре ферментом RNase III Drosha, создавая более короткие предшественники miRNA (pre-miRNA; Lee et al., 2003b). Пре-миРНК транспортируется экспортином-5 (XPO5) через нуклеопорный комплекс (NPC; Yi et al., 2003) из ядра (Lee et al., 2011), где далее процессируется ферментом РНКазой II, Dicer. , и включается в Argonaute-содержащий РНК-индуцированный комплекс молчания (RISC; Lee et al., 2002). В комплексе RISC миРНК связывается со специфической мРНК-мишенью путем несовершенного спаривания оснований с ее 3′-UTR и опосредует посттранскрипционную репрессию (PTR) или распад специфических мРНК-мишеней (рис.
Они обладают способностью точно настраивать экспрессию, чтобы гарантировать стабильность при внезапных внешних или внутренних возмущениях или, при необходимости, обеспечивать выполнение новой программы экспрессии генов, позволяющей организму выдерживать новую среду (Ebert and Sharp, 2012). miRNAs транскрибируются, в основном, РНК-полимеразой II (Pol II) в виде кэпированных и полиаденилированных первичных miRNAs (pri-miRNAs), которые складываются в удлиненные шпилечные структуры. pri-miRNAs расщепляются в ядре ферментом RNase III Drosha, создавая более короткие предшественники miRNA (pre-miRNA; Lee et al., 2003b). Пре-миРНК транспортируется экспортином-5 (XPO5) через нуклеопорный комплекс (NPC; Yi et al., 2003) из ядра (Lee et al., 2011), где далее процессируется ферментом РНКазой II, Dicer. , и включается в Argonaute-содержащий РНК-индуцированный комплекс молчания (RISC; Lee et al., 2002). В комплексе RISC миРНК связывается со специфической мРНК-мишенью путем несовершенного спаривания оснований с ее 3′-UTR и опосредует посттранскрипционную репрессию (PTR) или распад специфических мРНК-мишеней (рис. 3C; Lee et al., 2002, 2003b). , 2011; Паскинелли, 2012). Надежность в системах, которые контролируют клеточную судьбу, переходы в развитии и реакцию на стресс, требуется в изменяющихся условиях, поскольку колебания внутренней или внешней среды могут быть фатальными для организма. miRNAs могут генерировать быстрые и обратимые ответы и, таким образом, являются идеальными молекулами для опосредования ответов на стресс. Как делеция отдельных микроРНК (Miska et al., 2007) или целых семейств микроРНК в C. elegans (Alvarez-Saavedra and Horvitz, 2010) практически не влияет на жизнеспособность и развитие, и, поскольку большинство мышей с нокаутом микроРНК не проявляют каких-либо выраженных фенотипов (Park et al., 2010), полагают, что основная функция miRNAs может заключаться в буферизации экспрессии генов, когда организм подвергается стрессовым воздействиям. Поддерживая эту идею, Чжан и его коллеги показали, что делеция mir-71 нарушала долговременное выживание нематод во время индуцированной голоданием диапаузы L1 (Zhang et al.
3C; Lee et al., 2002, 2003b). , 2011; Паскинелли, 2012). Надежность в системах, которые контролируют клеточную судьбу, переходы в развитии и реакцию на стресс, требуется в изменяющихся условиях, поскольку колебания внутренней или внешней среды могут быть фатальными для организма. miRNAs могут генерировать быстрые и обратимые ответы и, таким образом, являются идеальными молекулами для опосредования ответов на стресс. Как делеция отдельных микроРНК (Miska et al., 2007) или целых семейств микроРНК в C. elegans (Alvarez-Saavedra and Horvitz, 2010) практически не влияет на жизнеспособность и развитие, и, поскольку большинство мышей с нокаутом микроРНК не проявляют каких-либо выраженных фенотипов (Park et al., 2010), полагают, что основная функция miRNAs может заключаться в буферизации экспрессии генов, когда организм подвергается стрессовым воздействиям. Поддерживая эту идею, Чжан и его коллеги показали, что делеция mir-71 нарушала долговременное выживание нематод во время индуцированной голоданием диапаузы L1 (Zhang et al. , 2011b). Кроме того, было показано, что миР-7 необходима для поддержания регуляторной стабильности при температурном стрессе во время развития Орган чувств дрозофилы (Li et al., 2009b). miRNAs обильно экспрессируются в нервной системе, и связь между miRNAs и реакциями нейронов на стресс была продемонстрирована в различных модельных системах. Совсем недавно mir-71 также был связан с увеличением продолжительности жизни у C. elegans (Boulias and Horvitz, 2012). Это исследование показало, что экспрессия mir-71 только в нейронах была достаточной для обеспечения долголетия, опосредованного зародышевой линией, и предложила модель, в которой mir-71 опосредует сигналы, увеличивающие продолжительность жизни, через транскрипционный фактор DAF-16/FOXO в нервной системе. Прямой механизм, с помощью которого нейроны воспринимают внутреннее напряжение, не ясен; однако было показано, что функция миР-71 частично зависит от экспрессии TCER-1 (Boulias and Horvitz, 2012), фактора элонгации транскрипции, который, как было показано, способствует транскрипционной активности DAF-16 в кишечнике (Ghazi et al.
, 2011b). Кроме того, было показано, что миР-7 необходима для поддержания регуляторной стабильности при температурном стрессе во время развития Орган чувств дрозофилы (Li et al., 2009b). miRNAs обильно экспрессируются в нервной системе, и связь между miRNAs и реакциями нейронов на стресс была продемонстрирована в различных модельных системах. Совсем недавно mir-71 также был связан с увеличением продолжительности жизни у C. elegans (Boulias and Horvitz, 2012). Это исследование показало, что экспрессия mir-71 только в нейронах была достаточной для обеспечения долголетия, опосредованного зародышевой линией, и предложила модель, в которой mir-71 опосредует сигналы, увеличивающие продолжительность жизни, через транскрипционный фактор DAF-16/FOXO в нервной системе. Прямой механизм, с помощью которого нейроны воспринимают внутреннее напряжение, не ясен; однако было показано, что функция миР-71 частично зависит от экспрессии TCER-1 (Boulias and Horvitz, 2012), фактора элонгации транскрипции, который, как было показано, способствует транскрипционной активности DAF-16 в кишечнике (Ghazi et al. , 2009). Системный стресс также может быть вызван алкоголем, и было показано, что адаптация нейронов к этому стрессу вызывает быстрое увеличение миР-9.экспрессия в нейронах (Pietrzykowski et al., 2008). Это привело к транскрипции активируемой напряжением изоформы калиевого канала, связанной с повышением толерантности к алкоголю. Этот процесс может представлять собой общий механизм адаптации нейронов к алкоголю и предполагает, что miR-9 играет важную роль в пластичности нейронов (Pietrzykowski et al., 2008). Исследование первичных нейрональных клеток гиппокампа крысы также показало, что при гипоксии семейство miR-130 сильно экспрессируется (Saito et al., 2011). В частности, miR-130a, по-видимому, снижает уровни белка DDX6, нормальная функция которого заключается в ограничении мРНК HIF 1α (HIF-1α) P-тельцами нейрональных клеток гиппокампа мышей (Saito et al., 2011). При гипоксии из этих очагов высвобождается мРНК HIF-1α, и этот белок может регулировать кислородный гомеостаз (Saito et al., 2011).
, 2009). Системный стресс также может быть вызван алкоголем, и было показано, что адаптация нейронов к этому стрессу вызывает быстрое увеличение миР-9.экспрессия в нейронах (Pietrzykowski et al., 2008). Это привело к транскрипции активируемой напряжением изоформы калиевого канала, связанной с повышением толерантности к алкоголю. Этот процесс может представлять собой общий механизм адаптации нейронов к алкоголю и предполагает, что miR-9 играет важную роль в пластичности нейронов (Pietrzykowski et al., 2008). Исследование первичных нейрональных клеток гиппокампа крысы также показало, что при гипоксии семейство miR-130 сильно экспрессируется (Saito et al., 2011). В частности, miR-130a, по-видимому, снижает уровни белка DDX6, нормальная функция которого заключается в ограничении мРНК HIF 1α (HIF-1α) P-тельцами нейрональных клеток гиппокампа мышей (Saito et al., 2011). При гипоксии из этих очагов высвобождается мРНК HIF-1α, и этот белок может регулировать кислородный гомеостаз (Saito et al., 2011). Также было показано, что экспрессия miRNAs в ответ на стресс является клеточно-специфичной. В анализе на основе первичных клеточных культур астроциты и нейроны подвергались кислородно-глюкозной депривации для имитации ишемии, которая является важным признаком черепно-мозговых травм (Ziu et al., 2011). В этой модели разные панели miRNAs активировались в двух типах клеток, что указывает на то, что разные нейроны используют разные биохимические пути для ответа на физиологический стресс (Ziu et al., 2011). Вместе эти исследования показывают, что miRNAs вовлечены в реакции нейронов на стресс. Однако ожидается, что дальнейшие исследования ответят на дополнительные вопросы о том, как miRNAs регулируют реакцию нейронов на стресс и определят их влияние на гомеостаз организма.
Также было показано, что экспрессия miRNAs в ответ на стресс является клеточно-специфичной. В анализе на основе первичных клеточных культур астроциты и нейроны подвергались кислородно-глюкозной депривации для имитации ишемии, которая является важным признаком черепно-мозговых травм (Ziu et al., 2011). В этой модели разные панели miRNAs активировались в двух типах клеток, что указывает на то, что разные нейроны используют разные биохимические пути для ответа на физиологический стресс (Ziu et al., 2011). Вместе эти исследования показывают, что miRNAs вовлечены в реакции нейронов на стресс. Однако ожидается, что дальнейшие исследования ответят на дополнительные вопросы о том, как miRNAs регулируют реакцию нейронов на стресс и определят их влияние на гомеостаз организма.
Обсуждение
Физический мир построен на принципах, определяющих использование и управление энергией. Все эти принципы связаны основными законами физики и подчиняются одним и тем же основным ограничениям и ограничениям. Мы можем думать о живых организмах как о биологических двигателях, использующих свои структуры для использования энергии, чтобы выжить и размножаться в определенной среде. Негативное биологическое воздействие стресса на живые системы заключается в неспособности последних функционировать и продолжать использовать энергию при определенных условиях. Это может отражать либо ограниченность некоторых основных принципов, когда, например, никакая жизнь не может развиваться при температуре абсолютного нуля (-273 °C), либо отсутствие адаптации конкретного организма к данной среде, когда, например, слон не может выжить в Антарктиде, а белый медведь не может выжить в африканской саванне. Помимо таких крайних несоответствий между жизнью и условиями окружающей среды, есть более мягкие, которые определяют стресс, как мы обсуждаем здесь. Стрессовые условия часто различаются между организмами, поскольку разные виды адаптировались к разным условиям. Степень, в которой каждый вид принял механизмы защиты от стрессоров, может отражать степень наличия соответствующих условий в ходе эволюции.
Мы можем думать о живых организмах как о биологических двигателях, использующих свои структуры для использования энергии, чтобы выжить и размножаться в определенной среде. Негативное биологическое воздействие стресса на живые системы заключается в неспособности последних функционировать и продолжать использовать энергию при определенных условиях. Это может отражать либо ограниченность некоторых основных принципов, когда, например, никакая жизнь не может развиваться при температуре абсолютного нуля (-273 °C), либо отсутствие адаптации конкретного организма к данной среде, когда, например, слон не может выжить в Антарктиде, а белый медведь не может выжить в африканской саванне. Помимо таких крайних несоответствий между жизнью и условиями окружающей среды, есть более мягкие, которые определяют стресс, как мы обсуждаем здесь. Стрессовые условия часто различаются между организмами, поскольку разные виды адаптировались к разным условиям. Степень, в которой каждый вид принял механизмы защиты от стрессоров, может отражать степень наличия соответствующих условий в ходе эволюции.
Внутренний стресс развития и старение также могут считаться селективными факторами для генов, дающих преимущество в выживании в ходе эволюции, точно так же, как это делает внешний стресс окружающей среды. Стресс, вызванный развитием, мог побудить организмы принять определенные программы развития, которые привели к окончательным структурам; и старение, возможно, выбрало молекулярные пути, которые приводят различные организмы к достижению продолжительности здоровья, соответствующей их экологической роли. Учитывая клеточные свойства нейронов и их задокументированное участие в реакциях на стресс, нервная система может представлять собой «горячую точку» для эволюционной адаптации организмов к различным стрессам. В этом смысле стресс можно рассматривать как движущую силу биоразнообразия в долгосрочной перспективе, которая, возможно, особенно применялась на разных уровнях нейронной организации для отбора разнообразных механизмов адаптации к стрессу, которые мы здесь представили. Однако роль нейронов в старении высших организмов еще недостаточно изучена. Большая часть наших знаний в этой области основана на моделях беспозвоночных, для которых характерно, что долгоживущие мутанты животных проявляют устойчивость к различным стрессам (Kourtis and Tavernarakis, 2011). Тем не менее, явно существует дополнительный уровень активной регуляции старения и долголетия нейронами, который выходит за рамки простой устойчивости к стрессу окружающей среды.
Большая часть наших знаний в этой области основана на моделях беспозвоночных, для которых характерно, что долгоживущие мутанты животных проявляют устойчивость к различным стрессам (Kourtis and Tavernarakis, 2011). Тем не менее, явно существует дополнительный уровень активной регуляции старения и долголетия нейронами, который выходит за рамки простой устойчивости к стрессу окружающей среды.
В течение жизни организма стрессовые условия создают нагрузку, с которой необходимо бороться и преодолевать ее, чтобы выжить и размножаться. Мы описали механизмы, разработанные для этой цели; однако стресс часто приводит к болезни и смерти. Этот стресс можно назвать «патофизиологическим стрессом», и он выходит за рамки данного обзора. Более того, бактериальные и другие инфекции представляют собой форму экологического стресса, который приводит к нейронным входам иммунных ответов, которые обсуждались в другом месте (Rosas-Ballina and Tracey, 2009).).
Несмотря на множество суровых условий жизни организма, живые системы прекрасно справляются с внутренними и внешними стрессами и сохраняют гомеостатический баланс. Большая часть этой способности зависит от нервной системы, как мы описали в этом обзоре. Поскольку нейроны ощущают колебания условий, они используют эту информацию для организации соответствующих защитных и адаптационных реакций на разных уровнях (рис. 2). Кроме того, нейроны могут системно воздействовать на другие клетки, регулируя их реакцию на стресс. Важность роли нервной системы в реакциях на стресс просто подчеркивается хорошо известной способностью нейронов быстро реагировать на изменения окружающей среды. Эта способность интегрирует внешние данные в несколько различных линий защиты, от защиты клеток до поведенческих стратегий. О степени адаптации нейронов к различным стрессам в процессе своего развития также свидетельствует тот факт, что незрелые в развитии нейроны более устойчивы к гипоксии (Romero et al., 2003; Shirai et al., 2006), чем их зрелые аналоги, тогда как зрелые нейроны более устойчивы к УФ и ИК, чем незрелые (Биклер и Бак, 1998). Эта устойчивость нейронов к разным стрессам на разных стадиях развития может отражать подверженность организмов этим стрессам в течение их жизни.
Большая часть этой способности зависит от нервной системы, как мы описали в этом обзоре. Поскольку нейроны ощущают колебания условий, они используют эту информацию для организации соответствующих защитных и адаптационных реакций на разных уровнях (рис. 2). Кроме того, нейроны могут системно воздействовать на другие клетки, регулируя их реакцию на стресс. Важность роли нервной системы в реакциях на стресс просто подчеркивается хорошо известной способностью нейронов быстро реагировать на изменения окружающей среды. Эта способность интегрирует внешние данные в несколько различных линий защиты, от защиты клеток до поведенческих стратегий. О степени адаптации нейронов к различным стрессам в процессе своего развития также свидетельствует тот факт, что незрелые в развитии нейроны более устойчивы к гипоксии (Romero et al., 2003; Shirai et al., 2006), чем их зрелые аналоги, тогда как зрелые нейроны более устойчивы к УФ и ИК, чем незрелые (Биклер и Бак, 1998). Эта устойчивость нейронов к разным стрессам на разных стадиях развития может отражать подверженность организмов этим стрессам в течение их жизни.
Природным системам также присущ элемент стресса, связанный со старением. Независимо от того, насколько совершенна окружающая среда и насколько хорошо организм приспособлен к этой среде, в конечном итоге организм функционально угасает. Вместо того, чтобы рассматривать старение как событие, которое наступает позже в биологическом «уравнении» живых систем, мы предлагаем рассматривать старение как дополнительный уровень стресса, который действует на протяжении всей жизни и связан с физической энтропией (рис. 1). Поскольку энергия не может быть преобразована из одной формы в другую без качественных потерь (второй закон термодинамики), каждая отдельная химическая реакция, осуществляемая клеткой, может способствовать старению. Подобные идеи были поддержаны другими (Hayflick, 2007 и ссылки в нем).
В настоящее время старение определяется как пострепродуктивный процесс, препятствующий отбору и передаче соответствующих генов следующему поколению. Однако ряд исследований в настоящее время показал, что многие молекулярные пути влияют на продолжительность жизни организма и что эти пути законсервированы среди видов. Наша гипотеза о том, что старение происходит до, во время и после размножения, может стать основой для эволюции генетической программы, регулирующей старение. В то же время стохастический характер старения из-за физической энтропии может объяснить различия в продолжительности жизни и экспрессии биомаркеров старения между генетически идентичными особями, например, в клонированных популяциях червей (Herndon et al., 2002). Однако для таких вариаций были предложены и другие объяснения, такие как эпигенетические модификации, происходящие в раннем развитии и во взрослом возрасте (Bell and Spector, 2011; Steves et al., 2012).
Наша гипотеза о том, что старение происходит до, во время и после размножения, может стать основой для эволюции генетической программы, регулирующей старение. В то же время стохастический характер старения из-за физической энтропии может объяснить различия в продолжительности жизни и экспрессии биомаркеров старения между генетически идентичными особями, например, в клонированных популяциях червей (Herndon et al., 2002). Однако для таких вариаций были предложены и другие объяснения, такие как эпигенетические модификации, происходящие в раннем развитии и во взрослом возрасте (Bell and Spector, 2011; Steves et al., 2012).
В дополнение к активной реакции нейронов при определенных стрессах нейроны могут испытывать несколько побочных эффектов в стрессовых условиях. Различие между активным ответом нейронов и дефектом нейронов, вызванным стрессом, часто неясно. В лабораторных условиях потенциальное полезное преимущество нейронального фенотипа при воздействии стрессора может быть упущено из-за отсутствия условия, при котором этот фенотип способствует выживанию, и которое присутствует в естественной среде обитания организма. Однако во многих случаях, как мы описали, можно распознать сильное разрушающее воздействие напряжения на различные структуры.
Однако во многих случаях, как мы описали, можно распознать сильное разрушающее воздействие напряжения на различные структуры.
Изучение внутреннего стресса, связанного с развитием, и его значения для развития эмбрионов и нейронов, по общему признанию, технически сложно. Очень немногие исследования четко показали влияние такого стресса на нормальное развитие (Zhang et al., 2011a), и меньшее их количество было посвящено нейронам (Benard and Hobert, 2009). Тем не менее, информация, полученная в результате этих исследований, обеспечивает основу для дальнейших исследований и дает первое представление о важности различных аспектов внутреннего стресса, связанного с развитием, для нормального развития.
В области биологии человека и мышей «стресс» в основном связывают с психологической реакцией человека на стрессовые внешние раздражители и связывают с центральной нервной системой, которая порождает такие чувства, как страх и тревога. Хотя это составляет очень важный аспект биологии «стресса», он чрезвычайно сложен по своему происхождению и проявлению. Поэтому мы считаем, что изучение первичного «напряжения» в редукционистской манере с использованием таких моделей, как C. elegans предоставит нам более подробную информацию о том, как нейроны выживают и реагируют на «стресс», и как он на них влияет. В пользу этого подхода свидетельствует множество примеров, когда психологический стресс включает механизм, аналогичный другим более основным аспектам стресса (Yao et al., 2007).
Поэтому мы считаем, что изучение первичного «напряжения» в редукционистской манере с использованием таких моделей, как C. elegans предоставит нам более подробную информацию о том, как нейроны выживают и реагируют на «стресс», и как он на них влияет. В пользу этого подхода свидетельствует множество примеров, когда психологический стресс включает механизм, аналогичный другим более основным аспектам стресса (Yao et al., 2007).
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы хотели бы поблагодарить А. Подоска из лаборатории Pocock за критическое прочтение рукописи. К. К. также благодарит Л. Релла и К. Коллина за полезные обсуждения. Эта работа финансировалась Европейским исследовательским советом (ERC), начальный грант с номером 260807 для RP
References
Abraham, RT (2001). Передача сигналов контрольной точки клеточного цикла через киназы ATM и ATR. Гены Дев. 15, 2177–2196.
Передача сигналов контрольной точки клеточного цикла через киназы ATM и ATR. Гены Дев. 15, 2177–2196.
Опубликован Аннотация | Опубликован полный текст | Полнотекстовая перекрестная ссылка
АбуСоуд, Х.М., Руссо, Д.Л., и Штюр, Д.Дж. (1996). Связывание оксида азота с гем нейрональной синтазы оксида азота связывает его активность с изменениями напряжения кислорода. Дж. Биол. хим. 271, 32515–32518.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Акерфельт, М., Моримото, Р. И., и Систонен, Л. (2010). Факторы теплового шока: интеграторы клеточного стресса, развития и продолжительности жизни. Нац. Преподобный Мол. Клеточная биол. 11, 545–555.
Опубликовано Резюме | Опубликован полный текст | Полный текст CrossRef
Альседо, Дж., и Кеньон, К. (2004). Регуляция продолжительности жизни C. elegans специфическими вкусовыми и обонятельными нейронами. Нейрон 41, 45–55.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Али, Ю. О., МакКормак, Р., Дарр, А., и Чжай, Р. Г. (2011). Никотинамидмононуклеотидаденилилтрансфераза представляет собой белок реакции на стресс, регулируемый путем фактора теплового шока/гипокси-индуцируемого фактора 1альфа. Дж. Биол. хим. 286, 19089–19099.
О., МакКормак, Р., Дарр, А., и Чжай, Р. Г. (2011). Никотинамидмононуклеотидаденилилтрансфераза представляет собой белок реакции на стресс, регулируемый путем фактора теплового шока/гипокси-индуцируемого фактора 1альфа. Дж. Биол. хим. 286, 19089–19099.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Альварес-Сааведра, Э., и Хорвиц, Х. Р. (2010). Многие семейства микроРНК C. elegans не являются необходимыми для развития или жизнеспособности. Курс. биол. 20, 367–373.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Ан, Дж. Х., и Блэквелл, Т. К. (2003). SKN-1 связывает мезэнтодермальную спецификацию C. elegans с законсервированной реакцией на окислительный стресс. Гены Dev. 17, 1882–1893 гг.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Andersen, JK (2004). Окислительный стресс при нейродегенерации: причина или следствие? Нац. Мед. 10(Прил.), S18–S25.
10(Прил.), S18–S25.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Антониу, X., и Борселло, Т. (2012). Путь передачи сигналов JNK в головном мозге. Фронт. Бионауч. (Элитное издание) 4, 2110–2120.
Опубликован Аннотация | Опубликован полный текст | Полнотекстовая перекрестная ссылка
Антониу, X., Гассманн, М., и Огуншола, О. О. (2011). Cdk5 взаимодействует с Hif-1alpha в нейронах: новый гипоксический сигнальный механизм? Мозг Res. 1381, 1–10.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Апфельд, Дж., и Кеньон, К. (1998). Неавтономность клеток C. elegans daf-2 в регуляции диапаузы и продолжительности жизни. Сотовый 95, 199–210.
Опубликован Аннотация | Опубликован полный текст | CrossRef полный текст
Апфельд, Дж., и Кеньон, К. (1999). Регуляция продолжительности жизни посредством сенсорного восприятия у Caenorhabditis elegans. Природа 402, 804–809.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Ара, Дж., Фекете, С., Франк, М., Голден, Дж. А., Удовольствие, Д., и Валенсия, И. (2011). Гипоксическое прекондиционирование индуцирует нейропротекцию против гипоксии-ишемии в головном мозге новорожденных поросят. Нейробиол. Дис. 43, 473–485.
Опубликован Аннотация | Опубликован полный текст | Полнотекстовая перекрестная ссылка
Аренкил, Б. Р., Хасегава, Х., Йи, Дж. Дж., Ларсен, Р. С., Уоллес, М. Л., Филпот, Б. Д., и др. (2011). Индуцированное активностью ремоделирование микросхем обонятельных луковиц, выявленное с помощью моносинаптической трассировки. PLoS ONE 6, e29423. doi:10.1371/journal.pone.0029423
CrossRef Полный текст
Арпино К., Д’Ардженцио Л., Тиккони К., Ди Паоло А., Стеллин В., Лопес Л. и др. др. (2005). Поражение головного мозга у недоношенных детей: этиологические пути. Энн. Ист. Супер. Санита 41, 229–237.
Опубликован Аннотация | Полный текст в публикации
Аспберг А. и Тоттмар О. (1992). Развитие антиоксидантных ферментов в мозге крысы и в реагрегационной культуре клеток головного мозга плода. Мозг Res. Дев. Мозг Res. 66, 55–58.
и Тоттмар О. (1992). Развитие антиоксидантных ферментов в мозге крысы и в реагрегационной культуре клеток головного мозга плода. Мозг Res. Дев. Мозг Res. 66, 55–58.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Баранова О., Миранда Л. Ф., Пичиуле П., Драгацис И., Джонсон Р. С. и Чавес Дж. К. (2007). Нейрон-специфическая инактивация индуцируемого гипоксией фактора 1 альфа увеличивает повреждение головного мозга в мышиной модели транзиторной фокальной церебральной ишемии. J. Neurosci. 27, 6320–6332.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Барзилай, А., Битон, С., и Шайло, Ю. (2008). Роль реакции на повреждение ДНК в развитии, организации и поддержании нейронов. Ремонт ДНК (Амстердам) 7, 1010–1027.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Батулан З., Шиндер Г. А., Минотти С., Хе Б. П., Дорудчи М., Налбантоглу Дж. и др. (2003). Высокий порог индукции стрессового ответа в мотонейронах связан с неспособностью активировать HSF1. J. Neurosci. 23, 5789–5798.
Высокий порог индукции стрессового ответа в мотонейронах связан с неспособностью активировать HSF1. J. Neurosci. 23, 5789–5798.
Опубликован Аннотация | Полный текст в публикации
Белл, Х.Дж., Иноуэ, Т., Шум, К., Лук, К., и Сайед, Н.И. (2007). Периферические чувствительные к кислороду клетки напрямую модулируют выход идентифицированного нейрона, генерирующего респираторный центральный паттерн. евро. Дж. Нейроски. 25, 3537–3550.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Белл, Дж. Т., и Спектор, Т. Д. (2011). Двойной подход к разгадке эпигенетики. Тенденции Жене. 27, 116–125.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Бенар, К., и Хоберт, О. (2009). Глядя дальше развития: поддержание архитектуры нервной системы. Курс. Верхний. Дев. биол. 87, 175–194.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Бенар, С. Ю., Боянов, А., Холл, Д.Х., и Хоберт, О. (2006). DIG-1, новый гигантский белок, неавтономно опосредует поддержание архитектуры нервной системы. Разработка 133, 3329–3340.
Ю., Боянов, А., Холл, Д.Х., и Хоберт, О. (2006). DIG-1, новый гигантский белок, неавтономно опосредует поддержание архитектуры нервной системы. Разработка 133, 3329–3340.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Bickler, P.E., and Buck, L.T. (1998). Адаптации нейронов позвоночных к гипоксии и аноксии: поддержание критических концентраций Са2+. Дж. Экспл. биол. 201, 1141–1152.
Опубликован Аннотация | Полный текст в публикации
Бишоп, Н.А., и Гуаренте, Л. (2007). Два нейрона опосредуют продолжительность жизни C. elegans, вызванную ограничением диеты. Природа 447, 545–549.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Бито, Б., Карпак, Дж., Хванбо, Д., и Джаспер, Х. (2011). Регуляция продолжительности жизни дрозофилы с помощью передачи сигналов JNK. Экспл. Геронтол. 46, 349–354.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Бьедов И. , Тойвонен Дж. М., Керр Ф., Слэк С., Якобсон Дж., Фоли А. и др. (2010). Механизмы увеличения продолжительности жизни рапамицином плодовой мушки Drosophila melanogaster. Клеточный метаб. 11, 35–46.
, Тойвонен Дж. М., Керр Ф., Слэк С., Якобсон Дж., Фоли А. и др. (2010). Механизмы увеличения продолжительности жизни рапамицином плодовой мушки Drosophila melanogaster. Клеточный метаб. 11, 35–46.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Bondareff, W., and Geinisman, Y. (1976). Потеря синапсов в зубчатой извилине стареющей крысы. утра. Дж. Анат. 145, 129–136.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Boulias, K., and Horvitz, HR (2012). МикроРНК mir-71 C. elegans действует в нейронах, способствуя опосредованному зародышевой линией долголетию посредством регуляции DAF-16/FOXO. Клеточный метаб. 15, 439–450.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Brown, GC (2010). Оксид азота и гибель нейронов. Оксид азота 23, 153–165.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Брюер У. , Вейх М.К., Исаев Н.К., Майзель А., Рушер К., Бергк А. и др. (1997). Индукция толерантности в корковых нейронах крысы: гипоксическое прекондиционирование. ФЭБС Письмо. 414, 117–121.
, Вейх М.К., Исаев Н.К., Майзель А., Рушер К., Бергк А. и др. (1997). Индукция толерантности в корковых нейронах крысы: гипоксическое прекондиционирование. ФЭБС Письмо. 414, 117–121.
Опубликовано Резюме | Опубликован полный текст | Полный текст CrossRef
Берк, С. Н., и Барнс, Калифорния (2006). Нейронная пластичность в стареющем мозге. Нац. Преподобный Нейроски. 7, 30–40.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Burket, C.T., Higgins, C.E., Hull, L.C., Berninsone, P.M., and Ryder, E.F. (2006). Ген dig-1 C. elegans кодирует гигантский член суперсемейства иммуноглобулинов, который способствует фасцикуляции нейронных отростков. Дев. биол. 299, 193–205.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Браун, Д. Д., Кристин, К. С., Шоуэлл, К., и Конлон, Ф. Л. (2007). Небольшой белок теплового шока hsp27 необходим для правильного формирования сердечной трубки. Бытие 45, 667–678.
Бытие 45, 667–678.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Бирн, Р. А., Рандл, С. Д., Смиртуэйт, Дж. Дж., и Спайсер, Дж. И. (2009). Эмбриональное вращательное поведение у прудовика Lymnaea stagnalis: влияние кислорода окружающей среды и стадии развития. Зоология (Йена) 112, 471–477.
Опубликован Аннотация | Полный текст в публикации
Cadet, JL (1988). Свободнорадикальные механизмы в центральной нервной системе: обзор. Междунар. Дж. Нейроски. 40, 13–18.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Чанг, А.Дж., и Баргманн, К.И. (2008). Гипоксия и путь транскрипции HIF-1 реорганизуют нейронную цепь для кислородозависимого поведения у Caenorhabditis elegans. Проц. Натл. акад. науч. США 105, 7321–7326.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Chechlacz, M., Vemuri, M.C., and Naegele, JR (2001). Роль ДНК-зависимой протеинкиназы в выживании нейронов. Дж. Нейрохим. 78, 141–154.
Дж. Нейрохим. 78, 141–154.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Чен Д., Томас Э. Л. и Капахи П. (2009). HIF-1 модулирует опосредованное диетическими ограничениями увеличение продолжительности жизни посредством IRE-1 у Caenorhabditis elegans. Генетика PLoS. 5, е1000486. doi:10.1371/journal.pgen.1000486
CrossRef Full Text
Chen, H., Xiong, T., Qu, Y., Zhao, F., Ferriero, D., and Mu, D. (2012). mTOR активирует индуцируемый гипоксией фактор-1альфа и ингибирует апоптоз нейронов в развивающемся мозге крыс на ранней стадии после гипоксии-ишемии. Неврологи. лат. 507, 118–123.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Чен, С., и Браун, И. Р. (2007). Нейрональная экспрессия конститутивных белков теплового шока: значение для нейродегенеративных заболеваний. Шапероны клеточного стресса 12, 51–58.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Cheng, I. H., Lin, Y.C., Hwang, E., Huang, H.T., Chang, W.H., Liu, Y.L., et al. (2011). Коллаген VI защищает от апоптоза нейронов, вызванного ультрафиолетовым облучением, посредством сигнального пути Akt/фосфатидилинозитол-3-киназы. Неврология 183, 178–188.
H., Lin, Y.C., Hwang, E., Huang, H.T., Chang, W.H., Liu, Y.L., et al. (2011). Коллаген VI защищает от апоптоза нейронов, вызванного ультрафиолетовым облучением, посредством сигнального пути Akt/фосфатидилинозитол-3-киназы. Неврология 183, 178–188.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Чунг, Б.Х., Коэн, М., Роджерс, К., Альбайрам, О., и Де Боно, М. (2005). Зависимая от опыта модуляция поведения C. elegans кислородом окружающей среды. Курс. биол. 15, 905–917.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Чиу, С.Л., Чен, К.М., и Клайн, Х.Т. (2008). Передача сигналов инсулинового рецептора регулирует количество синапсов, пластичность дендритов и функцию цепи in vivo. Нейрон 58, 708–719.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Чо, С.И., Нам, Ю.С., Чу, Л.Ю., Ли, Дж.Х., Банг, Дж.С., Ким, Х.Р., и др. (2012). Чрезвычайно низкочастотные магнитные поля модулируют передачу сигналов оксида азота в мозгу крыс. Биоэлектромагнетизм 33, 568–574.
Биоэлектромагнетизм 33, 568–574.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Choi, W.S., Eom, D.S., Han, B.S., Kim, W.K., Han, B.H., Choi, E.J., et al. (2004). Фосфорилирование p38 MAPK, вызванное окислительным стрессом, связано с активацией обоих путей апоптоза, опосредованных каспазой-8 и 9, в дофаминергических нейронах. Дж. Биол. хим. 279, 20451–20460.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Чонг, З.З., Шанг, Ю.К., Чжан, Л., Ван, С., и Майезе, К. (2010). Млекопитающие-мишень рапамицина: попадание в яблочко для неврологических расстройств. Оксид. Мед. Клетка. Лонгев. 3, 374–391.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Чоу, А. М., и Браун, И. Р. (2007). Индукция белков теплового шока в дифференцированных нейронах человека и грызунов целастролом. Шапероны клеточного стресса 12, 237–244.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Кларк, Д. А., Гейбл, К. В., Гейбл, Х., и Сэмюэл, А. Д. (2007). Паттерны временной активности в термосенсорных нейронах свободно перемещающихся Caenorhabditis elegans кодируют пространственные температурные градиенты. J. Neurosci. 27, 6083–6090.
А., Гейбл, К. В., Гейбл, Х., и Сэмюэл, А. Д. (2007). Паттерны временной активности в термосенсорных нейронах свободно перемещающихся Caenorhabditis elegans кодируют пространственные температурные градиенты. J. Neurosci. 27, 6083–6090.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Contestabile, A. (2008). Регуляция факторов транскрипции оксидом азота в нейронах и опухолевых клетках нервного происхождения. Прог. Нейробиол. 84, 317–328.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Корнилс, А., Глок, М., Чен, З., Чжан, Ю., и Альседо, Дж. (2011). Специфические инсулиноподобные пептиды кодируют сенсорную информацию для регулирования различных процессов развития. Развитие 138, 1183–1193.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Костелло, Д. А., Кларет, М., Аль-Кассаб, Х., Платтнер, Ф., Ирвин, Э. Э., Чоудхури, А. И., и др. (2012). Делеция субстрата 2 рецептора инсулина в мозге нарушает синаптическую пластичность и метапластичность гиппокампа. PLoS One 7, e31124. doi:10.1371/journal.pone.0031124
Делеция субстрата 2 рецептора инсулина в мозге нарушает синаптическую пластичность и метапластичность гиппокампа. PLoS One 7, e31124. doi:10.1371/journal.pone.0031124
CrossRef Полный текст
Койл, Дж. Т., и Путтфаркен, П. (1993). Окислительный стресс, глутамат и нейродегенеративные расстройства. Наука 262, 689–695.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Culmsee, C., and Mattson, MP (2005). p53 в апоптозе нейронов. Биохим. Биофиз. Рез. коммун. 331, 761–777.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Далфо, Д., Майклсон, Д., и Хаббард, Э. Дж. (2012). Сенсорная регуляция зародышевой линии C. elegans посредством TGF-бета-зависимой передачи сигналов в нише. Курс. биол. 22, 712–719.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Доусон-Скалли, К., и Мелдрам Робертсон, Р. (1998). Тепловой шок защищает синаптическую передачу в двигательных схемах полета саранчи. Нейроотчет 9, 2589–2593.
Нейроотчет 9, 2589–2593.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Дакка, А., Вишванат, В., и Патапутян, А. (2006). Ионные каналы Trp и температурная чувствительность. год. Преподобный Нейроски. 29, 135–161.
Опубликован Аннотация | Опубликован полный текст | Полнотекстовая перекрестная ссылка
Диллон А.С., Хаган С., Рат О. и Колч В. (2007). Сигнальные пути MAP-киназы при раке. Онкоген 26, 3279–3290.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Диркс, Р. П., Ван Гил, Р., Хенсен, С. М., Ван Дженесен, С. Т., и Лубсен, Н. Х. (2010). Манипулирование фактором теплового шока-1 у головастиков Xenopus: нейрональные ткани невосприимчивы к экзогенной экспрессии. PLoS ONE 5, e10158. doi:10.1371/journal.pone.0010158
CrossRef Full Text
Доманска-Яник К., Бонг П., Брониш-Ковальчик А., Заяц Х. и Заблока Б. (1999). Активация транскрипционного фактора AP1 и ее связь с апоптозом пирамидных нейронов CA1 гиппокампа после транзиторной ишемии у песчанок. J. Neurosci. Рез. 57, 840–846.
J. Neurosci. Рез. 57, 840–846.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Дунан, Р., МакЭлви, Дж. Дж., Маттиссенс, Ф., Уокер, Г. А., Хаутхуфд, К., Бэк, П., и др. (2008). Против теории окислительного повреждения старения: супероксиддисмутазы защищают от окислительного стресса, но мало или совсем не влияют на продолжительность жизни Caenorhabditis elegans. Гены Dev. 22, 3236–3241.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Duan, H., Wearne, S.L., Rocher, A.B., Macedo, A., Morrison, JH, and Hof, P.R. (2003). Возрастные изменения дендритов и шипов в кортикокортикально выступающих нейронах у макак. Церебр. Кора 13, 950–961.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Dunwoodie, SL (2009). Роль гипоксии в развитии зародыша млекопитающих. Дев. Ячейка 17, 755–773.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Durieux, J. , Wolff, S., and Dillin, A. (2011). Неавтономная клеточная природа долголетия, опосредованного цепью переноса электронов. сотовый 144, 79–91.
, Wolff, S., and Dillin, A. (2011). Неавтономная клеточная природа долголетия, опосредованного цепью переноса электронов. сотовый 144, 79–91.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Эберт, М.С., и Шарп, П.А. (2012). Роль микроРНК в придании устойчивости биологическим процессам. Сотовый 149, 515–524.
Опубликовано Резюме | Опубликован полный текст | Полный текст CrossRef
Эмото, К., Пэрриш, Дж. З., Ян, Л. Ю., и Ян, Ю. Н. (2006). Опухолевой супрессор Hippo действует с киназами NDR на мозаичную структуру дендритов и их поддержание. Природа 443, 210–213.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Эпштейн, А.К.Р., Глидл, Дж.М., Макнил, Л.А., Хьюитсон, К.С., О’Рурк, Дж., Моул, Д.Р., и др. (2001). C-elegans EGL-9 и гомологи млекопитающих определяют семейство диоксигеназ, которые регулируют HIF путем гидроксилирования пролила. Моб. 107, 43–54.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Эванс, Т. Г., Ямамото, Ю., Джеффри, В. Р., и Кроун, П. Х. (2005). Рыбкам данио Hsp70 необходим для формирования хрусталика эмбриона. Шапероны клеточного стресса 10, 66–78.
Г., Ямамото, Ю., Джеффри, В. Р., и Кроун, П. Х. (2005). Рыбкам данио Hsp70 необходим для формирования хрусталика эмбриона. Шапероны клеточного стресса 10, 66–78.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Фернандес, А. М., и Торрес-Алеман, И. (2012). Многоликая передача сигналов инсулиноподобным пептидом в головном мозге. Нац. Преподобный Нейроски. 13, 225–239.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Фишер Х.Г., Моравски М., Брукнер М.К., Миттаг А., Тарнок А. и Арендт Т. (2012). Изменение состава ДНК нейронов в головном мозге человека при старении. Ячейка старения 11, 628–633.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Freude, S., Schilbach, K., Hettich, M.M., Bronneke, H.S., Zemva, J., Krone, W., et al. (2012). Нейрон-специфическая делеция одной копии гена рецептора инсулиноподобного фактора роста-1 уменьшает накопление жира при старении. Горм. Метаб. Рез. 44, 99–104.
Горм. Метаб. Рез. 44, 99–104.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Фукунага, К., и Миямото, Э. (1998). Роль MAP-киназы в нейронах. Мол. Нейробиол. 16, 79–95.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Ган, Л., и Маке, Л. (2008). Пути конвергенции: сиртуины при старении и нейродегенерации. Нейрон 58, 10–14.
Опубликован Аннотация | Опубликован полный текст | Полнотекстовая перекрестная ссылка
Гарсия С.М., Казануева М.О., Сильва М.К., Амарал М.Д. и Моримото Р.И. (2007). Передача сигналов нейронами модулирует белковый гомеостаз в постсинаптических мышечных клетках Caenorhabditis elegans. Гены Дев. 21, 3006–3016.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Гехарт, Х., Кумпф, С., Иттнер, А., и Риччи, Р. (2010). Передача сигналов MAPK в клеточном метаболизме: стресс или здоровье? EMBO Rep. 11, 834–840.
11, 834–840.
Опубликован Аннотация | Опубликован полный текст | Полнотекстовая перекрестная ссылка
Гершман, Р., Гилберт, Д.Л., Най, С.В., Двайер, П., и Фенн, У.О. (1954). Кислородное отравление и рентгеновское облучение: общий механизм. Наука 119, 623–626.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Гази, А., Хенис-Коренблит, С., и Кеньон, К. (2009). Фактор удлинения транскрипции, который связывает сигналы от репродуктивной системы с увеличением продолжительности жизни у Caenorhabditis elegans. Генетика PLoS. 5, е1000639. doi:10.1371/journal.pgen.1000639
CrossRef Полный текст
Гильери, В., Пендолино, В., Багетта, В., Сгобио, К., Калабрези, П., и Пиккони, Б. (2010). Ингибитор mTOR рапамицин подавляет стриарную постишемическую LTP. Экспл. Нейрол. 226, 328–331.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Gozzo, Y., Vohr, B., Lacadie, C. , Hampson, M., Katz, K.H., Maller-Kesselman, J., et al. (2009). Изменения в нейронных связях у недоношенных детей в школьном возрасте. Нейроизображение 48, 458–463.
, Hampson, M., Katz, K.H., Maller-Kesselman, J., et al. (2009). Изменения в нейронных связях у недоношенных детей в школьном возрасте. Нейроизображение 48, 458–463.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Гримм К., Герман Д. М., Богданова А., Хотоп С., Килич У., Венцель А. и др. (2005). Нейропротекция путем гипоксического прекондиционирования: HIF-1 и эритропоэтин защищают от дегенерации сетчатки. Семин. Сотовый Дев. биол. 16, 531–538.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Го, Г., и Бхат, Н. Р. (2007). p38alpha MAP-киназа опосредует индуцированную гипоксией гибель двигательных нейронов: потенциальная мишень нейропротекторного действия миноциклина. Нейрохим. Рез. 32, 2160–2166.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Halterman, M.W., Gill, M., Dejesus, C., Ogihara, M., Schor, N.F., and Federoff, HJ (2010). Фактор стрессовой реакции эндоплазматического ретикулума CHOP-10 защищает от гибели нейронов, вызванной гипоксией. Дж. Биол. хим. 285, 21329–21340.
Дж. Биол. хим. 285, 21329–21340.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Хаммарлунд М., Никс П., Хаут Л., Йоргенсен Э. М. и Бастиани М. (2009 г.). Для регенерации аксонов требуется консервативный путь киназы MAP. Наука 323, 802–806.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Harman, D. (1956). Старение: теория, основанная на свободнорадикальной и радиационной химии. Дж. Геронтол. 11, 298–300.
Опубликован Аннотация | Полный текст публикации
Harrison, D.E., Strong, R., Sharp, Z.D., Nelson, J.F., Astle, C.M., Flurkey, K., et al. (2009). Рапамицин, вводимый в конце жизни, увеличивает продолжительность жизни генетически гетерогенных мышей. Природа 460, 392–395.
Опубликован Аннотация | Полный текст в публикации
Хавранкова, Дж., Рот, Дж., и Браунштейн, М. (1978). Рецепторы инсулина широко распространены в центральной нервной системе крыс. Природа 272, 827–829.
Природа 272, 827–829.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Хейфлик, Л. (2007). Энтропия объясняет старение, генетический детерминизм объясняет долголетие, а неопределенная терминология объясняет непонимание обоих. Генетика PLoS. 3, е220. doi:10.1371/journal.pgen.0030220
CrossRef Full Text
Hekimi, S., Lapointe, J., and Wen, Y. (2011). Взгляните «хорошо» на свободные радикалы в процессе старения. Trends Cell Biol. 21, 569–576.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Henderson, CE (1996). Роль нейротрофических факторов в развитии нейронов. Курс. мнение Нейробиол. 6, 64–70.
Опубликован Аннотация | Опубликован полный текст | Полнотекстовая перекрестная ссылка
Херндон Л.А., Шмайсснер П.Дж., Дударонек Дж.М., Браун П.А., Листнер К.М., Сакано Ю. и др. (2002). Стохастические и генетические факторы влияют на тканеспецифическое снижение старения C. elegans. Природа 419, 808–814.
elegans. Природа 419, 808–814.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Херруп, К. (2012). Вклад незапланированных событий нейронального клеточного цикла в гибель нейронов при болезни Альцгеймера. Фронт. Бионауч. (Элитное издание) 4, 2101–2109.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Херруп, К., Неве, Р., Акерман, С.Л., и Копани, А. (2004). Разделяйся и умирай: события клеточного цикла как триггеры гибели нервных клеток. J. Neurosci. 24, 9232–9239.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Хоффер, К.А., и Кланн, Э. (2010). Сигнализация mTOR: на перекрестке пластичности, памяти и болезней. Trends Neurosci. 33, 67–75.
Опубликован Аннотация | Опубликован полный текст | Полнотекстовая перекрестная ссылка
Хуземанс, Дж. Дж., и Шепер, В. (2012). Эндоплазматический ретикулум: реакция развернутого белка связана с нейродегенерацией. Междунар. Дж. Биохим. Клеточная биол. 44, 1295–1298.
Междунар. Дж. Биохим. Клеточная биол. 44, 1295–1298.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Horstmann, S., Kahle, P.J., и Borasio, G.D. (1998). Ингибиторы митоген-активируемой протеинкиназы p38 способствуют выживанию нейронов in vitro. J. Neurosci. Рез. 52, 483–490.
Опубликован Аннотация | Опубликован полный текст | Полнотекстовая перекрестная ссылка
Хсу, А.Л., Мерфи, К.Т., и Кеньон, К. (2003). Регуляция старения и возрастных заболеваний с помощью DAF-16 и фактора теплового шока. Наука 300, 1142–1145.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Хунг, К.В., Чен, Ю.К., Се, В.Л., Чиоу, С.Х., и Као, К.Л. (2010). Старение и нейродегенеративные заболевания. Сопротивление старению. Ред. 9 (Приложение 1), S36–S46.
Опубликован Аннотация | Опубликован полный текст | CrossRef полный текст
Хассон, С.Дж., Мертенс, И., Янссен, Т., Линдеманс, М. , и Шофс, Л. (2007). Нейропептидергическая передача сигналов у нематоды Caenorhabditis elegans. Прог. Нейробиол. 82, 33–55.
, и Шофс, Л. (2007). Нейропептидергическая передача сигналов у нематоды Caenorhabditis elegans. Прог. Нейробиол. 82, 33–55.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Хванг, А.Б., и Ли, С.Дж. (2011). Регуляция продолжительности жизни митохондриальным дыханием: связь HIF-1 и АФК. Старение (Олбани, штат Нью-Йорк) 3, 304–310.
Опубликован Аннотация | Полный текст публикации
Идэ Ф., Иида Н., Накацуру Ю., Ода Х., Никайдо О. и Исикава Т. (2000). Обнаружение ультрафиолетовых фотопродуктов in vivo и их репарация в клетках Пуркинье. Лаб. Инвестировать. 80, 465–470.
Опубликован Аннотация | Полный текст в публикации
Икономиду, К., и Кайндл, А.М. (2011). Гибель нейронов и окислительный стресс в развивающемся мозге. Антиоксидант. Окислительно-восстановительный сигнал. 14, 1535–1550.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Изуми, Н., Ямасита, А. , и Оно, С. (2012). Комплексная регуляция PIKK-опосредованных стрессовых реакций с помощью AAA+ белков RUVBL1 и RUVBL2. Ядро 3, 29–43.
, и Оно, С. (2012). Комплексная регуляция PIKK-опосредованных стрессовых реакций с помощью AAA+ белков RUVBL1 и RUVBL2. Ядро 3, 29–43.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Яворски, Дж., и Шэн, М. (2006). Растущая роль mTOR в развитии и пластичности нейронов. Мол. Нейробиол. 34, 205–219.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Дженсен Х.А., Лукогеоргакис С., Яннопулос Ф., Римпилайнен Э., Петцольд А., Туоминен Х. и др. (2011). Дистанционное ишемическое прекондиционирование защищает мозг от повреждения после гипотермической остановки кровообращения. Тираж 123, 714–721.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Чон, Дж. К., Сео, Дж. С., Мун, М. Х., Ли, Ю. Дж., Сеол, Дж. В., и Пак, С. Ю. (2012). Индуцируемый гипоксией фактор-1 альфа регулирует экспрессию прионного белка для защиты от повреждения нейронных клеток. Нейробиол. Старение 33, 1006 e1001–1010.
Старение 33, 1006 e1001–1010.
CrossRef Full Text
Jiang, H., Huang, Y., Xu, Xu, Sun, Y., Han, N., and Li, Q. F. (2012). Индуцируемый гипоксией фактор-1альфа участвует в нейродегенерации, индуцированной изофлураном в головном мозге новорожденных крыс. Дж. Нейрохим. 120, 453–460.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Джонсон, Р. П., и Крамер, Дж. М. (2012). Нейронная роль поддержания матричного рецептора дистрогликана и комплекса ядерного крепления у Caenorhabditis elegans. Генетика 190, 1365–1377.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Джолли С., Журниак Н., Ноде Ф., Гаутерон В., Мариани Дж. и Верне-Дер Гарабедян Б. (2011). Клеточно-автономные и неклеточно-автономные нейропротекторные функции ROR-альфа в нейронах и астроцитах при гипоксии. J. Neurosci. 31, 14314–14323.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Камеяма Ю. и Иноуэ М. (1994). Радиационное поражение развивающейся нервной системы: механизмы повреждения нейронов. Нейротоксикология 15, 75–80.
и Иноуэ М. (1994). Радиационное поражение развивающейся нервной системы: механизмы повреждения нейронов. Нейротоксикология 15, 75–80.
Опубликован Аннотация | Pubmed Full Text
Kappeler, L., Filho, C.D.M., Dupont, J., Leneuve, P., Cervera, P., Perin, L., et al. (2008). Мозговые рецепторы IGF-1 контролируют рост и продолжительность жизни млекопитающих посредством нейроэндокринного механизма. PLoS Биол. 6, е254. doi:10.1371/journal.pbio.0060254
CrossRef Full Text
Karunanithi, S., Barclay, JW, Robertson, R.M., Brown, I.R., и Atwood, H.L. (1999). Нейропротекция в синапсах дрозофилы, обеспечиваемая предшествующим тепловым шоком. J. Neurosci. 19, 4360–4369.
Опубликован Аннотация | Полный текст публикации
Като Х., Араки Т., Итояма Ю., Когуре К. и Като К. (1995). Иммуногистохимическое исследование белка теплового шока-27 в гиппокампе на модели церебральной ишемии и толерантности к ишемии у песчанок. Неврология 68, 65–71.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Катсуно, М., Санг, К., Адачи, Х., Минамияма, М., Ваза, М., Танака, Ф., и др. (2005). Фармакологическая индукция белков теплового шока облегчает заболевание двигательных нейронов, опосредованное полиглутамином. Проц. Натл. акад. науч. США 102, 16801–16806.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Кеньон, К., Чанг, Дж., Генш, Э., Руднер, А., и Табтианг, Р. (1993). Мутант C-elegans, который живет в два раза дольше, чем дикий тип. Природа 366, 461–464.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Керн А., Акерманн Б., Клемент А. М., Дюрк Х. и Бел К. (2010). Контролируемая HSF1 и связанная с возрастом способность шаперонов в нейронах и мышечных клетках C. elegans. PLoS ONE 5, e8568. doi:10.1371/journal.pone.0008568
CrossRef Полный текст
Кесвани, С. К., Бош-Марс, М. , Рид, Н., Фишер, А., Семенза, Г. Л., и Хок, А. (2011). Оксид азота предотвращает дегенерацию аксонов, индуцируя HIF-1-зависимую экспрессию эритропоэтина. Проц. Натл. акад. науч. США 108, 4986–4990.
, Рид, Н., Фишер, А., Семенза, Г. Л., и Хок, А. (2011). Оксид азота предотвращает дегенерацию аксонов, индуцируя HIF-1-зависимую экспрессию эритропоэтина. Проц. Натл. акад. науч. США 108, 4986–4990.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Kimura, K.D., Tissenbaum, H.A., Liu, Y.X., и Ruvkun, G. (1997). daf-2, ген, подобный рецептору инсулина, который регулирует продолжительность жизни и диапаузу у Caenorhabditis elegans. Наука 277, 942–946.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Кирквуд, Т.Б.Л., и Остад, С.Н. (2000). Почему мы стареем? Природа 408, 233–238.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Китагава К., Мацумото М., Кувабара К., Тагая М., Оцуки Т., Хата Р. и др. (1991). Феномен толерантности к ишемии обнаружен в различных областях головного мозга. Мозг Res. 561, 203–211.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Клайн, Д. Д., Рамирес-Наварро, А., и Кунце, Д. Л. (2007). Адаптивная депрессия синаптической передачи в ядре одиночного тракта после хронической перемежающейся гипоксии in vivo: свидетельство гомеостатической пластичности. J. Neurosci. 27, 4663–4673.
Д., Рамирес-Наварро, А., и Кунце, Д. Л. (2007). Адаптивная депрессия синаптической передачи в ядре одиночного тракта после хронической перемежающейся гипоксии in vivo: свидетельство гомеостатической пластичности. J. Neurosci. 27, 4663–4673.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Клячко, В. А., и Стивенс, К. Ф. (2006). Температурно-зависимый сдвиг баланса между компонентами кратковременной пластичности в синапсах гиппокампа. J. Neurosci. 26, 6945–6957.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Коннер, А. К., Хесс, С., Товар, С., Месарос, А., Санчес-Лашерас, К., Эверс, Н., и др. (2011). Роль передачи сигналов инсулина в катехоламинергических нейронах в контроле энергетического гомеостаза. Клеточный метаб. 13, 720–728.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Куртис, Н., Николетопулу, В., и Тавернаракис, Н. (2012). Небольшие белки теплового шока защищают от нейродегенерации, связанной с тепловым ударом. Природа 490, 213–218.
Природа 490, 213–218.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Куртис, Н., и Тавернаракис, Н. (2011). Пути клеточной реакции на стресс и старение: сложные молекулярные взаимосвязи. EMBO J. 30, 2520–2531.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Круман И.И., Версто Р.П., Кардозо-Пелаес Ф., Смиленов Л., Чан С.Л., Хрест Ф.Дж. и др. (2004). Активация клеточного цикла связана с гибелью нейронов, вызванной повреждением ДНК. Нейрон 41, 549–561.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Куанг, С., и Голдберг, Дж. И. (2001). Лазерная абляция выявляет регуляцию активности ресничек серотонинергическими нейронами у эмбрионов моллюсков. J. Нейробиол. 47, 1–15.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Куанг, С. Х., Доран, С. А., Уилсон, Р. Дж. А., Госс, Г. Г., и Голдберг, Дж. И. (2002). Серотонинергические сенсорно-моторные нейроны опосредуют поведенческую реакцию на гипоксию у эмбрионов прудовика. Дж. Нейробиол. 52, 73–83.
И. (2002). Серотонинергические сенсорно-моторные нейроны опосредуют поведенческую реакцию на гипоксию у эмбрионов прудовика. Дж. Нейробиол. 52, 73–83.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Lagerwerf, S., Vrouwe, M.G., Overmeer, R.M., Fousteri, M.I., and Mullenders, L.H. (2011). Реакция на повреждение ДНК и транскрипция. Восстановление ДНК (Amst.) 10, 743–750.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Леду С.П., Дружина Н.М., Холленсворт С.Б., Харрисон Дж.Ф. и Уилсон Г.Л. (2007). Восстановление митохондриальной ДНК: важнейший игрок в ответе клеток ЦНС на генотоксические повреждения. Неврология 145, 1249–1259.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Lee, K.S., Iijima-Ando, K., Iijima, K., Lee, W.J., Lee, J.H., Yu, K., et al. (2009 г.). JNK/FOXO-опосредованная нейрональная экспрессия гомолога пероксиредоксина II у мух снижает окислительный стресс и увеличивает продолжительность жизни. Дж. Биол. хим. 284, 29454–29461.
Дж. Биол. хим. 284, 29454–29461.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Lee, SJ, Hwang, A.B., and Kenyon, C. (2010). Подавление дыхания увеличивает продолжительность жизни C. elegans за счет активных форм кислорода, которые повышают активность HIF-1. Курс. биол. 20, 2131–2136.
Опубликован Аннотация | Опубликован полный текст | Полнотекстовая перекрестная ссылка
Ли, С.Дж., Дзико, К., Ямасита, Э., и Цукихара, Т. (2011). Селективный ядерный механизм экспорта малых РНК. Курс. мнение Структура биол. 21, 101–108.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Lee, SJ, and Kenyon, C. (2009). Регуляция реакции долголетия на температуру термосенсорными нейронами у Caenorhabditis elegans. Курс. биол. 19, 715–722.
Опубликован Аннотация | Опубликован полный текст | Полнотекстовая перекрестная ссылка
Ли С.С., Кеннеди С., Толонен А.С. и Рувкун Г. (2003a). DAF-16 нацелен на гены, которые контролируют продолжительность жизни и метаболизм C-elegans. Наука 300, 644–647.
и Рувкун Г. (2003a). DAF-16 нацелен на гены, которые контролируют продолжительность жизни и метаболизм C-elegans. Наука 300, 644–647.
CrossRef Full Text
Lee, Y., Ahn, C., Han, J., Choi, H., Kim, J., Yim, J., et al. (2003б). Ядерная РНКаза III Drosha инициирует процессинг микроРНК. Природа 425, 415–419.
Полный текст CrossRef
Ли, Ю., Чон, К., Ли, Дж. Т., Ким, С., и Ким, В. Н. (2002). Созревание микроРНК: пошаговый процессинг и субклеточная локализация. EMBO J. 21, 4663–4670.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Ли, Ю., и Маккиннон, П.Дж. (2007). Реагирование на двухцепочечные разрывы ДНК в нервной системе. Неврология 145, 1365–1374.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Лейзер, С. Ф., Бегун, А., и Каберляйн, М. (2011). HIF-1 модулирует продолжительность жизни и продолжительность жизни в зависимости от температуры. Ячейка старения 10, 318–326.
Ячейка старения 10, 318–326.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Li, C., Hisamoto, N., Nix, P., Kanao, S., Mizuno, T., Bastiani, M., et al. (2012). Фактор роста SVH-1 регулирует регенерацию аксонов у C. elegans через каскад JNK MAPK. Нац. Неврологи. 15, 551–557.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Ли, Д., Бай, Т., и Брорсон, Дж. Р. (2011). Адаптация к умеренной гипоксии защищает корковые нейроны от ишемически-реперфузионного повреждения и эксайтотоксичности независимо от HIF-1альфа. Экспл. Нейрол. 230, 302–310.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Li, J.L., Han, Y.R., Plummer, M.R., and Herrup, K. (2009a). Цитоплазматический АТМ в нейронах модулирует синаптическую функцию. Курс. биол. 19, 2091–2096.
CrossRef Full Text
Li, X., Cassidy, J.J., Reinke, C.A., Fischboeck, S., и Carthew, R. W. (2009b). МикроРНК придает устойчивость к колебаниям окружающей среды во время развития. Ячейка 137, 273–282.
W. (2009b). МикроРНК придает устойчивость к колебаниям окружающей среды во время развития. Ячейка 137, 273–282.
CrossRef Полный текст
Ли, В. К., Кеннеди, С. Г., и Рувкун, Г. (2003). daf-28 кодирует член суперсемейства инсулина C-elegans, который регулируется сигналами окружающей среды и действует на сигнальный путь DAF-2. Гены Дев. 17, 844–858.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Li, Y., Chopp, M., Powers, C., and Jiang, N. (1997). Иммунореактивность циклина D1/cdk4 в нейронах и олигодендроцитах после фокальной ишемии головного мозга у крыс. Дж. Цереб. Кровоток Метаб. 17, 846–856.
Опубликован Аннотация | Полный текст в публикации
Ли, Ю. К., Го, Ю. П., Джей, В., Стюарт, П. А., и Вонг, К. С. (1996). Динамика радиационно-индуцированного апоптоза в спинном мозге взрослых крыс. Радиотер. Онкол. 39, 35–42.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Либерт С. , Цвинер Дж., Чу X., Ванвурхис В., Роман Г. и Плетчер С. Д. (2007). Регуляция продолжительности жизни дрозофилы с помощью обоняния и пищевых запахов. Наука 315, 1133–1137.
, Цвинер Дж., Чу X., Ванвурхис В., Роман Г. и Плетчер С. Д. (2007). Регуляция продолжительности жизни дрозофилы с помощью обоняния и пищевых запахов. Наука 315, 1133–1137.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Лин, К., Хсин, Х., Либина, Н., и Кеньон, К. (2001). Регуляция белка долголетия Caenorhabditis elegans DAF-16 с помощью инсулина/IGF-1 и передачи сигналов зародышевой линии. Нац. Жене. 28, 139–145.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Липтон, П. (1999). Ишемическая гибель клеток в нейронах головного мозга. Физиол. 79, 1431–1568.
Опубликован Аннотация | Полный текст в публикации
Литгоу Г.Дж., Уайт Т.М., Мелов С. и Джонсон Т.Е. (1995). Термотолерантность и увеличенная продолжительность жизни, обусловленные мутациями одного гена и вызванные тепловым стрессом. Проц. Натл. акад. науч. США 92, 7540–7544.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Лю, С. , Шульце, Э., и Баумайстер, Р. (2012). Нейроны, чувствительные к температуре и прикосновению, объединяют активность каналов CNG и TRPV, чтобы контролировать избегание тепла у Caenorhabditis elegans. PLoS ONE 7, e32360. doi:10.1371/journal.pone.0032360
, Шульце, Э., и Баумайстер, Р. (2012). Нейроны, чувствительные к температуре и прикосновению, объединяют активность каналов CNG и TRPV, чтобы контролировать избегание тепла у Caenorhabditis elegans. PLoS ONE 7, e32360. doi:10.1371/journal.pone.0032360
CrossRef Full Text
Liu, W., D’ercole, J.A., and Ye, P. (2011). Притупление экспрессии рецептора инсулиноподобного фактора роста 1 типа усугубляет апоптоз нейронов после гипоксического/ишемического повреждения. BMC Neurosci. 12, 64. doi:10.1186/1471-2202-12-64
CrossRef Полный текст
Liu, X.D., Liu, P.C., Santoro, N., and Thiele, D.J. (1997). Сохранение реакции на стресс: транскрипционные факторы теплового шока человека функционально заменяют дрожжевой HSF. EMBO J. 16, 6466–6477.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Лю Ю., Като Х., Наката Н. и Когуре К. (1993). Временной профиль синтеза белка теплового шока 70 при толерантности к ишемии, индуцированной прекондиционирующей ишемией в гиппокампе крыс. Неврология 56, 921–927.
Неврология 56, 921–927.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Лоунс, М. Т., Раллу, М., Мезгер, В., и Моранж, М. (1997). Экспрессия гена HSP и HSF2 в развитии мышей. Мол.клетки. Жизнь наук. 53, 179–190.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Лопес-Эрнандес Б., Посадас И., Подлесный П., Абад М. А., Труллас Р. и Сина В. (2012). HIF-1альфа оказывает нейропротекторное действие на ранних фазах легкой гипоксии в нейронах коры головного мозга крыс. Экспл. Нейрол. 233, 543–554.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Lu, T., Pan, Y., Kao, S.Y., Li, C., Kohane, I., Chan, J., et al. (2004). Регуляция генов и повреждение ДНК в стареющем человеческом мозге. Природа 429, 883–891.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Ма, Д.К., Воздек, Р., Бхатла, Н., и Хорвиц, Х. Р. (2012). CYSL-1 взаимодействует с O2-чувствительной гидроксилазой EGL-9, способствуя поведенческой пластичности, вызванной гипоксией, модулируемой h3S, у C. elegans. Нейрон 73, 925–940.
Р. (2012). CYSL-1 взаимодействует с O2-чувствительной гидроксилазой EGL-9, способствуя поведенческой пластичности, вызванной гипоксией, модулируемой h3S, у C. elegans. Нейрон 73, 925–940.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Маймундар, А. Дж., Вонг, В. Дж., и Саймон, М. К. (2010). Гипоксия-индуцируемые факторы и реакция на гипоксический стресс. Мол. Ячейка 40, 294–309.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Малтепе, Э., и Саймон, М.С. (1998). Кислород, гены и развитие: анализ роли регуляции гипоксических генов во время развития сосудов мышей. Дж. Мол. Мед. (Берл.) 76, 391–401.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Масса, П.Т., Алейасин, Х., Парк, Д.С., Мао, X., и Баргер, С.В. (2006). NFkappaB в нейронах? Принцип неопределенности в нейробиологии. Дж. Нейрохим. 97, 607–618.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Масуда, Х. , Хосокава, Н., и Нагата, К. (1998). Экспрессия и локализация коллагенсвязывающего стрессового белка Hsp47 в развитии эмбриона мыши: сравнение с коллагеном I и II типов. Шапероны клеточного стресса 3, 256–264.
, Хосокава, Н., и Нагата, К. (1998). Экспрессия и локализация коллагенсвязывающего стрессового белка Hsp47 в развитии эмбриона мыши: сравнение с коллагеном I и II типов. Шапероны клеточного стресса 3, 256–264.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Mattson, MP, and Cheng, A.W. (2006). Нейрогорметические фитохимические вещества: низкие дозы токсинов, вызывающие адаптивные реакции нейронов на стресс. Тенденции нейробиологии. 29, 632–639.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
McGahan, L., Hakim, A.M., Nakabeppu, Y., and Robertson, G.S. (1998). Индуцированной ишемией гибели нейронов CA1 предшествует повышенная экспрессия FosB и Jun и сниженные уровни NGFI-A и JunB. Мол. Мозг Res. 56, 146–161.
CrossRef Full Text
Мехта, Р., Штайнкраус, К.А., Сутфин, Г.Л., Рамос, Ф.Дж., Шамиех, Л.С., Хух, А., и др. (2009). Протеасомная регуляция гипоксической реакции модулирует старение у C. elegans. Наука 324, 1196–1198.
elegans. Наука 324, 1196–1198.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Мельцер, Л. А., Ябалури, Р., и Дейссерот, К. (2005). Роль контурного гомеостаза во взрослом нейрогенезе. Trends Neurosci. 28, 653–660.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Миллер, Б. А., Перес, Р. С., Шах, А. Р., Гонсалес, Э. Р., Парк, Т. С., и Гиддей, Дж. М. (2001). Церебральная защита путем гипоксического прекондиционирования в мышиной модели фокальной ишемии-реперфузии. Нейроотчет 12, 1663–1669.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Miska, E.A., Alvarez-Saavedra, E., Abbott, A.L., Lau, N.C., Hellman, A.B., McGonagle, S.M., et al. (2007). Большинство микроРНК Caenorhabditis elegans по отдельности не являются существенными для развития или жизнеспособности. Генетика PLoS. 3, е215. doi:10.1371/journal.pgen.0030215
CrossRef Полный текст
Моримото Р. И., Клайн М.П., Бимстон Д.Н. и Котто Дж.Дж. (1997). Реакция на тепловой шок: регуляция и функция белков теплового шока и молекулярных шаперонов. Очерки биохимии. 32, 17–29.
И., Клайн М.П., Бимстон Д.Н. и Котто Дж.Дж. (1997). Реакция на тепловой шок: регуляция и функция белков теплового шока и молекулярных шаперонов. Очерки биохимии. 32, 17–29.
Опубликован Аннотация | Полный текст в публикации
Морли, Дж. Ф., и Моримото, Р. И. (2004). Регуляция продолжительности жизни Caenorhabditis elegans с помощью фактора теплового шока и молекулярных шаперонов. Мол. биол. Ячейка 15, 657–664.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Моррисон, С.Дж., Чете, М., Гровс, А.К., Мелега, В., Уолд, Б., и Андерсон, Д.Дж. (2000). Культивирование при пониженном уровне кислорода способствует клоногенной симпатоадреналовой дифференцировке с помощью изолированных стволовых клеток нервного гребня. J. Neurosci. 20, 7370–7376.
Опубликован Аннотация | Опубликован полный текст
Моррис, Г. М., и Нью, Д. А. (1979). Влияние концентрации кислорода на морфогенез краниальных нервных складок и нервного гребня у культивируемых эмбрионов крыс. Дж. Эмбриол. Эксп. Морфол. 54, 17–35.
Дж. Эмбриол. Эксп. Морфол. 54, 17–35.
Опубликован Аннотация | Полный текст в публикации
Морроу, Г., Самсон, М., Мишо, С., и Тангуай, Р. М. (2004). Сверхэкспрессия небольшого митохондриального Hsp22 увеличивает продолжительность жизни дрозофилы и повышает устойчивость к окислительному стрессу. FASEB J. 18, 598–599.
Опубликован Аннотация | Полный текст в публикации
Мураками, С. (2007). Caenorhabditis elegans как модельная система для изучения старения обучения и памяти. Мол. Нейробиол. 35, 85–94.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Murphy, C.T., McCarroll, S.A., Bargmann, C.I., Fraser, A., Kamath, R.S., Ahringer, J., et al. (2003). Гены, которые действуют после DAF-16, влияют на продолжительность жизни Caenorhabditis elegans. Природа 424, 277–284.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Namgung, U., and Xia, Z.G. (2000). Индуцированный арсенитом апоптоз в нейронах коры опосредуется N-концевой протеинкиназой 3 c-Jun и митоген-активируемой протеинкиназой p38. J. Neurosci. 20, 6442–6451.
Индуцированный арсенитом апоптоз в нейронах коры опосредуется N-концевой протеинкиназой 3 c-Jun и митоген-активируемой протеинкиназой p38. J. Neurosci. 20, 6442–6451.
Опубликован Аннотация | Полный текст в публикации
Нойманн-Хефелин, Э., Ци, В., Финкбайнер, Э., Вальц, Г., Баумайстер, Р., и Хертвек, М. (2008). SHC-1/p52Shc воздействует на сигнальные пути инсулина/IGF-1 и JNK, чтобы модулировать продолжительность жизни и реакцию на стресс у C. elegans. Гены Dev. 22, 2721–2735.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Ода С., Томиока М. и Иино Ю. (2011). Пластичность нейронов, регулируемая инсулиноподобным сигнальным путем, лежит в основе обучения солевому хемотаксису у Caenorhabditis elegans. Дж. Нейрофизиол. 106, 301–308.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
О’Дрисколл, К.М., и Горман, А.М. (2005). Гипоксия индуцирует рост нейритов в клетках PC12, который опосредуется через рецепторы аденозина A2A. Неврология 131, 321–329.
Неврология 131, 321–329.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
О’Дрисколл, М., и Джегго, П.А. (2006). Роль репарации двухцепочечных разрывов — выводы из генетики человека. Нац. Преподобный Жене. 7, 45–54.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
О, С. В., Мухопадхьяй, А., Сврзикапа, Н., Цзян, Ф., Дэвис, Р. Дж., и Тиссенбаум, Х. А. (2005). JNK регулирует продолжительность жизни Caenorhabditis elegans, модулируя ядерную транслокацию фактора транскрипции forkhead/DAF-16. Проц. Натл. акад. науч. США 102, 4494–4499.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Page, T.L., Einstein, M., Duan, H., He, Y., Flores, T., Rolshud, D., et al. (2002). Морфологические изменения в нейронах, образующих корково-кортикальные проекции в неокортексе старых обезьян Patas. Неврологи. лат. 317, 37–41.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Pan, C. L., Peng, C.Y., Chen, C.H., and McIntire, S. (2011). Генетический анализ возрастных дефектов сенсорных рецепторных нейронов Caenorhabditis elegans. Проц. Натл. акад. науч. США 108, 9274–9279.
L., Peng, C.Y., Chen, C.H., and McIntire, S. (2011). Генетический анализ возрастных дефектов сенсорных рецепторных нейронов Caenorhabditis elegans. Проц. Натл. акад. науч. США 108, 9274–9279.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Park, CY, Choi, YS, and McManus, MT (2010). Анализ нокаутов микроРНК у мышей. Гул. Мол. Жене. 19, Р169–Р175.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Парк Д.С., Левин Б., Феррари Г. и Грин Л.А. (1997). Ингибиторы циклинзависимой киназы и доминантно-отрицательная циклинзависимая киназа 4 и 6 способствуют выживанию симпатических нейронов, лишенных NGF. J. Neurosci. 17, 8975–8983.
Опубликован Аннотация | Полный текст Pubmed
Парк, Д.С., Моррис, Э.Дж., Падманабхан, Дж., Шелански, М.Л., Геллер, Х.М., и Грин, Л.А. (1998). Циклинзависимые киназы участвуют в гибели нейронов, вызванной агентами, повреждающими ДНК. J. Cell Biol. 143, 457–467.
143, 457–467.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Park, E.C., Ghose, P., Shao, Z.Y., Ye, Q., Kang, L.J., Xu, X.Z.S., et al. (2012). Гипоксия регулирует транспортировку глутаматных рецепторов посредством HIF-независимого механизма. EMBO J. 31, 1379–1393.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Парк, Дж., и Лю, А.Ю. (2001). JNK фосфорилирует домен активации транскрипции HSF1: роль JNK в регуляции ответа на тепловой шок. Дж. Сотовый. Биохим. 82, 326–338.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Паркес, Т.Л., Хилликер, А.Дж., и Филлипс, Дж.П. (1999). Моторнейроны, реактивный кислород и продолжительность жизни дрозофилы. Нейробиол. Старение 20, 531–535.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Паскуаль-Леоне, А., Фрейтас, К., Оберман, Л., Хорват, Дж. К., Халко, М. , Эльдаиф, М., и др. (2011). Характеристика пластичности коры головного мозга и сетевой динамики в зависимости от возраста в норме и при заболеваниях с помощью ТМС-ЭЭГ и ТМС-фМРТ. Топогр головного мозга. 24, 302–315.
, Эльдаиф, М., и др. (2011). Характеристика пластичности коры головного мозга и сетевой динамики в зависимости от возраста в норме и при заболеваниях с помощью ТМС-ЭЭГ и ТМС-фМРТ. Топогр головного мозга. 24, 302–315.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Паскинелли, А. Э. (2012). Некодирующие РНК-микроРНК и их мишени: распознавание, регуляция и возникающие реципрокные отношения. Нац. Преподобный Жене. 13, 271–282.
Опубликован Аннотация | Pubmed Full Text
Пенни, Дж., Цурудоме, К., Ляо, Э. Х., Элаццузи, Ф., Ливингстон, М., Гонсалес, М., и др. (2012). TOR необходим для ретроградной регуляции синаптического гомеостаза в нервно-мышечном соединении дрозофилы. Нейрон 74, 166–178.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Пирс, С. Б., Коста, М., Визоцки, Р., Девадхар, С., Хомбургер, С. А., Бухман, А. Р., и др. (2001). Регуляция передачи сигналов рецептора DAF-2 человеческим инсулином и ins-1, членом необычно большого и разнообразного семейства генов инсулина C. elegans. Гены Dev. 15, 672–686.
elegans. Гены Dev. 15, 672–686.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Pietrzykowski, A.Z., Friesen, R.M., Martin, G.E., Puig, S.I., Nowak, C.L., Wynne, P.M., et al. (2008). Посттранскрипционная регуляция стабильности варианта сплайсинга BK-канала с помощью miR-9 лежит в основе нейроадаптации к алкоголю. Нейрон 59, 274–287.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Покок, Р., и Хоберт, О. (2008). Уровни кислорода влияют на направление аксонов и миграцию нейронов у Caenorhabditis elegans. Нац. Неврологи. 11, 894–900.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Покок, Р., и Хоберт, О. (2010). Гипоксия активирует латентный контур обработки вкусовой информации у C. elegans. Нац. Неврологи. 13, 610–614.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Potter, W.B., O’riordan, K. J., Barnett, D., Osting, S.M., Wagoner, M., Burger, C., et al. (2010). Метаболическая регуляция пластичности нейронов с помощью датчика энергии AMPK. PLoS ONE 5, e8996. doi:10.1371/journal.pone.0008996
J., Barnett, D., Osting, S.M., Wagoner, M., Burger, C., et al. (2010). Метаболическая регуляция пластичности нейронов с помощью датчика энергии AMPK. PLoS ONE 5, e8996. doi:10.1371/journal.pone.0008996
CrossRef Full Text
Prabhakar, N.R., Pieramici, S.F., Premkumar, D.R.D., Kumar, G.K., and Kalaria, R.N. (1996). Активация экспрессии гена синтазы оксида азота при гипоксии в центральных и периферических нейронах. Мол. Мозг Res. 43, 341–346.
CrossRef Полный текст
Прахлад, В., Корнелиус, Т., и Моримото, Р. И. (2008). Регуляция клеточного ответа на тепловой шок у Caenorhabditis elegans термосенсорными нейронами. Наука 320, 811–814.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Прахлад, В., и Моримото, Р.И. (2011). Нейрональная схема регулирует реакцию Caenorhabditis elegans на неправильно свернутые белки. Проц. Натл. акад. науч. США 108, 14204–14209.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Qiu, J. , Grafe, M.R., Schmura, S.M., Glasgow, J.N., Kent, T.A., Rassin, D.K., et al. (2001). Дифференциальная регуляция NF-каппа B экспрессии гена bcl-x в гиппокампе и базальных отделах переднего мозга в ответ на гипоксию. J. Neurosci. Рез. 64, 223–234.
, Grafe, M.R., Schmura, S.M., Glasgow, J.N., Kent, T.A., Rassin, D.K., et al. (2001). Дифференциальная регуляция NF-каппа B экспрессии гена bcl-x в гиппокампе и базальных отделах переднего мозга в ответ на гипоксию. J. Neurosci. Рез. 64, 223–234.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Рамирес, Дж. М., Эльсен, Ф. П., и Робертсон, Р. М. (1999). Долгосрочные эффекты предшествующего теплового шока на токи калия в нейронах, зарегистрированные в новом препарате срезов ганглиев насекомых. Дж. Нейрофизиол. 81, 795–802.
Опубликован Аннотация | Полный текст в публикации
Рамоцкий, М.Б., и Зогби, Х.Ю. (2008). Нарушение нейронального гомеостаза приводит к распространенным нейропсихиатрическим фенотипам. Природа 455, 912–918.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Ричард, М.Б., Тейлор, С.Р., и Грир, К.А. (2010). Индуцированное возрастом нарушение селективных синаптических цепей обонятельных луковиц. Проц. Натл. акад. науч. США 107, 15613–15618.
Проц. Натл. акад. науч. США 107, 15613–15618.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Робертсон, А.Б., Клунгланд, А., Рогнес, Т., и Лейрос, И. (2009). Репарация ДНК в клетках млекопитающих: эксцизионная репарация основания: длинное и короткое. Сотовый. Мол. Жизнь наук. 66, 981–993.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Робертсон, Р. М. (2004). Модуляция работы нейронной цепи предшествующим стрессом окружающей среды. Интегр. Комп. биол. 44, 21–27.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Ромеро А.А., Гросс С.Р., Ченг К.Ю., Голдсмит Н.К. и Геллер Х.М. (2003). Возрастное повышение устойчивости к апоптотической гибели клеток, вызванной повреждением ДНК, связано с развитием механизмов репарации ДНК. Дж. Нейрохим. 84, 1275–1287.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Рордорф, Г. , Корошец, В. Дж., и Бонвентре, Дж. В. (1991). Тепловой шок защищает культивируемые нейроны от глутаматной токсичности. Нейрон 7, 1043–1051.
, Корошец, В. Дж., и Бонвентре, Дж. В. (1991). Тепловой шок защищает культивируемые нейроны от глутаматной токсичности. Нейрон 7, 1043–1051.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Росас-Баллина, М., и Трейси, К. Дж. (2009). Неврология иммунной системы: нервные рефлексы регулируют иммунитет. Нейрон 64, 28–32.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Саха, Р. Н., Гош, А., Паленсия, К. А., Фунг, Ю. К., Дудек, С. М., и Пахан, К. (2009). Прекондиционирование TNF-альфа защищает нейроны за счет нейрон-специфической повышающей регуляции CREB-связывающего белка. Дж. Иммунол. 183, 2068–2078.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Сайто К., Кондо Э. и Мацусита М. (2011). Семейство микроРНК 130 регулирует ответный сигнал гипоксии через белок Р-тела DDX6. Рез. нуклеиновых кислот. 39, 6086–6099.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Сакашита Т. , Таканами Т., Янасэ С., Хамада Н., Судзуки М., Кимура Т. и др. (2010). Радиационная биология Caenorhabditis elegans: реакция зародышевых клеток, старение и поведение. Дж. Радиат. Рез. 51, 107–121.
, Таканами Т., Янасэ С., Хамада Н., Судзуки М., Кимура Т. и др. (2010). Радиационная биология Caenorhabditis elegans: реакция зародышевых клеток, старение и поведение. Дж. Радиат. Рез. 51, 107–121.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Sammeta, N., and McClintock, TS (2010). Химический стресс индуцирует развернутый белковый ответ в обонятельных сенсорных нейронах. Дж. Комп. Нейрол. 518, 1825–1836 гг.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Шулингкамп, Р. Дж., Пагано, Т. С., Хунг, Д., и Раффа, Р. Б. (2000). Рецепторы инсулина и действие инсулина в головном мозге: обзор и клинические последствия. Неврологи. Биоповедение. Ред. 24, 855–872.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Шульц, Т.Дж., Зарс, К., Фойгт, А., Урбан, Н., Биррингер, М., и Ристоу, М. (2007). Ограничение потребления глюкозы продлевает продолжительность жизни Caenorhabditis elegans, индуцируя митохондриальное дыхание и усиливая окислительный стресс. Метаболизм клеток 6, 280–293.
Метаболизм клеток 6, 280–293.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Скотт, Б.А., Авидан, М.С., и Краудер, К.М. (2002). Регуляция гипоксической смерти у C. elegans гомологом рецептора инсулина/ИФР DAF-2. Наука 296, 2388–2391.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Сиберг Э., Эйде Л. и Бьорас М. (1995). Базовый путь эксцизионной репарации. Тенденции биохим. науч. 20, 391–397.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Сендоэль, А., Колер, И., Феллманн, К., Лоу, С.В., и Хенгартнер, М.О. (2010). HIF-1 противодействует р53-опосредованному апоптозу посредством секретируемой нейрональной тирозиназы. Природа 465, 577–583.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Шамовский И. и Нудлер Э. (2008). Новое понимание механизма активации реакции теплового шока. Сотовый. Мол. Жизнь наук. 65, 855–861.
Мол. Жизнь наук. 65, 855–861.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Shao, G., Zhou, WH, Gao, C.Y., Zhang, R., and Lu, G.W. (2007). Влияние гипоксии, предваряющей отсутствие связывающей активности HIF-1, на HRE с ЭПО в гиппокампе мышей. Чжунго Ин Юн Шэн Ли Сюэ За Чжи 23, 1–4.
Опубликован Аннотация | Pubmed Full Text
Shen, L., Hu, Y., Cai, T., Lin, X., and Wang, D. (2010a). Регуляция долголетия генами, необходимыми для функций интернейрона AIY у нематоды Caenorhabditis elegans. мех. Старение Дев. 131, 732–738.
CrossRef Full Text
Shen, L.L., Du, M., Lin, X.F., Cai, T., and Wang, D.Y. (2010b). Гены, необходимые для функций обонятельных нейронов AWA, регулируют продолжительность жизни Caenorhabditis elegans в зависимости от передачи сигналов инсулином/IGF. Неврологи. Бык. 26, 91–103.
Полный текст CrossRef
Шеррин Т., Бланк Т. и Тодорович К. (2011). N-концевые киназы c-Jun в памяти и синаптической пластичности. Преподобный Neurosci. 22, 403–410.
Преподобный Neurosci. 22, 403–410.
Опубликован Аннотация | Pubmed Full Text
Ши А.Ю., Имбо С., Баракаускас В., Эрб Х., Цзян Л., Ли П. и др. (2005). Индукция Nrf2-управляемого антиоксидантного ответа обеспечивает нейропротекцию во время митохондриального стресса in vivo. Дж. Биол. хим. 280, 22925–22936.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Шираи К., Мизуи Т., Судзуки Ю., Кобаяши Ю., Накано Т. и Ширао Т. (2006). Дифференциальные эффекты рентгеновского облучения на незрелые и зрелые нейроны гиппокампа in vitro. Неврологи. лат. 399, 57–60.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Саймон, М. К., и Кейт, Б. (2008). Роль доступности кислорода в эмбриональном развитии и функции стволовых клеток. Нац. Преподобный Мол. Клеточная биол. 9, 285–296.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Саймон М. С., Рамирез-Бержерон Д., Мак Ф., Ху С.Дж., Пан Ю. и Мэнсфилд К. (2002). Гипоксия, HIFs и развитие сердечно-сосудистой системы. Гавань Колд Спринг. Симп. Квант. биол. 67, 127–132.
С., Рамирез-Бержерон Д., Мак Ф., Ху С.Дж., Пан Ю. и Мэнсфилд К. (2002). Гипоксия, HIFs и развитие сердечно-сосудистой системы. Гавань Колд Спринг. Симп. Квант. биол. 67, 127–132.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Снайдер, Б.Дж., Лобнер, Д., Ямада, К.А., и Чой, Д.В. (1998). Кондиционирующий тепловой стресс снижает эксайтотоксические и апоптотические компоненты гибели нейронов, вызванной кислородно-глюкозной депривацией in vitro. Дж. Нейрохим. 70, 120–129.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Стивенсон Т.Дж., Трин Т., Когельшатц К., Фуджимото Э., Лаш М.Е., Пиотровски Т. и др. (2012). Нарушение гипоксии поиска путей в ЦНС позвоночных через EphrinB2 устраняется магнием. Генетика PLoS. 8, е1002638. doi:10.1371/journal.pgen.1002638
CrossRef Full Text
Steves, C.J., Spector, TD, and Jackson, S.H. (2012). Старение, гены, окружающая среда и эпигенетика: что говорят нам исследования близнецов сейчас и в будущем. Возраст Старение 41, 581–586.
Возраст Старение 41, 581–586.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Странахан, А. М., и Маттсон, М. П. (2012). Рекрутинг адаптивных клеточных реакций на стресс для успешного старения мозга. Нац. Преподобный Нейроски. 13, 209–216.
Опубликован Аннотация | Pubmed Full Text
Studer, L., Csete, M., Lee, S.H., Kabbani, N., Walikonis, J., Wold, B., et al. (2000). Повышенная пролиферация, выживаемость и дофаминергическая дифференцировка предшественников ЦНС при пониженном уровне кислорода. J. Neurosci. 20, 7377–7383.
Опубликован Аннотация | Полный текст в публикации
Такахама, К., Томита, Дж., Уэно, Т., Ямазаки, М., Куме, С., и Куме, К. (2012). Паннейронный нокдаун N-концевой киназы c-Jun (JNK) приводит к сокращению сна и продолжительности жизни у дрозофилы. Биохим. Биофиз. Рез. коммун. 417, 807–811.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Такеда, К. , и Ичидзё, Х. (2002). Нейрональная передача сигналов p38 MAPK: новый регулятор судьбы и функции клеток в нервной системе. Гены Клетки 7, 1099–1111.
, и Ичидзё, Х. (2002). Нейрональная передача сигналов p38 MAPK: новый регулятор судьбы и функции клеток в нервной системе. Гены Клетки 7, 1099–1111.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Tank, E.M., Rodgers, K.E., and Kenyon, C. (2011). Спонтанное возрастное ветвление нейритов у Caenorhabditis elegans. J. Neurosci. 31, 9279–9288.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Татар, М., Копельман, А., Эпштейн, Д., Ту, М.П., Инь, К.М., и Гарофало, Р.С. (2001). Мутантный гомолог инсулинового рецептора дрозофилы, увеличивающий продолжительность жизни и нарушающий нейроэндокринную функцию. Наука 292, 107–110.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Teixeira-Castro, A., Ailion, M., Jalles, A., Brignull, H.R., Vilaca, J.L., Dias, N., et al. (2011). Нейрон-специфическая протеотоксичность мутантного атаксина-3 у C. elegans: спасение путями DAF-16 и HSF-1. Гул. Мол. Жене. 20, 2996–3009.
Гул. Мол. Жене. 20, 2996–3009.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Тиан, Б., Ян, К., и Мао, З. (2009). Фосфорилирование ATM с помощью Cdk5 опосредует передачу сигналов о повреждении ДНК и регулирует гибель нейронов. Нац. Клеточная биол. 11, 211–218.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Timsit, S., Rivera, S., Ouaghi, P., Guischard, F., Tremblay, E., Ben-Ari, Y., et al. (1999). Повышение циклина D1 в уязвимых нейронах гиппокампа после ишемии и эпилепсии: модулятор запрограммированной гибели клеток in vivo? Евро. Дж. Нейроски. 11, 263–278.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Томиока М., Адачи Т., Судзуки Х., Кунитомо Х., Шафер В. Р. и Иино Ю. (2006). Путь инсулина/PI 3-киназы регулирует обучение солевому хемотаксису у Caenorhabditis elegans. Нейрон 51, 613–625.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Тоноки, А. , и Дэвис, Р.Л. (2012). Старение ухудшает среднесрочную поведенческую память, нарушая след памяти дорсальных парных медиальных нейронов. Проц. Натл. акад. науч. США 109, 6319–6324.
, и Дэвис, Р.Л. (2012). Старение ухудшает среднесрочную поведенческую память, нарушая след памяти дорсальных парных медиальных нейронов. Проц. Натл. акад. науч. США 109, 6319–6324.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Турриджано, Г.Г., и Нельсон, С.Б. (2004). Гомеостатическая пластичность в развивающейся нервной системе. Нац. Преподобный Нейроски. 5, 97–107.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Unger, J., McNeill, T.H., Moxley, R.T. III, White, M., Moss, A., and Livingston, J.N. (1989). Распределение инсулиноподобной иммунореактивности в переднем мозге крыс. Неврология 31, 143–157.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Ван Эссен, округ Колумбия (1997). Основанная на напряжении теория морфогенеза и компактной проводки в центральной нервной системе. Природа 385, 313–318.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
van Heemst, D. (2010). Инсулин, ИФР-1 и долголетие. Старение Dis. 1, 147–157.
(2010). Инсулин, ИФР-1 и долголетие. Старение Dis. 1, 147–157.
Опубликован Аннотация | Полный текст в публикации
van Heemst, D., Beekman, M., Mooijaart, S.P., Heijmans, B.T., Brandt, B.W., Zwaan, B.J., et al. (2005). Снижение передачи сигналов инсулина/ИФР-1 и увеличение продолжительности жизни человека. Ячейка старения 4, 79–85.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Ван Рамсдонк, Дж. М., и Хекими, С. (2010). Активные формы кислорода и старение Caenorhabditis elegans: причинно-следственная или случайная связь? Антиоксидант. Окислительно-восстановительный сигнал. 13, 1911–1953 гг.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Ван Рамсдонк, Дж. М., и Хекими, С. (2012). Супероксиддисмутаза необходима для нормальной продолжительности жизни животных. Проц. Натл. акад. науч. США 109, 5785–5790.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Уолтон, Н. М., Шин, Р., Таджинда, К., Хойснер, К. Л., Коган, Дж. Х., Мияке, С., и др. (2012). Взрослый нейрогенез временно вызывает окислительный стресс. PLoS ONE 7, e35264. doi:10.1371/journal.pone.0035264
М., Шин, Р., Таджинда, К., Хойснер, К. Л., Коган, Дж. Х., Мияке, С., и др. (2012). Взрослый нейрогенез временно вызывает окислительный стресс. PLoS ONE 7, e35264. doi:10.1371/journal.pone.0035264
CrossRef Full Text
Wang, M.C., Bohmann, D., and Jasper, H. (2005). JNK продлевает продолжительность жизни и ограничивает рост, противодействуя клеточным и общим реакциям организма на передачу сигналов инсулина. сотовый 121, 115–125.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Вестон, С. Р., и Дэвис, Р. Дж. (2002). Путь передачи сигнала JNK. Курс. мнение Жене. Дев. 12, 14–21.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Уайт, Дж. Г., Саутгейт, Э., Томсон, Дж. Н., и Бреннер, С. (1986). Строение нервной системы нематоды Caenorhabditis elegans. Филос. Транс. Р. Соц. Лонд. Б биол. науч. 314, 1–340.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Уильямс Т. , Курше Дж., Вайоллет Б., Бренман Дж. Э. и Полле Ф. (2011). Активность AMP-активируемой протеинкиназы (AMPK) не требуется для развития нейронов, но регулирует аксогенез во время метаболического стресса. Проц. Натл. акад. науч. США 108, 5849–5854.
, Курше Дж., Вайоллет Б., Бренман Дж. Э. и Полле Ф. (2011). Активность AMP-активируемой протеинкиназы (AMPK) не требуется для развития нейронов, но регулирует аксогенез во время метаболического стресса. Проц. Натл. акад. науч. США 108, 5849–5854.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Волков, К.А., Кимура, К.Д., Ли, М.С., и Рувкун, Г. (2000). Регуляция продолжительности жизни C. elegans с помощью инсулиноподобной передачи сигналов в нервной системе. Наука 290, 147–150.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Вудрафф-Пак Д. С., Фой М. Р., Акопян Г. Г., Ли К. Х., Зак Дж., Нгуен К. П. и др. (2010). Дифференциальные эффекты и темпы нормального старения мозжечка и гиппокампа. Проц. Натл. акад. науч. США 107, 1624–1629.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Ву, Б.С., Ли, Дж.К., Томпсон, К.М., Уокер, В.К., Мойес, К. Д., и Робертсон, Р.М. (2002). Аноксия вызывает термотолерантность в системе полета саранчи. Дж. Эксп. биол. 205, 815–827.
Д., и Робертсон, Р.М. (2002). Аноксия вызывает термотолерантность в системе полета саранчи. Дж. Эксп. биол. 205, 815–827.
Опубликован Аннотация | Полный текст в публикации
Ву, Б.С., Уокер, В.К., и Робертсон, Р.М. (2001). Индуцированная тепловым шоком термозащита потенциалов действия в системе полета саранчи. Дж. Нейробиол. 49, 188–199.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Вульшлегер, С., Лоевит, Р., и Холл, М. Н. (2006). Передача сигналов TOR в росте и метаболизме. Сотовый 124, 471–484.
Опубликовано Резюме | Опубликован полный текст | Полный текст CrossRef
Yan, D., Wu, Z., Chisholm, A.D., and Jin, Y. (2009). Киназа DLK-1 способствует стабильности мРНК и локальной трансляции в синапсах C. elegans и регенерации аксонов. Сотовый 138, 1005–1018.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Янкнер, Б. А., Лу, Т., и Лёрх, П. (2008). Стареющий мозг. год. Преподобный Патол. 3, 41–66.
(2008). Стареющий мозг. год. Преподобный Патол. 3, 41–66.
Опубликован Аннотация | Опубликован полный текст | Полнотекстовая перекрестная ссылка
Яо С., Пэн М., Чжу С., Ченг М. и Ци С. (2007). Белок теплового шока72 защищает нейроны гиппокампа от апоптоза, вызванного хроническим психологическим стрессом. Междунар. Дж. Нейроски. 117, 1551–1564.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Ye, WZ, and Blain, SW (2010). Вступление в S-фазу вызывает смерть, вызванную гомоцистеином, в то время как атаксия, телеангиэктазия и белок, родственный Rad3, действуют антиапоптотически для защиты нейронов. Мозг 133, 2295–2312.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Йен, К., Патель, Х. Б., Люблин, А. Л., и Моббс, К. В. (2009). Изоформы SOD не играют никакой роли в продолжительности жизни при импровизации или диетических ограничениях, но мутационная инактивация SOD-1 снижает продолжительность жизни при простуде. Мех. Старение Дев. 130, 173–178.
Мех. Старение Дев. 130, 173–178.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Йи Р., Цинь Ю., Макара И. Г. и Каллен Б. Р. (2003). Экспортин-5 опосредует ядерный экспорт пре-микроРНК и коротких шпилечных РНК. Гены Dev. 17, 3011–3016.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Чжан, Х., Ландманн, Ф., Захреддин, Х., Родригес, Д., Кох, М., и Лабуэс, М. (2011a). Индуцированный натяжением путь механотрансдукции способствует эпителиальному морфогенезу. Природа 471, 99–103.
CrossRef Full Text
Zhang X., Zabinsky R., Teng Y., Cui M. и Han M. (2011b). микроРНК играют решающую роль в выживании и восстановлении Caenorhabditis elegans после индуцированной голоданием диапаузы L1. Проц. Натл. акад. науч. США 108, 17997–18002.
CrossRef Full Text
Чжан П., Абрахам В. С., Крафт К. Р., Рабчевский А. Г., Шефф С. В. и Суэйн Дж. А. (2000). Гипертермическое прекондиционирование защищает от ишемического повреждения спинного мозга. Энн. Торак. Surg. 70, 1490–1495.
Энн. Торак. Surg. 70, 1490–1495.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Чжан Ю., Шао З., Чжай З., Шен К. и Пауэлл-Коффман Дж. А. (2009). Фактор, индуцируемый гипоксией HIF-1, модулирует продолжительность жизни C. elegans. PLoS ONE 4, e6348. doi:10.1371/journal.pone.0006348
CrossRef Full Text
Zheng, S., and Zuo, Z. (2004). Прекондиционирование изофлураном индуцирует нейропротекцию против ишемии посредством активации митоген-активируемых протеинкиназ Р38. Мол. Фармакол. 65, 1172–1180.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Чжоу, Л., и Чжу, Д.Ю. (2009). Нейрональная синтаза оксида азота: структура, субклеточная локализация, регуляция и клиническое значение. Оксид азота 20, 223–230.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Чжоу, С.Ю., Кастро-Мур, Ф., и Гошгарян, Х.Г. (2001). Активация латентного респираторно-двигательного пути путем стимуляции нейронов в области медуллярных хеморецепторов крысы. Экспл. Нейрол. 171, 176–184.
Экспл. Нейрол. 171, 176–184.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Zhu, J., Li, W., and Mao, Z. (2011). Cdk5: медиатор развития нейронов, гибели и реакции на повреждение ДНК. мех. Старение Дев. 132, 389–394.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Зиу М., Флетчер Л., Рана С., Хименес Д. Ф. и Дигикайлиоглу М. (2011). Временные различия в паттернах экспрессии микроРНК в астроцитах и нейронах после ишемического повреждения. PLoS ONE 6, e14724. doi:10.1371/journal.pone.0014724
CrossRef Полный текст
Всесторонний обзор нейробиологии стресса: основные концепции и клинические последствия
Введение
Стресс признан важной проблемой фундаментальных и клинических исследований в области неврологии (de Kloet et al., 2005a; McEwen et al., 2015). Хотя это физиологическое явление имеет основополагающее значение для выживания, оно также тесно связано с рядом нарушений головного мозга, включая депрессию, тревогу, посттравматическое стрессовое расстройство (Ruiz et al. , 2007; Heim et al., 2008; Martin et al., 2009). ; Walsh, 2011; Saveanu and Nemeroff, 2012; Nemeroff, 2016) в соответствии с Международной классификацией болезней 10-го издания (МКБ-10). Исследования, посвященные сложности стресса, по-прежнему сложны, но несколько исследований на животных и людях внесли существенный вклад в его прогресс в последние годы, согласно обзору Hariri and Holmes (2015). Однако крайне важно обеспечить более значимые достижения в области стресса с помощью трансляционного подхода, объединяющего базовые знания и клиническую практику.
, 2007; Heim et al., 2008; Martin et al., 2009). ; Walsh, 2011; Saveanu and Nemeroff, 2012; Nemeroff, 2016) в соответствии с Международной классификацией болезней 10-го издания (МКБ-10). Исследования, посвященные сложности стресса, по-прежнему сложны, но несколько исследований на животных и людях внесли существенный вклад в его прогресс в последние годы, согласно обзору Hariri and Holmes (2015). Однако крайне важно обеспечить более значимые достижения в области стресса с помощью трансляционного подхода, объединяющего базовые знания и клиническую практику.
В этой обзорной статье мы кратко описываем историю исследования стресса и выделяем основные концепции стресса, исследуем сложную нейроанатомию, фактически сети, системы стресса и его острых осей и медиаторов, а также временные области стресса. отклик. Наконец, мы поднимаем клинические последствия этих концепций и обсуждаем проблемы будущих исследований в области стресса.
История исследования стресса
В начале прошлого века североамериканский физиолог Уолтер Брэдфорт Кэннон после ряда исследований составил сборник висцеральных адаптивных реакций на различные раздражители. В этой подборке, которая в основном проводилась в физиологических лабораториях Гарвардского университета, описываются телесные изменения, происходящие в связи с ноцицептивными событиями, голодом и холодом, физическими упражнениями и сильными эмоциями. Кэннон отмечал, что функции, устанавливающие и поддерживающие энергетические резервы организма в состоянии покоя, в условиях стрессовой ситуации, немедленно усиливаются или полностью прерываются для мобилизации большой энергии. Эта мобилизация позволяет улучшить потенциальную реакцию побега и нападения и/или защиты. На основе этих наблюдений Кэннон предложил то, что он назвал « «сражайся или беги» «ответ» (Cannon, 1915).
В этой подборке, которая в основном проводилась в физиологических лабораториях Гарвардского университета, описываются телесные изменения, происходящие в связи с ноцицептивными событиями, голодом и холодом, физическими упражнениями и сильными эмоциями. Кэннон отмечал, что функции, устанавливающие и поддерживающие энергетические резервы организма в состоянии покоя, в условиях стрессовой ситуации, немедленно усиливаются или полностью прерываются для мобилизации большой энергии. Эта мобилизация позволяет улучшить потенциальную реакцию побега и нападения и/или защиты. На основе этих наблюдений Кэннон предложил то, что он назвал « «сражайся или беги» «ответ» (Cannon, 1915).
Несколько лет спустя Кэннон ввел термин гомеостаз , основываясь на идее milieu intérieur (внутренняя среда) Клода Бернара; Кэннон писал: «кровь и другие жидкости, окружающие клетки, составляют внутреннюю среду, с которой происходят непосредственные обмены каждой клетки, и она всегда должна поддерживаться с параметрами, подходящими для функционирования клетки, независимо от изменений, которые могут происходить во внешней среде. ». Кэннон определил гомеостаз как способность поддерживать физиологические системы в направлении динамического равновесия. Концепция гомеостаза вместе с реакцией «бей или беги» легла в основу исследований стресса.
». Кэннон определил гомеостаз как способность поддерживать физиологические системы в направлении динамического равновесия. Концепция гомеостаза вместе с реакцией «бей или беги» легла в основу исследований стресса.
Ганс Селье, еще будучи студентом-медиком, обнаружил, что у пациентов, страдающих различными заболеваниями, часто проявляются сходные симптомы, которые могут составлять единый синдром. Эти доказательства снова столкнулись с ним, когда он искал новые гормоны из экстрактов яичников коров на кафедре биохимии в Университете Макгилла в Монреале. В его исследовании эффекты, которые в первую очередь приписывались гормону яичников, также наблюдались после введения различных других экстрактов из нескольких органов и токсичных веществ. Последние, вне зависимости от способа приготовления, вызывали одни и те же изменения: увеличение размеров коры надпочечников, язвы желудочно-кишечного тракта, а также инволюцию тимуса и лимфатических узлов, составляя, таким образом, так называемый «общий адаптационный синдром» (Селье, 19). 36).
36).
Общий адаптационный синдром характеризуется совокупностью неспецифических реакций, которые, по Селье, развиваются в три стадии: (1) фаза тревоги, характеризующаяся острыми проявлениями; (2) фаза резистентности, когда исчезают острые проявления; и (3) фаза истощения, когда может снова присутствовать реакция первой стадии или когда может наступить коллапс организма (Selye, 1936).
В этом контексте он был разработан как основа теории стресса, а концепция стресса была построена на физических законах Гука. Селье первым дал определение стресс с биологической точки зрения как « неспецифический ответ организма на любое предъявляемое к нему требование » (Selye, 1950, 1976).
Ученые обнаружили, что реакция на стрессовые стимулы вырабатывается и запускается известной в настоящее время системой стресса , которая объединяет большое разнообразие мозговых структур, которые в совокупности способны обнаруживать события и интерпретировать их как реальные или потенциальная угроза: стрессор (Dedovic et al. , 2009). После этого периода было проведено множество исследований, в результате которых были получены большие знания в области стресса (McEwen et al., 2015).
, 2009). После этого периода было проведено множество исследований, в результате которых были получены большие знания в области стресса (McEwen et al., 2015).
Таким образом, восприятие реальной или потенциальной угрозы приводит к высвобождению молекул-посредников. Взаимодействие между этими молекулами с соответствующими рецепторами на периферии и в головном мозге приводит к стрессовой реакции , которая с помощью физиологических и поведенческих механизмов восстанавливает гомеостаз организма и способствует адаптации (de Kloet et al., 2005a; Joëls and Барам, 2009 г.; Фигура 1).
Рисунок 1 . Система стресса. Обработка и преодоление стрессовых ситуаций требует включения сложных механизмов, которые объединяют мозг и тело. Реакция на стрессовые стимулы выражается широким разнообразием мозговых структур, которые в совокупности способны обнаруживать или интерпретировать события как реальные или потенциальные угрозы (стрессоры) . Восприятие этих событий как стрессоров включает в себя различные сети в зависимости от того, является ли это физическим или психологическим стрессором. Идентификация стрессора приводит к активации двух основных компонентов стрессовой системы и высвобождению ее конечных молекул-посредников. Симпато-адрено-медуллярная (SAM) ось секретирует норадреналин и норадреналин, а ось гипоталамус-гипофиз-надпочечники (HPA) секретирует глюкокортикоиды. Как только эти оси активируются в ответ на данный стрессор, они будут генерировать скоординированный ответ, который начинается в течение нескольких секунд и может длиться в течение нескольких дней, обеспечивая быстрые ответы, позволяющие практически сразу же использовать соответствующую стратегию и восстанавливать гомеостаз. Для этого реакция на стресс систематически способствует мобилизации энергии, метаболическим изменениям, активации иммунной системы и подавлению пищеварительной и репродуктивной систем. В частности, в головном мозге стрессовая реакция вызывает краткосрочные и долгосрочные эффекты посредством негеномных, геномных и эпигенетических механизмов. Эти центральные эффекты в сочетании с провоспалительной передачей сигналов приводят к изменениям клеточной возбудимости, а также синаптической и нейронной пластичности.
Идентификация стрессора приводит к активации двух основных компонентов стрессовой системы и высвобождению ее конечных молекул-посредников. Симпато-адрено-медуллярная (SAM) ось секретирует норадреналин и норадреналин, а ось гипоталамус-гипофиз-надпочечники (HPA) секретирует глюкокортикоиды. Как только эти оси активируются в ответ на данный стрессор, они будут генерировать скоординированный ответ, который начинается в течение нескольких секунд и может длиться в течение нескольких дней, обеспечивая быстрые ответы, позволяющие практически сразу же использовать соответствующую стратегию и восстанавливать гомеостаз. Для этого реакция на стресс систематически способствует мобилизации энергии, метаболическим изменениям, активации иммунной системы и подавлению пищеварительной и репродуктивной систем. В частности, в головном мозге стрессовая реакция вызывает краткосрочные и долгосрочные эффекты посредством негеномных, геномных и эпигенетических механизмов. Эти центральные эффекты в сочетании с провоспалительной передачей сигналов приводят к изменениям клеточной возбудимости, а также синаптической и нейронной пластичности. В совокупности эти эффекты тела и мозга опосредуют изменения в физиологии и поведении, которые обеспечивают адаптацию и выживание.
В совокупности эти эффекты тела и мозга опосредуют изменения в физиологии и поведении, которые обеспечивают адаптацию и выживание.
За последние несколько десятилетий первоначальные представления о стрессе были пересмотрены. Sterling and Eyer (1988), а также другие (McEwen and Stellar, 1993; Schulkin et al., 1994) предложили новую концепцию аллостаза , аллостатической нагрузки и аллостатической перегрузки . Эти концепции будут учитывать результаты исследований стресса 60-х, 70-х и 80-х годов, такие как физиологические вариации в нормальных состояниях и наличие упреждающих реакций на стрессоры (Dallman, 2003; Schulkin, 2003). Последние авторы подчеркнули, что новые концепции аллостаза, аллостатической нагрузки и аллостатической перегрузки биологически более точны, чем стресс, для понимания сложной системы адаптации или дезадаптации. В определении аллостаза заданная точка для поддержания физиологического равновесия постоянно меняется, поэтому то, что идеально для исходных ситуаций, не обязательно идеально в стрессовых ситуациях (Koolhaas et al. , 2010, 2011). Более того, установка для поддержания физиологического баланса при аллостазе не работает линейно, а может регулироваться несколькими способами (McEwen and Karatsoreos, 2015). Наконец, термины «аллостатическая нагрузка» и «аллостатическая перегрузка» учитывают кумулятивное воздействие стрессоров на организм в нормальных физиологических и патологических ситуациях соответственно (McEwen and Karatsoreos, 2015). Несмотря на предложение концепции аллостаза, некоторые авторы утверждают, что концепция гомеостаза интерпретировалась ограниченно, и использование термина аллостаз было бы просто семантическим изменением, поскольку система аллостатического ответа остается той же самой биологической системой, изучаемой в гомеостатических исследованиях. ответ (Dallman, 2003; Day, 2005). На самом деле предложенные концепции аллостаза по-прежнему мало помогают в понимании стресса и вместо того, чтобы внести ясность, внесли несколько недоразумений в нейробиологию стресса (Davies, 2016). Наконец, необходимость концепций аллостаза подвергается сомнению с указанием на то, что это не является необходимым или желательным на данном этапе исследования стресса (Dallman, 2003).
, 2010, 2011). Более того, установка для поддержания физиологического баланса при аллостазе не работает линейно, а может регулироваться несколькими способами (McEwen and Karatsoreos, 2015). Наконец, термины «аллостатическая нагрузка» и «аллостатическая перегрузка» учитывают кумулятивное воздействие стрессоров на организм в нормальных физиологических и патологических ситуациях соответственно (McEwen and Karatsoreos, 2015). Несмотря на предложение концепции аллостаза, некоторые авторы утверждают, что концепция гомеостаза интерпретировалась ограниченно, и использование термина аллостаз было бы просто семантическим изменением, поскольку система аллостатического ответа остается той же самой биологической системой, изучаемой в гомеостатических исследованиях. ответ (Dallman, 2003; Day, 2005). На самом деле предложенные концепции аллостаза по-прежнему мало помогают в понимании стресса и вместо того, чтобы внести ясность, внесли несколько недоразумений в нейробиологию стресса (Davies, 2016). Наконец, необходимость концепций аллостаза подвергается сомнению с указанием на то, что это не является необходимым или желательным на данном этапе исследования стресса (Dallman, 2003). В целом концепции стресса, стрессора и реакции на стресс до сих пор широко используются и принимаются научным сообществом, и соответственно мы принимаем их в настоящем обзоре.
В целом концепции стресса, стрессора и реакции на стресс до сих пор широко используются и принимаются научным сообществом, и соответственно мы принимаем их в настоящем обзоре.
Нейроанатомия
Реакция на стресс включает эффективную, эволюционно законсервированную и сложную систему с модуляцией на нескольких уровнях центральной нервной системы (ЦНС), управляющую обучением, памятью и принятием стратегических решений (Sapolsky and Pulsinelli, 1985; Sapolsky et al. ., 1985; Pavlides et al., 1993; Sapolsky, 2000a; McEwen, 2007; Joëls and Baram, 2009; Bains et al., 2015).
Первым шагом в реакции на стресс является восприятие стрессора. Когда ситуация воспринимается как угроза, мозг задействует несколько нейронных цепей для поддержания физиологической целостности даже в самых неблагоприятных условиях (Ulrich-Lai and Herman, 2009).). Однако для обнаружения разных типов стрессоров требуется участие разных сетей. Психологические и физические стрессоры задействуют различные нейронные сети и клеточную активность, оставляя в мозгу отчетливые следы. К физическим стрессорам относят стимулы, вызывающие реальные нарушения физиологического состояния, переполняющие организм, например, кровоизлияние или инфекцию. С другой стороны, психологические стрессоры обычно определяются как стимулы, которые угрожают текущему состоянию и воспринимаются в упреждающем состоянии, например, аверсивные стимулы окружающей среды, сигналы, связанные с хищником, и неспособность удовлетворить внутренние побуждения (Dayas et al., 2001).
К физическим стрессорам относят стимулы, вызывающие реальные нарушения физиологического состояния, переполняющие организм, например, кровоизлияние или инфекцию. С другой стороны, психологические стрессоры обычно определяются как стимулы, которые угрожают текущему состоянию и воспринимаются в упреждающем состоянии, например, аверсивные стимулы окружающей среды, сигналы, связанные с хищником, и неспособность удовлетворить внутренние побуждения (Dayas et al., 2001).
Таким образом, физические и психологические факторы стресса обрабатываются разными схемами мозга, которые в некоторых случаях могут перекрываться. Независимо от обработки стрессора система стресса будет активирована скоординированным образом. Здесь мы представляем актуальную информацию об обработке мозгом физических и психологических факторов стресса и о том, как они взаимодействуют (рис. 2).
Рисунок 2 . Нейроанатомия стресса. Схематическое изображение в первую очередь нейроанатомических субстратов, ответственных за обработку физических (розовый) и психологических (синий) стрессоров. Верхние панели показывают, что нейронная обработка для обнаружения различных типов стрессоров и оценки ситуации задействует несколько структур, которые в некоторых случаях могут перекрываться в мозге человека и грызунов (9).0021 А, В соответственно). Нижние панели показывают, как физические и психогенные стрессоры требуют вовлечения различных сетей ( C, D соответственно). Физические стрессоры в основном активируют структуры, связанные с контролем жизненно важных функций, расположенные в стволе мозга и гипоталамусе. Такие структуры, как ядро солитарного тракта (NTS) и locus coeruleus (LC), играют важную роль в путях физического стресса. Однако прозэнцефальные области также участвуют в обработке физического стресса, например прелимбическая область (PL) в префронтальной коре (PFC). Также важно отметить, что центральное ядро миндалевидного тела (ЦеА) участвует в интеграции вегетативных реакций. Например, психологические стрессоры воспринимаются в предвосхищающем состоянии, которое может сильно зависеть от лимбических структур и может модулироваться системой вознаграждения.
Верхние панели показывают, что нейронная обработка для обнаружения различных типов стрессоров и оценки ситуации задействует несколько структур, которые в некоторых случаях могут перекрываться в мозге человека и грызунов (9).0021 А, В соответственно). Нижние панели показывают, как физические и психогенные стрессоры требуют вовлечения различных сетей ( C, D соответственно). Физические стрессоры в основном активируют структуры, связанные с контролем жизненно важных функций, расположенные в стволе мозга и гипоталамусе. Такие структуры, как ядро солитарного тракта (NTS) и locus coeruleus (LC), играют важную роль в путях физического стресса. Однако прозэнцефальные области также участвуют в обработке физического стресса, например прелимбическая область (PL) в префронтальной коре (PFC). Также важно отметить, что центральное ядро миндалевидного тела (ЦеА) участвует в интеграции вегетативных реакций. Например, психологические стрессоры воспринимаются в предвосхищающем состоянии, которое может сильно зависеть от лимбических структур и может модулироваться системой вознаграждения. Префронтальная кора имеет решающее значение для развития соответствующих ответов на изменения окружающей среды, и она плотно иннервируется дофаминергическими проекциями из вентральной области покрышки (VTA) и прилежащего ядра (NAc). Нарушение префронтальной коры связано с ангедонией и аберрантным поведением в поисках вознаграждения. Хотя вовлечение префронтальной коры является сложным и в целом объединяет различные реакции на стресс, PL и инфралимбические (IL) области координируют нисходящий контроль. Миндалевидный комплекс также участвует в схемах психологического стресса, и с нарушением префронтальной коры его участие становится более распространенным, и схема переключается на управление снизу вверх. Другой важной структурой, которая выделяется из-за своей важности для когнитивной функции и функции памяти и которая активируется в ответ на физические и психологические стрессоры, является гиппокамп (HIPPO). Область CA1 имеет важные связи с вышеупомянутыми лимбическими структурами, а HIPPO является важной структурой отрицательной обратной связи оси HPA.
Префронтальная кора имеет решающее значение для развития соответствующих ответов на изменения окружающей среды, и она плотно иннервируется дофаминергическими проекциями из вентральной области покрышки (VTA) и прилежащего ядра (NAc). Нарушение префронтальной коры связано с ангедонией и аберрантным поведением в поисках вознаграждения. Хотя вовлечение префронтальной коры является сложным и в целом объединяет различные реакции на стресс, PL и инфралимбические (IL) области координируют нисходящий контроль. Миндалевидный комплекс также участвует в схемах психологического стресса, и с нарушением префронтальной коры его участие становится более распространенным, и схема переключается на управление снизу вверх. Другой важной структурой, которая выделяется из-за своей важности для когнитивной функции и функции памяти и которая активируется в ответ на физические и психологические стрессоры, является гиппокамп (HIPPO). Область CA1 имеет важные связи с вышеупомянутыми лимбическими структурами, а HIPPO является важной структурой отрицательной обратной связи оси HPA. Паравентрикулярное ядро гипоталамуса (PVN) и LC (показаны серым цветом) представляют собой основное реле реакции на стресс, запускающее соответственно ось HPA и SAM. Перекрестная активность между этими ядрами позволяет когнитивно обрабатывать реакцию на стресс и обеспечивает сложные поведенческие реакции.
Паравентрикулярное ядро гипоталамуса (PVN) и LC (показаны серым цветом) представляют собой основное реле реакции на стресс, запускающее соответственно ось HPA и SAM. Перекрестная активность между этими ядрами позволяет когнитивно обрабатывать реакцию на стресс и обеспечивает сложные поведенческие реакции.
Физические стрессоры
Физические стрессоры в основном обрабатываются областями ствола мозга и гипоталамуса (Dayas et al., 2001; de Kloet et al., 2005a; Fenoglio et al., 2006; Joëls and Baram, 2009; Ulrich-Lai and Herman , 2009), они обычно требуют немедленной системной реакции, которую можно считать рефлекторной (Ulrich-Lai and Herman, 2009). Таким образом, первая фаза реакции на стресс (симпатическая адреномедуллярная система — SAM) обеспечивает быструю физиологическую адаптацию, приводящую к кратковременным реакциям, таким как настороженность, бдительность и оценка ситуации, что позволяет принять стратегическое решение, чтобы противостоять вызову в начальная фаза стрессового события (de Kloet et al. , 2005a; Joëls and Baram, 2009). Принимая во внимание, что вторичная фаза включает гормональный механизм (гипоталамо-гипофизарно-надпочечниковая ось — HPA), который считается вялым по сравнению с синаптическими механизмами, активирующими SAM, но приводит к усиленному и длительному секреторному ответу (длительные ответы). Оси SAM и HPA будут подробно описаны в следующих разделах.
, 2005a; Joëls and Baram, 2009). Принимая во внимание, что вторичная фаза включает гормональный механизм (гипоталамо-гипофизарно-надпочечниковая ось — HPA), который считается вялым по сравнению с синаптическими механизмами, активирующими SAM, но приводит к усиленному и длительному секреторному ответу (длительные ответы). Оси SAM и HPA будут подробно описаны в следующих разделах.
Таким образом, когда реальный стрессор распознается или воспринимается через сигналы (такие как боль, воспаление и другие) стволом мозга, активируются нейросхемы, включающие преганглионарные вегетативные нейроны и гипофизотрофические нейроны в паравентрикулярном ядре гипоталамуса (ПВЯ), создание быстрых ответов вегетативной нервной системы (ВНС) и оси HPA (как показано на рисунке 1; Ulrich-Lai and Herman, 2009).).
В дополнение к нескольким ядрам систем ствола головного мозга, медуллярного и спинного мозга (которые участвуют в активации ВНС через ее симпатические и парасимпатические ветви), физические стрессоры вызывают активацию других структур головного мозга, которые регулируют вегетативную реакцию на стресс, включая PVN, ядра солитарного тракта (NTS) и дорсомедиального гипоталамуса (DMH; Geerling et al. , 2010). Такие структуры также имеют проекции как на симпатические, так и на парасимпатические ветви ВНС.
, 2010). Такие структуры также имеют проекции как на симпатические, так и на парасимпатические ветви ВНС.
PVN содержит отдельные популяции нейронов, которые проецируются на вегетативные мишени в стволе головного и спинном мозге (такие как средний клеточный столб, парабрахиальное ядро, DMX и NTS) и симпатический отток срединного возвышения, следовательно, может быть опосредован PVN, но не исключительно. В дополнение к роли PVN, другим важным ядром гипоталамуса является DMH, в котором находятся анатомически сегрегированные популяции нейронов, ответственные за регуляцию вегетативных реакций, а также важные для активации или ингибирования активности оси HPA (Ulrich-Lai and Herman, 2009).).
Голубое пятно (LC; Cunningham and Sawchenko, 1988) и ростральная вентролатеральная часть продолговатого мозга (RVLM; Dempsey et al., 2017) также непосредственно иннервируют промежуточно-латеральный столбик клеток, в то время как дорсальное двигательное ядро блуждающего нерва (DMX) и двойное ядро (NA) опосредует нисходящие выходы для постганглионарной парасимпатической нервной системы (Saper and Stornetta, 2015).
Хорошо известно, что NTS в стволе мозга играет важную роль в путях стресса. Он расположен в весьма стратегическом месте и представляет собой ретранслятор сенсорной, висцеральной и соматической информации (Sapolsky et al., 2000; Herman et al., 2003; Ulrich-Lai and Herman, 2009).; Бейнс и др., 2015). Кроме того, NTS непосредственно участвует в контроле сердечно-сосудистой и дыхательной функций, содержащих различные группы нейронов, которые получают различные восходящие пути, как часть систем регуляции барорефлекса и хеморецепторов (Machado, 2001; Zoccal et al., 2014). NTS также модулирует активность оси HPA в основном через норадренергические и адренергические проекции на PVN, но некоторые исследования указывают на участие в этой модуляции других катехоламинергических путей (Herman et al., 2003; Gaillet et al., 19).91; Риттер и др., 2003).
Другими важными структурами для запуска реакции на стресс являются околожелудочковые органы (т. е. срединное преоптическое ядро, субфорникальный орган (SFO) и organum vasculosum терминальной пластинки), которые реагируют на возмущения в жидкости и посылают проекции на другие интегративные области головного мозга. Например, активация медиального парвоцеллюлярного PVN с помощью SFO необходима для регуляции центрального кровяного давления ангиотензином II и регуляции питьевого поведения (Simpson and Routtenberg, 19).75; Хиндмарч и Фергюсон, 2016).
Например, активация медиального парвоцеллюлярного PVN с помощью SFO необходима для регуляции центрального кровяного давления ангиотензином II и регуляции питьевого поведения (Simpson and Routtenberg, 19).75; Хиндмарч и Фергюсон, 2016).
И, наконец, также было описано, что лимбические области переднего мозга могут также способствовать обработке физических стрессоров, влияя на функции вегетативных реакций на стресс и активацию оси HPA (Ulrich-Lai and Herman, 2009). Эти лимбические цепи стресса включают миндалевидное тело, гиппокамп и префронтальную кору (ПФК), которые получают ассоциативную информацию из подкорковых и корковых областей, а их выходные данные конвергируют в подкорковые ретрансляционные участки, обеспечивая обработку лимбической информации ниже по течению (регуляция сверху вниз; Ульрих-Лай и Герман). , 2009 г.). Эти схемы будут рассмотрены в разделе, посвященном перекрывающимся схемам, и мы подчеркнули, как стрессоры могут взаимодействовать с системой вознаграждения (приближение × отвращение).
Психологические стрессоры
В то время как стрессоры, которые требуют преимущественно физических усилий, с большей вероятностью вызывают вегетативные стрессовые реакции, психологические неконтролируемые и социально-оценочные угрожающие стрессоры вызывают как физические, так и когнитивные стрессовые реакции (Skoluda et al., 2015). Вместе с прозэнцефальными ядрами компоненты лимбических цепей, такие как префронтальная кора, миндалина, гиппокамп (HIPPO), PVN, вентральная область покрышки (VTA) и прилежащее ядро (NAc), играют фундаментальную роль в регуляции реакции на стресс (Ulrich-Lai). и Герман, 2009 г.; Руссо и Нестлер, 2013).
Префронтальная кора имеет решающее значение для выработки соответствующих реакций на изменения окружающей среды, обеспечивая поведенческую пластичность (Ridderinkhof et al., 2004). Однако участие префронтальной коры в реакции на стресс является сложным, поскольку разные анатомические подразделения играют разные роли. Двустороннее поражение прелимбической (PL) части коры увеличивает уровень в плазме аденокортикотропного гормона (АКТГ), кортикостерона и экспрессию c-Fos PVN (Dioro et al. , 1993; Figueiredo et al., 2003). Однако поражение инфралимбической (IL) коры снижает секрецию кортикостерона (Sullivan and Gratton, 19).99). Более того, исследования поведения животных показали, что поражения дорсальных участков префронтальной коры приводят к анксиогенным эффектам, в то время как поражения вентральных участков префронтальной коры вызывают анксиолитические эффекты (Sullivan and Gratton, 2002). Эти данные показывают, что PL и IL оказывают противоположное влияние на психологический стрессорный ответ, ингибируя активность PVN с анксиолитическими эффектами или стимулируя PVN с анксиогенным поведением, соответственно (Radley et al., 2006; Jones et al., 2011).
, 1993; Figueiredo et al., 2003). Однако поражение инфралимбической (IL) коры снижает секрецию кортикостерона (Sullivan and Gratton, 19).99). Более того, исследования поведения животных показали, что поражения дорсальных участков префронтальной коры приводят к анксиогенным эффектам, в то время как поражения вентральных участков префронтальной коры вызывают анксиолитические эффекты (Sullivan and Gratton, 2002). Эти данные показывают, что PL и IL оказывают противоположное влияние на психологический стрессорный ответ, ингибируя активность PVN с анксиолитическими эффектами или стимулируя PVN с анксиогенным поведением, соответственно (Radley et al., 2006; Jones et al., 2011).
Несмотря на функциональную связь между ПФК и ПВЯ, анатомические исследования показывают, что ПФК имеет только непрямые проекции на ПВЯ (Herman et al., 2003). PL иннервирует несколько ГАМКергических нейронов в BST, что индуцирует ингибирование PVN, тогда как предполагается, что путь IL проецируется на не-ГАМКергические нейроны в BST для стимуляции PVN (Radley, 2012). Однако еще предстоит выяснить точные пути между PVN и PFC (Bains et al., 2015).
Однако еще предстоит выяснить точные пути между PVN и PFC (Bains et al., 2015).
Префронтальная кора также имеет основные проекции на миндалевидное тело, важную структуру, связанную с обработкой эмоций (Gabbott et al., 2005; LeDoux, 2007). Вначале кажется, что весь комплекс миндалевидного тела способствует синтезу и секреции кортикостероидов (Kawakami et al., 1968; Saito et al., 1989). Однако последующие исследования показали, что субъядра миндалевидного тела играют различную роль в реакции на стресс (Roozendaal et al., 2009). Комплекс миндалевидного тела можно разделить на базолатеральное ядро (BLA), центральное ядро миндалины (CeA) и медиальное ядро (MeA). Среди них BLA играет важную роль в обработке психологических стрессоров (Janak and Tye, 2015), в основном активируясь предвосхищающими стрессорами (Cullinan et al., 19).95). Однако сам по себе БЛА не влияет на высвобождение кортикостерона (Seggie, 1987). Роль BLA в обработке психологических стрессоров, по-видимому, более важна для консолидации аверсивных воспоминаний (Roozendaal et al. , 2009).
, 2009).
Инфузии агонистов ГАМКергических рецепторов Intra-BLA нарушают консолидацию аверсивной памяти (Brioni et al., 1989). Кроме того, после эмоционального возбуждения нейроны BLA демонстрируют продолжительное увеличение частоты спонтанных возбуждений, что может способствовать консолидации эмоциональных воспоминаний посредством изменений синаптической пластичности (Pelletier et al., 2005). Изменения в эмоциональном и ассоциативном обучении (т. е. агрессия и приобретенная беспомощность) увеличивали разветвление дендритов в нейронах BLA (Vyas et al., 2004; Bennur et al., 2007; Wood et al., 2008). В частности, некоторые исследования показывают, что путь BLA-PFC играет важную роль в консолидации памяти и реакции на стресс (Laviolette and Grace, 2006; Felix-Ortiz et al., 2016; Burgos-Robles et al., 2017). BLA имеют обширные двунаправленные моносинаптические глутаматергические проекции с префронтальной корой (PL и IL; Gabbott et al., 2005; Dilgen et al., 2013; McGarry and Carter, 2016), что имеет решающее значение для эмоционального обучения, реакций, связанных со страхом, тревожное поведение и социальные взаимодействия (Laviolette and Grace, 2006; Felix-Ortiz et al. , 2016; Burgos-Robles et al., 2017). Наконец, активность реакции на стресс в BLA, вероятно, зависит не только от взаимодействия с префронтальной корой, но и опосредована проекциями между PVN и миндалевидным телом (Prewitt and Herman, 19).98).
, 2016; Burgos-Robles et al., 2017). Наконец, активность реакции на стресс в BLA, вероятно, зависит не только от взаимодействия с префронтальной корой, но и опосредована проекциями между PVN и миндалевидным телом (Prewitt and Herman, 19).98).
BLA имеет обильные выходы в CeA и MeA, которые имеют мультисинаптические связи с PVN (Herman et al., 2003). CeA и MeA иннервируют структуры ствола мозга, которые непосредственно проецируются в PVN, такие как ядро ложа конечной полоски (BNST; Prewitt and Herman, 1998). Однако недавние данные с подходами оптогенетики указывают на то, что проекции PVN на CeA активируются во время извлечения долговременных воспоминаний о страхе. Напротив, извлечение кратковременных воспоминаний в основном зависит от входов префронтальной коры в BLA, что указывает на зависящий от времени сдвиг в цепях воспоминаний о страхе (Do-Monte et al., 2015). В свою очередь, CeA имеет прямые связи с периакведуктальным серым цветом (PAG), фундаментальной областью, которая организует реакцию на угрозу (LeDoux, 2012). В частности, дорсальный PAG связан с воздействием безусловных угроз, а вентральный PAG активируется при условных угрозах, каждая из которых имеет разные поведенческие результаты. В то время как повреждения дорсальной ПАГ усиливали замирание, повреждение вентральной ПАГ снижало замирание (De Oca et al., 19).98; Леду, 2012).
В частности, дорсальный PAG связан с воздействием безусловных угроз, а вентральный PAG активируется при условных угрозах, каждая из которых имеет разные поведенческие результаты. В то время как повреждения дорсальной ПАГ усиливали замирание, повреждение вентральной ПАГ снижало замирание (De Oca et al., 19).98; Леду, 2012).
Другой важной лимбической структурой для обработки стресса является формирование гиппокампа (McEwen et al., 1968; Smotherman et al., 1981), которое состоит из зубчатой извилины (DG) и аммонова рога/ Cornus Ammonics (CA) подполей которые составляют хорошо известную трисинаптическую цепь, сначала от клеток-зерен DG к пирамидным клеткам СА3, а затем от СА3 к пирамидным клеткам СА1 (Amaral and Witter, 1989; Andersen et al., 2000; Naber et al., 2001). В то время как DG получает большую часть внегиппокампальных афферентов от энторинальной коры через перфорантный путь (Witter, 2007), СА1 и субикулюмальные пирамидные нейроны являются основным выходом HIPPO для нескольких областей, таких как возбуждающие проекции на префронтальную кору (PL и IL). и непрямые ингибирующие проекции на PVN (Barbas and Blatt, 1995; Герман и Мюллер, 2006).
и непрямые ингибирующие проекции на PVN (Barbas and Blatt, 1995; Герман и Мюллер, 2006).
Ингибирующий контроль гиппокампа над осью HPA действует по принципу отрицательной обратной связи, подавляя ее (Jacobson and Sapolsky, 1991; Herman et al., 1996). В основном непрямой ввод HIPPO в гипоталамус происходит в CA1 и subiculum, которые плотно иннервируют BNST и структуры гипоталамуса, за исключением PVN (Canteras and Swanson, 1992; Cullinan et al., 1993).
Проекции HIPPO как на префронтальную кору, так и на BLA играют одну из наиболее важных ролей в памяти, но особенно в регуляции психологической реакции на стресс (Godsil et al., 2013). HIPPO имеет двусторонние связи с BLA, но в то же время позволяет PFC модулировать систему стресса с помощью нисходящего контроля (Mcdonald, 19).98; Джанак и Тай, 2015 г.; Рэдли и др., 2015). Однако моносинаптические глутаматергические эфференты CA1 и subiculum к PL и IL могут функционально нарушаться после интенсивного психологического стресса (Zheng and Zhang, 2015). При сильном эмоциональном переживании HIPPO и BLA быстро активируют связанные с памятью механизмы синаптической пластичности, в то время как функционирование префронтальной коры подавляется, способствуя долговременным воспоминаниям-вспышкам (Diamond et al., 2007).
При сильном эмоциональном переживании HIPPO и BLA быстро активируют связанные с памятью механизмы синаптической пластичности, в то время как функционирование префронтальной коры подавляется, способствуя долговременным воспоминаниям-вспышкам (Diamond et al., 2007).
Таким образом, при наличии психологических стрессоров, если активность миндалевидного тела и ГИППО становится более преобладающей, стрессовая система может переключаться на управление снизу вверх (Arnsten, 2009).). Кроме того, длительный психологический стресс снижает глутаматергическую проекцию на интернейроны в BLA, что приводит к потере ингибирования BLA префронтальной корой и, наконец, к повышенной возбудимости BLA, которая отвечает за поведенческие аномалии, связанные со стрессом (Wei et al., 2017). ).
На этом этапе среди нескольких ядер гипоталамуса, которые непосредственно участвуют в регуляции оси HPA и вегетативных реакциях на стрессоры, PVN выделяется как основной интегратор сигналов стресса (Herman et al. , 2003; Ulrich-Lai and Herman, 2009).). В общем, медиальные парвоцеллюлярные нейроны PVN получают проекции первого или второго порядка соматических афферентных ноцицептивных, висцеральных, гуморальных или сенсорных путей, помимо таковых лимбической системы и системы вознаграждения, таких как префронтальная кора, миндалина, HIPPO, VTA и NAc (Russo и Нестлер, 2013; Бейнс и др., 2015). Как уже упоминалось ранее, большинство лимбико-PVN-связей являются непрямыми и осуществляются через группы ГАМКергических клеток в областях BNST и пери-PVN гипоталамуса (Crestani et al., 2013). Исследования, включающие картирование активности (в основном экспрессия c-Fos), продемонстрировали важную роль BNST в регуляции оси HPA (Zhu et al., 2001), в то время как задние ядра BNST участвуют в ингибировании оси HPA, антеровентральные ядра участвуют в его возбуждении (Choi et al., 2007). В системе вознаграждения фармакологическое ингибирование NAc увеличивало экспрессию c-Fos в PVN (Noh et al., 2012). Наконец, парвоцеллюлярные нейроны PVN стратегически связаны с несколькими ядрами ствола и переднего мозга, такими как NTS, DMH, LC, VLM, DMX и NA, что важно для обработки и интеграции обоих модальностей стрессоров, физических и психологических, что приводит к быстрая активация оси HPA (Ulrich-Lai and Herman, 2009; Сенст и Бейнс, 2014).
, 2003; Ulrich-Lai and Herman, 2009).). В общем, медиальные парвоцеллюлярные нейроны PVN получают проекции первого или второго порядка соматических афферентных ноцицептивных, висцеральных, гуморальных или сенсорных путей, помимо таковых лимбической системы и системы вознаграждения, таких как префронтальная кора, миндалина, HIPPO, VTA и NAc (Russo и Нестлер, 2013; Бейнс и др., 2015). Как уже упоминалось ранее, большинство лимбико-PVN-связей являются непрямыми и осуществляются через группы ГАМКергических клеток в областях BNST и пери-PVN гипоталамуса (Crestani et al., 2013). Исследования, включающие картирование активности (в основном экспрессия c-Fos), продемонстрировали важную роль BNST в регуляции оси HPA (Zhu et al., 2001), в то время как задние ядра BNST участвуют в ингибировании оси HPA, антеровентральные ядра участвуют в его возбуждении (Choi et al., 2007). В системе вознаграждения фармакологическое ингибирование NAc увеличивало экспрессию c-Fos в PVN (Noh et al., 2012). Наконец, парвоцеллюлярные нейроны PVN стратегически связаны с несколькими ядрами ствола и переднего мозга, такими как NTS, DMH, LC, VLM, DMX и NA, что важно для обработки и интеграции обоих модальностей стрессоров, физических и психологических, что приводит к быстрая активация оси HPA (Ulrich-Lai and Herman, 2009; Сенст и Бейнс, 2014).
Перекрывающаяся обработка
Многие из вышеперечисленных схем и областей мозга, ответственных за физические и психологические факторы стресса, могут показаться связанными исключительно со стволом и передним мозгом соответственно. Однако некоторые структуры также взаимодействуют с различными модальностями стрессора (рис. 2).
Наиболее хорошо охарактеризованная цепь вознаграждения в мозге состоит из дофаминергических нейронов в VTA, которые проецируются в NAc, подразделение вентрального полосатого тела (Bath et al., 2017). Первичные центры вознаграждения мозга сложным образом связаны между собой в схеме вознаграждения мозга, но в основном VTA и NAc регулируют лимбические области, упомянутые выше (Heshmati and Russo, 2015).
Дофаминергический тонус VTA имеет основополагающее значение для распознавания наград или наказаний в окружающей среде (Russo and Nestler, 2013). Возбуждение всех нейронов VTA усиливает/имитирует вызванные стрессом эффекты социального поражения на социальное избегание и ангедонию, в то время как замалчивание всех нейронов VTA (независимо от области проекции или типа клеток) способствует противоположному эффекту (Krishnan et al. , 2007). С другой стороны, оптогенетическая стимуляция дофаминергических нейронов ВОП приводит к условному предпочтению места (Tsai et al., 2009).), тогда как ингибирование VTA способствует условно-рефлекторному отвращению (Tan et al., 2012).
, 2007). С другой стороны, оптогенетическая стимуляция дофаминергических нейронов ВОП приводит к условному предпочтению места (Tsai et al., 2009).), тогда как ингибирование VTA способствует условно-рефлекторному отвращению (Tan et al., 2012).
Однако VTA состоит из разных субпопуляций нейронов, которые участвуют в разных цепях, кодирующих разные мотивационные сигнатуры (Lammel et al., 2012, 2014). Дофаминергические нейроны VTA проецируются на NAc, HIPPO, BLA и PFC, однако NAc также получает глутаматергическую иннервацию от вентральных HIPPO, BLA и PFC (Russo and Nestler, 2013; Lammel et al., 2014), и все эти ядра находятся под регулирующее влияние дофамина. В самом деле, дофаминергические нейроны, которые иннервируют mPFC, проявляют пониженную активацию после социального поражения при хроническом стрессе (Chaudhury et al., 2012). Дофаминергические нейроны в VTA демонстрируют два паттерна спонтанной импульсной активности: медленная, единичная активация и импульсная активация, которые эффективно регулируют активность нейронов в дофаминергических областях-мишенях и кодируют сигналы, связанные с вознаграждением (Grace et al. , 2007). . Этот механизм кодирования и задействования конкретных сетей имеет смысл, поскольку поведенческая реакция на вознаграждающий (приближение) и неприятный опыт (отвращение) различна и, следовательно, включает разные, возможно, перекрывающиеся нейронные цепи (Lammel et al., 2011).
, 2007). . Этот механизм кодирования и задействования конкретных сетей имеет смысл, поскольку поведенческая реакция на вознаграждающий (приближение) и неприятный опыт (отвращение) различна и, следовательно, включает разные, возможно, перекрывающиеся нейронные цепи (Lammel et al., 2011).
Соответственно, связывая эту точно настроенную регуляцию VTA с обработкой стресса, было предположено, что специфический вентральный путь VTA связан с болезненным физическим стрессом. Несколько результатов показали, что дофаминергические клетки, которые специфически проецируются на mPFC, регулируют процесс вредных раздражителей (Abercrombie et al., 1989; Mantz et al., 1989; Bassareo et al., 2002; Brischoux et al., 2009; Matsumoto and Hikosaka). , 2009; Ламмель и др., 2011). Но важно отметить, что, хотя дофамин играет центральную роль в обработке физических стрессоров, в этом сценарии NAc сохраняет центральную роль в регулировании системы вознаграждения (Grace et al., 2007), которая тесно связана с обработкой психологических стрессов. стрессоры и поощрение поведенческой гибкости (Хешмати и Руссо, 2015).
стрессоры и поощрение поведенческой гибкости (Хешмати и Руссо, 2015).
По существу, проекции HIPPO на NAc способствуют восприимчивости к психологическому стрессу, путь BLA-NAc усиливает поведение, направленное на поиск вознаграждения, а PFC-NAc способствует устойчивости (Stuber et al., 2011; Vialou et al., 2014; Bagot et al., 2015; Хешмати и Руссо, 2015). Повышенное возбуждение дофаминергических нейронов VTA, которые иннервируют NAc, происходит только у восприимчивых мышей после хронического стресса социального поражения, в то время как путь VTA-PFC снижает возбуждение после того же протокола (Chaudhury et al., 2012). Следовательно, мы можем видеть, что, хотя мезокортикальные пути кодируют физическую обработку, NAc может представлять собой важный узел обработки психологического стресса.
Не только активность префронтальной коры соответствует интегративной горячей точке лимбической системы и цепи вознаграждения, но и ее вклад в ингибирование оси HPA посредством нисходящего контроля префронтальной коры имеет решающее значение. Если обратная связь тормозной оси ГГН не функционирует должным образом, как в случае хронического стресса и нервно-психических расстройств, потеря отрицательной обратной связи в ПВЯ, регулируемой ПФК и ГИППО, связанная с повышенной возбудимостью БЛА и подавлением NAc, создает положительную реакцию. обратная связь в PVN, которая может как перегружать систему стресса (Duvarci and Paré, 2007; Willner et al., 2013), так и истощать систему вознаграждения (Heshmati and Russo, 2015).
Если обратная связь тормозной оси ГГН не функционирует должным образом, как в случае хронического стресса и нервно-психических расстройств, потеря отрицательной обратной связи в ПВЯ, регулируемой ПФК и ГИППО, связанная с повышенной возбудимостью БЛА и подавлением NAc, создает положительную реакцию. обратная связь в PVN, которая может как перегружать систему стресса (Duvarci and Paré, 2007; Willner et al., 2013), так и истощать систему вознаграждения (Heshmati and Russo, 2015).
Кроме того, что касается PFC, интересные данные показали, что стимуляция PL усиливает опосредованные гипоксией реакции кортикостерона и PVN с помощью картирования активации c-Fos (Jones et al., 2011). Некоторые ядра ствола мозга, которые регулируют вегетативную реакцию, такие как DMX и NAc, получают и отправляют информацию из других областей ЦНС и в них, соответственно, включая части IL и PL префронтальной коры, CeA и BNST (Ulrich-Lai and Herman, 2009). .
CeA, ранее упоминавшийся как центральный узел реакции на страх, также считается ключевым узлом интеграции стресса (Ulrich-Lai and Herman, 2009). ). Более того, NTS также плотно иннервируется афферентными проекциями из CeA (Smith and Vale, 2006). NTS может активироваться во время парадигмы обусловливания, предполагая, что этот путь также играет роль в интеграции предвосхищающего стресса (Pezzone et al., 1993).
). Более того, NTS также плотно иннервируется афферентными проекциями из CeA (Smith and Vale, 2006). NTS может активироваться во время парадигмы обусловливания, предполагая, что этот путь также играет роль в интеграции предвосхищающего стресса (Pezzone et al., 1993).
Важно подчеркнуть, что различные модальности стрессоров, которые активируют PVN, также активируют систему LC-норэпинефрина (LC-NE), например, сдерживание, шок (особенно непредсказуемый), аудиогенный стресс, вегетативные и иммунологические проблемы, а также социальный стресс (Вуд и Валентино, 2016). LC представляет собой компактное ядро моста, примыкающее к четвертому желудочку, и содержит большинство экспрессирующих NE нейронов в головном мозге и иннервирует всю невральную ось (Swanson and Hartman, 19).75).
Активация LC-NE происходит параллельно и координируется с активацией PVN. Это перекрестное взаимодействие между этими ядрами позволяет осуществлять когнитивную обработку реакции на стресс с вовлечением лимбических и проэнцефалических областей, таких как HIPPO и кора, которые регулируют возбудимость нейронов, познание, память и сложное поведение (Joëls and de Kloet, 1989; Wood and Valentino). , 2016). Недавние методы, такие как хемогенетика, оптогенетика, в сочетании с традиционным ретроградным отслеживанием, которые позволяют избирательно манипулировать системой LC-NE у грызунов, определили ключевую роль LC-NE, например, для стресс-индуцированного тревожно-подобного поведения (McCall). и др., 2015). Интересно, что гормон высвобождения кортикотропина (CRH), который первоначально был открыт и определен как гормон, инициирующий каскад, который в конечном итоге приводит к высвобождению глюкокортикоидов, по-видимому, выделяется как молекула, которая координирует взаимодействие между двумя системами (Валентино и Ван Бокстале, 2008).
, 2016). Недавние методы, такие как хемогенетика, оптогенетика, в сочетании с традиционным ретроградным отслеживанием, которые позволяют избирательно манипулировать системой LC-NE у грызунов, определили ключевую роль LC-NE, например, для стресс-индуцированного тревожно-подобного поведения (McCall). и др., 2015). Интересно, что гормон высвобождения кортикотропина (CRH), который первоначально был открыт и определен как гормон, инициирующий каскад, который в конечном итоге приводит к высвобождению глюкокортикоидов, по-видимому, выделяется как молекула, которая координирует взаимодействие между двумя системами (Валентино и Ван Бокстале, 2008).
Сеть LC-NE является основной целью CRH (Chappell et al., 1986; Wood and Valentino, 2016). Во время стресса CRH высвобождается в LC, увеличивая скорость возбуждения нейронов и, следовательно, высвобождение NE в мишенях переднего мозга (Valentino et al., 1991; Jedema and Grace, 2004). Различные структуры, координирующие вегетативную и лимбическую обработку, такие как CeA (Van Bockstaele et al. , 1998), BNST (Van Bockstaele et al., 1999), PVN (Reyes et al., 2005), парагигантоцеллюлярное ядро и ядро Баррингтона (Valentino et al. ал., 1992, 1996) посылают модуляторные проекции CRH в LC. Ядро Баррингтона является одним из немногих ядер, которые фактически посылают проекции непосредственно в ядро LC, а также имеют важные проекции в преганглионарную колонку пояснично-крестцового отдела спинного мозга (Valentino et al., 1996).
, 1998), BNST (Van Bockstaele et al., 1999), PVN (Reyes et al., 2005), парагигантоцеллюлярное ядро и ядро Баррингтона (Valentino et al. ал., 1992, 1996) посылают модуляторные проекции CRH в LC. Ядро Баррингтона является одним из немногих ядер, которые фактически посылают проекции непосредственно в ядро LC, а также имеют важные проекции в преганглионарную колонку пояснично-крестцового отдела спинного мозга (Valentino et al., 1996).
Интересно, что высвобождение CRH в LC также регулируется базальными уровнями кортикостероидов (Valentino and Van Bockstaele, 2008). Эта связь между HPA и осью LC-NE определяет структурную основу эмоционального возбуждения, облегчает познание и способствует гибкому поведению. реакции на стресс (Коул и Куб, 19 лет).88; Valentino, Van Bockstaele, 2008), поскольку высвобождение КРГ в ЖК при стрессе облегчает переключение внимания между различными стимулами (Snyder et al., 2012). Таким образом, эти перекрестные помехи позволяют организмам адаптировать различные стратегии для решения постоянно меняющихся экологических проблем.
SAM Axis и катехоламины
Стрессовая реакция на физические и/или психологические стрессоры, организованная ранее описанной схемой мозга, включает быструю физиологическую адаптацию, опосредованную главным образом катехоламинами (de Kloet et al., 2005a; Joëls and Baram, 2009; Танк и Ли Вонг, 2015 г.). Фактически адреналин (Э) и НЭ секретируются мозговым веществом надпочечников (Cannon, 1914; de Kloet et al., 2005a; Joëls and Baram, 2009; Kvetnansky et al., 2009; Tank and Lee Wong, 2015), а НЭ — из симпатические нервы (Euler, 1946; Kvetnansky et al., 2009; Tank, Lee Wong, 2015).
Схема, ответственная за эти вегетативные модуляции, включает прямые проекции от PVN, LC и RVLM (Iversen et al., 2000; Ulrich-Lai and Herman, 2009) к преганглионарным симпатическим нейронам, присутствующим в дорсальной промежуточной латеральной клеточной колонке (IML) спинной мозг (грудопоясничная область), поскольку эти ядра модулируются NTS (Ulrich-Lai and Herman, 2009).). Каждое преганглионарное волокно соединяется со многими постганглионарными нейронами, расположенными в одном или нескольких преспинномозговых ганглиях или симпатических паравертебральных ядрах (Boron and Boulpaep, 2009). Хотя существует множество эфферентных путей ВНС, для передачи импульсов между ЦНС в эффекторную ткань необходимы только два нейрона (Mccorry, 2007).
Хотя существует множество эфферентных путей ВНС, для передачи импульсов между ЦНС в эффекторную ткань необходимы только два нейрона (Mccorry, 2007).
Другие преганглионарные нейроны, оканчивающиеся в спинном мозге, не образуют синапсов с постганглионарными нейронами. Например, они образуют синапсы непосредственно с хромаффинными клетками мозгового вещества надпочечников (Mccorry, 2007; Boron and Boulpaep, 2009).). Эта железистая ткань синтезирует и секретирует E и NE, что составляет 80% катехоламинов, выделяемых мозговым веществом надпочечников у человека (Goldstein et al., 2003; Dünser and Hasibeder, 2009; Tank and Lee Wong, 2015). Таким образом, эти два компонента повышают способность симпатического отдела влиять на висцеральные реакции организма (Boron and Boulpaep, 2009). Активация симпатической системы приводит к активации сигнальных путей, вызывающих изменения в кровеносных сосудах, железах, внутренних органах и гладких мышцах (Tank and Lee Wong, 2015).
Парасимпатический компонент ВНС регулирует действие и продолжительность вегетативных реакций, генерируя так называемый «вагусный тонус» сердечной и дыхательной систем (Iversen et al. , 2000; McEwen, 2007; Davidson, McEwen, 2012). ). Преганглионарные парасимпатические нейроны отходят от краниосакральных позвоночных сегментов (ствола головного мозга и крестцового отдела спинного мозга) синапсов с постганглионарными нейронами в терминальных узлах, расположенных более периферически и обычно на стенке органов-мишеней. Постпарасимпатические ганглионарные нейроны стимулируют мускариновые и никотиновые рецепторы, присутствующие на мембране клеток-мишеней, высвобождая ацетилхолин (Boron and Boulpaep, 2009).).
, 2000; McEwen, 2007; Davidson, McEwen, 2012). ). Преганглионарные парасимпатические нейроны отходят от краниосакральных позвоночных сегментов (ствола головного мозга и крестцового отдела спинного мозга) синапсов с постганглионарными нейронами в терминальных узлах, расположенных более периферически и обычно на стенке органов-мишеней. Постпарасимпатические ганглионарные нейроны стимулируют мускариновые и никотиновые рецепторы, присутствующие на мембране клеток-мишеней, высвобождая ацетилхолин (Boron and Boulpaep, 2009).).
Эффект, вызываемый любым из этих веществ, ацетилхолином, норэпинефрином и адреналином, зависит от биохимических свойств клеток и от распределения рецепторов в определенной ткани (Mccorry, 2007). В целом считается, что активация SAM опосредует краткосрочные эффекты с быстрым ответом, в то время как активация оси HPA приводит к краткосрочным и долгосрочным эффектам (Joëls and Baram, 2009; Tank and Lee Wong, 2015). Как упоминалось ранее, взаимодействия этих основных стрессовых систем (SAM и HPA) происходят на нескольких уровнях, функционируя совместно и/или последовательно, действуя противоположным образом на большинство внутренних органов-мишеней.
Хотя эти симпатическая и парасимпатическая системы действуют независимо друг от друга (Antunes-Rodrigues et al., 2005; Ulrich-Lai and Herman, 2009; Tank and Lee Wong, 2015), доминирование симпатической системы возникает при таких условиях, как физические упражнения и реакции «бей или беги», в состоянии покоя преобладает парасимпатическая система (Mccorry, 2007).
Э и НЭ взаимодействуют с адренорецепторами, присутствующими в клеточных мембранах гладких мышц и во многих органах, а также в нейронах, широко распространенных в ЦНС (Mccorry, 2007; Tank, Lee Wong, 2015). Эти рецепторы представляют собой рецепторы, сопряженные с G-белком (GPCR), которые гомологичны мускариновым рецепторам, т. е. представляют собой белки, встроенные в клеточную мембрану с семью трансмембранными доменами (Mccorry, 2007; Dünser and Hasibeder, 2009).). Есть два основных типа адренергических рецепторов; α-адренорецепторы и β-адренорецепторы с их подтипами (Langer, 1980; Guimarães and Moura, 2001; Dünser and Hasibeder, 2009).
Увеличение циркулирующих E и NE вызывает общие физиологические изменения, подготавливающие организм к реакции «бей или беги» (Cannon, 1915, 1929; Bowman, 1930). Их эффекты включают в себя: поддержание бдительности, метаболические действия (увеличение уровня глюкозы за счет гликогенолиза и глюконеогенеза, липолиза, увеличение потребления кислорода и термогенеза) и сердечно-сосудистые действия (Aires, 2012).
Центральная норадренергическая система, в частности LC, участвует во множестве нейрохимических цепей, имеющих связи с нейроанатомическими структурами, участвующими в реакции на стресс, такими как HIPPO, миндалевидное тело и височная неокортекс. Исследования указывают на важную роль LC в ответ на острый стресс (Myers et al., 2017), выступая в качестве «сигнальной системы» во внимании, возбуждении и защитных реакциях (Cassens et al., 1981; Valentino and Van Bockstaele, 2008). Однако хроническая активация LC может играть потенциальную роль в развитии патологического поведения, связанного со стрессом (Southwick et al. , 19).99; Зиглер и др., 1999; Валентино и др., 2012 г.; Джордж и др., 2013 г.; Reyes et al., 2015), который будет обсуждаться в одном из следующих разделов.
, 19).99; Зиглер и др., 1999; Валентино и др., 2012 г.; Джордж и др., 2013 г.; Reyes et al., 2015), который будет обсуждаться в одном из следующих разделов.
Таким образом, высвобождение норадреналина оказывает центральное действие, координирует и модулирует вегетативные, эндокринные и нейроэндокринные реакции через обширные связи головного и спинного мозга, в то время как прямые проекции от LC к медиальному парвоцеллюлярному отделу PVN (Cunningham and Sawchenko, 1988) позволяют модуляция оси HPA (Armario et al., 2012). С другой стороны, на активность самой КП может влиять КРГ через афферентные проекции от миндалевидного тела и ядер ствола мозга (McCall et al., 2015; Sun et al., 2015), облегчая сложные поведенческие и когнитивные реакции на стресс (Valentino и Ван Бокстале, 2008 г.).
Гипофизарно-надпочечниковая ось и глюкокортикоиды
Когда организм сталкивается с угрожающим стимулом, психологическим или физическим, как объяснялось в предыдущих разделах, многие области мозга активируются скоординированным образом, чтобы задействовать сложную структуру, известную как гипоталамус, которая состоит из множества субъядер. Как уже обсуждалось, среди этих ядер есть PVN, который отвечает за активацию оси HPA, одного из основных компонентов реакции на стресс. PVN синтезирует три различных нейрохимических соединения, которые ведут себя либо как нейротрансмиттеры, либо как гормоны, в зависимости от того, где они действуют. Этими соединениями являются окситоцин, вазопрессин и КРГ (Vale et al., 19).81; Савченко и др., 1992, 1996).
Как уже обсуждалось, среди этих ядер есть PVN, который отвечает за активацию оси HPA, одного из основных компонентов реакции на стресс. PVN синтезирует три различных нейрохимических соединения, которые ведут себя либо как нейротрансмиттеры, либо как гормоны, в зависимости от того, где они действуют. Этими соединениями являются окситоцин, вазопрессин и КРГ (Vale et al., 19).81; Савченко и др., 1992, 1996).
Гипофиз расположен каудально и над перекрестом зрительных нервов и состоит из передней части (аденогипофиза), которая синтезирует и секретирует гормоны, и задней части (нейрогипофиза), которая хранит окситоцин и вазопрессин, синтезируемые парвоцеллюлярными нейронами в PVN (McCann and Brobeck, 1954; Joëls and Baram, 2009).
Когда КРГ достигает передней доли гипофиза, он стимулирует кортикотрофы к синтезу и высвобождению АКТГ (Vale et al., 1981). АКТГ секретируется через гипофизарную портальную систему и действует на кору надпочечников, в частности, на средний слой, называемый fascicullata (Vale et al. , 1978; Herman et al., 2003), который отвечает за выработку глюкокортикоидов. синтез и секреция (Vale et al., 1978). Основным глюкокортикоидом у человека является кортизол, а его эквивалентом у грызунов является кортикостерон (de Kloet, 2013).
, 1978; Herman et al., 2003), который отвечает за выработку глюкокортикоидов. синтез и секреция (Vale et al., 1978). Основным глюкокортикоидом у человека является кортизол, а его эквивалентом у грызунов является кортикостерон (de Kloet, 2013).
Хотя ось HPA имеет ультрадианный ритм (Young et al., 2004; de Kloet and Sarabdjitsingh, 2008; Lightman and Conway-Campbell, 2010), уровни кортикостероидных гормонов следуют циркадному ритму, а также пику секреции глюкокортикоидов. у людей, возникающих ранним утром, и у грызунов в начале вечера (Reppert and Weaver, 2002). Есть много свидетельств того, что супрахиазматическое ядро (СХЯ) гипоталамуса является генератором циркадианного ритма (Welsh et al., 19).95; Джагота и др., 2000; Репперт и Уивер, 2002 г.; Энгеланд и Арнхольд, 2005). Глюкокортикоиды действуют на переднюю долю гипофиза, PVN и другие структуры головного мозга, такие как HIPPO (McEwen et al., 1968), контролируя активность ГГА оси. Это явление называется соответственно короткой и длинной петлями отрицательной обратной связи (de Kloet et al. , 1991; Joëls and Baram, 2009; Bains et al., 2015).
, 1991; Joëls and Baram, 2009; Bains et al., 2015).
Глюкокортикоиды являются стероидами и легко проникают через клеточные мембраны, а поскольку они высвобождаются в кровоток, они могут достигать практически любой клетки организма. Хотя периферически глюкокортикоиды действуют массивно на несколько органов-мишеней, здесь мы сосредоточимся на их влиянии на головной мозг. Кортизол, или кортикостерон у грызунов, оказывает свое действие на мозг, связываясь с двумя типами рецепторов, глюкокортикоидным рецептором (GR) и минералокортикоидным рецептором (MR; Reul and de Kloet, 19).85; де Клоет и др., 2005a,b). Эти рецепторы опосредуют эффекты глюкокортикоидов в головном мозге через геномные и негеномные механизмы (Verkuyl et al., 2005; de Kloet and Sarabdjitsingh, 2008; Groeneweg et al., 2012; Joëls et al., 2012) и, следовательно, GR и Характеристики MR, такие как распределение, сродство и механизм действия, являются определяющими для регуляции гомеостаза в исходном состоянии или для содействия адаптации посредством реакции на стресс.
MR демонстрирует в 10 раз более высокое сродство к кортикостерону, чем GR (Reul and de Kloet, 1985). Такая разница переводится в занятость рецепторов в течение дня, во время сквозной фазы циркадного цикла, когда уровни глюкокортикоидов низкие, MR заняты, тогда как GR в основном свободны. Во время пиковой фазы циркадного цикла или после высокого высвобождения глюкокортикоидов из-за реакции на стресс MR полностью заняты, в то время как GR частично заняты (Kitchener et al., 2004; Young et al., 2004).
Хотя глюкокортикоиды способны достигать всех нейронов головного мозга, они воздействуют на те нейроны, которые экспрессируют GR и MR. ГР многочисленны и широко распространены по всему мозгу. С другой стороны, МР экспрессируются в ограниченных областях мозга (Reul and de Kloet, 19).86). Также важно отметить, что существуют некоторые ключевые структуры, которые экспрессируют оба рецептора, такие как PVN, HIPPO, миндалина, латеральная перегородка, LC и NTS, среди прочих. Более того, GR и MR также совместно локализуются с адренорецепторами, обеспечивая взаимодействие между осями SAM и HPA (Härfstrand et al. , 1986; Joëls and de Kloet, 1989; Pu et al., 2007; Krugers et al., 2012; Zhou). и др., 2012).
, 1986; Joëls and de Kloet, 1989; Pu et al., 2007; Krugers et al., 2012; Zhou). и др., 2012).
При связывании с GR или MR, находящимися в цитозоле, комплекс рецептор-лиганд образует мономеры или димеры (гомо- или гетеродимеры), которые транслоцируются в ядро и связываются с промоторными областями примерно 1–2% генома (известными как Glucocorticoid Responsive Elements) или взаимодействуют с факторами транскрипции, обычно снижая их эффективность (Morsink et al., 2006; Datson et al., 2008; Grbesa and Hakim, 2017; Weikum et al., 2017). Эти отсроченные и длительные эффекты активации рецепторов GR и MR (Joëls et al., 2012) опосредуют транскрипцию белков, участвующих в иммунных, когнитивных, метаболических и многих других физиологических процессах, чтобы способствовать изменениям в физиологии и поведении. Более того, также было показано, что не только геномные процессы запускаются ГР и МР, на самом деле существуют исследования, четко показывающие быстрые эффекты мембранной активации МР и ГР (Borski, 2000; Johnson et al. , 2005; Karst et al. ., 2005; Olijslagers et al., 2008; Wang and Wang, 2009.; Эвансон и др., 2010 г.; Карст и др., 2010; Розендаал и др., 2010; Гроеневег и др., 2012 г.; Нахар и др., 2016).
, 2005; Karst et al. ., 2005; Olijslagers et al., 2008; Wang and Wang, 2009.; Эвансон и др., 2010 г.; Карст и др., 2010; Розендаал и др., 2010; Гроеневег и др., 2012 г.; Нахар и др., 2016).
Важно отметить, что было продемонстрировано, что уровни ГР и, следовательно, функция оси HPA могут модулироваться окружающей средой, а также жизненным опытом (острые и хронические стрессоры) посредством стабильных изменений в хроматине ДНК, которые не изменять последовательность ДНК, механизм, известный как эпигенетика (Hunter et al., 2009; Griffiths and Hunter, 2014; Buschdorf and Meaney, 2015). Изменения, такие как метилирование и ацетилирование гистонов, происходят по всему геному, усиливая или препятствуя активности хроматина, однако метилирование ДНК также может происходить геноспецифическим образом, изменяя его экспрессию (Tsankova et al., 2006; Nestler, 2014). Фактически, Уивер и др. (2004) показали, что факторы окружающей среды, такие как материнская забота, играют фундаментальную роль в программировании функции оси HPA, в частности, на подсемействе ядерных рецепторов 3 группы C члена 1 (9). 0282 NR3C1) ген (GR), который сохраняется во взрослом возрасте. Эти авторы продемонстрировали, что детеныши, за которыми мало ухаживали (вылизывали и ухаживали за щенками) от своих матерей, имели более высокое метилирование гиппокампа NC3R1 , связанное с более низкой экспрессией GR, по сравнению с теми, которые получали высокие уровни вылизывания и ухода.
0282 NR3C1) ген (GR), который сохраняется во взрослом возрасте. Эти авторы продемонстрировали, что детеныши, за которыми мало ухаживали (вылизывали и ухаживали за щенками) от своих матерей, имели более высокое метилирование гиппокампа NC3R1 , связанное с более низкой экспрессией GR, по сравнению с теми, которые получали высокие уровни вылизывания и ухода.
Эпигенетическая модуляция экспрессии ГР также была описана у людей, что было подчеркнуто Palma-Gudiel et al. (2015) и Smart et al. (2015), и хотя некоторые исследования указывают на тот факт, что стресс (невзгоды в раннем возрасте) приводит к NR3C1 гиперметилирование, связь этих эпигенетических изменений с такими психопатологиями, как депрессия у людей, до сих пор остается спорной (McGowan et al., 2009; Alt et al., 2010; Na et al., 2014; Palma-Gudiel et al. , 2015; Смарт и др., 2015). С другой стороны, доклинические данные связывают индуцированные стрессом эпигенетические изменения с уязвимостью или устойчивостью к состояниям, подобным психиатрии (Covington et al. , 2009, 2011; Wilkinson et al., 2009; Nestler, 2014).
, 2009, 2011; Wilkinson et al., 2009; Nestler, 2014).
Стресс и иммунная система
Как упоминалось ранее, именно через рецептор GR ось HPA модулирует иммунную систему, которая включает белок-белковые взаимодействия и/или взаимодействия ДНК (для дальнейшего обзора см. Liu et al., 2014). Хотя открытие взаимодействия между воспалительной и эндокринной системами датируется давней историей, оно по-прежнему остается горячей темой в области исследований стресса. В тот же период, когда Ганс Селье открыл свои канонические открытия о стрессе, престижная клиника Майо разработала вещество Е (Neeck, 2002; Hillier, 2007; Lupien, 2015). Это вещество, кристаллизованное доктором Кендаллом (Mason et al., 1936) применялся для лечения болезни Аддисона (Kendall, 1953), позже признанного кортизолом, что дало жизнь множеству «чудесных» лекарств от различных воспалительных заболеваний, таких как ревматоидный артрит (Neeck, 2002; Hillier, 2007). ; Люпьен, 2015).
Совсем недавно исследования взаимосвязи между гормонами стресса и иммунной системой раскрыли множество запутанных путей, которые также могут быть изучены на предмет их клинического значения. Было высказано предположение, что помимо подготовки организма к требованиям окружающей среды, стресс активирует иммунную систему, которая обеспечивает активную защиту от физических травм и патогенов. В конечном счете, цитокины продуцируются для стимуляции нескольких видов воспалительных реакций (Takahashi et al., 2018). Но в сообщениях говорится, что усиленная стрессом воспалительная активность присутствует при отсутствии инфекционных патогенов, особенно у пациентов с депрессией (Audet et al., 2014).
Было высказано предположение, что помимо подготовки организма к требованиям окружающей среды, стресс активирует иммунную систему, которая обеспечивает активную защиту от физических травм и патогенов. В конечном счете, цитокины продуцируются для стимуляции нескольких видов воспалительных реакций (Takahashi et al., 2018). Но в сообщениях говорится, что усиленная стрессом воспалительная активность присутствует при отсутствии инфекционных патогенов, особенно у пациентов с депрессией (Audet et al., 2014).
Чтобы выяснить, являются ли стресс или его гормоны про- или противовоспалительными, данные с использованием моделей грызунов показали, что стресс сам по себе может быть как про-, так и противовоспалительным. Некоторые авторы предположили, что время проведения иммунных тестов и измерений определяет направление действия глюкокортикоидов. Эти авторы предположили, что глюкокортикоиды изначально оказывают противовоспалительное действие, но позже сенсибилизируют иммунный ответ на фазе восстановления (после стрессора; Frank et al. , 2013).
, 2013).
Стресс может напрямую влиять на иммунную сигнализацию двумя основными способами: уменьшая ингибирующие эффекты действия глюкокортикоидов или напрямую стимулируя иммунную систему через ось HPA и SAM (Liu et al., 2014; Wohleb et al., 2015). Но не только нервные компоненты стресса задействуют иммунную систему, иммунная система также влияет на ЦНС, модулируя ось HPA (Berkenbosch et al., 1987; Linthorst et al., 1994; Angeli et al., 1999). Следовательно, при острых стрессовых переживаниях повышается уровень циркуляторных провоспалительных цитокинов (Steptoe et al., 2007). Некоторые из этих воспалительных цитокинов либо локально продуцируются активированной микроглией (Wohleb et al., 2015), либо попадают в мозг через околожелудочковые участки (Vitkovic et al., 2000), либо транспортируются (Banks, 2006).
Интересно, что участки с повышенной провоспалительной иммунной реактивностью, по-видимому, связаны с модальностями острого стрессора. Социальные стрессоры повышают экспрессию провоспалительных интерлейкинов и активируют микроглию в таких участках, как префронтальная кора, миндалина и HIPPO (Audet et al. , 2010, 2011; Tynan et al., 2010; Wohleb et al., 2011; Hinwood et al., 2012, 2013), тогда как физические стрессоры способствовали увеличению гипоталамуса (O’Connor et al., 2003; Deak et al., 2005; Hueston, Deak, 2014).
, 2010, 2011; Tynan et al., 2010; Wohleb et al., 2011; Hinwood et al., 2012, 2013), тогда как физические стрессоры способствовали увеличению гипоталамуса (O’Connor et al., 2003; Deak et al., 2005; Hueston, Deak, 2014).
Временная область стресса
Сложность реакции на стресс не ограничивается нейроанатомией и молекулами-посредниками, но также различается в зависимости от времени и продолжительности воздействия стрессора, а также его краткосрочных и/или долгосрочных последствий (de Клоэт, 2013). Медиаторы стресса действуют в петле обратной связи после активации оси HPA и регулируют, положительным или отрицательным образом, различные структуры мозга для восстановления гомеостаза (de Kloet et al., 2005b). Когда время реакции на стресс является неподходящим, аберрантная активность оси HPA может привести к патологическим состояниям (Heim et al., 2000, 2008; de Kloet et al., 2005a; Juruena, 2013; Nemeroff, 2016). Мы можем разделить базальную регуляцию выброса глюкокортикоидов на ультрадианный и циркадный циклы, а также классифицировать эффекты стрессовой реакции на быстрые или отсроченные по их инициации, а также на краткосрочные или долгосрочные по продолжительности, в обоих сценариях они варьируются от миллисекунд до дней (Joëls et al. , 2012). Кроме того, стресс также различается, когда он возникает в молодости или во взрослом возрасте, что может увеличивать или уменьшать вероятность развития нарушений головного мозга (Lupien et al., 2009).; Юруэна, 2013 г.; Тиммерманс и др., 2013).
, 2012). Кроме того, стресс также различается, когда он возникает в молодости или во взрослом возрасте, что может увеличивать или уменьшать вероятность развития нарушений головного мозга (Lupien et al., 2009).; Юруэна, 2013 г.; Тиммерманс и др., 2013).
В ультрадианных и циркадных циклах пики высвобождения кортикостерона способствуют регуляции основных метаболических потребностей и реакции на стресс (Lightman and Conway-Campbell, 2010). Происхождение пульсирующего высвобождения кортикостерона в ультрадианном и циркадном ритме полностью не выяснено, но существует общее предположение, что гипоталамус модулирует это явление, в частности, гипоталамическая СХЯ имеет эфферентные проекции к нейроэндокринным клеткам в PVN, которые запускают ось HPA. активации (Engeland and Arnhold, 2005).
Медиаторы острого стресса начинают действовать в течение нескольких секунд после обнаружения стрессора и обеспечивают быстрые ответы на соответствующую стратегию, включая модуляцию лимбико-кортикальных цепей (Bains et al. , 2015). PVN при остром стрессе имеет фундаментальное значение как для запуска реакции «бей или беги» посредством высвобождения медиаторов стресса, так и для подавления острой реакции (Dallman, 2005). После высвобождения кортикостерона частота миниатюрных возбуждающих постсинаптических токов (мВПСТ) в ПВЯ подавляется, что снижает глутаматергическую возбудимость и усиливает ГАМК-торможение (Di et al., 2005). Эти эффекты кортикостерона в PVN проявляются в основном за счет негеномной активности GR и эндоканнабиноидной передачи сигналов (Di et al., 2003; Verkuyl et al., 2005). Однако в других структурах возбуждающая активность увеличивается после острого стресса (Joëls et al., 2012), например, высвобождение кортикостерона увеличивает частоту мВПСТ посредством MR в пирамидных клетках СА1 (Karst et al., 2005; Olijslagers et al., 2008). . Точно так же частота мВПСТ при БЛА также увеличивается за счет МР после острого высвобождения кортикостерона (Karst et al., 2010). Интересно, что частота возбуждения нейронов BLA остается на высоком уровне даже после вымывания кортикостерона, в основном модулируемого GR и каннабиноидным рецептором 1 (Karst et al.
, 2015). PVN при остром стрессе имеет фундаментальное значение как для запуска реакции «бей или беги» посредством высвобождения медиаторов стресса, так и для подавления острой реакции (Dallman, 2005). После высвобождения кортикостерона частота миниатюрных возбуждающих постсинаптических токов (мВПСТ) в ПВЯ подавляется, что снижает глутаматергическую возбудимость и усиливает ГАМК-торможение (Di et al., 2005). Эти эффекты кортикостерона в PVN проявляются в основном за счет негеномной активности GR и эндоканнабиноидной передачи сигналов (Di et al., 2003; Verkuyl et al., 2005). Однако в других структурах возбуждающая активность увеличивается после острого стресса (Joëls et al., 2012), например, высвобождение кортикостерона увеличивает частоту мВПСТ посредством MR в пирамидных клетках СА1 (Karst et al., 2005; Olijslagers et al., 2008). . Точно так же частота мВПСТ при БЛА также увеличивается за счет МР после острого высвобождения кортикостерона (Karst et al., 2010). Интересно, что частота возбуждения нейронов BLA остается на высоком уровне даже после вымывания кортикостерона, в основном модулируемого GR и каннабиноидным рецептором 1 (Karst et al. , 2010). В корковых структурах, таких как префронтальная кора, острая стрессовая ситуация увеличивает зависимое от ГР высвобождение глутамата (Musazzi et al., 2010).
, 2010). В корковых структурах, таких как префронтальная кора, острая стрессовая ситуация увеличивает зависимое от ГР высвобождение глутамата (Musazzi et al., 2010).
Через несколько часов после воздействия стрессора отсроченные эффекты начинают по-другому проявляться в лимбико-кортикальных структурах (Joëls et al., 2012). Нейроны СА1 имеют повышенную амплитуду, но не частоту мВПСК посредством GR (Karst et al., 2005; Martin et al., 2009). Активность GR также модулирует синаптическую пластичность в CA1, способствуя длительной депрессии (LTD) и ухудшая долгосрочную потенциацию (LTP; Pavlides et al., 1993; Xiong et al., 2004; Kim et al., 2006). Напротив, кортикостерон проявляет отсроченные эффекты через MR, увеличивая индукцию LTP в CA1 (Pavlides et al., 19).96). При BLA отсроченные эффекты кортикостерона повышают возбудимость нейронов, сохраняя возбудимость после острого стресса (Duvarci and Paré, 2007). Сходным образом кортикостерон усиливает глутаматергическую передачу и уменьшает тормозные постсинаптические токи (mIPSCs) в префронтальной коре (Hill et al. , 2011). Эти отсроченные эффекты стресса в лимбико-кортикальных структурах восстанавливают гомеостаз, а также сохраняют важную информацию, чтобы лучше справляться с подобными ситуациями в будущем (Joëls et al., 2013).
, 2011). Эти отсроченные эффекты стресса в лимбико-кортикальных структурах восстанавливают гомеостаз, а также сохраняют важную информацию, чтобы лучше справляться с подобными ситуациями в будущем (Joëls et al., 2013).
При чрезмерном воздействии стрессоров, продолжающемся от часов до дней, можно наблюдать структурные изменения в лимбико-кортикальных областях и даже в системе вознаграждения (Joëls et al., 2013; Russo and Nestler, 2013). Сложность дендритов постепенно снижается при HIPPO и PFC после хронического воздействия стрессоров (McEwen and Magarinos, 1997; Holmes and Wellman, 2009). Напротив, нейроны в BLA и NAc увеличивают плотность дендритов, повышают возбуждающий тонус и снижают тормозной тонус в этом контексте (Vyas et al., 2002; Christoffel et al., 2011; Мухаммад и др., 2012). На клеточном уровне хронический стресс нарушает индукцию LTP в CA1 HIPPO и снижает как AMPA, так и NMDA-опосредованную синаптическую передачу (Joëls et al., 2012; Yuen et al., 2012). Поведенческие последствия этих структурных изменений были связаны с тревожным поведением, вероятно, с гипертрофией миндалевидного тела (Mitra and Sapolsky, 2008) и дефицитом обучения, что можно объяснить нарушением структур гиппокампа и префронтальной коры (Joëls et al. , 2012; de Kloet, 2013) и снижение BDNF в ВТА (Krishnan et al., 2007).
, 2012; de Kloet, 2013) и снижение BDNF в ВТА (Krishnan et al., 2007).
Интересно отметить, что хронический стресс, переживаемый в раннем возрасте, влияет на мозг дольше, чем в зрелом возрасте (Lupien et al., 2009). Когда детеныши грызунов подвергаются длительному разлучению с матерью, плотность сайтов связывания CRH увеличивается в HIPPO, миндалевидном теле и префронтальной коре (Anisman et al., 1998). Активность CRH опосредует связанную со стрессом потерю синаптической пластичности в HIPPO, анксиогенное поведение, зависящее от миндалевидного тела, и когнитивные нарушения, связанные с префронтальной корой (Schulkin et al., 19).98; Санчес и др., 2001; Fenoglio и др., 2006).
Клинические последствия
На данный момент в нашей эволюционной истории стресс может быть связан с неадекватным поведением значительной части населения, учитывая большое количество сопутствующих заболеваний, возникающих из-за дисфункции стрессовой системы (de Kloet et al. ., 2005б). Нарушение регуляции оси HPA и длительное воздействие глюкокортикоидов снижают способность нейронов сопротивляться повреждениям, увеличивая риск повреждения другими токсическими явлениями (Lupien et al. , 2009).). Кроме того, новые исследования привлекли внимание к невзгодам в раннем возрасте, которые в значительной степени связаны с более высокой уязвимостью к расстройствам в более позднем возрасте, вызывая долгосрочное воздействие на схемы, ответственные за когнитивные и эмоциональные функции (Gold et al., 1988; Heim). и Nemeroff, 2002; Lippmann et al., 2007; Chrousos, 2009; Lupien et al., 2009; Juruena, 2013; Lucassen et al., 2013; Krugers et al., 2017).
, 2009).). Кроме того, новые исследования привлекли внимание к невзгодам в раннем возрасте, которые в значительной степени связаны с более высокой уязвимостью к расстройствам в более позднем возрасте, вызывая долгосрочное воздействие на схемы, ответственные за когнитивные и эмоциональные функции (Gold et al., 1988; Heim). и Nemeroff, 2002; Lippmann et al., 2007; Chrousos, 2009; Lupien et al., 2009; Juruena, 2013; Lucassen et al., 2013; Krugers et al., 2017).
В этом смысле как фундаментальные, так и клинические исследования продвинулись вперед в последние годы, но многое еще предстоит понять по этому вопросу. В целом, модели на животных дали всестороннее представление о влиянии стресса на мозг, особенно на лимбические структуры (Hariri and Holmes, 2015). Миндалевидное тело является высококонсервативной структурой мозга, которая имеет основополагающее значение для обнаружения потенциальной опасности (Janak and Tye, 2015), в то время как HIPPO обеспечивает поддержку кодирования информации об окружающей среде, связанной со стрессором (Herman et al. , 2005), а префронтальная кора обеспечивает ассоциации между сигналами. и стрессор (Milad and Quirk, 2012). Идентификация этих высокоэволюционно консервативных сетей, на которые влияет стресс, позволила сделать важные открытия в клинических исследованиях (Hariri and Holmes, 2015).
, 2005), а префронтальная кора обеспечивает ассоциации между сигналами. и стрессор (Milad and Quirk, 2012). Идентификация этих высокоэволюционно консервативных сетей, на которые влияет стресс, позволила сделать важные открытия в клинических исследованиях (Hariri and Holmes, 2015).
Все больше данных подчеркивают, что крайне изнурительные сопутствующие стрессу заболевания, такие как депрессия, тревожные расстройства, посттравматическое стрессовое расстройство и эпилепсия, имеют общие патогенетические механизмы со стрессовой дисфункцией и между собой. Эти механизмы, вероятно, глубоко связаны, и структурные и функциональные изменения, вызванные одним заболеванием, вызывают другое, несмотря на это, до сих пор неясна взаимосвязь между ними (Gold et al., 1988; de Kloet et al., 2005a,b; Каннер, 2012). Учитывая это, мы представили в этом обзоре краткий обзор того, как стресс связан с этими патологиями ЦНС. Для дальнейшего ознакомления мы предлагаем обратиться к цитируемой здесь литературе.
У значительного процента пациентов с большой депрессией (БД) отмечаются повышенные концентрации кортизола в плазме, моче и спинномозговой жидкости, преувеличенная реакция кортизола после стимуляции гормоном АКТГ и гиперплазия гипофиза и надпочечников (Gold et al., 1988; Juruena и др., 2004). Кроме того, одним из наиболее последовательных результатов в нейропсихиатрии является уменьшение объема гиппокампа на 10-15% при БМ (Sapolsky, 2000b).
Хронические стрессоры в раннем возрасте приводят к необратимым эпигенетическим, эндокринным, нервным, иммунным и воспалительным изменениям, что является важным фактором риска развития ряда нервно-психических заболеваний во взрослой жизни (Xiong and Zhang, 2013; Zhang et al., 2013; Berens et al. ., 2017). Травматические детские переживания, такие как жестокое обращение, пренебрежение и потеря родителей, увеличивают частоту психических расстройств, таких как MD, которые повышаются до 59.%–75% во взрослой жизни (Widom et al., 2007) и тревожные расстройства, которые в 1,9–3,6 раза чаще встречаются у людей, испытывающих стресс в раннем возрасте (Fernandes and Osório, 2015). При эпилепсии стресс может влиять по-разному, часто провоцируя припадки, но также увеличивая риск развития эпилепсии (van Campen et al., 2014). Кроме того, нарушение регуляции оси HPA при стрессе может запускать иммунологические реакции, которые считаются фактором риска болезни Альцгеймера (Jeong et al., 2006; Caruso et al., 2018; Hoijemakers et al., 2016).
При эпилепсии стресс может влиять по-разному, часто провоцируя припадки, но также увеличивая риск развития эпилепсии (van Campen et al., 2014). Кроме того, нарушение регуляции оси HPA при стрессе может запускать иммунологические реакции, которые считаются фактором риска болезни Альцгеймера (Jeong et al., 2006; Caruso et al., 2018; Hoijemakers et al., 2016).
Однако исследования показывают, что младенчество совпадает с периодом, называемым периодом гипореактивности к стрессу (период гипореактивности к стрессу — SHRP), который считается периодом, необходимым для правильного развития мозга после рождения (Sapolsky and Meaney, 1986; де Клоет и др., 2005b). Это соответствует периоду низкой периферической концентрации глюкокортикоидов, при котором физиологический ответ на умеренный стресс (увеличение глюкокортикоидов и адреналина, усиление сердечно-сосудистой циркуляции, модификации иммунной системы) не происходит. Нет единого мнения, когда именно начинается этот период или как долго он длится, но предполагается, что у грызунов он может длиться примерно со 2-го по 12-й день после рождения (Sapolsky and Meaney, 19). 86) и до 5 лет у человека (Gunnar and Donzella, 2002; Curley et al., 2011).
86) и до 5 лет у человека (Gunnar and Donzella, 2002; Curley et al., 2011).
Интересно, что психологические (Sapolsky and Meaney, 1986) и мультимодальные стрессоры (Godoy et al., 2018) могут нарушать SHRP, поворачивая ось HPA в ответ на стрессоры на более ранних этапах развития (Cowan et al., 2016) и вызывая нарушения сопутствующие психопатологии (Loi et al., 2014; Bath et al., 2017).
Влияние стресса в раннем возрасте (ELS) на мозг было тщательно изучено (обзор см. в Lupien et al., 2009).; Лукассен и др., 2013 г.; Крюгерс и др., 2017). ELS нарушает правильное развитие и функцию лимбических структур, что приводит к пожизненной подверженности стрессу в отношении поведения и познания, а также системы вознаграждения (Peña et al., 2017). Совсем недавно было продемонстрировано, что ELS приводит к раннему возникновению синхронизированного подавления страха в процессе развития, что коррелирует с ранним созреванием (Bath et al., 2016).
Сопутствующая депрессия-тревога тесно связана с нарушением здоровья, а также когнитивных и эмоциональных функций (Kroenke et al. , 2007). Точно так же длительное лечение кортикостероном не только вызывает депрессивные симптомы, но также вызывает гипертрофию миндалины и усиление анксиогенных поведенческих реакций (Mitra and Sapolsky, 2008). У людей индивидуальные различия в реакции миндалевидного тела на выражения лица, связанные с угрозой, предсказывают уязвимость к стрессу, например, субъекты с гиперактивацией миндалины чаще испытывают симптомы депрессии и тревоги (Yang et al., 2008; Swartz et al., 2015). ).
, 2007). Точно так же длительное лечение кортикостероном не только вызывает депрессивные симптомы, но также вызывает гипертрофию миндалины и усиление анксиогенных поведенческих реакций (Mitra and Sapolsky, 2008). У людей индивидуальные различия в реакции миндалевидного тела на выражения лица, связанные с угрозой, предсказывают уязвимость к стрессу, например, субъекты с гиперактивацией миндалины чаще испытывают симптомы депрессии и тревоги (Yang et al., 2008; Swartz et al., 2015). ).
Кроме того, гиперактивация LC-NE связана с нервно-психическими расстройствами, такими как посттравматическое стрессовое расстройство и MD, активация этой системы вне надлежащего контекста может привести к чрезмерному возбуждению, потере концентрации, беспокойству и нарушению сосредоточенного внимания, которые являются характерными симптомами стресса. сопутствующие психические расстройства (Southwick et al., 1999; Wong et al., 2000). Например, посттравматическое стрессовое расстройство связано с повышенным уровнем тревоги и депрессии (Nemeroff et al. , 2006). Однако в некоторых клинических исследованиях сообщалось о низком уровне кортизола у пациентов с посттравматическим стрессовым расстройством, в то время как у лиц с тревожными расстройствами или депрессией наблюдается усиление реакции кортизола (Daskalakis et al., 2013; Zoladz and Diamond, 2016; Zorn et al., 2017).
, 2006). Однако в некоторых клинических исследованиях сообщалось о низком уровне кортизола у пациентов с посттравматическим стрессовым расстройством, в то время как у лиц с тревожными расстройствами или депрессией наблюдается усиление реакции кортизола (Daskalakis et al., 2013; Zoladz and Diamond, 2016; Zorn et al., 2017).
Фактически, в литературе сообщается об изменениях оси HPA у пациентов с посттравматическим стрессовым расстройством, а в исследовании Mason et al. (1986), в которых у пациентов с посттравматическим стрессовым расстройством были обнаружены низкие базальные уровни кортизола, все больше и больше исследований подтверждали этот вывод (Yehuda et al., 1990, 1993; Brand et al., 2006; Rohleder and Karl, 2006; Wessa et al. ., 2006). Однако есть исследования, показывающие отсутствие различий (Baker et al., 1999; Duval et al., 2004; Yehuda et al., 2004a,b; Otte et al., 2007), а также увеличение (Bremner et al., 2003; Inslicht et al., 2006; Lindauer et al., 2006) уровни базального кортизола у пациентов с ПТСР. Поскольку эта тема остается спорной в литературе, рекомендуется больше идей, подобных тем, которые представлены в Zoladz and Diamond (2013). У пациентов с посттравматическим стрессовым расстройством также были выявлены изменения в других отделах оси HPA, такие как повышенная чувствительность GR и усиление отрицательной обратной связи по оси HPA (Grossman et al., 2003; Duval et al., 2004; Yehuda et al., 2004b; Rohleder and Karl). , 2006), повышенный уровень КРГ в спинномозговой жидкости (Bremner et al., 1997; Baker et al., 1999) и снижение высвобождения АКТГ после введения КРГ (Smith et al., 1989) и CCK4 (Kellner et al., 2000). Животные модели посттравматического стрессового расстройства могут непосредственно ответить на эти вопросы, но известно, что различные типы аверсивного воздействия в моделях посттравматического стрессового расстройства (например, хищник, шок, запах) или даже контролируемость стресса взаимодействуют в сложной системе нейро-ген-среда (Даскалакис). et al., 2013; Zoladz and Diamond, 2013; Homberg et al.
Поскольку эта тема остается спорной в литературе, рекомендуется больше идей, подобных тем, которые представлены в Zoladz and Diamond (2013). У пациентов с посттравматическим стрессовым расстройством также были выявлены изменения в других отделах оси HPA, такие как повышенная чувствительность GR и усиление отрицательной обратной связи по оси HPA (Grossman et al., 2003; Duval et al., 2004; Yehuda et al., 2004b; Rohleder and Karl). , 2006), повышенный уровень КРГ в спинномозговой жидкости (Bremner et al., 1997; Baker et al., 1999) и снижение высвобождения АКТГ после введения КРГ (Smith et al., 1989) и CCK4 (Kellner et al., 2000). Животные модели посттравматического стрессового расстройства могут непосредственно ответить на эти вопросы, но известно, что различные типы аверсивного воздействия в моделях посттравматического стрессового расстройства (например, хищник, шок, запах) или даже контролируемость стресса взаимодействуют в сложной системе нейро-ген-среда (Даскалакис). et al., 2013; Zoladz and Diamond, 2013; Homberg et al. , 2016; Maier and Seligman, 2016).
, 2016; Maier and Seligman, 2016).
На самом деле считается, что воздействие тяжелых стрессоров, таких как городское насилие, сексуальное насилие, боевые действия на войне, стихийные бедствия и многие другие, связано с развитием посттравматического стрессового расстройства, приводящего к физиологическим и поведенческим изменениям, включая ночные кошмары, повышенную бдительность, воспоминания травмы и нарушения сна (DSM-V, Zoladz and Diamond, 2013; Yehuda et al., 2015). Хотя сообщалось о положительной корреляции между тяжестью травмы и симптомами посттравматического стрессового расстройства у солдат-ветеранов (Snow et al., 1988; Sutker et al., 1993), а также у гражданских лиц (Shore et al., 1986; Pynoos et al., 1993; Mollica et al., 1998) это не всегда так (Başoglu et al., 1994; Schnyder et al., 2001; Stevenson et al., 2001). Также сообщалось, что тип стрессора, по-видимому, играет большую роль, чем его тяжесть (Kessler et al., 1995; Amir et al., 1996).
Интересно, что не у всех развивается посттравматическое стрессовое расстройство после травмы, что позволяет предположить, что другие факторы (несмотря на тяжесть и тип травмы), такие как социально-экономический профиль, психиатрическое расстройство в анамнезе, злоупотребление психоактивными веществами, иммунная система, генетика и эпигенетика, играют роль в восприимчивости для ПТСР. На самом деле существуют доказательства того, что взаимодействие между окружающей средой и генетикой (и эпигенетикой) является фактором риска развития посттравматического стрессового расстройства (Mehta and Binder, 2012; Wilker and Kolassa, 2012; DiGangi et al., 2013).
На самом деле существуют доказательства того, что взаимодействие между окружающей средой и генетикой (и эпигенетикой) является фактором риска развития посттравматического стрессового расстройства (Mehta and Binder, 2012; Wilker and Kolassa, 2012; DiGangi et al., 2013).
У пациентов с эпилепсией стресс обычно считается одним из основных факторов, провоцирующих припадки (Frucht et al., 2000; Spector et al., 2000; Nakken et al., 2005; Sperling et al., 2008; van Campen et al. и др., 2012; Ферлиси, Шорвон, 2014). У взрослых существует положительная корреляция между стрессом и частотой эпилептических припадков (Swinkels et al., 1998; Moshe et al., 2008). Точно так же дети с эпилепсией, живущие вблизи районов конфликтов/военных действий, имеют более высокую частоту приступов по сравнению с детьми, живущими в районах, где нет конфликтов (Bosnjak et al., 2002). Эпилептогенез — это многоэтапный процесс, который может начаться в раннем возрасте и на который может отрицательно влиять стресс (Joëls, 2009). ), и в настоящее время предполагается, что стресс в раннем возрасте может создать постоянную уязвимость к развитию эпилепсии (Huang, 2014).
), и в настоящее время предполагается, что стресс в раннем возрасте может создать постоянную уязвимость к развитию эпилепсии (Huang, 2014).
Таким образом, многие данные указывают на то, что стресс имеет значение в фазах эпилептогенеза как у взрослых, так и у молодых людей. Кортикостерон играет важную роль в эпилептогенном процессе на животных моделях эпилепсии (Karst et al., 1999; Kumar et al., 2007; Hemanth Kumar et al., 2012; Salzberg et al., 2007; Koe et al., 2009). ; Castro et al., 2012; Jones, 2013; van Campen et al., 2014), и существует несколько действий кортикостерона в головном мозге, которые могут опосредовать такие эффекты. Это может происходить косвенно из-за геномных эффектов глюкокортикоидов, приводящих к изменениям сетей, связанных с припадками, или из-за их прямого негеномного воздействия на возбудимость лимбической системы (Joëls, 2009).).
Другие патологии поражают периферическую нервную систему и многие другие органы. Цепь CRH, соединяющая LC-NE и PVN, имеет стратегическое положение, поэтому она может контролировать вегетативные реакции на висцеральные стимулы и может лежать в основе коморбидности тазовых висцеральных и поведенческих симптомов, наблюдаемых при многих расстройствах, связанных со стрессом (Valentino et al. , 1999). Хотя большинство немедленных реакций, координируемых осью SAM, важны для выживания, когда уровни циркулирующих катехоламинов поддерживаются повышенными в течение длительных периодов времени, они могут привести к различным патологиям. Эти патологии могут в первую очередь затрагивать сердечно-сосудистую систему (аритмии сердца, стенокардия, застойные явления, сердечная недостаточность, гипертензия и/или гипертрофия сердца; Antunes-Rodrigues et al., 2005; Lundberg, 2005; McEwen, 2007; Dünser and Hasibeder, 2009).; Чжан и Андерсон, 2014 г.; Картер и Гольдштейн, 2015 г.; Танк и Ли Вонг, 2015 г .; Брин и др., 2016).
, 1999). Хотя большинство немедленных реакций, координируемых осью SAM, важны для выживания, когда уровни циркулирующих катехоламинов поддерживаются повышенными в течение длительных периодов времени, они могут привести к различным патологиям. Эти патологии могут в первую очередь затрагивать сердечно-сосудистую систему (аритмии сердца, стенокардия, застойные явления, сердечная недостаточность, гипертензия и/или гипертрофия сердца; Antunes-Rodrigues et al., 2005; Lundberg, 2005; McEwen, 2007; Dünser and Hasibeder, 2009).; Чжан и Андерсон, 2014 г.; Картер и Гольдштейн, 2015 г.; Танк и Ли Вонг, 2015 г .; Брин и др., 2016).
В последние десятилетия идентификация нейронных цепей, связанных со стрессом, а также их взаимодействие с медиаторами во времени имели решающее значение не только для понимания физиологических реакций на стресс, но и для понимания их клинических последствий. Связанные со стрессом расстройства головного мозга чрезвычайно распространены, поэтому определение механизмов, связанных со стрессом, и, следовательно, потенциальная разработка новых фармакологических терапевтических подходов необходимы и неотложны.
Например, проводятся доклинические исследования по темам, связанным с психопатологией, с использованием классического антагониста ГР RU486 (Arp et al., 2016), а также с использованием недавно разработанных соединений, которые модулируют ГР тканеспецифическим образом. . Эти соединения представляют собой так называемые селективные модуляторы глюкокортикоидных рецепторов (SGRM), которые при связывании с GR способствуют дифференцированной конформации рецептора, что приводит к дифференцированному набору коррегуляторов и, следовательно, усиливает или препятствует экспрессии генов клеточно-тканевым специфичным образом. Таким образом, одно и то же соединение может вызывать эффекты, подобные агонистам и антагонистам, например, SGRM C10829.7 действует как антагонист связанных с нейрогенезом процессов, таких как пролиферация и выживание нейронов гиппокампа, и как агонист сохранения памяти о страхе в задаче избегающего поведения (Zalachoras et al., 2013). С другой стороны, соединение C118335 действует как антагонист в той же задаче, проявляя при этом агонистические эффекты на уровни кортикостерона в плазме (Atucha et al. , 2015).
, 2015).
Исходя из нашего собственного опыта, линия Wistar Audioogenic Rat (WAR) представляет собой генетически отобранную экспериментальную модель эпилепсии, которая после 56 поколений инбридинга демонстрирует не только поведение, связанное с судорогами, и электрофизиологические изменения, но и сопутствующие заболевания, включая высокую тревожность, гиперактивность HPA. ось, гиперплазия мозгового вещества надпочечников, эктопические экстрасистолы, высокое кровяное давление, тахикардия и нарушения центрального дыхания (Fazan et al., 2011, 2015; Umeoka et al., 2011; Granjeiro et al., 2016; Totola et al., 2017), недавний всеобъемлющий обзор штамма WAR см. в Garcia-Cairasco et al. (2017). Поэтому необходимы дальнейшие эксперименты для оценки фармакологического профиля новых противоэпилептических, анксиолитических или даже антидепрессивных препаратов с использованием в качестве модели сопутствующих заболеваний штамма WAR.
В клиническом сценарии можно сделать последний комментарий, говоря о дополнительной сложности, связанной, например, с наличием сопутствующих неврологических и нейропсихиатрических состояний, таких как, например, эпилепсия, аутизм и расстройства настроения, признавая, что речь идет о сетевых нарушениях (Kanner et al. , 2017). В конкретном случае депрессии, тревоги и эпилепсии Kanner (2017) и Nogueira et al. (2017) подчеркивают, насколько сильны двунаправленные связи, существующие между эпилепсией и депрессией, тревогой и эпилепсией. Следовательно, стрессоры, которые работают как триггеры, такие как упомянутые в текущем обзоре, являются общими для всех ситуаций. С другой стороны, Rayner (2017) подчеркивает, что сложные когнитивные сети, связанные с депрессией, настолько сильно взаимодействуют с сетями, связанными с эпилепсией, что трудности с диагностикой и лечением возрастают, как только мы признаем, что эти сети имеют общие структуры и механизмы. . Одним из способов преодоления этого, чтобы внести существенный и надежный вклад в эту область, является построение алгоритмов на основе компьютерного моделирования нейронауки, где фактические данные, полученные из фундаментальной науки или из клинических условий человека, используются для создания прогнозов с трансляционной ценностью. В этом контексте недавно Spiga et al.
, 2017). В конкретном случае депрессии, тревоги и эпилепсии Kanner (2017) и Nogueira et al. (2017) подчеркивают, насколько сильны двунаправленные связи, существующие между эпилепсией и депрессией, тревогой и эпилепсией. Следовательно, стрессоры, которые работают как триггеры, такие как упомянутые в текущем обзоре, являются общими для всех ситуаций. С другой стороны, Rayner (2017) подчеркивает, что сложные когнитивные сети, связанные с депрессией, настолько сильно взаимодействуют с сетями, связанными с эпилепсией, что трудности с диагностикой и лечением возрастают, как только мы признаем, что эти сети имеют общие структуры и механизмы. . Одним из способов преодоления этого, чтобы внести существенный и надежный вклад в эту область, является построение алгоритмов на основе компьютерного моделирования нейронауки, где фактические данные, полученные из фундаментальной науки или из клинических условий человека, используются для создания прогнозов с трансляционной ценностью. В этом контексте недавно Spiga et al. (2017) разработали математическую модель сети регуляции стероидогенеза надпочечников, которая учитывает ключевые регуляторные процессы, происходящие в разных временных масштабах, и использует модель для прогнозирования временной эволюции стероидогенеза в ответ на физиологические изменения АКТГ (базальные импульсы в сравнении с воспалительным стрессом). Вкратце, эти авторы показали на крысиной модели, что, хотя архитектуры стероидогенной регуляторной сети достаточно, чтобы реагировать как на небольшие, так и на большие возмущения АКТГ, связь регуляторной сети с иммунной системой может объяснить диссоциированную динамику между АКТГ и глюкокортикоидами, наблюдаемую при воспалительном стрессе. настоящее.
(2017) разработали математическую модель сети регуляции стероидогенеза надпочечников, которая учитывает ключевые регуляторные процессы, происходящие в разных временных масштабах, и использует модель для прогнозирования временной эволюции стероидогенеза в ответ на физиологические изменения АКТГ (базальные импульсы в сравнении с воспалительным стрессом). Вкратце, эти авторы показали на крысиной модели, что, хотя архитектуры стероидогенной регуляторной сети достаточно, чтобы реагировать как на небольшие, так и на большие возмущения АКТГ, связь регуляторной сети с иммунной системой может объяснить диссоциированную динамику между АКТГ и глюкокортикоидами, наблюдаемую при воспалительном стрессе. настоящее.
Заключительные замечания
Мы способны адаптироваться к динамичной и сложной среде, в которой мы живем, а также к неожиданным жизненным событиям, с которыми мы время от времени сталкиваемся. Примеры бесконечны, и в большинстве случаев мы можем преодолеть эти события. Мы в состоянии сделать это благодаря существованию довольно сложных сетей, которые объединяют тело и мозг, чтобы повысить производительность, способствовать адаптации и, в конечном счете, выживанию, система стресса .
Разнообразие областей мозга объединяет сенсорные, физиологические и эмоциональные признаки. Когда разные сети мозга интерпретируют эти признаки как угрозу (реальную или потенциальную), следует ряд ответов, повышающих производительность, чтобы справиться с ситуацией и сохранить эту информацию, чтобы лучше справляться с подобными ситуациями в будущем, характеризуя реакция на стресс . Реакция на стресс с помощью молекул-медиаторов способствует кратковременным и долговременным изменениям клеточной возбудимости, а также пластичности нейронов и синапсов, что приводит к временным и/или постоянным изменениям в физиологии и поведении.
Недостатком системы стресса является то, что иногда она не в состоянии преодолеть потребности окружающей среды, физиологические или эмоциональные потребности. В основном это происходит в случаях, когда спрос чрезвычайно высок, хроничен и / или во время разработки.
Цель этой обзорной статьи состояла в том, чтобы предоставить всесторонние базовые понятия о системе стресса, такие как история исследований стресса, нейроанатомия, основные эффекторы реакции на стресс, временные области стресса и клинические последствия неисправности, которые могут иметь влияние на восприимчивость к стрессу. развитие все более распространенных расстройств брапдина.
развитие все более распространенных расстройств брапдина.
Вклад автора
LDG, MTR и PD-P написали черновик рукописи. NG-C и EHLU разработали концепцию, написали и исправили рукопись. LDG и MTR внесли равный вклад в эту работу.
Финансирование
Эта работа финансировалась Национальным советом по научно-техническому развитию, Координацией по улучшению кадров высшего образования, Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) PROEX-Physiology и Исследовательским фондом Сан-Паулу (Fundação de Amparo à Pesquisa do Estado de São Paulo, FAPESP 2007/50261-4). В настоящее время LDG имеет стипендию FAPESP 2014/17959-1 и 2017/11339-0, MTR имеет стипендию Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) 142451/2014-2, PD-P имеет стипендию CAPES, NG-C имеет стипендию CNPQ Research. 305883/2014-3 и EHLU имеет стипендии FAPESP 2016/21369-0, 2015/18773-1.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы хотели бы поблагодарить всех студентов, записавшихся на курс «Поведенческие, нейропсихофармакологические, эндокринные и молекулярные аспекты стресса » (RFI-5803), проводимый в рамках программы магистратуры по физиологии (PROEX-CAPES) FMRP-USP в июле 2015 г., который внес свой вклад в содержательные обсуждения. Сотрудникам курса Мариан Жоэлс, Рон де Клоэт, Марио Юруэна, Маркус Брандао, Самия Джока и Кристиан Баес за их вдохновляющие лекции.
Ссылки
Abercrombie, E.D., Keefe, K.A., DiFrischia, D.S., and Zigmond, M.J. (1989). Дифференциальное влияние стресса на высвобождение дофамина in vivo в полосатом теле, прилежащем ядре и медиальной лобной коре. Дж. Нейрохим. 52, 1655–1658. doi: 10.1111/j.1471-4159.1989.tb09224.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Aires, MM (2012). Физиология. 4-е изд. Рио-де-Жанейро: Гуанабара-Куган.
Альт, С. Р., Тернер, Дж. Д., Клок, М. Д., Мейер, О. К., Лакке, Э. А. Дж. Ф., Дерейк, Р. Х., и соавт. (2010). Дифференциальная экспрессия транскриптов глюкокортикоидных рецепторов при большом депрессивном расстройстве не запрограммирована эпигенетически. Психонейроэндокринология 35, 544–556. doi: 10.1016/j.psyneuen.2009.09.001
Д., Клок, М. Д., Мейер, О. К., Лакке, Э. А. Дж. Ф., Дерейк, Р. Х., и соавт. (2010). Дифференциальная экспрессия транскриптов глюкокортикоидных рецепторов при большом депрессивном расстройстве не запрограммирована эпигенетически. Психонейроэндокринология 35, 544–556. doi: 10.1016/j.psyneuen.2009.09.001
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Амарал Д.Г. и Виттер М.П. (1989). Трехмерная организация образования гиппокампа: обзор анатомических данных. Неврология 31, 571–591. doi: 10.1016/0306-4522(89)-7
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Амир М., Каплан З. и Котлер М. (1996). Тип травмы, тяжесть основных симптомов посттравматического стрессового расстройства и связанные с ним особенности. J. Общая психология. 123, 341–351. doi: 10.1080/00221309.1996.9
6PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Андерсен П., Соленг А. Ф. и Раастад М. (2000). Пересмотр гипотезы ламеллы гиппокампа. Мозг Res. 886, 165–171. doi: 10.1016/s0006-8993(00)02991-7
и Раастад М. (2000). Пересмотр гипотезы ламеллы гиппокампа. Мозг Res. 886, 165–171. doi: 10.1016/s0006-8993(00)02991-7
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Анджели А., Масера Р. Г., Сартори М. Л., Фортунати Н., Ракка С., Довио А. и др. (1999). Модуляция цитокинами глюкокортикоидного действия. Энн. НЮ акад. науч. 876, 210–220. doi: 10.1111/j.1749-6632.1999.tb07641.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Анисман Х., Захария М. Д., Мини М. Дж. и Мералис З. (1998). Изменяют ли события в раннем возрасте навсегда поведение и гормональные реакции на стрессоры? Междунар. Дж. Дев. Неврологи. 16, 149–164. doi: 10.1016/s0736-5748(98)00025-2
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Antunes-Rodrigues, J., Moreira, A.C., Elias, LLK, and Castro, M. (2005). Нейроэндокринология: основы и приложения. 1-е изд. Рио-де-Жанейро: Гуанабра-Куган.
Армарио, А., Давиу, Н., Муньос-Абеллан, К., Рабаса, К., Фуэнтес, С., Белда, X., и др. (2012). Что мы можем узнать из гормонов гипофиза-надпочечников о природе и последствиях воздействия эмоциональных стрессоров? Сотовый. Мол. Нейробиол. 32, 749–758. doi: 10.1007/s10571-012-9814-6
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Арнстен, AFT (2009). Сигнальные пути стресса, которые нарушают структуру и функцию префронтальной коры. Нац. Преподобный Нейроски. 10, 410–422. doi: 10.1038/nrn2648
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Арп Дж. М., Тер Хорст Дж. П., Лой М., ден Блаувен Дж., Бангерт Э., Фернандес Г. и др. (2016). Блокирование глюкокортикоидных рецепторов в подростковом возрасте предотвращает усиленное замирание между повторяющимися сигнальными воздействиями после условного страха у взрослых мышей, выращенных в условиях хронического стресса в раннем возрасте. Нейробиол. Учиться. Мем. 133, 30–38. doi: 10.1016/j.nlm.2016.05.009
Учиться. Мем. 133, 30–38. doi: 10.1016/j.nlm.2016.05.009
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Атуча Э., Залахорас И., ван ден Хеувел Дж. К., ван Верт Л. Т. К. М., Мелчерс Д., Мол И. М. и др. (2015). Смешанный селективный модулятор глюкокортикоидов/минералокортикоидов с доминирующим антагонизмом в головном мозге самцов крыс. Эндокринология 156, 4105–4114. doi: 10.1210/en.2015-1390
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Одет, М. К., Якобсон-Пик, С., Ванн, Б. П., и Анисман, Х. (2011). Социальное поражение способствует специфическим вариациям цитокинов в префронтальной коре при последующих агрессивных или эндотоксиновых воздействиях. Поведение мозга. Иммун. 25, 1197–1205. doi: 10.1016/j.bbi.2011.03.010
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Одет, М. К., Мангано, Е. Н., и Анисман, Х. (2010). Изменения поведения и провоспалительных цитокинов среди подчиненных и доминирующих мышей, вовлеченных в агрессивные столкновения: сдерживание реактивностью кортикостерона. Фронт. Поведение Неврологи. 4:156. doi: 10.3389/fnbeh.2010.00156
Фронт. Поведение Неврологи. 4:156. doi: 10.3389/fnbeh.2010.00156
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Одет М.-К., Маккуэйд Р. Дж., Мерали З. и Анисман Х. (2014). Цитокиновые вариации и расстройства настроения: влияние социальных стрессоров и социальная поддержка. Фронт. Неврологи. 8:416. doi: 10.3389/fnins.2014.00416
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Bagot, R.C., Parise, E.M., Pena, C.J., Zhang, H.-X., Maze, I., Chaudhury, D., et al. (2015). Вентральные афференты гиппокампа к прилежащему ядру регулируют восприимчивость к депрессии. Нац. коммун. 6:7062. doi: 10.1038/ncomms8626
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Бейнс, Дж. С., Вамстикер Кусулин, Дж. И., и Иноуэ, В. (2015). Синаптическая пластичность гипоталамуса, связанная со стрессом. Нац. Преподобный Нейроски. 16, 377–388. doi: 10.1038/nrn3881
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Бейкер Д. Г., Уэст С.А., Николсон В.Е., Эхатор Н.Н., Касков Дж.В., Хилл К.К. и др. (1999). Серийные уровни кортикотропин-рилизинг-гормона в спинномозговой жидкости и активность коры надпочечников у ветеранов боевых действий с посттравматическим стрессовым расстройством. утра. Журнал психиатрии 156, 585–588.
Г., Уэст С.А., Николсон В.Е., Эхатор Н.Н., Касков Дж.В., Хилл К.К. и др. (1999). Серийные уровни кортикотропин-рилизинг-гормона в спинномозговой жидкости и активность коры надпочечников у ветеранов боевых действий с посттравматическим стрессовым расстройством. утра. Журнал психиатрии 156, 585–588.
Реферат PubMed | Google Scholar
Бэнкс, Вашингтон (2006). Гематоэнцефалический барьер в психонейроиммунологии. Нейрол. клин. 24, 413–419. doi: 10.1016/j.ncl.2006.03.009
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Барбас Х. и Блатт Г. Дж. (1995). Топографически специфические проекции гиппокампа нацелены на функционально различные префронтальные области у макак-резусов. Гиппокамп 5, 511–533. doi: 10.1002/hipo.450050604
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Башоглу М., Пакер М., Озмен Э., Ташдемир О. и Шахин Д. (1994). Факторы, связанные с долгосрочными травматическими реакциями на стресс у лиц, переживших пытки в Турции. JAMA 272, 357–363. doi: 10.1001/jama.1994.03520050037027
JAMA 272, 357–363. doi: 10.1001/jama.1994.03520050037027
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Бассарео, В., Де Лука, М. А., и Ди Кьяра, Г. (2002). Дифференциальное выражение свойств мотивационного стимула дофамином в оболочке прилежащего ядра по сравнению с ядром и префронтальной корой. J. Neurosci. 22, 4709–4719. doi: 10.1523/JNEUROSCI.22-11-04709.2002
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Бат К., Мансано-Ньевес Г. и Гудвилл Х. (2016). Стресс в раннем возрасте ускоряет поведенческое и нервное созревание гиппокампа у самцов мышей. Горм. Поведение 82, 64–71. doi: 10.1016/j.yhbeh.2016.04.010
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Бат, К. Г., Руссо, С. Дж., Плейл, К. Э., Вохлеб, Э. С., Думан, Р. С., и Рэдли, Дж. Дж. (2017). Цепные и синаптические механизмы повторяющегося стресса: точки зрения из разных контекстов, продолжительности и развития. Нейробиол. Стресс 7, 137–151. doi: 10.1016/j.ynstr.2017.05.001
Нейробиол. Стресс 7, 137–151. doi: 10.1016/j.ynstr.2017.05.001
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Беннур С., Шанкаранараяна Рао Б. С., Павлак Р., Стрикленд С., Макьюэн Б. С. и Чаттарджи С. (2007). Стресс-индуцированная потеря шипов в медиальной миндалине опосредована тканевым активатором плазминогена. Неврология 144, 8–16. doi: 10.1016/j.neuroscience.2006.08.075
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Беренс, А. Э., Дженсен, С. К. Г., и Нельсон, К. А. III. (2017). Биологическое закрепление детских невзгод: от физиологических механизмов до клинических последствий. БМС Мед. 15:135. doi: 10.1186/s12916-017-0895-4
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Беркенбош Ф., ван Орс Дж., дель Рей А., Тилдерс Ф. и Беседовский Х. (1987). Нейроны, продуцирующие кортикотропин-рилизинг-фактор, у крыс активируются интерлейкином-1. Наука 238, 524–526. doi: 10.1126/science.2443979
doi: 10.1126/science.2443979
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Борон, В. Ф., и Булпаеп, Э. Л. (2009). Медицинская физиология: клеточный и молекулярный подход. 2-е изд. Филадельфия, Пенсильвания: Saunders Elsevier.
Google Scholar
Borski, RJ (2000). Негеномные мембранные действия глюкокортикоидов у позвоночных. Тенденции Эндокринол. Метаб. 11, 427–436. doi: 10.1016/s1043-2760(00)00325-8
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
Босняк Дж., Вукович-Бобич М. и Меяски-босняк В. (2002). Поведенческое влияние войны на возникновение эпилептических припадков у детей. Эпилепсия Поведение. 3, 502–509. doi: 10.1016/s1525-5050(02)00602-9
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Bowman, KM (1930). Телесные изменения в виде боли, голода, страха и ярости. (Уолтер Б. Кэннон, 404 страницы. Нью-Йорк: Д. Эпплтон и Ко., 1929) Ам. Журнал психиатрии 86, 770–771. doi: 10.1176/ajp.86.4.770
Журнал психиатрии 86, 770–771. doi: 10.1176/ajp.86.4.770
CrossRef Full Text
Brand, S.R., Engel, S.M., Canfield, R.L., and Yehuda, R. (2006). Влияние посттравматического стрессового расстройства у матери после внутриутробной травмы на поведение и темперамент 9-месячного младенца. Энн. НЮ акад. науч. 1071, 454–458. doi: 10.1196/annals.1364.041
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Брин М.С., Белякова-Бетелл Н., Мухика-Пароди Л.Р., Карлсон Дж.М., Энсайн В.Ю., Вулк С.Х. и др. (2016). Острый психологический стресс вызывает кратковременный вариабельный иммунный ответ. Поведение мозга. Иммун. 53, 172–182. doi: 10.1016/j.bbi.2015.10.008
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Бремнер, Дж. Д., Личинио, Дж., Дарнелл, А., Кристал, Дж. Х., Оуэнс, М. Дж., Саутвик, С. М., и др. (1997). Повышенные концентрации кортикотропин-рилизинг-фактора в спинномозговой жидкости при посттравматическом стрессовом расстройстве. утра. Журнал психиатрии 154, 624–629. doi: 10.1176/ajp.154.5.624
утра. Журнал психиатрии 154, 624–629. doi: 10.1176/ajp.154.5.624
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Бремнер, Дж. Д., Витилингам, М., Верметтен, Э., Адил, Дж., Хан, С., Назир, А., и соавт. (2003). Реакция кортизола на когнитивный стресс при посттравматическом стрессовом расстройстве (ПТСР), связанном с жестоким обращением в детстве. Психонейроэндокринология 28, 733–750. doi: 10.1016/s0306-4530(02)00067-7
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Бриони, Дж. Д., Нагахара, А. Х., и Макго, Дж. Л. (1989). Участие ГАМКергической системы миндалевидного тела в модуляции хранения памяти. Мозг Res. 487, 105–112. doi: 10.1016/0006-8993(89)-1
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Бришу Ф., Чакраборти С., Брайерли Д. И. и Унглесс М. А. (2009). Фазовое возбуждение дофаминовых нейронов в вентральной ВОП повреждающими раздражителями. Проц. Натл. акад. науч. США 106, 4894–4899. doi: 10.1073/pnas.0811507106
Проц. Натл. акад. науч. США 106, 4894–4899. doi: 10.1073/pnas.0811507106
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Burgos-Robles, A., Kimchi, E.Y., Izadmehr, E.M., Porzenheim, M.J., Ramos-Guasp, W.A., Nieh, E.H., et al. (2017). Сигналы, поступающие от миндалевидного тела в префронтальную кору, определяют поведение в условиях противоречивых сигналов вознаграждения и наказания. Нац. Неврологи. 20, 824–835. doi: 10.1038/nn.4553
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Бушдорф, Дж. П., и Мини, М. Дж. (2015). «Эпигенетика/программирование в оси HPA», в Комплексная физиология , Хобокен, Нью-Джерси: John Wiley and Sons, Inc., 87–110.
Google Scholar
Cannon, WB (1914). Взаимосвязь эмоций, предложенная недавними физиологическими исследованиями. утра. Дж. Психол. 25, 256–282. дои: 10.2307/1413414
Полный текст перекрестной ссылки | Google Scholar
Cannon, WB (1915). Телесные изменения боли, голода, страха и ярости. Отчет о недавних исследованиях функции эмоционального возбуждения. Нью-Йорк, Нью-Йорк и Лондон: Appleton Co.
Телесные изменения боли, голода, страха и ярости. Отчет о недавних исследованиях функции эмоционального возбуждения. Нью-Йорк, Нью-Йорк и Лондон: Appleton Co.
Google Scholar
Cannon, WB (1929). Организация физиологического гомеостаза. Физиол. Ред. 9, 399–431. doi: 10.1152/physrev.1929.9.3.399
Полный текст CrossRef | Google Scholar
Кантерас, Н. С., и Суонсон, Л. В. (1992). Проекции вентральной субикулюмы на миндалевидное тело, перегородку и гипоталамус: исследование антеградного тракта PHAL у крыс. Дж. Комп. Нейрол. 324, 180–194. doi: 10.1002/cne.0204
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Картер, Дж. Р., и Гольдштейн, Д. С. (2015). Симпатоневральные и адреномедуллярные реакции на психический стресс. Компр. Физиол. 5, 119–146. doi: 10.1002/cphy.c140030
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Карузо А., Николетти Ф., Манго Д. , Саиди А., Орландо Р. и Скаччаноче С. (2018). Стресс как фактор риска болезни Альцгеймера. Фармакол. Рез. 132, 130–134. doi: 10.1016/j.phrs.2018.04.017
, Саиди А., Орландо Р. и Скаччаноче С. (2018). Стресс как фактор риска болезни Альцгеймера. Фармакол. Рез. 132, 130–134. doi: 10.1016/j.phrs.2018.04.017
PubMed Abstract | CrossRef Full Text
Cassens, G., Kuruc, A., Roffman, M., Orsulak, P.J., and Schildkraut, J.J. (1981). Изменения в метаболизме и поведении норадреналина в головном мозге, вызванные раздражителями из окружающей среды, которые ранее сопровождались неизбежным шоком. Поведение. Мозг Res. 2, 387–407. doi: 10.1016/0166-4328(81)
-6
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Castro, O.W., Santos, V.R., Pun, R.Y.K., McKlveen, J.M., Batie, M., Holland, K.D., et al. (2012). Влияние лечения кортикостероном на частоту спонтанных припадков и эпилептиформную активность у мышей с хронической эпилепсией. PLoS One 7:e46044. doi: 10.1371/journal.pone.0046044
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Чаппелл, П. Б., Смит, М.А., Килтс, К.Д., Биссетт, Г., Ричи, Дж., Андерсон, К., и др. (1986). Изменения иммунореактивности, подобной кортикотропин-рилизинг-фактору, в дискретных областях мозга крыс после острого и хронического стресса. J. Neurosci. 6, 2908–2914. doi: 10.1523/JNEUROSCI.06-10-02908.1986
Б., Смит, М.А., Килтс, К.Д., Биссетт, Г., Ричи, Дж., Андерсон, К., и др. (1986). Изменения иммунореактивности, подобной кортикотропин-рилизинг-фактору, в дискретных областях мозга крыс после острого и хронического стресса. J. Neurosci. 6, 2908–2914. doi: 10.1523/JNEUROSCI.06-10-02908.1986
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Чаудхури Д., Уолш Дж. Дж., Фридман А. К., Хуарес Б., Ку С. М., Ку Дж. В. и др. (2012). Быстрая регуляция поведения, связанного с депрессией, путем контроля дофаминовых нейронов среднего мозга. Природа 493, 532–536. doi: 10.1038/nature11713
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Чой, Д. К., Фурей, А. Р., Эвансон, Н. К., Острандер, М. М., Ульрих-Лай, Ю. М., и Герман, Дж. П. (2007). Ядра ложа субрегионов концевой полоски по-разному регулируют активность гипоталамо-гипофизарно-надпочечниковой оси: значение для интеграции лимбических входов. J. Neurosci. 27, 2025–2034 гг. doi: 10.1523/JNEUROSCI.4301-06.2007
doi: 10.1523/JNEUROSCI.4301-06.2007
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Christoffel, D.J., Golden, S.A., Dumitriu, D., Robison, A.J., Janssen, W.G., Ahn, H.F., et al. (2011). Киназа IκB регулирует индуцированную стрессом социальную синаптическую и поведенческую пластичность. J. Neurosci. 31, 314–321. doi: 10.1523/JNEUROSCI.4763-10.2011
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Chrousos, GP (2009). Стресс и нарушения стрессовой системы. Нац. Преподобный Эндокринол. 5, 374–381. doi: 10.1038/nrendo.2009.106
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
Коул, Б. Дж., и Кооб, Г. Ф. (1988). Пропранолол противодействует усиленному условному страху, вызываемому рилизинг-фактором кортикотропина. Дж. Фармакол. Эксп. тер. 247, 902–910.
Реферат PubMed | Google Scholar
Covington, H. E. III., Maze, I., LaPlant, Q. C., Vialou, V. F., Ohnishi, Y. N., Berton, O., et al. (2009). Антидепрессивное действие ингибиторов гистондеацетилазы. J. Neurosci. 29, 11451–11460. doi: 10.1523/JNEUROSCI.1758-09.2009
F., Ohnishi, Y. N., Berton, O., et al. (2009). Антидепрессивное действие ингибиторов гистондеацетилазы. J. Neurosci. 29, 11451–11460. doi: 10.1523/JNEUROSCI.1758-09.2009
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Covington, H. E. III., Maze, I., Sun, H., Bomze, H. M., DeMaio, K. D., Wu, E. Y., et al. (2011). Роль репрессивного метилирования гистонов в индуцированной кокаином уязвимости к стрессу. Нейрон 71, 656–670. doi: 10.1016/j.neuron.2011.06.007
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Коуэн, К.С.М., Каллаган, Б.Л., Кан, Дж.М., и Ричардсон, Р. (2016). Длительное воздействие невзгод в раннем возрасте на людей и их потомков: потенциальные механизмы и надежда на вмешательство. Гены Поведение мозга. 15, 155–168. doi: 10.1111/gbb.12263
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Crestani, C.C., Alves, F.H., Gomes, F.V., Resstel, L.B. , Correa, FM, and Herman, JP (2013). Механизмы ядра ложа терминальной полоски, участвующие в контроле вегетативных и нейроэндокринных функций: обзор. Курс. Нейрофармакол. 11, 141–159. doi: 10.2174/1570159X11311020002
, Correa, FM, and Herman, JP (2013). Механизмы ядра ложа терминальной полоски, участвующие в контроле вегетативных и нейроэндокринных функций: обзор. Курс. Нейрофармакол. 11, 141–159. doi: 10.2174/1570159X11311020002
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Куллинан В.Е., Герман Дж.П., Батталья Д.Ф., Акил Х. и Уотсон С.Дж. (1995). Паттерн и временной ход немедленной ранней экспрессии генов в мозге крыс после острого стресса. Неврология 64, 477–505. doi: 10.1016/0306-4522(94)00355-9
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Cullinan, WE, Herman, JP, and Watson, SJ (1993). Вентральные субикулярные взаимодействия с гипоталамическим паравентрикулярным ядром: свидетельство реле в ядре ложа терминальной полоски. Дж. Комп. Нейрол. 332, 1–20. doi: 10.1002/cne.
0102PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Cunningham, ET Jr., and Sawchenko, PE (1988). Анатомическая специфика норадренергических входов в паравентрикулярное и супраоптическое ядра гипоталамуса крысы. Дж. Комп. Нейрол. 274, 60–76. doi: 10.1002/cne.
Анатомическая специфика норадренергических входов в паравентрикулярное и супраоптическое ядра гипоталамуса крысы. Дж. Комп. Нейрол. 274, 60–76. doi: 10.1002/cne.
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Curley, JP, Jensen, C.L., Mashoodh, R., and Champagne, F.A. (2011). Социальные влияния на нейробиологию и поведение: эпигенетические эффекты во время развития. Психонейроэндокринология 36, 352–371. doi: 10.1016/j.psyneuen.2010.06.005
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Даллман, М. Ф. (2003). Подчеркните любым другим именем …? Горм. Поведение 43, 18–20. doi: 10.1016/s0018-506x(02)00034-x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Даллман, М. Ф. (2005). Быстродействующие глюкокортикоиды на головной мозг: назад в будущее. Фронт. Нейроэндокринол. 26, 103–108. doi: 10.1016/j.yfrne.2005.08.001
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
Даскалакис Н. П., Иегуда Р. и Даймонд Д.М. (2013). Животные модели в трансляционных исследованиях посттравматического стрессового расстройства. Психоневроэндокринология 38, 1895–1911. doi: 10.1016/j.psyneuen.2013.06.006
П., Иегуда Р. и Даймонд Д.М. (2013). Животные модели в трансляционных исследованиях посттравматического стрессового расстройства. Психоневроэндокринология 38, 1895–1911. doi: 10.1016/j.psyneuen.2013.06.006
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Датсон, Н. А., Морсинк, М. К., Мейер, О. К., и де Клот, Э. Р. (2008). Центральное действие кортикостероидов: поиск генных мишеней. евро. Дж. Фармакол. 583, 272–289. doi: 10.1016/j.ejphar.2007.11.070
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Дэвидсон Р. Дж. и Макьюэн Б. С. (2012). Социальное влияние на нейропластичность: стресс и меры для улучшения самочувствия. Нац. Неврологи. 15, 689–695. doi: 10.1038/nn.3093
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Дэвис, KJA (2016). Адаптивный гомеостаз. Мол. Аспекты Мед. 49, 1–7. doi: 10.1016/j.mam.2016.04.007
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
Day, TA (2005). Определение стресса как прелюдии к картированию его нейросхем: аллостаз не поможет. Прог. Нейропсихофармакол. биол. Психиатрия 29, 1195–1200. doi: 10.1016/j.pnpbp.2005.08.005
Определение стресса как прелюдии к картированию его нейросхем: аллостаз не поможет. Прог. Нейропсихофармакол. биол. Психиатрия 29, 1195–1200. doi: 10.1016/j.pnpbp.2005.08.005
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Dayas, C.V., Buller, K.M., Crane, JW, Xu, Y., and Day, TA (2001). Категоризация стрессора: острые физические и психологические стрессоры вызывают характерные паттерны рекрутирования в миндалевидном теле и в группах норадренергических клеток продолговатого мозга. Евро. Дж. Нейроски. 14, 1143–1152. doi: 10.1046/j.0953-816x.2001.01733.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
де Клоет, Э. Р. (2013). Функциональный профиль бинарной системы рецепторов кортикостероидов головного мозга: опосредование, многозадачность, координация, интеграция. евро. Дж. Фармакол. 719, 53–62. doi: 10.1016/j.ejphar.2013.04.053
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
de Kloet, E. R., Joëls, M., and Holsboer, F. (2005a). Стресс и мозг: от адаптации к болезни. Нац. Преподобный Нейроски. 6, 463–475. doi: 10.1038/nrn1683
R., Joëls, M., and Holsboer, F. (2005a). Стресс и мозг: от адаптации к болезни. Нац. Преподобный Нейроски. 6, 463–475. doi: 10.1038/nrn1683
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
де Клоет, Э. Р., Сибуг, Р. М., Хельмерхорст, Ф. М., и Шмидт, М. (2005b). Стресс, гены и механизм программирования мозга на дальнейшую жизнь. Неврологи. Биоповедение. Ред. 29, 271–281. doi: 10.1016/j.neubiorev.2004.10.008
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
де Клоет, Э. Р., и Сарабджитсингх, Р. А. (2008). У всего есть ритм: сосредоточьтесь на пульсации глюкокортикоидов. Эндокринология 149, 3241–3243. doi: 10.1210/en.2008-0471
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
de Kloet, E.R., Sutanto, W., Rots, N., van Haarst, A., van den Berg, D., Oitzl, M., et al. (1991). Пластичность и функция кортикостероидных рецепторов головного мозга при старении. Акта Эндокринол. 125, 65–72.
125, 65–72.
Реферат PubMed | Google Scholar
Де Ока Б.М., ДеКола Дж.П., Марен С. и Фанселоу М.С. (1998). Отдельные области периакведуктального серого цвета участвуют в приобретении и выражении защитных реакций. J. Neurosci. 18, 3426–3432. doi: 10.1523/JNEUROSCI.18-09-03426.1998
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Дик Т., Борднер К. А., МакЭлдерри Н. К., Барнум С. Дж., Бландино П. мл., Дик М. М. и др. (2005). Стресс-индуцированное увеличение гипоталамического IL-1: систематический анализ множественных парадигм стрессора. Мозг Res. Бык. 64, 541–556. doi: 10.1016/j.brainresbull.2004.11.003
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Дедович, К., Дюшен, А., Эндрюс, Дж., Энгерт, В., и Прюсснер, Дж. К. (2009). Мозг и ось стресса: нейронные корреляты регуляции кортизола в ответ на стресс. Нейроизображение 47, 864–871. doi: 10.1016/j.neuroimage.2009.05.074
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Демпси Б. , Ле С., Тернер А., Бокинец П., Рамадас Р., Бьяали Дж. Г. и др. (2017). Картирование и анализ коннектома симпатических премоторных нейронов в ростральном вентролатеральном отделе продолговатого мозга крысы с использованием объемного атласа головного мозга. Фронт. Нейронные схемы 11:9. doi: 10.3389/fncir.2017.00009
, Ле С., Тернер А., Бокинец П., Рамадас Р., Бьяали Дж. Г. и др. (2017). Картирование и анализ коннектома симпатических премоторных нейронов в ростральном вентролатеральном отделе продолговатого мозга крысы с использованием объемного атласа головного мозга. Фронт. Нейронные схемы 11:9. doi: 10.3389/fncir.2017.00009
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Di, S., Malcher-Lopes, R., Halmos, KC, and Tasker, JG (2003). Негеномное ингибирование глюкокортикоидов посредством высвобождения эндоканнабиноидов в гипоталамусе: механизм быстрой обратной связи. J. Neurosci. 23, 4850–4857. doi: 10.1523/JNEUROSCI.23-12-04850.2003
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Ди, С., Малчер-Лопес, Р., Марчеселли, В. Л., Базан, Н. Г., и Таскер, Дж. Г. (2005). Быстрое высвобождение эндоканнабиноидов, опосредованное глюкокортикоидами, и противодействующая регуляция поступления глутамата и альфа-аминомасляной кислоты в крупноклеточные нейроны гипоталамуса. Эндокринология 146, 4292–4301. doi: 10.1210/en.2005-0610
Эндокринология 146, 4292–4301. doi: 10.1210/en.2005-0610
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Даймонд, Д. М., Кэмпбелл, А. М., Парк, Ч. Р., Халонен, Дж., и Золадз, П. Р. (2007). Темпоральная динамическая модель обработки эмоциональной памяти: синтез на нейробиологической основе стресс-индуцированной амнезии, вспышек и травматических воспоминаний и закона Йеркса-Додсона. Нейропласт. 2007:60803. doi: 10.1155/2007/60803
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
ДиГанги, Дж., Гуффанти, Г., Маклафлин, К.А., и Коенен, К.С. (2013). Рассмотрение воздействия травмы в контексте генетических исследований посттравматического стрессового расстройства: систематический обзор. биол. Тревожное расстройство настроения. 3:2. doi: 10.1186/2045-5380-3-2
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Дилген Дж., Техеда Х. А. и О’Доннелл П. (2013). Входы миндалевидного тела вызывают прямое торможение в медиальной префронтальной коре. Дж. Нейрофизиол. 110, 221–229. doi: 10.1152/jn.00531.2012
Дж. Нейрофизиол. 110, 221–229. doi: 10.1152/jn.00531.2012
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Диоро, Д., Виау, В., и Мини, М. Дж. (1993). Роль медиальной префронтальной коры (поясной извилины) в регуляции гипоталамо-гипофизарно-надпочечниковых реакций на стресс. J. Neurosci. 13, 3839–3847. doi: 10.1523/JNEUROSCI.13-09-03839.1993
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
До-Монте, Ф. Х., Киньонес-Ларакуенте, К., и Квирк, Г. Дж. (2015). Временной сдвиг в цепях, опосредующих извлечение воспоминаний о страхе. Природа 519, 460–463. doi: 10.1038/nature14030
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Дюнсер М.В. и Хасибедер В.Р. (2009). Симпатическая чрезмерная стимуляция во время критического состояния: неблагоприятные последствия адренергического стресса. J. Медицинская интенсивная терапия. 24, 293–316. doi: 10.1177/088506660
19
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Дюваль Ф. , Крок М. А., Гилон М. С., Мокрани М. К., Монреаль Дж., Бейли П. и др. (2004). Увеличение подавления адренокортикотропина после введения дексаметазона у подростков, подвергшихся сексуальному насилию, с посттравматическим стрессовым расстройством. Энн. НЮ акад. науч. 1032, 273–275. doi: 10.1196/annals.1314.036
, Крок М. А., Гилон М. С., Мокрани М. К., Монреаль Дж., Бейли П. и др. (2004). Увеличение подавления адренокортикотропина после введения дексаметазона у подростков, подвергшихся сексуальному насилию, с посттравматическим стрессовым расстройством. Энн. НЮ акад. науч. 1032, 273–275. doi: 10.1196/annals.1314.036
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Дуварчи С. и Паре Д. (2007). Глюкокортикоиды усиливают возбудимость основных базолатеральных нейронов миндалины. J. Neurosci. 27, 4482–4491. doi: 10.1523/JNEUROSCI.0680-07.2007
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Engeland, WC, and Arnhold, MM (2005). Нейронная схема в регуляции ритмичности кортикостерона надпочечников. Эндокринная система 28, 325–332. doi: 10.1385/endo:28:3:325
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Euler, USV (1946). Специфический симпатомиметический эргон в адренергических нервных волокнах (симпатин) и его связь с адреналином и норадреналином. Acta Physiol. 12, 73–97. doi: 10.1111/j.1748-1716.1946.tb00368.x
Acta Physiol. 12, 73–97. doi: 10.1111/j.1748-1716.1946.tb00368.x
Полный текст CrossRef | Google Scholar
Эвансон Н.К., Герман Дж.П., Сакаи Р.Р. и Краузе Э.Г. (2010). Негеномные действия стероидов надпочечников на центральную нервную систему. J. Нейроэндокринол. 22, 846–861. doi: 10.1111/j.1365-2826.2010.02000.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Фазан Р. мл., де Оливейра М., Оливейра Дж. А., Сальгадо Х. К. и Гарсия-Кайраско Н. (2011). Изменения вегетативной регуляции сердечно-сосудистой системы у аудиогенных крыс линии Wistar (WAR). Эпилепсия Поведение. 22, 666–670. doi: 10.1016/j.yebeh.2011.09.010
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Фазан, Р. мл., Сильва, К. А., Оливейра, Дж. А., Сальгадо, Х. К., Монтано, Н., и Гарсия-Кайраско, Н. (2015). Оценка сердечно-сосудистых факторов риска у аудиогенных крыс линии Wistar (WAR). PLoS One 10:e0129574. doi: 10.1371/journal.pone.0129574
doi: 10.1371/journal.pone.0129574
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Феликс-Ортис, А. К., Бургос-Роблес, А., Бхагат, Н. Д., Леппла, К. А., и Тай, К. М. (2016). Двунаправленная модуляция поведения, связанного с тревогой, и социального поведения проекциями миндалевидного тела на медиальную префронтальную кору. Неврология 321, 197–209. doi: 10.1016/j.neuroscience.2015.07.041
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Фенолио, К. А., Брансон, К. Л., и Барам, Т. З. (2006). Нейропластичность гиппокампа, вызванная стрессом в раннем возрасте: функциональные и молекулярные аспекты. Фронт. Нейроэндокринол. 27, 180–192. doi: 10.1016/j.yfrne.2006.02.001
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Ферлиси М. и Шорвон С. (2014). Преципитанты судорог (пусковые факторы) у больных эпилепсией. Эпилепсия Поведение. 33, 101–105. doi: 10.1016/j.yebeh. 2014.02.019
2014.02.019
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Фернандес, В., и Осорио, Ф.Л. (2015). Есть ли связь между ранней эмоциональной травмой и тревожными расстройствами? Данные систематического обзора литературы и метаанализа. евро. Психиатрия 30, 756–764. doi: 10.1016/j.eurpsy.2015.06.004
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Фигейредо, Х. Ф., Брюстл, А., Боди, Б., Долгас, К. М., и Герман, Дж. П. (2003). Медиальная префронтальная кора по-разному регулирует индуцированную стрессом экспрессию c-fos в переднем мозге в зависимости от типа стрессора. Евро. Дж. Нейроски. 18, 2357–2364. doi: 10.1046/j.1460-9568.2003.02932.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Франк М. Г., Уоткинс Л. Р. и Майер С. Ф. (2013). Стресс-индуцированные глюкокортикоиды как нейроэндокринный сигнал тревоги об опасности. Поведение мозга. Иммун. 33, 1–6. doi: 10. 1016/j.bbi.2013.02.004
1016/j.bbi.2013.02.004
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Frucht, M.M., Quigg, M., Schwaner, C., and Fountain, NB (2000). Распределение предвестников приступов среди эпилептических синдромов. Эпилепсия 41, 1534–1539. doi: 10.1111/j.1528-1167.2000.01534.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Гэббот П. Л. А., Уорнер Т. А., Джейс П. Р. Л., Салуэй П. и Басби С. Дж. (2005). Префронтальная кора крысы: проекции на подкорковые вегетативные, двигательные и лимбические центры. Дж. Комп. Нейрол. 492, 145–177. doi: 10.1002/cne.20738
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Gaillet, S., Lachuer, J., Malaval, F., Assenmacher, I., and Szafarczyk, A. (1991). Участие норадренергических восходящих путей в индуцированной стрессом активации секреции АКТГ и кортикостерона зависит от природы стрессоров. Экспл. Мозг Res. 87, 173–180. doi: 10. 1007/bf00228518
1007/bf00228518
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Гарсия-Кайраско, Н., Умеока, Э.Х.Л., и Кортес де Оливейра, Дж.А. (2017). Штамм Wistar Audioogenic Rat (WAR) и его вклад в эпилептологию и сопутствующие заболевания: история и перспективы. Эпилепсия Поведение. 71, 250–273. doi: 10.1016/j.yebeh.2017.04.001
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Герлинг Дж. К., Шин Дж. В., Чименти П. К. и Лоуи А. Д. (2010). Паравентрикулярное ядро гипоталамуса: проекции аксонов на ствол мозга. Дж. Комп. Нейрол. 518, 1460–1499. doi: 10.1002/cne.22283
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Джордж С.А., Нокс Д., Кертис А.Л., Олдридж Дж.В., Валентино Р.Дж. и Либерзон И. (2013). Изменение функции норадреналина голубого пятна после однократного длительного стресса. Евро. Дж. Нейроски. 37, 901–909. doi: 10.1111/ejn.12095
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Годой Л. Д., Умеока Э.Х.Л., Рибейро Д.Е., Сантос В.Р., Антунес-Родригес Дж., Джока С.Р.Л. и др. (2018). Мультимодальный стресс в раннем возрасте вызывает биологические изменения, связанные с психопатологиями. Горм. Поведение 100, 69–80. doi: 10.1016/j.yhbeh.2018.03.005
Д., Умеока Э.Х.Л., Рибейро Д.Е., Сантос В.Р., Антунес-Родригес Дж., Джока С.Р.Л. и др. (2018). Мультимодальный стресс в раннем возрасте вызывает биологические изменения, связанные с психопатологиями. Горм. Поведение 100, 69–80. doi: 10.1016/j.yhbeh.2018.03.005
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Годсил, Б. П., Кисс, Дж. П., и Спеддинг, М. (2013). Гиппокампально-префронтальный путь: слабое звено психических расстройств? Евро. J. Нейропсихофармакол. 10, 1165–1181. doi: 10.1016/j.euroneuro.2012.10.018
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Gold, P.W., Goodwin, F.K., and Chrousos, G.P. (1988). Клинические и биохимические проявления депрессии. Н. англ. Дж. Мед. 319, 413–420. doi: 10.1056/nejm1988081831
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Гольдштейн Д. С., Эйзенхофер Г. и Копин И. Дж. (2003). Источники и значение уровней катехолов и их метаболитов в плазме крови человека. J. Pharmacol. Эксп. тер. 305, 800–811. doi: 10.1124/jpet.103.049270
J. Pharmacol. Эксп. тер. 305, 800–811. doi: 10.1124/jpet.103.049270
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Грейс А.А., Флореско С.Б., Гото Ю. и Лодж Д.Дж. (2007). Регуляция возбуждения дофаминергических нейронов и контроль целенаправленного поведения. Trends Neurosci. 30, 220–227. doi: 10.1016/j.tins.2007.03.003
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Granjeiro, É. М., да Силва, Г.С., Джусти, Х., Оливейра, Дж.А., Гласс, М.Л., и Гарсия-Кайраско, Н. (2016). Поведенческие, вентиляционные и терморегуляторные реакции на гиперкапнию и гипоксию у линии аудиогенных крыс Wistar (WAR). PLoS One 11:e0154141. doi: 10.1371/journal.pone.0154141
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Грбеса И. и Хаким О. (2017). Геномные эффекты глюкокортикоидов. Протоплазма 254, 1175–1185. doi: 10.1007/s00709-016-1063-y
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Гриффитс, Б. Б., и Хантер, Р. Г. (2014). Нейроэпигенетика стресса. Неврология 275, 420–435. doi: 10.1016/j.neuroscience.2014.06.041
Б., и Хантер, Р. Г. (2014). Нейроэпигенетика стресса. Неврология 275, 420–435. doi: 10.1016/j.neuroscience.2014.06.041
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
Groeneweg, F.L., Karst, H., de Kloet, E.R., and Joëls, M. (2012). Минералокортикоидные и глюкокортикоидные рецепторы на нейрональной мембране, регуляторы негеномной кортикостероидной сигнализации. Мол. Клетка. Эндокринол. 350, 299–309. doi: 10.1016/j.mce.2011.06.020
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Гроссман Р., Иегуда Р., Нью А., Шмайдлер Дж., Сильверман Дж., Митропулоу В. и др. (2003). Результаты теста подавления дексаметазона у субъектов с расстройствами личности: ассоциации с посттравматическим стрессовым расстройством и большой депрессией. утра. Журнал психиатрии 160, 1291–1298. doi: 10.1176/appi.ajp.160.7.1291
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Гимарайнш С. и Моура Д. (2001). Сосудистые адренорецепторы: обновление. Фармакол. Ред. 53, 319–356.
и Моура Д. (2001). Сосудистые адренорецепторы: обновление. Фармакол. Ред. 53, 319–356.
Реферат PubMed | Google Scholar
Gunnar, M.R., and Donzella, B. (2002). Социальная регуляция уровня кортизола в раннем развитии человека. Психонейроэндокринология 27, 199–220. doi: 10.1016/s0306-4530(01)00045-2
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
Херфстранд А., Фуксе К., Цинтра А., Агнати Л. Ф., Зини И., Викстрем А. С. и др. (1986). Иммунореактивность глюкокортикоидных рецепторов в моноаминергических нейронах головного мозга крыс. Проц. Натл. акад. науч. США 83, 9779–9783. doi: 10.1073/pnas.83.24.9779
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Харири, А. Р., и Холмс, А. (2015). Поиск перевода в исследовании стресса. Нац. Неврологи. 18, 1347–1352. doi: 10.1038/nn.4111
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Heim, C. , and Nemeroff, CB (2002). Нейробиология стресса в раннем возрасте: клинические исследования. Семин. клин. Нейропсихиатрия 7, 147–159. doi: 10.1053/scnp.2002.33127
, and Nemeroff, CB (2002). Нейробиология стресса в раннем возрасте: клинические исследования. Семин. клин. Нейропсихиатрия 7, 147–159. doi: 10.1053/scnp.2002.33127
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Хейм К., Ньюпорт Дж., Хейт С., Грэм Ю.П., Уилкокс М., Бонсолл Р. и др. (2000). Гипофизарно-адреналовые и вегетативные реакции на стресс у женщин после сексуального и физического насилия в детстве. JAMA 284, 592–597. doi: 10.1001/jama.284.5.592
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Хейм К., Ньюпорт Д. Дж., Млецко Т., Миллер А. Х. и Немерофф К. Б. (2008). Связь между детской травмой и депрессией: результаты исследований оси HPA у людей. Психонейроэндокринология 33, 693–710. doi: 10.1016/j.psyneuen.2008.03.008
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Хемант Кумар Б.С., Мишра С.К., Рана П., Сингх С. и Хушу С. (2012). Нейродегенеративные признаки во время раннего начала депрессии у крыс CMS, обнаруженные с помощью протонной магнитно-резонансной спектроскопии при 7 T. Поведение. Мозг Res. 232, 53–59. doi: 10.1016/j.bbr.2012.03.011
Поведение. Мозг Res. 232, 53–59. doi: 10.1016/j.bbr.2012.03.011
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Герман Дж. П., Фигейредо Х., Мюллер Н. К., Ульрих-Лай Ю., Острандер М. М., Чой Д. К. и др. (2003). Центральные механизмы интеграции стресса: иерархическая схема, контролирующая реакцию гипоталамо-гипофизарно-надпочечниковой системы. Фронт. Нейроэндокринол. 24, 151–180. doi: 10.1016/j.yfrne.2003.07.001
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Герман, Дж. П., и Мюллер, Н. К. (2006). Роль вентрального субикулума в интеграции стресса. Поведение. Мозг Res. 174, 215–224. doi: 10.1016/j.bbr.2006.05.035
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Герман Дж. П., Острандер М. М., Мюллер Н. К. и Фигейредо Х. (2005). Механизмы лимбической системы регуляции стресса: гипоталамо-гипофизарно-адренокортикальная ось. Прог. Нейропсихофармакол. биол. Психиатрия 29, 1201–1213. doi: 10.1016/j.pnpbp.2005.08.006
биол. Психиатрия 29, 1201–1213. doi: 10.1016/j.pnpbp.2005.08.006
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
Herman, JP, Prewitt, CM, and Cullinan, WE (1996). Регуляция нервной цепи гипоталамо-гипофизарно-надпочечниковой оси стресса. Крит. Преподобный Нейробиол. 10, 371–394. doi: 10.1615/critrevneurobiol.v10.i3-4.50
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Хешмати, М., и Руссо, С.Дж. (2015). Ангедония и схема вознаграждения мозга при депрессии. Курс. Поведение Неврологи. Отчеты 2, 146–153. doi: 10.1007/s40473-015-0044-3
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Hill, M.N., McLaughlin, R.J., Pan, B., Fitzgerald, M.L., Roberts, C.J., Lee, T.T.Y., et al. (2011). Рекрутирование глюкокортикоидами передачи сигналов эндоканнабиноидов префронтальной коры способствует прекращению стрессовой реакции. J. Neurosci. 31, 10506–10515. doi: 10. 1523/JNEUROSCI.0496-11.2011
1523/JNEUROSCI.0496-11.2011
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Хиллиер, С. Г. (2007). Бриллианты навсегда: наследие кортизона. Дж. Эндокринол. 195, 1–6. doi: 10.1677/joe-07-0309
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Hindmarch, CCT, and Ferguson, AV (2016). Физиологические роли субфорникального органа: динамический транскриптом, сформированный вегетативным состоянием. J. Physiol. 594, 1581–1589. doi: 10.1113/jp270726
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Хинвуд, М., Морандини, Дж., Дэй, Т.А., и Уокер, Ф.Р. (2012). Доказательства того, что микроглия опосредует нейробиологические эффекты хронического психологического стресса на медиальную префронтальную кору. Церебр. Кора 22, 1442–1454. doi: 10.1093/cercor/bhr229
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Хинвуд М., Тайнан Р. Дж., Чарнли Дж. Л., Бейнон С. Б., Дэй Т. А. и Уокер Ф. Р. (2013). Ремоделирование префронтальной коры, вызванное хроническим стрессом: структурная реорганизация микроглии и ингибирующее действие миноциклина. Церебр. Кортекс 23, 1784–1797 гг. doi: 10.1093/cercor/bhs151
Дж., Чарнли Дж. Л., Бейнон С. Б., Дэй Т. А. и Уокер Ф. Р. (2013). Ремоделирование префронтальной коры, вызванное хроническим стрессом: структурная реорганизация микроглии и ингибирующее действие миноциклина. Церебр. Кортекс 23, 1784–1797 гг. doi: 10.1093/cercor/bhs151
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Hoijemakers, L., Heinen, Y., van Dam, A.M., Lucassen, PJ, and Korosi, A. (2016). Примирование микроглии и болезнь Альцгеймера: возможная роль (ранних) иммунных проблем и эпигенетики? Фронт. Гум. Неврологи. 10:398. doi: 10.3389/fnhum.2016.00398
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Холмс А. и Веллман С. Л. (2009 г.). Стресс-индуцированная префронтальная реорганизация и исполнительная дисфункция у грызунов. Неврологи. Биоповедение. Ред. 33, 773–783. doi: 10.1016/j.neubiorev.2008.11.005
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Homberg, J. R., Kyzar, E. J., Scattoni, M. L., Norton, W. H., Pittman, J., Gaikwad, S., et al. (2016). Генетическая и экологическая модуляция нарушений развития нервной системы: перевод информации из лабораторий в кровати. Мозг Res. Бык. 125, 79–91. doi: 10.1016/j.brainresbull.2016.04.015
R., Kyzar, E. J., Scattoni, M. L., Norton, W. H., Pittman, J., Gaikwad, S., et al. (2016). Генетическая и экологическая модуляция нарушений развития нервной системы: перевод информации из лабораторий в кровати. Мозг Res. Бык. 125, 79–91. doi: 10.1016/j.brainresbull.2016.04.015
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Huang, LT (2014). Стресс в раннем возрасте влияет на развивающийся гиппокамп и способствует возникновению приступов: клеточные, молекулярные и эпигенетические механизмы. Фронт. Мол. Неврологи. 7:8. doi: 10.3389/fnmol.2014.00008
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Хьюстон, К.М., и Дик, Т. (2014). Ось воспаления: взаимодействие между стрессом, гормонами и экспрессией генов, связанных с воспалением, в ключевых структурах, составляющих ось гипоталамо-гипофизарно-надпочечниковая. Физиол. Поведение 124, 77–91. doi: 10.1016/j.physbeh.2013.10.035
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Хантер Р. Г., Маккарти К. Дж., Милн Т. А., Пфафф Д. В. и Макьюэн Б. С. (2009). Регуляция метилирования гистона h4 гиппокампа при остром и хроническом стрессе. Проц. Натл. акад. науч. США 106, 20912–20917. doi: 10.1073/pnas.0
Г., Маккарти К. Дж., Милн Т. А., Пфафф Д. В. и Макьюэн Б. С. (2009). Регуляция метилирования гистона h4 гиппокампа при остром и хроническом стрессе. Проц. Натл. акад. науч. США 106, 20912–20917. doi: 10.1073/pnas.0
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Инслихт С.С., Мармар С.Р., Нейлан Т.С., Мецлер Т.Дж., Харт С.Л., Отте С. и др. (2006). Повышенный уровень кортизола у женщин с посттравматическим стрессовым расстройством, связанным с насилием со стороны интимного партнера. Энн. НЮ акад. науч. 1071, 428–429. doi: 10.1196/annals.1364.035
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Иверсен С., Иверсен Л. и Сапер С. Б. (2000). Принципы нейробиологии. 4-е изд. Нью-Йорк, штат Нью-Йорк: McGraw-Hill.
Якобсон Л. и Сапольски Р. (1991). Роль гиппокампа в регуляции обратной связи гипоталамо-гипофизарно-надпочечниковой оси. Эндокр. Ред. 12, 118–134. doi: 10.1210/edrv-12-2-118
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
Ягота А. , де ла Иглесиа Х. О. и Шварц В. Дж. (2000). Утренние и вечерние циркадные колебания в супрахиазматическом ядре in vitro . Нац. Неврологи. 3, 372–376. doi: 10.1038/73943
, де ла Иглесиа Х. О. и Шварц В. Дж. (2000). Утренние и вечерние циркадные колебания в супрахиазматическом ядре in vitro . Нац. Неврологи. 3, 372–376. doi: 10.1038/73943
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Джанак П. Х. и Тай К. М. (2015). От цепей к поведению в миндалевидном теле. Природа 517, 284–292. doi: 10.1038/nature14188
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
Джедема, Х. П., и Грейс, А. А. (2004). Кортикотропин-рилизинг-гормон напрямую активирует норадренергические нейроны голубого пятна, зарегистрированные in vitro . J. Neurosci. 24, 9703–9713. doi: 10.1523/JNEUROSCI.2830-04.2004
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Чжон Ю. Х., Пак Ч. Х., Ю Дж., Шин К. Ю., Ан С. М., Ким Х. С. и др. (2006). Хронический стресс ускоряет ухудшение обучения и памяти и увеличивает отложение амилоида у трансгенных мышей APPV717I-CT100 на модели болезни Альцгеймера. FASEB J. 20, 729–731. doi: 10.1096/fj.05-4265fje
FASEB J. 20, 729–731. doi: 10.1096/fj.05-4265fje
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Джоэльс, М. (2009). Стресс, гиппокамп и эпилепсия. Эпилепсия 50, 586–597. doi: 10.1111/j.1528-1167.2008.01902.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Жоэлс, М., и Барам, Т. З. (2009). Нейросимфония стресса. Нац. Преподобный Нейроски. 10, 459–466. doi: 10.1038/nrn2632
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Жоэлс М. и де Клоет Э. Р. (1989). Влияние глюкокортикоидов и норадреналина на возбудимость гиппокампа. Наука 245, 1502–1505. doi: 10.1126/science.2781292
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Жоэлс М., Пасрича Н. и Карст Х. (2013). Взаимодействие между быстрым и медленным действием кортикостероидов в головном мозге. евро. Дж. Фармакол. 719, 44–52. doi: 10.1016/j.ejphar. 2013.07.015
2013.07.015
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Джоэлс, М., Сарабджитсингх, Р. А., и Карст, Х. (2012). Раскрытие временных областей влияния кортикостероидного гормона на активность мозга: быстрый, медленный и хронический режимы. Фармакол. Ред. 64, 901–938. doi: 10.1124/pr.112.005892
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Джонсон, Л. Р., Фарб, К., Моррисон, Дж. Х., Макьюэн, Б. С., и Леду, Дж. Э. (2005). Локализация глюкокортикоидных рецепторов на постсинаптических мембранах латеральной миндалины. Неврология 136, 289–299. doi: 10.1016/j.neuroscience.2005.06.050
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Джонс, П. Б. (2013). Расстройства психического здоровья взрослых и возраст их возникновения. Бр. J. Psychiatry Suppl. 202, с5–с10. doi: 10.1192/bjp.bp.112.119164
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Джонс, К. Р., Майерс, Б., и Герман, Дж. П. (2011). Стимуляция прелимбической коры по-разному модулирует нейроэндокринные реакции на психогенные и системные стрессоры. Физиол. Поведение 104, 266–271. doi: 10.1016/j.physbeh.2011.03.021
Р., Майерс, Б., и Герман, Дж. П. (2011). Стимуляция прелимбической коры по-разному модулирует нейроэндокринные реакции на психогенные и системные стрессоры. Физиол. Поведение 104, 266–271. doi: 10.1016/j.physbeh.2011.03.021
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Юруэна, М. Ф. (2013). Стресс в раннем возрасте и ось HPA вызывают рецидивирующую депрессию во взрослом возрасте. Эпилепсия Поведение. 38, 148–159. doi: 10.1016/j.yebeh.2013.10.020
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Юруэна М. Ф., Клир Дж. и Париант М. (2004). Гипоталамо-гипофизарно-надпочечниковая ось, функция глюкокортикоидных рецепторов и связь с депрессией. Rev. Бюстгальтеры. Псикиатр. 26, 189–201. doi: 10.1590/S1516-44462004000300009
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Каннер, А. М. (2012). Могут ли нейробиологические патогенетические механизмы депрессии способствовать развитию судорожных расстройств? Ланцет Нейрол. 11, 1093–1102. doi: 10.1016/S1474-4422(12)70201-6
11, 1093–1102. doi: 10.1016/S1474-4422(12)70201-6
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Каннер, А. М. (2017). Могут ли нейрохимические изменения расстройств настроения объяснить повышенный риск эпилепсии или ухудшение контроля над приступами? Сон Мед. 42, 2071–2076. doi: 10.1007/s11064-017-2331-8
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Каннер А. М., Шарфман Х., Джетте Н., Анагносту Э., Бернард К., Камфилд К. и др. (2017). Эпилепсия как сетевое расстройство (1): чему мы можем научиться у других сетевых расстройств, таких как расстройства аутистического спектра и расстройства настроения? Эпилепсия Поведение. 77, 106–113. doi: 10.1016/j.yebeh.2017.09.014
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Карст Х., Бергер С., Эрдманн Г., Шютц Г. и Джоэлс М. (2010). Метапластичность реакций миндалевидного тела на гормон стресса кортикостерон. Проц. Натл. акад. науч. США 107, 14449–14454. doi: 10.1073/pnas.0
Проц. Натл. акад. науч. США 107, 14449–14454. doi: 10.1073/pnas.0
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Карст Х., Бергер С., Турио М., Тронш Ф., Шульц Г. и Жоэлс М. (2005). Минералокортикоидные рецепторы незаменимы для негеномной модуляции кортикостероном передачи глутамата в гиппокампе. Проц. Натл. акад. науч. США 102, 19204–19207. doi: 10.1073/pnas.0507572102
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Karst, H., de Kloet, E.R., and Joëls, M. (1999). Эпизодическое лечение кортикостероном ускоряет эпилептогенез киндлинга и запускает долговременные изменения в клетках CA1 гиппокампа в полностью киндлингированном состоянии. евро. Дж. Нейроски. 11, 889–898. doi: 10.1046/j.1460-9568.1999.00495.x
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Каваками М., Сето К., Терасава Э., Ёсида К., Миямото Т., Секигучи М. и др. (1968). Влияние электростимуляции и повреждения лимбической структуры на биосинтез адренокортикоидов у кролика. Нейроэндокринология 3, 337–348. doi: 10.1159/000121722
Нейроэндокринология 3, 337–348. doi: 10.1159/000121722
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Келлнер М., Видеманн К., Яссуридис А., Левенгуд Р., Го Л. С., Холсбур Ф. и др. (2000). Поведенческий и эндокринный ответ на тетрапептид холецистокинина у пациентов с посттравматическим стрессовым расстройством. биол. Психиатрия 47, 107–111. doi: 10.1016/s0006-3223(99)00118-3
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Кендалл, EC (1953). Гормоны коры надпочечников в норме и при патологии. Проц. Являюсь. Филос. соц. 97, 8–11.
Google Scholar
Кесслер Р. К., Соннега А., Бромет Э., Хьюз М. и Нельсон С. Б. (1995). Посттравматическое стрессовое расстройство в национальном обзоре сопутствующих заболеваний. Арх. Общая психиатрия 52, 1048–1060. doi: 10.1001/archpsyc.1995.030066012
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
Ким Дж. Дж., Сонг Э. Ю. и Костен Т. А. (2006). Стрессовые эффекты в гиппокампе: синаптическая пластичность и память. Стресс 9, 1–11. doi: 10.1080/102538
Дж., Сонг Э. Ю. и Костен Т. А. (2006). Стрессовые эффекты в гиппокампе: синаптическая пластичность и память. Стресс 9, 1–11. doi: 10.1080/102538
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Китченер П., Ди Блази Ф., Боррелли Э. и Пьяцца П. В. (2004). Различия между структурами мозга в ядерной транслокации и связывании ДНК глюкокортикоидного рецептора во время стресса и циркадного цикла. Евро. Дж. Нейроски. 19, 1837–1846 гг. doi: 10.1111/j.1460-9568.2004.03267.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Коу А.С., Джонс Н.К., Зальцберг М.Р., Мерфи А.З. и Стейт Г. (2009). Стресс в молодости как влияние на лимбическую эпилепсию: гипотеза, время которой пришло? Фронт. Поведение Неврологи. 3:24. doi: 10.3389/neuro.08.024.2009
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Колхас Дж. М., Бартоломуччи А., Бувалда Б., де Бур С. Ф., Флюгге Г. , Корте С. М. и др. (2011). Еще раз о стрессе: критическая оценка концепции стресса. Неврологи. Биоповедение. 35, 1291–1301. doi: 10.1016/j.neubiorev.2011.02.003
, Корте С. М. и др. (2011). Еще раз о стрессе: критическая оценка концепции стресса. Неврологи. Биоповедение. 35, 1291–1301. doi: 10.1016/j.neubiorev.2011.02.003
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Колхас Дж. М., де Бур С. Ф., Коппенс К. М. и Бувалда Б. (2010). Нейроэндокринология стилей преодоления: к пониманию биологии индивидуальных вариаций. Фронт. Нейроэндокринол. 31, 307–321. doi: 10.1016/j.yfrne.2010.04.001
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Кришнан В., Хан М.-Х., Грэм Д. Л., Бертон О., Рентал В., Руссо С. Дж. и др. (2007). Молекулярные адаптации, лежащие в основе восприимчивости и сопротивления социальному поражению в областях вознаграждения мозга. Мобильный 131, 391–404. doi: 10.1016/j.cell.2007.09.018
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Кроенке К., Спитцер Р. Л., Уильямс Дж. Б. В., Монахан П. О. и Лёве Б. (2007). Тревожные расстройства в первичной медико-санитарной помощи: распространенность, нарушения, коморбидность и выявление. Энн. Стажер Мед. 146, 317–325. doi: 10.7326/0003-4819-146-5-200703060-00004
(2007). Тревожные расстройства в первичной медико-санитарной помощи: распространенность, нарушения, коморбидность и выявление. Энн. Стажер Мед. 146, 317–325. doi: 10.7326/0003-4819-146-5-200703060-00004
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Крюгерс Х. Дж., Арп Дж. М., Сюн Х., Канацу С., Лесуис С. Л., Короси А. и др. (2017). Невзгоды в раннем возрасте: долгосрочные последствия для эмоционального обучения. Нейробиол. Стресс 6, 14–21. doi: 10.1016/j.ynstr.2016.11.005
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Крюгерс Х., Карст Х. и Джоэлс М. (2012). Взаимодействие между норадреналином и кортикостероидами в головном мозге: от электрической активности до когнитивных функций. Фронт. Клетка. Неврологи. 6:15. doi: 10.3389/fncel.2012.00015
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Кумар Г., Купер А., Брайен Т.Дж.О., Зальцберг М.Р., Джонс Н. К., Рис С.М. и др. (2007). Ускорение эпилептогенеза возбуждения миндалевидного тела хроническим введением низких доз кортикостерона затрагивает как минералокортикоидные, так и глюкокортикоидные рецепторы. Психонейроэндокринология 32, 834–842. doi: 10.1016/j.psyneuen.2007.05.011
К., Рис С.М. и др. (2007). Ускорение эпилептогенеза возбуждения миндалевидного тела хроническим введением низких доз кортикостерона затрагивает как минералокортикоидные, так и глюкокортикоидные рецепторы. Психонейроэндокринология 32, 834–842. doi: 10.1016/j.psyneuen.2007.05.011
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Кветнанский Р., Саббан Э. Л. и Палковиц М. (2009). Катехоламинергические системы при стрессе: структурный и молекулярно-генетический подходы. Физиол. Ред. 89, 535–606. doi: 10.1152/physrev.00042.2006
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Ламмель С., Ион Д. И., Ропер Дж. и Маленко Р. К. (2011). Специфическая для проекции модуляция синапсов дофаминовых нейронов отталкивающими и вознаграждающими стимулами. Нейрон 70, 855–862. doi: 10.1016/j.neuron.2011.03.025
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Ламмель С., Лим Б. К. и Маленко Р. К. (2014). Вознаграждение и отвращение в гетерогенной дофаминовой системе среднего мозга. Нейрофармакология 76, 351–359. doi: 10.1016/j.neuropharm.2013.03.019
К. и Маленко Р. К. (2014). Вознаграждение и отвращение в гетерогенной дофаминовой системе среднего мозга. Нейрофармакология 76, 351–359. doi: 10.1016/j.neuropharm.2013.03.019
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Ламмель С., Лим Б.К., Ран С., Хуанг К.В., Бетли М.Дж., Тай К.М. и др. (2012). Специфический для входа контроль вознаграждения и отвращения в вентральной области покрышки. Природа 491, 212–217. doi: 10.1038/nature11527
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Лангер, С. З. (1980). Пресинаптическая регуляция выброса катехоламинов. Фармакол. Ред. 32, 337–362.
Реферат PubMed | Google Scholar
Лавиолетт С. Р. и Грейс А. А. (2006). Каннабиноиды усиливают пластичность эмоционального обучения в нейронах медиальной префронтальной коры через входы базолатеральной миндалевидного тела. J. Neurosci. 26, 6458–6468. doi: 10.1523/JNEUROSCI.0707-06.2006
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Леду, Дж. (2007). Миндалевидное тело. Курс. биол. 17, 868–874. doi: 10.1016/j.cub.2007.08.005
(2007). Миндалевидное тело. Курс. биол. 17, 868–874. doi: 10.1016/j.cub.2007.08.005
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Леду, Дж. (2012). Переосмысление эмоционального мозга. Нейрон 73, 653–676. doi: 10.1016/j.neuron.2012.02.004
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Лайтман, С.Л., и Конвей-Кэмпбелл, Б.Л. (2010). Решающая роль пульсирующей активности оси HPA для непрерывного динамического равновесия. Нац. Преподобный Нейроски. 11, 710–718. doi: 10.1038/nrn2914
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Линдауэр Р. Дж. Л., Олф М., ван Мейель Э. П. М., Карлье И. В. Э. и Герсонс Б. П. Р. (2006). Кортизол, обучение, память и внимание в связи с меньшим объемом гиппокампа у сотрудников полиции с посттравматическим стрессовым расстройством. биол. Психиатрия 59, 171–177. doi: 10.1016/j.biopsych.2005.06.033
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Linthorst, A. C., Flachskamm, C., Holsboer, F., and Reul, J.M. (1994). Местное введение рекомбинантного интерлейкина-1α человека в гиппокамп крыс увеличивает серотонинергическую нейротрансмиссию, активность гипоталамо-гипофизарно-адренокортикальной оси и температуру тела. Эндокринология 135, 520–532. doi: 10.1210/en.135.2.520
C., Flachskamm, C., Holsboer, F., and Reul, J.M. (1994). Местное введение рекомбинантного интерлейкина-1α человека в гиппокамп крыс увеличивает серотонинергическую нейротрансмиссию, активность гипоталамо-гипофизарно-адренокортикальной оси и температуру тела. Эндокринология 135, 520–532. doi: 10.1210/en.135.2.520
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
Липпманн М., Бресс А., Немерофф С. Б., Плотский П. М. и Монтеджиа Л. М. (2007). Долгосрочные поведенческие и молекулярные изменения, связанные с разлучением с матерью у крыс. евро. Дж. Нейроски. 25, 3091–3098. doi: 10.1111/j.1460-9568.2007.05522.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Лю Дж., Буисман-Пейлман Ф. и Хатчинсон М. Р. (2014). Толл-подобный рецептор 4: врожденный иммунный регулятор нейроиммунных и нейроэндокринных взаимодействий при стрессе и большом депрессивном расстройстве. Фронт. Неврологи. 8:309. doi: 10.3389/fnins. 2014.00309
2014.00309
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Лой, М., Корика, С., Лукассен, П. Дж., и Жоэлс, М. (2014). Влияние стресса в раннем возрасте на нейрогенез гиппокампа в зависимости от возраста и пола. Фронт. Эндокринол. 5:13. doi: 10.3389/fendo.2014.00013
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Лукассен, П. Дж., Нанинк, Э. Ф. Г., ван Гудовер, Дж. Б., Фитцсимонс, К., Джоэлс, М., и Короси, А. (2013). Перинатальное программирование структуры и функции гиппокампа взрослого человека; новые роли стресса, питания и эпигенетики. Тенденции нейробиологии. 36, 621–631. doi: 10.1016/j.tins.2013.08.002
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Лундберг, У. (2005). Гормоны стресса в здоровье и болезни: роль работы и пола. Психонейроэндокринология 30, 1017–1021. doi: 10.1016/j.psyneuen.2005.03.014
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Люпиен, С. (2015). История науки о стрессе: от Ганса Селье до открытия противовоспалительных препаратов. Санте Мент. Que. 40, 275–286. doi: 10.7202/1033056ar
(2015). История науки о стрессе: от Ганса Селье до открытия противовоспалительных препаратов. Санте Мент. Que. 40, 275–286. doi: 10.7202/1033056ar
PubMed Abstract | Полный текст CrossRef
Люпиен, С.Дж., Макьюэн, Б.С., Гуннар, М.Р., и Хейм, К. (2009). Влияние стресса на протяжении всей жизни на мозг, поведение и познание. Нац. Преподобный Нейроски. 10, 434–445. doi: 10.1038/nrn2639
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Мачадо, Б. Х. (2001). Нейротрансмиссия сердечно-сосудистых рефлексов в ядре одиночного пути бодрствующих крыс. Энн. НЮ акад. науч. 940, 179–196. doi: 10.1111/j.1749-6632.2001.tb03676.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Майер С.Ф. и Селигман М.Э.П. (2016). Выученная беспомощность в пятьдесят: выводы из неврологии. Психология. Ред. 123, 349–367. doi: 10.1037/rev0000033
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Манц Дж. , Тьерри А.М. и Гловински Дж. (1989). Влияние ядовитого ущемления хвоста на скорость разряда мезокортикальных и мезолимбических дофаминовых нейронов: избирательная активация мезокортикальной системы. Мозг Res. 476, 377–381. doi: 10.1016/0006-8993(89)-8
, Тьерри А.М. и Гловински Дж. (1989). Влияние ядовитого ущемления хвоста на скорость разряда мезокортикальных и мезолимбических дофаминовых нейронов: избирательная активация мезокортикальной системы. Мозг Res. 476, 377–381. doi: 10.1016/0006-8993(89)-8
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Мартин Э. И., Ресслер К. Дж., Биндер Э. и Немерофф С. Б. (2009). Нейробиология тревожных расстройств: визуализация мозга, генетика и психонейроэндокринология. Психиатр. клин. Север Ам. 32, 549–575. doi: 10.1016/j.psc.2009.05.004
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Мейсон Дж. В., Гиллер Э. Л., Костен Т. Р., Острофф Р. Б. и Подд Л. (1986). Уровни свободного кортизола в моче у пациентов с посттравматическим стрессовым расстройством. Дж. Нерв. Мент. Дис. 174, 145–149. doi: 10.1097/00005053-198603000-00003
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Мейсон Х. Л., Майерс К.С. и Кендалл Э.К. (1936). Химия кристаллических веществ, выделенных из надпочечников. Дж. Биол. хим. 114, 613–631.
Л., Майерс К.С. и Кендалл Э.К. (1936). Химия кристаллических веществ, выделенных из надпочечников. Дж. Биол. хим. 114, 613–631.
Google Scholar
Мацумото М. и Хикосака О. (2009). Два типа дофаминовых нейронов отчетливо передают положительные и отрицательные мотивационные сигналы. Природа 459, 837–841. doi: 10.1038/nature08028
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
McCall, J.G., Al-Hasani, R., Siuda, E.R., Hong, D.Y., Norris, A.J., Ford, C.P., et al. (2015). Задействование CRH норадренергической системы голубого пятна опосредует тревогу, вызванную стрессом. Нейрон 87, 605–620. doi: 10.1016/j.neuron.2015.07.002
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Макканн С. М. и Бробек Дж. Р. (1954). Доказательства роли супраоптико-гипофизарной системы в регуляции секреции адренокортикотропина. Проц. соц. Эксп. биол. Мед. 87, 318–324. doi: 10.3181/00379727-87-21368
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Маккорри, Л. К. (2007). Физиология вегетативной нервной системы. утра. Дж. Фарм. Образовательный 71:78. doi: 10.5688/aj710478
К. (2007). Физиология вегетативной нервной системы. утра. Дж. Фарм. Образовательный 71:78. doi: 10.5688/aj710478
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Mcdonald, A. J. (1998). Корковые пути к миндалевидному телу млекопитающих. Прог. Нейробиол. 55, 257–332. doi: 10.1016/s0301-0082(98)00003-3
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
McEwen, BS (2007). Физиология и нейробиология стресса и адаптации: центральная роль мозга. Физиол. Ред. 87, 873–904. doi: 10.1152/physrev.00041.2006
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Макьюэн, Б. С., Грей, Дж. Д., и Наска, К. (2015). 60 лет нейроэндокринологии: новое определение нейроэндокринологии: стресс, секс, когнитивная и эмоциональная регуляция. Дж. Эндокринол. 226, Т67–Т83. doi: 10.1530/joe-15-0121
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Макьюэн Б. С. и Карацореос И.Н. (2015). Депривация сна и нарушение циркадных ритмов: стресс, аллостаз и аллостатическая нагрузка. Сон Мед. клин. 10, 1–10. doi: 10.1016/j.jsmc.2014.11.007
С. и Карацореос И.Н. (2015). Депривация сна и нарушение циркадных ритмов: стресс, аллостаз и аллостатическая нагрузка. Сон Мед. клин. 10, 1–10. doi: 10.1016/j.jsmc.2014.11.007
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Макьюэн Б.С. и Магаринос А.М. (1997). Влияние стресса на морфологию и функцию гиппокампа. Энн. НЮ акад. науч. 821, 271–284. doi: 10.1111/j.1749-6632.1997.tb48286.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Макьюэн Б.С. и Стеллар Э. (1993). Стресс и личность: механизм, ведущий к болезни. Арх. Стажер Мед. 153, 2093–2101. doi: 10.1001/archinte.153.18.2093
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Макьюэн Б.С., Вайс Дж.М. и Шварц Л.С. (1968). Избирательное удержание кортикостерона лимбическими структурами мозга крыс. Природа 220, 911–912. doi: 10.1038/220911a0
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
МакГарри, Л. М., и Картер, А. Г. (2016). Тормозные входы базолатеральной миндалины в префронтальную кору. J. Neurosci. 36, 9391–9406. doi: 10.1523/jneurosci.0874-16.2016
М., и Картер, А. Г. (2016). Тормозные входы базолатеральной миндалины в префронтальную кору. J. Neurosci. 36, 9391–9406. doi: 10.1523/jneurosci.0874-16.2016
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Макгоуэн П.О., Сасаки А., Д’Алессио А.С., Дымов С., Лабонте Б., Шиф М. и др. (2009 г.). Эпигенетическая регуляция глюкокортикоидного рецептора в мозге человека связана с жестоким обращением в детстве. Нац. Неврологи. 12, 342–348. doi: 10.1038/nn.2270
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Мехта Д. и Биндер Э. Б. (2012). Ген × факторы уязвимости окружающей среды для посттравматического стрессового расстройства: ось HPA. Нейрофармакология 62, 654–662. doi: 10.1016/j.neuropharm.2011.03.009
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Милад, М. Р., и Квирк, Г. Дж. (2012). Исчезновение страха как модель трансляционной нейронауки: десять лет прогресса. год. Преподобный Психолог. 63, 129–151. doi: 10.1146/annurev.psych.121208.131631
год. Преподобный Психолог. 63, 129–151. doi: 10.1146/annurev.psych.121208.131631
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Митра Р. и Сапольски Р. М. (2008). Острой терапии кортикостероном достаточно, чтобы вызвать тревогу и гипертрофию миндалевидных дендритов. Проц. Натл. акад. науч. США 105, 5573–5578. doi: 10.1073/pnas.0705615105
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
Моллика Р.Ф., Макиннес К., Фам Т., Смит Фавзи М.С., Мерфи Э. и Лин Л. (1998). Взаимосвязь доза-эффект между пытками и психическими симптомами у вьетнамских бывших политических заключенных и группы сравнения. Дж. Нерв. Мент. Дис. 186, 543–553. doi: 10.1097/00005053-199809000-00005
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Морсинк, М. К., Жоэлс, М., Сарабджитсингх, А. Р., Мейер, О. К., де Клот, Э. Р., и Датсон, Н. А. (2006). Динамический паттерн транскрипционных ответов, опосредованных глюкокортикоидными рецепторами, в нейрональных клетках PC12. Дж. Нейрохим. 99, 1282–1298. doi: 10.1111/j.1471-4159.2006.04187.x
Дж. Нейрохим. 99, 1282–1298. doi: 10.1111/j.1471-4159.2006.04187.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Моше С., Шило М., Ходик Г., Ягев Ю., Блатт И., Корчин А. Д. и др. (2008). Возникновение судорог в связи со стрессом на работе у молодых мужчин-новобранцев. Эпилепсия 49, 1451–1456. doi: 10.1111/j.1528-1167.2008.01591.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Мухаммад А., Кэрролл К. и Колб Б. (2012). Стресс во время развития изменяет морфологию дендритов в прилежащем ядре и префронтальной коре. Неврология 216, 103–109. doi: 10.1016/j.neuroscience.2012.04.041
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Мусацци Л., Миланезе М., Фариселло П., Дзаппеттини С., Тардито Д., Барбьеро В. С. и др. (2010). Острый стресс увеличивает вызванное деполяризацией высвобождение глутамата в префронтальной/лобной коре крыс: демпфирующее действие антидепрессантов. PLoS One 5:e8566. doi: 10.1371/journal.pone.0008566
PLoS One 5:e8566. doi: 10.1371/journal.pone.0008566
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Майерс Б., Шейманн Дж. Р., Франко-Вильянуэва А. и Герман Дж. П. (2017). Восходящие механизмы интеграции стресса: последствия для регуляции ствола мозга нейроэндокринных и поведенческих реакций на стресс. Неврологи. Биоповедение. Ред. 74, 366–375. doi: 10.1016/j.neubiorev.2016.05.011
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Na, K.S., Chang, H.S., Won, E., Han, K.M., Choi, S., Tae, WS, et al. (2014). Связь между метилированием глюкокортикоидных рецепторов и субполями гиппокампа при большом депрессивном расстройстве. PLoS One 9:e85425. doi: 10.1371/journal.pone.0085425
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Набер П.А., Лопес да Силва Ф.Х. и Виттер М.П. (2001). Реципрокные связи между энторинальной корой и гиппокампальными полями СА1 и субикулюмом совпадают с проекциями СА1 на субикулюм. Гиппокамп 11, 99–104. doi: 10.1002/hipo.1028
Гиппокамп 11, 99–104. doi: 10.1002/hipo.1028
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Нахар, Дж., Рейнвилл, Дж. Р., Доханич, Г. П., и Таскер, Дж. Г. (2016). Еще одно доказательство мембранного рецептора, который связывает глюкокортикоиды в гипоталамусе грызунов. Стероиды 114, 33–40. doi: 10.1016/j.steroids.2016.05.013
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Наккен К.О., Солаас М.Х., Кьелдсен М.Дж., Фриис М.Л., Пеллок Дж.М. и Кори Л.А. (2005). О каких провоцирующих приступы факторах чаще всего сообщают пациенты с эпилепсией? Эпилепсия Поведение. 6, 85–89. doi: 10.1016/j.yebeh.2004.11.003
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Нек, Г. (2002). Пятидесятилетний опыт терапии кортизоном в изучении и лечении ревматоидного артрита. Энн. НЮ акад. науч. 966, 28–38. doi: 10.1111/j.1749-6632.2002.tb04199.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Nemeroff, CB (2016). Потерянный рай: нейробиологические и клинические последствия жестокого обращения с детьми и безнадзорности. Нейрон 89, 892–909. doi: 10.1016/j.neuron.2016.01.019
Потерянный рай: нейробиологические и клинические последствия жестокого обращения с детьми и безнадзорности. Нейрон 89, 892–909. doi: 10.1016/j.neuron.2016.01.019
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Немерофф, С. Б., Бремнер, Дж. Д., Фоа, Э. Б., Майберг, Х. С., Норт, К. С., и Штейн, М. Б. (2006). Посттравматическое стрессовое расстройство: современный обзор. J. Psychiatr. Рез. 40, 1–21. doi: 10.1016/j.jpsychires.2005.07.005
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Нестлер, Э. Дж. (2014). Эпигенетические механизмы депрессии. JAMA Psychiatry 71, 454–456. doi: 10.1001/jamapsychiatry.2013.4291
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Ногейра, М. Х., Ясуда, К. Л., Коан, А. К., Каннер, А. М., и Сендес, Ф. (2017). Сопутствующие расстройства настроения и тревожные расстройства связаны с фармакорезистентными приступами у пациентов с MTLE. Эпилепсия 58, 1268–1276. doi: 10.1111/epi.13781
Эпилепсия 58, 1268–1276. doi: 10.1111/epi.13781
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Но, С. Дж., Кан, Д.-В., Ю, С.Б., Ли, Дж. Ю., Ким, Дж. Ю., Ким, Б.-Т., и др. (2012). Стресс-зависимая регуляция прилежащего гипоталамического ядра может варьироваться в зависимости от стрессоров. Индийский Дж. Эксп. биол. 50, 447–454.
Реферат PubMed | Google Scholar
О’Коннор К. А., Джонсон Дж. Д., Хансен М. К., Визелер Франк Дж. Л., Максимова Э., Уоткинс Л. Р. и др. (2003). Периферический и центральный ответ провоспалительных цитокинов на тяжелый острый стрессор. Мозг Res. 991, 123–132. doi: 10.1016/j.brainres.2003.08.006
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Olijslagers, J. E., de Kloet, E. R., Elgersma, Y., Van Woerden, G. M., Joëls, M., and Karst, H. (2008). Быстрые изменения функции пирамидных клеток CA1 гиппокампа через пре- и постсинаптические мембранные минералокортикоидные рецепторы. Евро. Дж. Нейроски. 27, 2542–2550. doi: 10.1111/j.1460-9568.2008.06220.x
Евро. Дж. Нейроски. 27, 2542–2550. doi: 10.1111/j.1460-9568.2008.06220.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Отте К., Леночи М., Мецлер Т., Иегуда Р., Мармар С. Р. и Нейлан Т. С. (2007). Влияние метирапона на гипоталамо-гипофизарно-надпочечниковую ось и сон у женщин с посттравматическим стрессовым расстройством. биол. Психиатрия 61, 952–956. doi: 10.1016/j.biopsych.2006.08.018
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Пальма-Гудиэль, Х., Кордова-Паломера, А., Леза, Дж. К., и Фаньянас, Л. (2015). Процессы метилирования гена глюкокортикоидного рецептора (NR3C1) как медиаторы ранней неблагоприятной причинно-следственной связи, связанной со стрессом: критический обзор. Неврологи. Биоповедение. Ред. 55, 520–535. doi: 10.1016/j.neubiorev.2015.05.016
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Павлидес К., Огава С., Кимура А. и Макьюэн Б. С. (1996). Роль надпочечниковых стероидных минералокортикоидных и глюкокортикоидных рецепторов в долговременной потенциации в поле СА1 срезов гиппокампа. Мозг Res. 738, 229–235. doi: 10.1016/s0006-8993(96)00776-7
С. (1996). Роль надпочечниковых стероидных минералокортикоидных и глюкокортикоидных рецепторов в долговременной потенциации в поле СА1 срезов гиппокампа. Мозг Res. 738, 229–235. doi: 10.1016/s0006-8993(96)00776-7
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Павлидес, К., Ватанабе, Ю., и Макьюэн, Б.С. (1993). Влияние глюкокортикоидов на долговременную потенциацию гиппокампа. Гиппокамп 3, 183–192. doi: 10.1002/hipo.450030210
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Пеллетье, Дж. Г., Лихтик, Э., Филали, М., и Паре, Д. (2005). Длительное увеличение активности базолатеральной миндалины после эмоционального возбуждения: значение для облегчения консолидации эмоциональных воспоминаний. Учиться. Мем. 12, 96–102. doi: 10.1101/lm.88605
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Пенья, С. Дж., Кронман, Х. Г., Уокер, Д. М., Кейтс, Х. М., Багот, Р. К., Пурушотаман, И., и др. (2017). Стресс в раннем возрасте придает мышам пожизненную восприимчивость к стрессу через вентральную область покрышки OTX2. Наука 356, 1185–1188. doi: 10.1126/science.aan4491
К., Пурушотаман, И., и др. (2017). Стресс в раннем возрасте придает мышам пожизненную восприимчивость к стрессу через вентральную область покрышки OTX2. Наука 356, 1185–1188. doi: 10.1126/science.aan4491
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Пеццоне, М. А., Ли, В. С., Хоффман, Г. Е., Пеццоне, К. М., и Рабин, Б. С. (1993). Активация катехоламинергических нейронов ствола мозга условными и безусловными аверсивными стимулами по данным иммунореактивности c-Fos. Мозг Res. 608, 310–318. doi: 10.1016/0006-8993(93)-5
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Prewitt, CMF, and Herman, JP (1998). Анатомические взаимодействия между центральным миндалевидным ядром и паравентрикулярным ядром гипоталамуса крысы: анализ двойного тракта. J. Chem. Нейроанат. 15, 173–185. doi: 10.1016/s0891-0618(98)00045-3
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Pu, Z. , Krugers, HJ, and Joëls, M. (2007). Кортикостерон в зависимости от времени модулирует α-адренергические эффекты при долговременной потенциации в зубчатой извилине гиппокампа. Учиться. Мем. 14, 359–367. doi: 10.1101/lm.527207
, Krugers, HJ, and Joëls, M. (2007). Кортикостерон в зависимости от времени модулирует α-адренергические эффекты при долговременной потенциации в зубчатой извилине гиппокампа. Учиться. Мем. 14, 359–367. doi: 10.1101/lm.527207
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Пиноос Р.С., Гоенджян А., Ташджян М., Каракашян М., Манджикян Р., Манукян Г. и др. (1993). Посттравматические стрессовые реакции у детей после землетрясения в Армении 1988 г. Бр. Журнал психиатрии 163, 239–247. doi: 10.1192/bjp.163.2.239
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Рэдли, Дж. Дж. (2012). На пути к тормозной сети лимбической коры: последствия гипоталамо-гипофизарно-надпочечниковых реакций после хронического стресса. Фронт. Поведение Неврологи. 6:7. doi: 10.3389/fnbeh.2012.00007
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Рэдли, Дж. Дж., Ариас, К. М., и Савченко, П. Е. (2006). Региональная дифференциация медиальной префронтальной коры в регуляции адаптивных реакций на острый эмоциональный стресс. J. Neurosci. 26, 12967–12976. doi: 10.1523/jneurosci.4297-06.2006
Е. (2006). Региональная дифференциация медиальной префронтальной коры в регуляции адаптивных реакций на острый эмоциональный стресс. J. Neurosci. 26, 12967–12976. doi: 10.1523/jneurosci.4297-06.2006
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Рэдли Дж. Дж., Морилак Д., Виау В. и Кампо С. (2015). Хронический стресс и пластичность мозга: механизмы, лежащие в основе адаптивных и неадекватных изменений, и последствия для связанных со стрессом расстройств ЦНС. Неврологи. Биоповедение. Ред. 58, 79–91. doi: 10.1016/j.neubiorev.2015.06.018
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Райнер, Г. (2017). Вклад когнитивных сетей в депрессию при эпилепсии. Эпилепсия Curr. 17, 78–83. doi: 10.5698/1535-7511.17.2.78
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Репперт, С. М., и Уивер, Д. Р. (2002). Координация циркадных ритмов у млекопитающих. Природа 418, 935–941. doi: 10.1038/nature00965
doi: 10.1038/nature00965
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Реул, Дж. М., и де Клоет, Э. Р. (1985). Две рецепторные системы кортикостерона в мозге крыс: микрораспределение и дифференциальная оккупация. Эндокринология 117, 2505–2511. doi: 10.1210/endo-117-6-2505
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Реул, Дж. М., и де Клоет, Э. Р. (1986). Анатомическое разрешение двух типов участков рецепторов кортикостерона в мозге крыс с in vitro ауторадиография и компьютерный анализ изображений. J. Steroid Biochem. 24, 269–272. doi: 10.1016/0022-4731(86)
-4
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Рейес Б.А.С., Валентино Р.Дж., Сюй Г. и Ван Бокстале Э.Дж. (2005). Гипоталамические проекции на нейроны голубого пятна в головном мозге крысы. евро. Дж. Нейроски. 22, 93–106. doi: 10.1111/j.1460-9568.2005.04197.x
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Рейес Б. А.С., Зитник Г., Фостер К., Ван Бокстале Э.Дж. и Валентино Р.Дж. (2015). Социальный стресс задействует нейрохимически различные афференты к голубому пятну крысы в зависимости от стратегии выживания. eNeuro 2:ENEURO.0042-15.2015. doi: 10.1523/eneuro.0042-15.2015
А.С., Зитник Г., Фостер К., Ван Бокстале Э.Дж. и Валентино Р.Дж. (2015). Социальный стресс задействует нейрохимически различные афференты к голубому пятну крысы в зависимости от стратегии выживания. eNeuro 2:ENEURO.0042-15.2015. doi: 10.1523/eneuro.0042-15.2015
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Риддеринхоф, К.Р., Ульспергер, М., Кроун, Э.А., и Ньювенхейс, С. (2004). Роль медиальной лобной коры в когнитивном контроле. Наука 306, 443–447. doi: 10.1126/science.1100301
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Риттер С., Уоттс А. Г., Дин Т. Т., Санчес-Уоттс Г. и Педроу К. (2003). Иммунотоксинное поражение гипоталамически проецирующих норадреналиновых и адреналиновых нейронов по-разному влияет на циркадную и стимулированную стрессором секрецию кортикостерона. Эндокринология 144, 1357–1367. doi: 10.1210/en.2002-221076
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Роледер, Н. , и Карл, А. (2006). Роль эндокринных и воспалительных изменений в коморбидных соматических заболеваниях посттравматического стрессового расстройства. Минерва Эндокринол. 31, 273–288.
, и Карл, А. (2006). Роль эндокринных и воспалительных изменений в коморбидных соматических заболеваниях посттравматического стрессового расстройства. Минерва Эндокринол. 31, 273–288.
Реферат PubMed | Google Scholar
Розендал Б., Эрнандес А., Кабрера С. М., Хагевуд Р., Мальваез М., Стефанко Д. П. и др. (2010). Связанная с мембраной глюкокортикоидная активность необходима для модуляции долговременной памяти посредством модификации хроматина. J. Neurosci. 30, 5037–5046. doi: 10.1523/JNEUROSCI.5717-09.2010
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Розендаль Б., Макьюэн Б. С. и Чаттарджи С. (2009). Стресс, память и миндалевидное тело. Нац. Преподобный Нейроски. 10, 423–433. doi: 10.1038/nrn2651
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Руис Дж. Э., Барбоза Нето Дж., Шодль А. Ф. и Мелло М. Ф. (2007). Psiconeuroendocrinologia do transtorno de estresse pós-traumatico. Rev. Бюстгальтеры. Псикиатр. 29, с7–с12. doi: 10.1590/s1516-44462007000500003
Rev. Бюстгальтеры. Псикиатр. 29, с7–с12. doi: 10.1590/s1516-44462007000500003
Полный текст CrossRef
Russo, SJ, and Nestler, EJ (2013). Схема вознаграждения мозга при расстройствах настроения. Нац. Преподобный Нейроски. 14, 609–625. doi: 10.1038/nrn3381
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Сайто Х., Каба Х., Сато Т., Хонмура А., Каваками Т., Сето К. и др. (1989). Влияние электрической стимуляции лимбической структуры на адренокортикальный стероидогенез у гипофизктомированных крыс. Экспл. клин. Эндроцинол. 94, 387–390. doi: 10.1055/s-0029-1210926
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Salzberg, M., Kumar, G., Supit, L., Jones, N.C., Morris, M.J., Rees, S., et al. (2007). Ранний постнатальный стресс придает стойкую уязвимость к лимбическому эпилептогенезу. Эпилепсия 48, 2079–2085. doi: 10.1111/j.1528-1167.2007.01246.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Санчес, М. М., Лэдд, К. О., и Плотский, П. М. (2001). Ранний неблагоприятный опыт как фактор риска развития более поздней психопатологии: данные моделей на грызунах и приматах. Дев. Психопат. 13, 419–449. doi: 10.1017/s003029
М., Лэдд, К. О., и Плотский, П. М. (2001). Ранний неблагоприятный опыт как фактор риска развития более поздней психопатологии: данные моделей на грызунах и приматах. Дев. Психопат. 13, 419–449. doi: 10.1017/s003029
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Saper, CB, and Stornetta, RL (2015). «Центральная вегетативная система», в Нервная система крыс , изд. Г. Паксинос, 4-е изд. (Амстердам: Эльзевир), 629–673.
Google Scholar
Сапольски, Р. М. (2000a). Глюкокортикоиды и атрофия гиппокампа при нервно-психических расстройствах. Арх. Общая психиатрия 57, 925–935. doi: 10.1001/archpsyc.57.10.925
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Сапольски, Р. М. (2000b). Возможность нейротоксичности в гиппокампе при большой депрессии: учебник по гибели нейронов. биол. Психиатрия 48, 755–765. doi: 10.1016/s0006-3223(00)00971-9
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Сапольски Р. М., Крей Л. К. и Макьюэн Б. С. (1985). Длительное воздействие глюкокортикоидов снижает количество нейронов гиппокампа: последствия для старения. J. Neurosci. 5, 1222–1227. doi: 10.1523/jneurosci.05-05-01222.1985
М., Крей Л. К. и Макьюэн Б. С. (1985). Длительное воздействие глюкокортикоидов снижает количество нейронов гиппокампа: последствия для старения. J. Neurosci. 5, 1222–1227. doi: 10.1523/jneurosci.05-05-01222.1985
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Сапольски, Р. М., и Мини, М. Дж. (1986). Созревание адренокортикальной реакции на стресс: механизмы нейроэндокринной регуляции и стресс-гипореактивный период. Мозг Res. 396, 64–76. doi: 10.1016/0165-0173(86)-x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Сапольски Р. и Пульсинелли В. (1985). Глюкокортикоиды потенцируют ишемическое повреждение нейронов: терапевтические последствия. Наука 229, 1397–1400. doi: 10.1126/science.4035356
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Сапольски, Р. М., Ромеро, Л. М., и Мунк, А. У. (2000). Как глюкокортикоиды влияют на стрессовые реакции? Интеграция разрешающих, подавляющих, стимулирующих и подготовительных действий. Эндокр. Ред. 21, 55–89. doi: 10.1210/edrv.21.1.0389
Эндокр. Ред. 21, 55–89. doi: 10.1210/edrv.21.1.0389
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Савену, Р. В., и Немерофф, К. Б. (2012). Этиология депрессии: генетические и экологические факторы. Психиатр. клин. Север Ам. 35, 51–71. doi: 10.1016/j.psc.2011.12.001
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Савченко П. Е., Браун Э. Р., Чан Р. К., Эрикссон А., Ли Х. Ю., Роланд Б. Л. и др. (1996). Паравентрикулярное ядро гипоталамуса и функциональная нейроанатомия висцеромоторных реакций на стресс. Прог. Мозг Res. 107, 201–222. doi: 10.1016/s0079-6123(08)61866-x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Савченко П.Е., Имаки Т. и Вейл В. (1992). Совместная локализация нейроактивных веществ в эндокринном гипоталамусе. Сиба найден. Симп. 168, 16–30.
Реферат PubMed | Google Scholar
Schnyder, U., Moergeli, H., Klaghofer, R. , and Buddeberg, C. (2001). Частота и прогнозирование симптомов посттравматического стрессового расстройства у пострадавших с тяжелыми травмами. утра. Журнал психиатрии 158, 594–599. doi: 10.1176/appi.ajp.158.4.594
, and Buddeberg, C. (2001). Частота и прогнозирование симптомов посттравматического стрессового расстройства у пострадавших с тяжелыми травмами. утра. Журнал психиатрии 158, 594–599. doi: 10.1176/appi.ajp.158.4.594
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Щулкин, Дж. (2003). Аллостаз: нейронная поведенческая перспектива. Горм. Поведение 43, 21–27. doi: 10.1016/s0018-506x(02)00035-1
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Schulkin, J., Gold, P.W., и McEwen, B.S. (1998). Индукция экспрессии гена кортикотропин-высвобождающего гормона глюкокортикоидами: значение для понимания состояний страха и тревоги и аллостатической нагрузки. Психонейроэндокринология 23, 219–243. doi: 10.1016/s0306-4530(97)00099-1
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Щулкин Дж., Макьюэн Б.С. и Голд П.В. (1994). Аллостаз, миндалевидное тело и тревога ожидания. Неврологи. Биоповедение. Ред. 18, 385–396. doi: 10.1016/0149-7634(94)
Неврологи. Биоповедение. Ред. 18, 385–396. doi: 10.1016/0149-7634(94)
-5
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Сегги, Дж. (1987). Дифференциальная реакция кортикостерона и пролактина на стресс после поражения перегородки или миндалины: последствия для психонейроэндокринологии. Прогр. Нейропсихофармакол. биол. Психиатрия 11, 315–324. doi: 10.1016/0278-5846(87)-5
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Селье, Х. (1936). Синдром, вызванный различными вредоносными агентами. Природа 138:32. doi: 10.1038/138032a0
CrossRef Полный текст | Google Scholar
Селье, Х. (1950). Стресс и общий адаптационный синдром. Бр. Мед. Дж. 1, 1383–1392.
Реферат PubMed | Академия Google
Селье, Х. (1976). Концепция стресса. Кан. Мед. доц. Дж. 115:718.
Реферат PubMed | Google Scholar
Сенст Л. и Бейнс Дж. (2014). Нейромодуляторы, стресс и пластичность: роль передачи сигналов эндоканнабиноидов. Дж. Экспл. биол. 217, 102–108. doi: 10.1242/jeb.089730
Дж. Экспл. биол. 217, 102–108. doi: 10.1242/jeb.089730
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Шор, Дж. Х., Татум, Э. Л., и Фоллмер, В. М. (1986). Психиатрические реакции на катастрофу: опыт на горе Сент-Хеленс. утра. Журнал психиатрии 143, 590–595. doi: 10.1176/ajp.143.5.590
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Симпсон Дж. Б. и Руттенберг А. (1975). Поражения субфорникальных органов уменьшают внутривенное употребление алкоголя, вызванного ангиотензином. Мозг Res. 88, 154–161. doi: 10.1016/0006-8993(75)
-8
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Сколуда Н., Стралер Дж., Шлотц В., Нидербергер Л., Маркес С., Фишер С. и др. (2015). Внутрииндивидуальные психологические и физиологические реакции на острые лабораторные стрессоры различной интенсивности. Психонейроэндокринология 51, 227–236. doi: 10.1016/j.psyneuen.2014. 10.002
10.002
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Смарт К., Стратди Г., Уотсон С., Мургатройд К. и Макаллистер-Уильямс Р. Х. (2015). Ранняя травма, депрессия и ген глюкокортикоидного рецептора — эпигенетическая перспектива. Психология. Мед. 45, 3393–3410. doi: 10.1017/s00332
001555
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Smith, M.A., Davidson, J., Ritchie, J.C., Kudler, H., Lipper, S., Chappell, P., et al. (1989). Тест на кортикотропин-рилизинг-гормон у пациентов с посттравматическим стрессовым расстройством. биол. Психиатрия 26, 349–355. doi: 10.1016/0006-3223(89)-4
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Смит, С. М., и Вейл, В. В. (2006). Роль гипоталамо-гипофизарно-надпочечниковой оси в нейроэндокринных реакциях на стресс. Диалоги Клин. Неврологи. 8, 383–395.
Реферат PubMed | Google Scholar
Смотерман В. П., Берт Г., Кимбл Д. П., Стрикрод Г., БреМиллер Р. и Левин С. (1981). Поведенческие и кортикостероновые эффекты при условном отвращении к вкусу после поражения гиппокампа. Физиол. Поведение 27, 569–574. doi: 10.1016/0031-9384(81)
П., Берт Г., Кимбл Д. П., Стрикрод Г., БреМиллер Р. и Левин С. (1981). Поведенческие и кортикостероновые эффекты при условном отвращении к вкусу после поражения гиппокампа. Физиол. Поведение 27, 569–574. doi: 10.1016/0031-9384(81)
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Сноу Б. Р., Стеллман Дж. М., Стеллман С. Д. и Соммер Дж. Ф. мл. (19 лет)88). Посттравматическое стрессовое расстройство у американских легионеров в связи с боевым опытом во Вьетнаме: сопутствующие и способствующие факторы. Окружающая среда. Рез. 47, 175–192. doi: 10.1016/s0013-9351(88)80040-9
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Снайдер К., Ван В. В., Хан Р., Макфадден К. и Валентино Р. Дж. (2012). Высвобождающий кортикотропин фактор в ядре норадреналина, голубом пятне, способствует поведенческой гибкости. Нейропсихофармакология 37, 520–530. doi: 10.1038/npp.2011.218
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Саутвик С. М., Бремнер Дж. Д., Расмуссон А., Морган С. А. III., Арнстен А. и Чарни Д. С. (1999). Роль норадреналина в патофизиологии и лечении посттравматического стрессового расстройства. биол. Психиатрия 46, 1192–1204. doi: 10.1016/s0006-3223(99)00219-x
М., Бремнер Дж. Д., Расмуссон А., Морган С. А. III., Арнстен А. и Чарни Д. С. (1999). Роль норадреналина в патофизиологии и лечении посттравматического стрессового расстройства. биол. Психиатрия 46, 1192–1204. doi: 10.1016/s0006-3223(99)00219-x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Спектор С., Калл К. и Гольдштейн Л. Х. (2000). Ускорители припадков и предполагаемый самоконтроль припадков у взрослых с плохо контролируемой эпилепсией. Рез. эпилепсии. 38, 207–216. doi: 10.1016/s0920-1211(99)00093-5
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Сперлинг М. Р., Шиллинг К. А., Глоссер Д., Трейси Дж. И. и Асади-Пуйя А. А. (2008). Самовосприятие факторов, провоцирующих припадки, и их связь с уровнем тревоги, депрессией и локусом контроля здоровья при эпилепсии. Изъятие 17, 302–307. doi: 10.1016/j.seizure.2007.09.003
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Спига Ф. , Завала Э., Уокер Дж. Дж., Чжао З., Терри Дж. Р. и Лайтман С. Л. (2017). Динамические ответы стероидогенной регуляторной сети надпочечников. Проц. Натл. акад. науч. США 114, E6466–E6474. doi: 10.1073/pnas.1703779114
, Завала Э., Уокер Дж. Дж., Чжао З., Терри Дж. Р. и Лайтман С. Л. (2017). Динамические ответы стероидогенной регуляторной сети надпочечников. Проц. Натл. акад. науч. США 114, E6466–E6474. doi: 10.1073/pnas.1703779114
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Степто А., Хамер М. и Чида Ю. (2007). Влияние острого психологического стресса на циркулирующие воспалительные факторы у человека: обзор и метаанализ. Поведение мозга. Иммун. 21, 901–912. doi: 10.1016/j.bbi.2007.03.011
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Стерлинг П. и Эйер Дж. (1988). Аллостаз Новая парадигма для объяснения патологии возбуждения. Справочник по познанию жизненного стресса и здоровью. Оксфорд: Издательство Оксфордского университета.
Стивенсон, М., Сеги-Гомес, М., Лескойер, И., Ди Скала, К., и Макдональд-Смит, Г. (2001). Обзор оценки тяжести травмы и новой оценки тяжести травмы. ИнДж. Пред. 7, 10–13. doi: 10.1136/ip.7.1.10
7, 10–13. doi: 10.1136/ip.7.1.10
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Стюарт М. Г., Дэвис Х. А., Санди К., Краев И. В., Рогачевский В. В., Педди С. Дж. и др. (2005). Стресс подавляет, а обучение вызывает пластичность в СА3 гиппокампа крысы: трехмерное ультраструктурное исследование колючих наростов и их постсинаптической плотности. Неврология 131, 43–54. doi: 10.1016/j.neuroscience.2004.10.031
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
Стубер, Г. Д., Спарта, Д. Р., Стаматакис, А. М., ван Леувен, В. А., Харджопрайтно, Дж. Э., Чо, С., и др. (2011). Передача возбуждения от миндалевидного тела к прилежащему ядру способствует поиску вознаграждения. Природа 475, 377–380. doi: 10.1038/nature10194
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Салливан, Р. М., и Граттон, А. (1999). Латеральные эффекты поражений медиальной префронтальной коры на нейроэндокринные и вегетативные реакции на стресс у крыс. J. Neurosci. 19, 2834–2840. doi: 10.1523/JNEUROSCI.19-07-02834.1999
J. Neurosci. 19, 2834–2840. doi: 10.1523/JNEUROSCI.19-07-02834.1999
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Салливан, Р. М., и Граттон, А. (2002). Поведенческие эффекты эксайтотоксических поражений вентральной медиальной префронтальной коры у крыс зависят от полушария. Мозг Res. 927, 69–79. doi: 10.1016/s0006-8993(01)03328-5
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Сунь С., Ян С., Мао Ю., Цзя С. и Чжан З. (2015). Снижение уровня холестерина связано с депрессивно-подобным поведением у крыс посредством модуляции мозга 5-HT1 Рецептор . Здоровье липидов Дис. 14:22. doi: 10.1186/s12944-015-0020-7
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Саткер П. Б., Аллен А. Н. и Уинстед Д. К. (1993). Психопатология и психиатрические диагнозы военнопленных и участников боевых действий Тихоокеанского театра Второй мировой войны. утра. Журнал психиатрии 150, 240–245. doi: 10.1176/ajp.150.2.240
Журнал психиатрии 150, 240–245. doi: 10.1176/ajp.150.2.240
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Суонсон, Л.В., и Хартман, Б.К. (1975). Центральная адренергическая система. Иммунофлуоресцентное исследование расположения клеточных тел и их эфферентных связей у крыс с использованием дофамин-α-гидроксилазы в качестве маркера. Дж. Комп. Нейрол. 163, 467–505. doi: 10.1002/cne.0406
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Шварц Дж. Р., Кнодт А. Р., Радтке С. Р. и Харири А. Р. (2015). Нейронный биомаркер психологической уязвимости к стрессу в будущей жизни. Нейрон 85, 505–511. doi: 10.1016/j.neuron.2014.12.055
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Swinkels, WAM, Engelsman, M., Kasteleijn-Nolst Trenite, DGA, Baal, M.G., de Haan, GJ, and Oosting, J. (1998). Влияние эвакуации в феврале 1995 г. в Нидерландах на частоту приступов у пациентов с эпилепсией: контролируемое исследование. Эпилепсия 39, 1203–1207. doi: 10.1111/j.1528-1157.1998.tb01312.x
Эпилепсия 39, 1203–1207. doi: 10.1111/j.1528-1157.1998.tb01312.x
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Такахаши, А., Фланиган, М.Е., Макьюэн, Б.С., и Руссо, С.Дж. (2018). Агрессия, социальный стресс и иммунная система у людей и животных моделей. Фронт. Поведение Неврологи. 12:56. doi: 10.3389/fnbeh.2018.00056
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Тан, К. Р., Ивон, К., Турио, М., Мирзабеков, Дж. Дж., Денер, Дж., Лабуэб, Г., и др. (2012). ГАМК-нейроны ВОП вызывают условное отвращение к месту. Нейрон 73, 1173–1183. doi: 10.1016/j.neuron.2012.02.015
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
Танк, А. В., и Ли Вонг, Д. (2015). Периферические и центральные эффекты циркулирующих катехоламинов. Компр. Физиол. 5, 1–15. doi: 10.1002/cphy.c140007
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Timmermans, W. , Xiong, H., Hoogenraad, C.C., and Krugers, HJ (2013). Стрессовые и возбуждающие синапсы: от здоровья к болезни. Неврология 248, 626–636. doi: 10.1016/j.neuroscience.2013.05.043
, Xiong, H., Hoogenraad, C.C., and Krugers, HJ (2013). Стрессовые и возбуждающие синапсы: от здоровья к болезни. Неврология 248, 626–636. doi: 10.1016/j.neuroscience.2013.05.043
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
Тотола, Л. Т., Такакура, А. С., Оливейра, Дж. А., Гарсия-Кайраско, Н., и Морейра, Т. С. (2017). Нарушение центрального дыхательного хеморефлекса в экспериментальной генетической модели эпилепсии. J. Physiol. 595, 983–999. doi: 10.1113/JP272822
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Tsai, H.-C., Zhang, F., Adamantidis, A., Stuber, G.D., Bonci, A., de Lecea, L., et al. (2009). Фазового возбуждения дофаминергических нейронов достаточно для поведенческого обусловливания. Наука 324, 1080–1084. doi: 10.1126/science.1168878
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Цанкова Н. М., Бертон О., Рентал В., Кумар А., Неве Р. Л. и Нестлер Э. Дж. (2006). Устойчивая регуляция хроматина гиппокампа в мышиной модели депрессии и действия антидепрессантов. Нац. Неврологи. 9, 519–525. doi: 10.1038/nn1659
и Нестлер Э. Дж. (2006). Устойчивая регуляция хроматина гиппокампа в мышиной модели депрессии и действия антидепрессантов. Нац. Неврологи. 9, 519–525. doi: 10.1038/nn1659
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Tynan, R.J., Naicker, S., Hinwood, M., Nalivaiko, E., Buller, K.M., Pow, D.V., et al. (2010). Хронический стресс изменяет плотность и морфологию микроглии в подмножестве чувствительных к стрессу областей мозга. Поведение мозга. Иммун. 24, 1058–1068. doi: 10.1016/j.bbi.2010.02.001
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Ульрих-Лай, Ю. М., и Герман, Дж. П. (2009). Нервная регуляция эндокринных и вегетативных реакций на стресс. Нац. Преподобный Нейроски. 10, 397–409. doi: 10.1038/nrn2647
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Умеока Э. Х., Гарсия С. Б., Антунес-Родригес Дж., Элиас Л. Л. и Гарсия-Кайраско Н. (2011). Функциональная характеристика гипоталамо-гипофизарно-надпочечниковой оси линии аудиогенных крыс Wistar (WAR). Мозг Res. 1381, 141–147. doi: 10.1016/j.brainres.2011.01.042
Мозг Res. 1381, 141–147. doi: 10.1016/j.brainres.2011.01.042
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Вейл В., Ривье К., Ян Л., Миник С. и Гийемин Р. (1978). Влияние очищенного гипоталамического фактора, высвобождающего кортикотропин, и других веществ на секрецию адренокортикотропина и α-эндорфиноподобную иммуноактивность in vitro . Эндокринология 103, 1910–1915. doi: 10.1210/endo-103-5-1910
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Вейл, В., Списс, Дж., Ривьер, К., и Ривье, Дж. (1981). Характеристика овечьего гипоталамического пептида, состоящего из 41 остатка, который стимулирует секрецию кортикотропина и α-эндорфина. Наука 213, 1394–1397. doi: 10.1126/science.6267699
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Валентино Р. Дж., Мизелис Р. Р. и Павкович Л. А. (1999). Мостовая регуляция тазовых органов: фармакологическая мишень для тазовых висцеральных дисфункций. Trends Pharmacol. науч. 20, 253–260. doi: 10.1016/s0165-6147(99)01332-2
Trends Pharmacol. науч. 20, 253–260. doi: 10.1016/s0165-6147(99)01332-2
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Валентино, Р. Дж., Пейдж, М. Э., и Кертис, А. Л. (1991). Активация норадренергических нейронов голубого пятна гемодинамическим стрессом обусловлена локальным высвобождением фактора, высвобождающего кортикотропин. Мозг Res. 555, 25–34. doi: 10.1016/0006-8993(91)-p
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Валентино Р. Дж., Пейдж М., Ван Бокстале Э. и Астон-Джонс Г. (1992). Иннервация кортикотропин-рилизинг-фактора области голубого пятна: распределение волокон и источники входа. Неврология 48, 689–705. doi: 10.1016/0306-4522(92)
-uPubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Валентино Р. Дж., Рейес Б., Ван Бокстале Э. и Бангассер Д. (2012). Молекулярные и клеточные половые различия на пересечении стресса и возбуждения. Нейрофармакология 62, 13–20. doi: 10.1016/j.neuropharm.2011.06.004
Нейрофармакология 62, 13–20. doi: 10.1016/j.neuropharm.2011.06.004
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
Валентино Р. Дж., Шэн К., Ян З. и Астон-Джонс Г. (1996). Доказательства расходящихся проекций на норадренергическую систему головного мозга и парасимпатическую систему позвоночника из ядра Баррингтона. Мозг Res. 732, 1–15. doi: 10.1016/0006-8993(96)00482-9
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Валентино, Р. Дж., и Ван Бокстале, Э. (2008). Конвергентная регуляция активности голубого пятна как адаптивный ответ на стресс. Евро. Дж. Фармакол. 583, 194–203. doi: 10.1016/j.ejphar.2007.11.062
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Van Bockstaele, EJ, Colago, EE, and Valentino, RJ (1998). Высвобождающий кортикотропин амигдалоидный фактор нацелен на дендриты голубого пятна: субстрат для координации эмоциональных и когнитивных составляющих реакции на стресс. J. Нейроэндокринол. 10, 743–757. doi: 10.1046/j.1365-2826.1998.00254.x
J. Нейроэндокринол. 10, 743–757. doi: 10.1046/j.1365-2826.1998.00254.x
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Ван Бокстале, Э. Дж., Пиплс, Дж., и Валентино, Р. Дж. (1999). Анатомические основы дифференциальной регуляции ростролатеральной области пери-голубого пятна лимбическими афферентами. биол. Психиатрия 46, 1352–1363. doi: 10.1016/s0006-3223(99)00213-9
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
ван Кампен, Дж. С., Янсен, Ф. Э., де Граан, П. Н., Браун, К. П., и Жоэльс, М. (2014). Стресс в раннем возрасте при эпилепсии: провоцирующий приступ и фактор риска эпилептогенеза. Эпилепсия Поведение. 38, 160–171. doi: 10.1016/j.yebeh.2013.09.029
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
ван Кампен, Дж. С., Янсен, Ф. Е., Стейнбуш, Л. К., Джоэлс, М., и Браун, К. П. Дж. (2012). Стрессовая чувствительность детской эпилепсии связана с пережитыми негативными жизненными событиями. Эпилепсия 53, 1554–1562. doi: 10.1111/j.1528-1167.2012.03566.x
Эпилепсия 53, 1554–1562. doi: 10.1111/j.1528-1167.2012.03566.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Verkuyl, JM, Karst, H., and Joëls, M. (2005). ГАМКергическая передача в паравентрикулярном ядре гипоталамуса крысы подавляется кортикостероном и стрессом. Евро. Дж. Нейроски. 21, 113–121. doi: 10.1111/j.1460-9568.2004.03846.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Виалоу В., Багот Р. К., Кэхилл М. Э., Фергюсон Д., Робисон А. Дж., Дитц Д. М. и др. (2014). Цепь префронтальной коры для поведения, связанного с депрессией и тревогой, опосредованного холецистокинином: роль FosB. J. Neurosci. 34, 3878–3887. doi: 10.1523/JNEUROSCI.1787-13.2014
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Виткович, Л., Консман, Дж. П., Бокарт, Дж., Данцер, Р., Хомбургер, В., и Жак, К. (2000). Сигналы цитокинов распространяются через мозг. Мол. Психиатрия 5, 604–615. doi: 10.1038/sj.mp.4000813
doi: 10.1038/sj.mp.4000813
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Вьяс А., Митра Р., Шанкаранараяна Рао Б. С. и Чаттарджи С. (2002). Хронический стресс индуцирует контрастные паттерны ремоделирования дендритов в нейронах гиппокампа и миндалевидного тела. J. Neurosci. 22, 6810–6818. doi: 10.1523/JNEUROSCI.22-15-06810.2002
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Вьяс А., Пиллаи А. Г. и Чаттарджи С. (2004). Восстановление после хронического стресса не может обратить вспять гипертрофию нейронов миндалевидного тела и усиление тревожного поведения. Неврология 128, 667–673. doi: 10.1016/j.neuroscience.2004.07.013
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Уолш, Р. (2011). Образ жизни и психическое здоровье. утра. Психол. 66, 579–592. doi: 10.1037/a0021769
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Wang, CC, and Wang, SJ (2009). Модуляция пресинаптических глюкокортикоидных рецепторов при высвобождении глутамата из нервных окончаний гиппокампа крысы. Синапс 63, 745–751. doi: 10.1002/syn.20654
Модуляция пресинаптических глюкокортикоидных рецепторов при высвобождении глутамата из нервных окончаний гиппокампа крысы. Синапс 63, 745–751. doi: 10.1002/syn.20654
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Weaver, I.C.G., Cervoni, N., Champagne, F.A., D’Alessio, A.C., Sharma, S., Seckl, J.R., et al. (2004). Эпигенетическое программирование материнским поведением. Нац. Неврологи. 7, 847–854. doi: 10.1038/nn1276
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Вэй Дж., Чжун П., Цинь Л., Тан Т. и Ян З. (2017). Хемикогенетическое восстановление префронтальной коры до пути миндалевидного тела улучшает дефицит, вызванный стрессом. Церебр. Кортекс 28, 1980–1990 гг. doi: 10.1093/cercor/bhx104
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Вейкум, Э. Р., Кнузель, М. Т., Ортлунд, Э. А., и Ямамото, К. Р. (2017). Глюкокортикоидный рецептор контролирует транскрипцию: точность и пластичность посредством аллостерии. Нац. Преподобный Мол. Клеточная биол. 18, 159–174. doi: 10.1038/nrm.2016.152
Нац. Преподобный Мол. Клеточная биол. 18, 159–174. doi: 10.1038/nrm.2016.152
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Уэлш Д.К., Логотетис Д.Е., Мейстер М. и Репперт С.М. (1995). Отдельные нейроны, диссоциированные от супрахиазматического ядра крысы, экспрессируют независимо фазированные циркадные ритмы возбуждения. Нейрон 14, 697–706. doi: 10.1016/0896-6273(95)
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Весса М., Роледер Н., Киршбаум К. и Флор Х. (2006). Измененная реакция пробуждения кортизола при посттравматическом стрессовом расстройстве. Психонейроэндокринология 31, 209–215. doi: 10.1016/j.psyneuen.2005.06.010
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Widom, C.S., DuMont, K., and Czaja, SJ (2007). Проспективное исследование большого депрессивного расстройства и сопутствующей патологии у детей, подвергшихся насилию и безнадзорности, выросших. Арх. Общая психиатрия 64, 49–56. doi: 10.1001/archpsyc.64.1.49
Арх. Общая психиатрия 64, 49–56. doi: 10.1001/archpsyc.64.1.49
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Уилкер С. и Коласса И. Т. (2012). Генетические влияния на посттравматическое стрессовое расстройство (ПТСР): вдохновение из подхода, ориентированного на память. Психиатр. Дунай. 24, 278–279.
Реферат PubMed | Google Scholar
Уилкинсон М. Б., Сяо Г., Кумар А., Лаплант К., Рентал В., Сикдер Д. и др. (2009). Лечение имипрамином и устойчивость демонстрируют сходную регуляцию хроматина в прилежащем ядре мыши в моделях депрессии. J. Neurosci. 29, 7820–7832. doi: 10.1523/JNEUROSCI.0932-09.2009
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Вилнер П., Шил-Крюгер Дж. и Белзунг К. (2013). Нейробиология депрессии и действие антидепрессантов. Неврологи. Биоповедение. Ред. 37, 2331–2371. doi: 10.1016/j.neubiorev.2012.12.007
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Виттер, член парламента (2007). Перфорантный путь: проекции от энторинальной коры до зубчатой извилины. Прог. Мозг Res. 163, 43–61. doi: 10.1016/s0079-6123(07)63003-9
Перфорантный путь: проекции от энторинальной коры до зубчатой извилины. Прог. Мозг Res. 163, 43–61. doi: 10.1016/s0079-6123(07)63003-9
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Wohleb, E. S., Hanke, M. L., Corona, A. W., Powell, N. D., Stiner, L. M., Bailey, M. T., et al. (2011). Антагонизм к β-адренорецепторам предотвращает тревожное поведение и реактивность микроглии, вызванные повторяющимися социальными поражениями. J. Neurosci. 31, 6277–6288. doi: 10.1523/JNEUROSCI.0450-11.2011
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Вохлеб, Э. С., МакКим, Д. Б., Шеридан, Дж. Ф., и Годбаут, Дж. П. (2015). Перенос моноцитов в мозг при стрессе и воспалении: новая ось связи между иммунитетом и мозгом, влияющая на настроение и поведение. Фронт. Неврологи. 8:447. doi: 10.3389/fnins.2014.00447
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Вонг М.Л. , Клинг М.А., Мансон П.Дж., Листвак С., Личинио Дж., Проло П. и др. (2000). Выраженная и устойчивая центральная гипернорадренергическая функция при большой депрессии с меланхолическими чертами: связь с гиперкортицизмом и кортикотропин-рилизинг-гормоном. Проц. Натл. акад. науч. США 97, 325–330. doi: 10.1073/pnas.97.1.325
, Клинг М.А., Мансон П.Дж., Листвак С., Личинио Дж., Проло П. и др. (2000). Выраженная и устойчивая центральная гипернорадренергическая функция при большой депрессии с меланхолическими чертами: связь с гиперкортицизмом и кортикотропин-рилизинг-гормоном. Проц. Натл. акад. науч. США 97, 325–330. doi: 10.1073/pnas.97.1.325
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Вуд, Г. Э., Норрис, Э. Х., Уотерс, Э., Столдт, Дж. Т., и Макьюэн, Б. С. (2008). Хронический иммобилизационный стресс изменяет аспекты эмоциональности и ассоциативного обучения у крыс. Поведение. Неврологи. 122, 282–292. doi: 10.1037/0735-7044.122.2.282
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Вуд, С. К., и Валентино, Р. Дж. (2016). Норадреналиновая система мозга, стресс и сердечно-сосудистая уязвимость. Неврологи. Биоповедение. Ред. 74, 393–400. doi: 10.1016/j.neubiorev.2016.04.018
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Xiong, W. , Wei, H., Xiang, X., Cao, J., Dong, Z., Wang, Y., et al. (2004). Влияние острого стресса на индукцию LTP и LTD в области CA1 гиппокампа анестезированных крыс в трех разных возрастах. Мозг Res. 1005, 187–192. doi: 10.1016/j.brainres.2004.01.051
, Wei, H., Xiang, X., Cao, J., Dong, Z., Wang, Y., et al. (2004). Влияние острого стресса на индукцию LTP и LTD в области CA1 гиппокампа анестезированных крыс в трех разных возрастах. Мозг Res. 1005, 187–192. doi: 10.1016/j.brainres.2004.01.051
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Сюн Ф. и Чжан Л. (2013). Роль гипоталамо-гипофизарно-надпочечниковой оси в программировании развития здоровья и болезней. Фронт. Нейроэндокринол. 34, 27–46. doi: 10.1016/j.yfrne.2012.11.002
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Ян Дж. К., Пак К., Ын С. Дж., Ли М. С., Юн Дж. С., Шин И. С. и др. (2008). Оценка зон коры головного мозга, связанных с сексуальным возбуждением у женщин с депрессией, с помощью функциональной МРТ. Дж. Секс. Мед. 5, 602–609. doi: 10.1111/j.1743-6109.2007.00737.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Иегуда Р., Буазоно Д. , Мейсон Дж. В. и Гиллер Э. Л. (1993). Количество глюкокортикоидных рецепторов и экскреция кортизола при настроении, тревоге и психотических расстройствах. биол. Психиатрия 34, 18–25. doi: 10.1016/0006-3223(93)-9
, Мейсон Дж. В. и Гиллер Э. Л. (1993). Количество глюкокортикоидных рецепторов и экскреция кортизола при настроении, тревоге и психотических расстройствах. биол. Психиатрия 34, 18–25. doi: 10.1016/0006-3223(93)-9
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Иегуда Р., Гольер Дж. А., Халлиган С. Л. и Харви П. Д. (2004a). Обучение и память у переживших Холокост с посттравматическим стрессовым расстройством. биол. Психиатрия 55, 291–295. doi: 10.1016/s0006-3223(03)00641-3
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Иегуда Р., Гольер Дж. А., Халлиган С. Л., Мини М. и Бирер Л. М. (2004b). Реакция АКТГ на дексаметазон при посттравматическом стрессовом расстройстве. утра. Журнал психиатрии 161, 1397–1403. doi: 10.1176/appi.ajp.161.8.1397
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Yehuda, R., Hoge, C.W., McFarlane, A.C., Vermetten, E., Lanius, R. A., Nievergelt, C.M., et al. (2015). Пост-травматическое стрессовое растройство. Нац. Преподобный Дис. Грунтовки 1:15057. doi: 10.1038/nrdp.2015.57
A., Nievergelt, C.M., et al. (2015). Пост-травматическое стрессовое растройство. Нац. Преподобный Дис. Грунтовки 1:15057. doi: 10.1038/nrdp.2015.57
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Иегуда Р., Саутвик С. М., Нуссбаум Г., Вахби В., Гиллер Э. Л. мл. и Мейсон Дж. В. (1990). Низкая экскреция кортизола с мочой у пациентов с посттравматическим стрессовым расстройством. Дж. Нерв. Мент. Дис. 178, 366–369. doi: 10.1097/00005053-19
00-00004PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Янг, Э. А., Абельсон, Дж., и Лайтман, С. Л. (2004). Пульсация кортизола и ее роль в регуляции стресса и здоровье. Фронт. Нейроэндокринол. 25, 69–76. doi: 10.1016/j.yfrne.2004.07.001
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Юэнь Э.Ю., Вэй Дж., Лю В., Чжун П., Ли Х. и Ян З. (2012). Повторяющийся стресс вызывает когнитивные нарушения, подавляя экспрессию и функцию глутаматных рецепторов в префронтальной коре. Нейрон 73, 962–977. doi: 10.1016/j.neuron.2011.12.033
Нейрон 73, 962–977. doi: 10.1016/j.neuron.2011.12.033
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Залахорас И., Хаутман Р., Атуча Э., Девос Р., Тийссен А. М. И., Ху П. и др. (2013). Дифференциальное нацеливание на цепи стресса мозга с помощью селективного модулятора глюкокортикоидных рецепторов. Проц. Натл. акад. науч. США 110, 7910–7915. doi: 10.1073/pnas.121
10
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Чжан Д.Ю. и Андерсон А.С. (2014). Симпатическая нервная система и сердечная недостаточность. Кардиол. клин. 32, 33–45. doi: 10.1016/j.ccl.2013.09.010
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Zhang, J., Abdallah, C.G., Chen, Y., Huang, T., Huang, Q., Xu, C., et al. (2013). Поведенческие дефициты, аномальный кортикостерон и снижение префронтальных метаболитов крыс-подростков, подверженных стрессу в раннем возрасте. Неврологи. лат. 545, 132–137. doi: 10.1016/j.neulet.2013.04.035
545, 132–137. doi: 10.1016/j.neulet.2013.04.035
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Чжэн, К., и Чжан, Т. (2015). Связанные с синаптической пластичностью нейронные колебания на пути гиппокамп-префронтальная кора при депрессии. Неврология 292, 170–180. doi: 10.1016/j.neuroscience.2015.01.071
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Zhou, M., Hoogenraad, C.C., Joëls, M., and Krugers, HJ (2012). Комбинированная активация β-адренорецепторов и кортикостероидных рецепторов регулирует функцию АМРА-рецепторов в нейронах гиппокампа. J. Психофармакол. 26, 516–524. doi: 10.1177/0269881111424930
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Чжу В., Умегаки Х., Судзуки Ю., Миура Х. и Игучи А. (2001). Участие ядра ложа конечной полоски в опосредованной гиппокампальной холинергической системой активации гипоталамо-гипофизарно-адренокортикальной оси у крыс. Мозг Res. 916, 101–106. doi: 10.1016/s0006-8993(01)02871-2
Мозг Res. 916, 101–106. doi: 10.1016/s0006-8993(01)02871-2
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Зиглер, Д. Р., Касс, В. А., и Герман, Дж. П. (1999). Возбуждающее влияние голубого пятна на реакцию гипоталамо-гипофизарно-надпочечниковой оси на стресс. J. Нейроэндокринол. 11, 361–369. doi: 10.1046/j.1365-2826.1999.00337.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Зоккал Д. Б., Фуруя В. И., Басси М., Коломбари Д. С. А. и Коломбари Э. (2014). Ядро солитарного тракта и координация дыхательной и симпатической активности. Фронт. Физиол. 5:238. doi: 10.3389/fphys.2014.00238
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Золадз П.Р. и Даймонд Д.М. (2013). Текущее состояние поведенческих и биологических маркеров посттравматического стрессового расстройства: поиск ясности в противоречивой литературе. Неврологи. Биоповедение. Ред. 37, 860–895. doi: 10.1016/j.neubiorev.2013.03.024
doi: 10.1016/j.neubiorev.2013.03.024
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Золадз П.Р. и Даймонд Д.М. (2016). Модель посттравматического стрессового расстройства у животных с психосоциальным стрессом на основе хищников: доклиническая оценка травматического стресса на когнитивном, гормональном, фармакологическом, сердечно-сосудистом и эпигенетическом уровнях анализа. Экспл. Нейрол. 284, 211–219. doi: 10.1016/j.expneurol.2016.06.003
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Цорн, Дж. В., Шюр, Р. Р., Бокс, М. П., Кан, Р. С., Джоэлс, М., и Винкерс, С. Х. (2017). Реактивность кортизола при психических расстройствах: систематический обзор и метаанализ. Психонейроэндокринология 77, 25–36. doi: 10.1016/j.psyneuen.2016.11.036
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Физиология стресса и способы управления им
Вы, вероятно, сталкивались с физиологическими последствиями стресса — потными ладонями, учащенным сердцебиением, поверхностным дыханием — и знакомы с чувством подавленности, которое он может вызвать. Реакция на стресс является частью механизма «бей или беги», который помогает нашему виду процветать. Однако требования современной жизни делают эту адаптивную реакцию проблематичной для нашего долгосрочного благополучия.
Реакция на стресс является частью механизма «бей или беги», который помогает нашему виду процветать. Однако требования современной жизни делают эту адаптивную реакцию проблематичной для нашего долгосрочного благополучия.
В этой статье будут рассмотрены физиологические основы стресса, его влияние на различные системы организма и полезные стратегии преодоления стресса.
Физиология стрессаРеакцией организма на стресс управляет симпатическая нервная система. Когда вы сталкиваетесь с острой опасностью, ваше тело реагирует каскадом физических и гормональных изменений, которые подготавливают вас к ответным действиям. Некоторые из этих изменений включают:
- Повышение артериального давления и частоты сердечных сокращений
- Всплеск гормонов адреналина, норадреналина и кортизола
- Снижение притока крови к внутренним органам и увеличение притока крови к опорно-двигательному аппарату
- Повышенное мышечное напряжение
- Угнетение иммунитета, пищеварительной и репродуктивной функций (Сапольский, 1994)
При столкновении с непосредственной угрозой для жизни эти физиологические реакции являются защитными. Они помогают мобилизовать доступные ресурсы организма, чтобы повысить шансы на выживание. Все, что не является необходимым немедленно, например, рост, пищеварение и размножение, подавляется. К сожалению, когда предполагаемая угроза перестает быть острой, а возникает из-за постоянного ежедневного давления, эти реакции могут угрожать вашему благополучию. В конце концов, реакция организма на стресс может причинить больше вреда, чем сам стрессор, что повлияет на многочисленные последствия для здоровья (Американская психологическая ассоциация, 2019 г.).).
Они помогают мобилизовать доступные ресурсы организма, чтобы повысить шансы на выживание. Все, что не является необходимым немедленно, например, рост, пищеварение и размножение, подавляется. К сожалению, когда предполагаемая угроза перестает быть острой, а возникает из-за постоянного ежедневного давления, эти реакции могут угрожать вашему благополучию. В конце концов, реакция организма на стресс может причинить больше вреда, чем сам стрессор, что повлияет на многочисленные последствия для здоровья (Американская психологическая ассоциация, 2019 г.).).
Существует сильная корреляция между высоким уровнем стресса и увеличением веса (Harding et al., 2014; Block et al., 2009). В основе этой зависимости лежат самые разные факторы. В то время как одни гормоны, связанные с реакцией на стресс, подавляют чувство голода, другие усиливают его. Уровень кортизола обычно повышается на поздних стадиях реакции на стресс и остается повышенным на этапе восстановления. Этот гормон усиливает чувство голода и мотивацию к еде как средство пополнения калорий, которые могли быть потеряны при реагировании на стрессор. Реакция организма на стресс также увеличивает тягу к чрезмерно вкусным продуктам, таким как быстроперевариваемые углеводы и продукты с высоким содержанием жира, в качестве средства быстрого пополнения запасов энергии (Yau and Potenza, 2013).
Этот гормон усиливает чувство голода и мотивацию к еде как средство пополнения калорий, которые могли быть потеряны при реагировании на стрессор. Реакция организма на стресс также увеличивает тягу к чрезмерно вкусным продуктам, таким как быстроперевариваемые углеводы и продукты с высоким содержанием жира, в качестве средства быстрого пополнения запасов энергии (Yau and Potenza, 2013).
Кроме того, кортизол вызывает увеличение отложения жира, особенно в области живота. Жировые клетки, расположенные в области живота, известные как висцеральный жир, особенно чувствительны к кортизолу и при воздействии на него накапливают больше жира, чем в других областях.
Хронический стресс и функция пищеварения Пищеварение быстро тормозится во время стресса. Кровоток отводится от органов пищеварения, желудочно-кишечные ферменты, ответственные за расщепление пищи, уменьшаются, а перистальтика (мышечные сокращения кишечника, помогающие продвигать пищу) подавляется. При столкновении с критической угрозой это полезно. Пищеварение не требуется немедленно, и кровоток перераспределяется на другие работающие ткани. Однако, когда стресс становится хроническим, это ослабляет пищеварительную систему. Стресс также может повышать маркеры воспаления желудочно-кишечного тракта и связан с такими состояниями, как синдром раздраженного кишечника, язвы, болезнь Крона и язвенный колит (Yaribeygi et al., 2017).
При столкновении с критической угрозой это полезно. Пищеварение не требуется немедленно, и кровоток перераспределяется на другие работающие ткани. Однако, когда стресс становится хроническим, это ослабляет пищеварительную систему. Стресс также может повышать маркеры воспаления желудочно-кишечного тракта и связан с такими состояниями, как синдром раздраженного кишечника, язвы, болезнь Крона и язвенный колит (Yaribeygi et al., 2017).
Хронический стресс может негативно влиять на настроение, а высокий уровень стресса связан с повышенным уровнем депрессии и тревоги (Khan and Alam Khan, 2017). Длительное воздействие кортизола и других кортикостероидов может усиливать чувство тревоги и способствовать развитию депрессии. Повышенный уровень кортизола часто наблюдается у людей с большой депрессией, а у животных с высоким уровнем кортикостероидов проявляются симптомы депрессии, такие как плохой сон, двигательные изменения, снижение аппетита и низкое либидо (Khan and Alam Khan, 2017). Кроме того, люди, подвергшиеся воздействию стрессоров в раннем возрасте, с большей вероятностью испытают клинически значимые последствия для психического здоровья во взрослом возрасте (Schneiderman, Ironson and Siegel, 2005).
Кроме того, люди, подвергшиеся воздействию стрессоров в раннем возрасте, с большей вероятностью испытают клинически значимые последствия для психического здоровья во взрослом возрасте (Schneiderman, Ironson and Siegel, 2005).
Преобладающая теория болезней, связанных с образом жизни, заключается в том, что они лежат в основе воспаления. Воспаление является частью иммунного ответа на болезнь или травму, когда лейкоциты, антитела и цитокины защищают поврежденные ткани. Как и стресс, это полезно в краткосрочной перспективе. Однако хроническое воспаление способствует развитию большинства хронических заболеваний. Неконтролируемый стресс может спровоцировать или увековечить системное воспаление, и исследования показывают, что стресс является распространенным фактором риска в 75-9.0% современных заболеваний, включая сердечно-сосудистые заболевания, диабет, заболевания печени, болезнь Альцгеймера и рак (Liu, Wang and Jiang, 2017).
Хотя может показаться, что стресс по своей природе негативен, он может быть полезен. Стресс может улучшить познание, мотивацию, память, творческий потенциал, бдительность и настойчивость. Кроме того, то, как мы воспринимаем стрессор, оказывает значительное влияние на то, как он влияет на нас. Простое рассмотрение стрессора как «вызова», а не «угрозы», приводит к лучшим физическим и психологическим последствиям (Kilby and Sherman, 2016). Стрессовые установки (наши установки и представления о последствиях стресса) изменяют наши поведенческие и психологические реакции на угрозу и, таким образом, наши долгосрочные результаты. Те, кто рассматривает стресс как адаптивный фактор, реже впадают в депрессию, сообщают о более высоком уровне счастья и большей удовлетворенности жизнью, чем те, кто считает стресс вредным (McGonigal, 2015).
Чтобы объективно проверить влияние образа мышления на физиологическую реакцию на стресс, исследователи поставили эксперимент, включающий имитацию интервью и измерили два гормона стресса: кортизол и дегидроэпиандростерон (ДГЭА). Как упоминалось ранее, кортизол стоит за некоторыми пагубными последствиями хронического стресса. Он помогает расщеплять накопленное топливо и блокировать ненужные системы во время реакции на стресс, но хронически высокие уровни могут ухудшить здоровье. DHEA также повышается во время реакции на стресс, что способствует росту мозга, восстановлению и восстановлению после стрессоров (McGonigal, 2015). Исследователи случайным образом поручили участникам посмотреть видео «стресс усиливает» или «стресс ослабляет» перед их имитацией интервью. Они обнаружили, что по сравнению с группой «стресс изнуряет» у тех, кто смотрел видео «стресс усиливает», уровень ДГЭА значительно повысился, что связано с улучшением состояния здоровья в ответ на стресс (Crum et al., 2016). ).
Как упоминалось ранее, кортизол стоит за некоторыми пагубными последствиями хронического стресса. Он помогает расщеплять накопленное топливо и блокировать ненужные системы во время реакции на стресс, но хронически высокие уровни могут ухудшить здоровье. DHEA также повышается во время реакции на стресс, что способствует росту мозга, восстановлению и восстановлению после стрессоров (McGonigal, 2015). Исследователи случайным образом поручили участникам посмотреть видео «стресс усиливает» или «стресс ослабляет» перед их имитацией интервью. Они обнаружили, что по сравнению с группой «стресс изнуряет» у тех, кто смотрел видео «стресс усиливает», уровень ДГЭА значительно повысился, что связано с улучшением состояния здоровья в ответ на стресс (Crum et al., 2016). ).
Стресс является естественной частью жизни. При отсутствии контроля физиологическая реакция организма может негативно сказаться на здоровье. Тем не менее, ваше мышление может трансформировать вашу реакцию на стресс, позволяя ему повысить креативность, мотивацию и настойчивость, что в конечном итоге поможет вам стать более устойчивым перед лицом будущих стрессоров.
Заинтересованы в том, чтобы помочь другим вести более здоровый образ жизни? Стать сертифицированным тренером по здоровому образу жизни ACE
Получить сертификат
Рекомендации
Американская психологическая ассоциация. (2019). Влияние стресса на организм.
Block, J.P. et al. (2009). Психосоциальный стресс и изменение веса среди взрослых в США. Американский журнал эпидемиологии , 170, 2, 181–192.
Крам, А.Дж. и другие. (2017). Роль стрессового мышления в формировании когнитивных, эмоциональных и физиологических реакций на вызывающий и угрожающий стресс. Беспокойство, стресс и преодоление трудностей , 30, 4, 379–395.
Harding, J.L. et al. (2014). Психосоциальный стресс положительно связан с увеличением индекса массы тела в течение 5 лет: данные продольного исследования AusDiab. Ожирение, 22, 1, 277286.
Кан, С. и Алам Кан, Р. (2017). Хронический стресс приводит к тревоге и депрессии. Annals of Psychiatry and Mental Health, 5, 1, 1091.
Annals of Psychiatry and Mental Health, 5, 1, 1091.
Kilby, C.J. and Sherman, K.A. (2016). Определение взаимосвязи между стрессовым мышлением и первичными оценками: предварительные выводы. SpringerPlus , 5, 336.
Лю, Ю.-З., Ван, Ю.-Х. и Цзян, К.-Л. (2017). Воспаление: общий путь заболеваний, связанных со стрессом. Frontiers in Human Neuroscience , 11, 316.
McGonigal, K. (2016). Положительная сторона стресса: почему стресс полезен для вас и как справиться с ним . Лондон, Соединенное Королевство: Пингвин.
Сапольский Р.М. (2004). Почему у зебр не бывает язв: Признанное руководство по стрессу, связанным со стрессом заболеваниям и преодолению стресса (3-е изд.). Нью-Йорк: Холт в мягкой обложке.
Шнайдерман Н., Айронсон Г. и Сигель С.Д. (2005). Стресс и здоровье: психологические, поведенческие и биологические детерминанты. Ежегодный обзор клинической психологии , 1, 607–628.
Ярибейги Х. и др. (2017). Влияние стресса на функцию организма: обзор. Журнал EXCLI , 16, 1057–1072.
и др. (2017). Влияние стресса на функцию организма: обзор. Журнал EXCLI , 16, 1057–1072.
Яу, Ю.Х.К. и Потенца, М.Н. (2013). Стресс и пищевое поведение. Minerva Endocrinologica , 38, 3, 255–267.
Физиологические основы стресса – методы управления стрессом
Глава 1: Стресс
Что происходит внутри нашего тела, когда мы испытываем стресс? Физиологические механизмы стресса чрезвычайно сложны, но они, как правило, включают работу двух систем — симпатической нервной системы и гипоталамо-гипофизарно-надпочечниковой (ГГН) оси. Когда человек впервые воспринимает что-то как стрессовое (реакция тревоги Селье), симпатическая нервная система запускает возбуждение посредством выброса адреналина из надпочечников. Высвобождение этих гормонов активирует реакцию «бей или беги» на стресс, например учащение пульса и дыхания. При этом особенно активизируется ГГН-ось, имеющая преимущественно эндокринный характер, хотя и работает значительно медленнее, чем симпатическая нервная система. В ответ на стресс гипоталамус (одна из лимбических структур головного мозга) высвобождает кортикотропин-рилизинг-фактор, гормон, который заставляет гипофиз высвобождать адренокортикотропный гормон (АКТГ). Затем АКТГ активирует надпочечники, чтобы выделить ряд гормонов в кровоток; важным из них является кортизол, который может повлиять практически на каждый орган в организме. Кортизол широко известен как гормон стресса и помогает обеспечить прилив энергии, когда мы впервые сталкиваемся со стрессором, подготавливая нас к побегу или драке. Однако устойчивый повышенный уровень кортизола ослабляет иммунную систему.
В ответ на стресс гипоталамус (одна из лимбических структур головного мозга) высвобождает кортикотропин-рилизинг-фактор, гормон, который заставляет гипофиз высвобождать адренокортикотропный гормон (АКТГ). Затем АКТГ активирует надпочечники, чтобы выделить ряд гормонов в кровоток; важным из них является кортизол, который может повлиять практически на каждый орган в организме. Кортизол широко известен как гормон стресса и помогает обеспечить прилив энергии, когда мы впервые сталкиваемся со стрессором, подготавливая нас к побегу или драке. Однако устойчивый повышенный уровень кортизола ослабляет иммунную систему.
Кратковременно этот процесс может иметь некоторые благоприятные эффекты, такие как предоставление дополнительной энергии, временное улучшение работы иммунной системы и снижение болевой чувствительности. Однако длительное высвобождение кортизола, как это происходит при длительном или хроническом стрессе, часто обходится дорого. Было показано, что высокий уровень кортизола вызывает ряд вредных эффектов. Например, повышение уровня кортизола может значительно ослабить нашу иммунную систему (Glaser & Kiecolt-Glaser, 2005), а высокий уровень часто наблюдается у людей с депрессией (Geoffroy, Hertzman, Li, & Power, 2013). Таким образом, стрессовое событие вызывает множество физиологических реакций, которые активируют надпочечники, которые, в свою очередь, выделяют адреналин, норадреналин и кортизол. Эти гормоны воздействуют на ряд телесных процессов таким образом, что подготавливают человека, находящегося в состоянии стресса, к непосредственным действиям, но также и таким образом, который может повысить вероятность заболевания.
Например, повышение уровня кортизола может значительно ослабить нашу иммунную систему (Glaser & Kiecolt-Glaser, 2005), а высокий уровень часто наблюдается у людей с депрессией (Geoffroy, Hertzman, Li, & Power, 2013). Таким образом, стрессовое событие вызывает множество физиологических реакций, которые активируют надпочечники, которые, в свою очередь, выделяют адреналин, норадреналин и кортизол. Эти гормоны воздействуют на ряд телесных процессов таким образом, что подготавливают человека, находящегося в состоянии стресса, к непосредственным действиям, но также и таким образом, который может повысить вероятность заболевания.
Когда стресс экстремальный или хронический, он может иметь крайне негативные последствия. Например, стресс часто способствует развитию некоторых психологических расстройств, в том числе посттравматического стрессового расстройства, большого депрессивного расстройства и других серьезных психических состояний. Кроме того, ранее мы отмечали, что стресс связан с развитием и прогрессированием различных физических заболеваний. Например, исследователи в одном из исследований обнаружили, что люди, получившие ранения во время катастрофы Всемирного торгового центра 11 сентября 2001 г. или у которых после этого развились симптомы посттравматического стресса, впоследствии значительно чаще страдали сердечными заболеваниями (Джордан, Миллер-Арчи, Коне, Морабия, и Стеллман, 2011). Другое исследование показало, что симптомы стресса, о которых сообщали сами пожилые и вышедшие на пенсию финские работники пищевой промышленности, были связаны с заболеваемостью 11 лет спустя. Это исследование также предсказывало возникновение скелетно-мышечной, нервной системы, эндокринных и метаболических нарушений (Salonen, Arola, Nygård, & Huhtala, 2008). Другое исследование показало, что южнокорейские рабочие-мужчины, которые сообщали о высоком уровне стресса на работе, с большей вероятностью заболевали простудой в течение следующих нескольких месяцев, чем те сотрудники, которые сообщали о более низком уровне стресса, связанного с работой (Park et al.
Например, исследователи в одном из исследований обнаружили, что люди, получившие ранения во время катастрофы Всемирного торгового центра 11 сентября 2001 г. или у которых после этого развились симптомы посттравматического стресса, впоследствии значительно чаще страдали сердечными заболеваниями (Джордан, Миллер-Арчи, Коне, Морабия, и Стеллман, 2011). Другое исследование показало, что симптомы стресса, о которых сообщали сами пожилые и вышедшие на пенсию финские работники пищевой промышленности, были связаны с заболеваемостью 11 лет спустя. Это исследование также предсказывало возникновение скелетно-мышечной, нервной системы, эндокринных и метаболических нарушений (Salonen, Arola, Nygård, & Huhtala, 2008). Другое исследование показало, что южнокорейские рабочие-мужчины, которые сообщали о высоком уровне стресса на работе, с большей вероятностью заболевали простудой в течение следующих нескольких месяцев, чем те сотрудники, которые сообщали о более низком уровне стресса, связанного с работой (Park et al. , 2011). ). Позже вы изучите механизмы, с помощью которых стресс может вызывать физические болезни и недуги.
, 2011). ). Позже вы изучите механизмы, с помощью которых стресс может вызывать физические болезни и недуги.
Резюме
Стресс — это процесс, при котором человек воспринимает и реагирует на события, которые оцениваются как подавляющие или угрожающие его благополучию. Научное исследование того, как стресс и эмоциональные факторы влияют на здоровье и благополучие, называется психологией здоровья — областью, посвященной изучению общего воздействия психологических факторов на здоровье. Первичная физиологическая реакция организма на стресс — реакция «бей или беги» — была впервые выявлена в начале 20 века Уолтером Кэнноном. Реакция «бей или беги» включает скоординированную активность как симпатической нервной системы, так и оси гипоталамус-гипофиз-надпочечники (ГГН). Ганс Селье, известный эндокринолог, назвал эти физиологические реакции на стресс частью общего адаптационного синдрома, который протекает в три стадии: реакция тревоги (начинаются реакции борьбы или бегства), сопротивление (тело начинает приспосабливаться к продолжающемуся стрессу). истощение (адаптационная энергия истощается, и стресс начинает сказываться на физическом состоянии).
Ганс Селье, известный эндокринолог, назвал эти физиологические реакции на стресс частью общего адаптационного синдрома, который протекает в три стадии: реакция тревоги (начинаются реакции борьбы или бегства), сопротивление (тело начинает приспосабливаться к продолжающемуся стрессу). истощение (адаптационная энергия истощается, и стресс начинает сказываться на физическом состоянии).
Проверьте свои знания
Скачать бесплатно на http://cnx.org/contents/[email protected]
Стресс у рыб: разнообразие реакций с особым упором на изменения в циркулирующих кортикостероидах1 | Интегративная и сравнительная биология
Журнальная статья
Брюс А. Бартон
Брюс А. Бартон
Ищите другие работы этого автора на:
Оксфордский академический
пабмед
Google ученый
Интегративная и сравнительная биология , том 42, выпуск 3, июль 2002 г. , страницы 517–525, https://doi.org/10.1093/icb/42.3.517
, страницы 517–525, https://doi.org/10.1093/icb/42.3.517
Опубликовано:
01 июля 2002 г. PDF
- Содержание статьи
- Рисунки и таблицы
- видео
- Аудио
- Дополнительные данные
Цитировать
Процитируйте
Брюс А. Бартон, Стресс у рыб: разнообразие реакций с особым упором на изменения в циркулирующих кортикостероидах, Интегративная и сравнительная биология , том 42, выпуск 3, июль 2002 г., страницы 517–525, https: //doi.org/10.1093/icb/42.3.517
Бартон, Стресс у рыб: разнообразие реакций с особым упором на изменения в циркулирующих кортикостероидах, Интегративная и сравнительная биология , том 42, выпуск 3, июль 2002 г., страницы 517–525, https: //doi.org/10.1093/icb/42.3.517
Выберите формат Выберите format.ris (Mendeley, Papers, Zotero).enw (EndNote).bibtex (BibTex).txt (Medlars, RefWorks)
Закрыть
Разрешения
- Электронная почта
- Твиттер
- Фейсбук
- Подробнее
Фильтр поиска панели навигации Интегративная и сравнительная биологияЭтот выпускЖурналы SICBБиологические наукиКнигиЖурналыOxford Academic Термин поиска мобильного микросайта
Закрыть
Фильтр поиска панели навигации Интегративная и сравнительная биологияЭтот выпускЖурналы SICBБиологические наукиКнигиЖурналыOxford Academic Термин поиска на микросайте
Advanced Search
Abstract
Физические, химические и воспринимаемые стрессоры могут вызывать у рыб неспецифические реакции, которые считаются адаптивными, позволяя рыбе справляться с нарушением и поддерживать свое гомеостатическое состояние. Если стрессор слишком сильный или продолжительный до такой степени, что рыба не способна восстановить гомеостаз, то сами реакции могут стать неадекватными и угрожать здоровью и благополучию рыбы. Физиологические реакции на стресс сгруппированы как первичные, которые включают эндокринные изменения, такие как измеримые уровни циркулирующих катехоламинов и кортикостероидов, и вторичные, которые включают изменения характеристик, связанных с метаболизмом, гидроминеральным балансом, сердечно-сосудистой, дыхательной и иммунной функциями. В некоторых случаях эндокринные реакции непосредственно ответственны за эти вторичные реакции, приводящие к изменениям концентрации компонентов крови, включая метаболиты и основные ионы, а также, на клеточном уровне, к экспрессии белков теплового шока или стресса. Третичные или общеживотные изменения в продуктивности, такие как рост, устойчивость к болезням и поведение, могут быть результатом первичных и вторичных реакций и, возможно, влиять на выживаемость.
Если стрессор слишком сильный или продолжительный до такой степени, что рыба не способна восстановить гомеостаз, то сами реакции могут стать неадекватными и угрожать здоровью и благополучию рыбы. Физиологические реакции на стресс сгруппированы как первичные, которые включают эндокринные изменения, такие как измеримые уровни циркулирующих катехоламинов и кортикостероидов, и вторичные, которые включают изменения характеристик, связанных с метаболизмом, гидроминеральным балансом, сердечно-сосудистой, дыхательной и иммунной функциями. В некоторых случаях эндокринные реакции непосредственно ответственны за эти вторичные реакции, приводящие к изменениям концентрации компонентов крови, включая метаболиты и основные ионы, а также, на клеточном уровне, к экспрессии белков теплового шока или стресса. Третичные или общеживотные изменения в продуктивности, такие как рост, устойчивость к болезням и поведение, могут быть результатом первичных и вторичных реакций и, возможно, влиять на выживаемость.
Рыбы демонстрируют широкий спектр физиологических реакций на стресс, что ясно проявляется в изменениях уровня кортикостероидов в плазме, главным образом кортизола у актиноптеригий, которые происходят после стрессового события. Характерное повышение циркулирующего кортизола в течение первого часа после острого нарушения может различаться более чем на два порядка у разных видов, и генетическая история, по-видимому, объясняет большую часть этих межвидовых вариаций. Оценка факторов, влияющих на величину, продолжительность и восстановление кортизола и других физиологических изменений, вызванных стрессом у рыб, важна для правильной интерпретации экспериментальных данных и разработки эффективных программ биологического мониторинга.
Характерное повышение циркулирующего кортизола в течение первого часа после острого нарушения может различаться более чем на два порядка у разных видов, и генетическая история, по-видимому, объясняет большую часть этих межвидовых вариаций. Оценка факторов, влияющих на величину, продолжительность и восстановление кортизола и других физиологических изменений, вызванных стрессом у рыб, важна для правильной интерпретации экспериментальных данных и разработки эффективных программ биологического мониторинга.
ВВЕДЕНИЕ
Ганс Селье однажды определил стресс как «неспецифический ответ организма на любое предъявляемое к нему требование» (Selye, 1973). Среди биологов-рыболовов распространено заблуждение, что стресс сам по себе губителен для рыб. Однако это не обязательно так. Реакция на стресс считается адаптивным механизмом, который позволяет рыбе справляться с реальными или воспринимаемыми стрессорами, чтобы поддерживать свое нормальное или гомеостатическое состояние. Проще говоря, стресс можно рассматривать как состояние угрожаемого гомеостаза, которое восстанавливается сложным набором адаптивных реакций (Chrousos, 19).98). Однако, если интенсивность стрессора слишком сильна или продолжительна, физиологические механизмы реакции могут быть нарушены и могут стать вредными для здоровья и благополучия рыбы или стать дезадаптивными, состояние, связанное с термином «дистресс» (Selye, 1974; Barton and Iwama, 1991) и серьезной заботой менеджеров и аквакультуристов.
Проще говоря, стресс можно рассматривать как состояние угрожаемого гомеостаза, которое восстанавливается сложным набором адаптивных реакций (Chrousos, 19).98). Однако, если интенсивность стрессора слишком сильна или продолжительна, физиологические механизмы реакции могут быть нарушены и могут стать вредными для здоровья и благополучия рыбы или стать дезадаптивными, состояние, связанное с термином «дистресс» (Selye, 1974; Barton and Iwama, 1991) и серьезной заботой менеджеров и аквакультуристов.
Физиологические реакции рыб на стрессовые факторы окружающей среды можно разделить на первичные и вторичные (рис. 1). Первичные реакции, которые включают начальные нейроэндокринные реакции, включают высвобождение катехоламинов из хромаффинной ткани (Randall and Perry, 19).92; Рид и др. , 1998), а также стимуляцию гипоталамо-гипофизарно-интерренальной (HPI) оси, завершающейся высвобождением кортикостероидных гормонов в кровоток (Donaldson, 1981; Wendelaar Bonga, 1997; Mommsen et al. , 1999). Вторичные реакции включают изменения уровней ионов и метаболитов в плазме и тканях, гематологических особенностей и белков теплового шока или стресса (HSP), все из которых связаны с физиологическими адаптациями, такими как метаболизм, дыхание, кислотно-щелочное состояние, гидроминеральный баланс, иммунная система. функция и клеточные реакции (Пикеринг, 1981; Ивама и др. , 1997, 1998; Моммзен и др. , 1999). Кроме того, возникают третичные реакции (рис. 1), которые относятся к аспектам общей продуктивности животного, таким как изменения в росте, состоянии, общей устойчивости к болезням, метаболических возможностях активности, поведении и, в конечном счете, выживании (Wedemeyer and McLeay, 1981; Wedemeyer и др. , 1990). Однако эта группировка является упрощенной, поскольку стресс, в зависимости от его величины и продолжительности, может воздействовать на рыбу на всех уровнях организации, от молекулярного и биохимического до популяционного и общественного (Адамс, 19).
, 1999). Вторичные реакции включают изменения уровней ионов и метаболитов в плазме и тканях, гематологических особенностей и белков теплового шока или стресса (HSP), все из которых связаны с физиологическими адаптациями, такими как метаболизм, дыхание, кислотно-щелочное состояние, гидроминеральный баланс, иммунная система. функция и клеточные реакции (Пикеринг, 1981; Ивама и др. , 1997, 1998; Моммзен и др. , 1999). Кроме того, возникают третичные реакции (рис. 1), которые относятся к аспектам общей продуктивности животного, таким как изменения в росте, состоянии, общей устойчивости к болезням, метаболических возможностях активности, поведении и, в конечном счете, выживании (Wedemeyer and McLeay, 1981; Wedemeyer и др. , 1990). Однако эта группировка является упрощенной, поскольку стресс, в зависимости от его величины и продолжительности, может воздействовать на рыбу на всех уровнях организации, от молекулярного и биохимического до популяционного и общественного (Адамс, 19). 90).
90).
Большая часть наших современных знаний о физиологических реакциях рыб на стресс была получена в результате изучения первичных реакций хромаффинной оси мозга и оси HPI на стрессоры и последующих или вторичных эффектов, связанных с нейроэндокринной стимуляцией, на метаболизм, размножение и иммунную систему. (Randall and Perry, 1992; Pickering, 1993; Iwama и др., , 1997; Reid, и др., , 1998; Mommsen, и др., , 1999). Большинство прошлых исследований физиологии стресса у рыб в течение последних нескольких десятилетий были сосредоточены на аквакультуре из-за интереса к управлению стрессом при максимальном увеличении продуктивности в искусственной среде. В этом контексте было опубликовано множество обзоров (Barton and Iwama, 19).91; Ивама и др. , 1997; Pickering, 1998), а некоторые из них касались природы реакции на стресс и изменения уровня стрессовых гормонов у рыб (Mazeaud et al. , 1977; Pickering, 1981; Gamperl et al. , 1994; Wendelaar Bonga, 1997; Mommsen и др. , 1999). Сравнительно меньше информации имеется о физиологических реакциях рыб на возмущения окружающей среды, связанные с природными или антропогенными стрессорами, в частности с переносимыми через воду загрязнителями (Кэрнс 9).0004 и др. , 1984; Адамс, 1990; Ниими, 1990; Браун, 1993; Хонтела, 1997). Цель этой статьи — проиллюстрировать разнообразие реакций на кортикостероидный стресс, возникающих у рыб, в контексте их генетической истории, истории развития и окружающей среды.
, 1999). Сравнительно меньше информации имеется о физиологических реакциях рыб на возмущения окружающей среды, связанные с природными или антропогенными стрессорами, в частности с переносимыми через воду загрязнителями (Кэрнс 9).0004 и др. , 1984; Адамс, 1990; Ниими, 1990; Браун, 1993; Хонтела, 1997). Цель этой статьи — проиллюстрировать разнообразие реакций на кортикостероидный стресс, возникающих у рыб, в контексте их генетической истории, истории развития и окружающей среды.
ЭНДОКРИННАЯ РЕАКЦИЯ РЫБ НА СТРЕСС
Когда рыба подвергается воздействию стрессора, физиологическая реакция на стресс инициируется распознаванием центральной нервной системой (ЦНС) реальной или предполагаемой угрозы. Симпатические нервные волокна, иннервирующие хромаффинные клетки, стимулируют высвобождение катехоламинов через холинергические рецепторы (Reid 9).0004 и др. , 1996, 1998). Хромаффинная ткань (гомолог мозгового вещества надпочечников) расположена в основном в передней области почки у костистых рыб (Reid et al. , 1998). Поскольку катехоламины, в основном адреналин у костистых рыб, запасаются в хромаффинных клетках, их высвобождение происходит быстро, а циркулирующие уровни этих гормонов немедленно возрастают при стрессе (Mazeaud et al. , 1977; Randall and Perry, 1992; Reid et al.). и др. , 1998).
, 1998). Поскольку катехоламины, в основном адреналин у костистых рыб, запасаются в хромаффинных клетках, их высвобождение происходит быстро, а циркулирующие уровни этих гормонов немедленно возрастают при стрессе (Mazeaud et al. , 1977; Randall and Perry, 1992; Reid et al.). и др. , 1998).
Высвобождение кортизола у костистых и других костистых рыб задерживается по сравнению с высвобождением катехоламинов. Путь высвобождения кортизола начинается в оси HPI с высвобождения кортикотропин-рилизинг-гормона (CRH) или фактора (CRF), главным образом из гипоталамуса в головном мозге, который стимулирует кортикотрофические клетки передней доли гипофиза к секреции адренокортикотропина (АКТГ). ). Циркулирующий АКТГ, в свою очередь, стимулирует интерренальные клетки (гомолог коры надпочечников), встроенные в почки, к синтезу и высвобождению кортикостероидов в кровоток для распределения в тканях-мишенях. Межпочечная ткань расположена в передней части почки у костистых рыб и демонстрирует значительные морфологические различия среди таксономических групп (Nandi, 1962), но у хондростеанов обнаруживается по всей почке (Idler and O’Halloran, 1970). Кортизол является основным кортикостероидом у актиноптериговых ( т.е. костистых, других неоптериговых и хрящевых) рыб (Sangalang et al. , 1971; Idler and Truscott, 1972; Hanson and Fleming, 1979; Barton , 1000 al.). ), тогда как 1α-гидроксикортикостерон является основным кортикостероидом у пластиножаберных (Idler and Truscott, 1966, 1967). Синтез и высвобождение кортизола интерренальными клетками происходит с задержкой в несколько минут, в отличие от хромаффинных клеток, и, следовательно, правильный протокол отбора проб может позволить измерить уровни этого гормона в состоянии покоя у рыб (Wedemeyer 9).0004 и др. , 1990; Гамперл и др. , 1994). В результате уровень циркулирующего кортизола обычно используется в качестве индикатора степени стресса, испытываемого рыбой (Barton and Iwama, 1991; Wendelaar Bonga, 1997). Контроль высвобождения кортизола осуществляется посредством отрицательной обратной связи гормона на всех уровнях оси HPI (Fryer and Peter, 1977; Donaldson, 1981; Bradford и др.
Кортизол является основным кортикостероидом у актиноптериговых ( т.е. костистых, других неоптериговых и хрящевых) рыб (Sangalang et al. , 1971; Idler and Truscott, 1972; Hanson and Fleming, 1979; Barton , 1000 al.). ), тогда как 1α-гидроксикортикостерон является основным кортикостероидом у пластиножаберных (Idler and Truscott, 1966, 1967). Синтез и высвобождение кортизола интерренальными клетками происходит с задержкой в несколько минут, в отличие от хромаффинных клеток, и, следовательно, правильный протокол отбора проб может позволить измерить уровни этого гормона в состоянии покоя у рыб (Wedemeyer 9).0004 и др. , 1990; Гамперл и др. , 1994). В результате уровень циркулирующего кортизола обычно используется в качестве индикатора степени стресса, испытываемого рыбой (Barton and Iwama, 1991; Wendelaar Bonga, 1997). Контроль высвобождения кортизола осуществляется посредством отрицательной обратной связи гормона на всех уровнях оси HPI (Fryer and Peter, 1977; Donaldson, 1981; Bradford и др. , 1992; Wendelaar Bonga, 1997). Однако регуляция оси HPI гораздо сложнее, чем следует из этого описания. Для получения дополнительной информации Самптер (1997), Hontela (1997) и Wendelaar Bonga (1997) дают более полное описание оси эндокринного стресса у рыб.
, 1992; Wendelaar Bonga, 1997). Однако регуляция оси HPI гораздо сложнее, чем следует из этого описания. Для получения дополнительной информации Самптер (1997), Hontela (1997) и Wendelaar Bonga (1997) дают более полное описание оси эндокринного стресса у рыб.
Во время стресса может повышаться уровень других периферических гормонов, в частности, тироксина (Brown et al. , 1978), пролактина (Avella et al. , 1991; Pottinger et al. , 1992 a) и соматолактина5 (Рэнд-Уивер
и др. , 1993; Какидзава и др. , 1995). Кроме того, стресс может подавлять циркуляцию репродуктивных гормонов (Pickering 9).0004 и др. , 1987; Панкхерст и Дедуал, 1994; Haddy and Pankhurst, 1999), как и повышенный уровень кортизола (Carragher и др. , 1989; Carragher and Sumpter, 1990). Однако еще не было продемонстрировано, что эти другие гормоны являются полезными индикаторами стресса per se и, следовательно, здесь не обсуждаются. В последнее время интерес сосредоточился на реакциях моноаминов центрального мозга, особенно катехоламинов и индоламинов, в ответ на стресс (Winberg and Nilsson, 19).93). В частности, серотонин участвует в регуляции адреналина и кортизола у рыб во время стресса (Fritsche et al. , 1993; Winberg and Nilsson, 1993; Winberg et al. , 1997).
В последнее время интерес сосредоточился на реакциях моноаминов центрального мозга, особенно катехоламинов и индоламинов, в ответ на стресс (Winberg and Nilsson, 19).93). В частности, серотонин участвует в регуляции адреналина и кортизола у рыб во время стресса (Fritsche et al. , 1993; Winberg and Nilsson, 1993; Winberg et al. , 1997).
ФАКТОРЫ, ВЛИЯЮЩИЕ НА КОРТИКОСТЕРОИДНЫЕ РЕАКЦИИ НА СТРЕСС
Генетические факторы
Реакции рыб на стрессоры, особенно эндокринные реакции, сильно различаются (Barton and Iwama, 1991; Gamperl et al. , 1994). Более ранние исследования реакции на кортикостероидный стресс, как правило, были сосредоточены на пресноводных рыбах, особенно лососевых, из-за их важности в государственной и коммерческой аквакультуре (Barton and Iwama, 19).91; Barton, 1997), но в последнее время интерес сосредоточился на важных с коммерческой точки зрения морских видах (Thomas and Robertson, 1991; Pankhurst and Sharples, 1992; Morgan et al. , 1996; Waring et al. , 1996; Barnett and Pankhurst, 1997; Rotllant и др. , 2000). Повышение уровня кортизола в плазме колеблется не менее чем на два порядка у рыб, подвергшихся воздействию идентичного стрессора (таблица 1), и может быть намного выше в зависимости от вида.
, 1996; Waring et al. , 1996; Barnett and Pankhurst, 1997; Rotllant и др. , 2000). Повышение уровня кортизола в плазме колеблется не менее чем на два порядка у рыб, подвергшихся воздействию идентичного стрессора (таблица 1), и может быть намного выше в зависимости от вида.
Характерное повышение уровня кортизола у рыб в ответ на острые стрессоры, как правило, колеблется в пределах от 30 до 300 нг/мл (Wedemeyer и др. , 1990; Barton and Iwama, 1991), но есть и заметные исключения. Бартон и др. (1998, 2000) наблюдали, что пиковые уровни кортизола после острого стрессора при обработке были низкими (таблица 1) у скафиринхидных осетров ( Scaphirhynchus spp.) и веслононов ( Polyodon spathula ). Их результаты свидетельствуют о тенденции к более низкой реакции на стресс у этих хондростов по сравнению с костистыми. Беланже и др. (2001), однако, обнаружили, что пик кортизола в плазме у белого осетра ( Acipenser transmontanus ) после острого нарушения составляла около 40 нг/мл, что указывает на то, что реакция на стресс с низким уровнем кортикостероидов не может быть универсальным явлением у этой группы рыб.
Среди костистых рыб некоторые виды также проявляют низкую реакцию кортикостероидов на острые стрессоры. У атлантической трески ( Gadus morhua ), например, пиковое повышение уровня кортизола в плазме до <15 нг/мл после обработки (Hemre et al. , 1991). В верхней части диапазона отклика Maule и др. (1988) во время изучения физиологического мониторинга мигрирующей молоди чавычи ( Oncorhynchus tshawytscha ) обнаружили, что пиковые концентрации кортизола после нарушения часто достигают 400 нг/мл во время и после транспортировки. Однако Congleton et al. (2000) позже измерили титры кортизола у чавычи, мигрирующей из той же системы, которые были значительно ниже. Мазик и др. (1991) зафиксировали повышение уровня кортизола в плазме у полосатых окуней (9).0004 Morone saxatilis ) до почти 2000 нг/мл во время восстановления после 5-часовой выборки, что представляет собой один из самых высоких зарегистрированных уровней.
Различия в реакциях на стрессоры четко видны у близкородственных видов рыб, и такие различия кажутся постоянными. Barton (2000) и Ruane et al. (1999) показали, что у кумжи ( Salmo trutta ) наблюдалось большее повышение уровня кортизола после непродолжительного обращения и кратковременного содержания соответственно, чем у радужной форели (9).0004 Oncorhynchus mykiss ). Это различие также согласуется с реакцией на глюкозу между этими двумя видами. Точно так же и McDonald et al. (1993) и Barton (2000) обнаружили, что озерная форель ( Salvelinus namaycush ) более чувствительна к транспортному стрессу, чем ручьевая форель ( Salvelinus fontinalis ), близкородственный вид гольца.
Barton (2000) и Ruane et al. (1999) показали, что у кумжи ( Salmo trutta ) наблюдалось большее повышение уровня кортизола после непродолжительного обращения и кратковременного содержания соответственно, чем у радужной форели (9).0004 Oncorhynchus mykiss ). Это различие также согласуется с реакцией на глюкозу между этими двумя видами. Точно так же и McDonald et al. (1993) и Barton (2000) обнаружили, что озерная форель ( Salvelinus namaycush ) более чувствительна к транспортному стрессу, чем ручьевая форель ( Salvelinus fontinalis ), близкородственный вид гольца.
В ходе нескольких исследований рыбу постоянно подвергали сильным стрессорам в попытке охарактеризовать максимальную реакцию кортикостероидов на стресс. Плазменный кортизол у осетровых и веслоносов достигал максимальных уровней около 13 и 60 нг/мл соответственно при длительном содержании в тяжелых условиях, сопровождаемом манипуляциями (Barton 9).0004 и др. , 1998, 2000), но у молоди радужной форели это плато составило около 160 нг/мл при использовании того же экспериментального протокола (Barton и др. , 1980). В подобных исследованиях пиковые концентрации кортизола в плазме превышали 500 нг/мл у молоди чавычи (Strange et al. , 1978) и приближались к 1400 нг/мл у полосатого окуня (Noga et al. , 1994), что еще больше подчеркивает широкие различия в реакциях на стресс, наблюдаемые у разных видов рыб.
, 1980). В подобных исследованиях пиковые концентрации кортизола в плазме превышали 500 нг/мл у молоди чавычи (Strange et al. , 1978) и приближались к 1400 нг/мл у полосатого окуня (Noga et al. , 1994), что еще больше подчеркивает широкие различия в реакциях на стресс, наблюдаемые у разных видов рыб.
Большинство исследованных видов рыб демонстрируют максимальное повышение уровня кортизола в плазме примерно через 0,5–1 час после стрессового воздействия (Barton and Iwama, 19).91), но есть и исключения из этой общей схемы. Виджаян и Мун (1994) обнаружили, что циркулирующий кортизол у морского ворона ( Hemitripterus americanus ), малоподвижной донной морской рыбы, достиг своего пикового уровня около 260 нг/мл после острого стрессора примерно через 4 часа. Эти авторы предположили, что медленная скорость реакции на стрессор может способствовать сохранению энергии у обычно неактивных видов, имеющих медленную скорость метаболизма.
Различия в реакции на кортикостероидный стресс также существуют среди штаммов или видов одного и того же вида (Iwama и др. , 1992; Pottinger and Moran, 1993), их гибриды (Noga и др. , 1994), а также между дикими и заводскими рыбами (Woodward and Strange, 1987). В пределах одной линии или популяции вариации реакции на стресс также имеют генетический компонент (Heath et al. , 1993), и некоторые рыбы могут быть предрасположены к последовательному проявлению высокого или низкого уровня кортизола в ответ на стрессоры (Pottinger et al. , 1992 b ; Tort и др. , 2001), паттерн, который, по-видимому, коррелирует с поведением (Øverli и др. , 2002). Тенденция к большим различиям в реакции на стресс между таксонами является признаком, который, по-видимому, является по крайней мере частично наследственным (Fevolden et al. , 1991; Fevolden and Røed, 1993; Pottinger et al. , 1994). Феволден и др. (1999) оценил значение наследуемости 0,56 для повышения уровня кортизола в плазме, измеренного у взрослой радужной форели после воздействия трех стрессовых событий, каждое из которых происходило с интервалом более 1 месяца.
, 1992; Pottinger and Moran, 1993), их гибриды (Noga и др. , 1994), а также между дикими и заводскими рыбами (Woodward and Strange, 1987). В пределах одной линии или популяции вариации реакции на стресс также имеют генетический компонент (Heath et al. , 1993), и некоторые рыбы могут быть предрасположены к последовательному проявлению высокого или низкого уровня кортизола в ответ на стрессоры (Pottinger et al. , 1992 b ; Tort и др. , 2001), паттерн, который, по-видимому, коррелирует с поведением (Øverli и др. , 2002). Тенденция к большим различиям в реакции на стресс между таксонами является признаком, который, по-видимому, является по крайней мере частично наследственным (Fevolden et al. , 1991; Fevolden and Røed, 1993; Pottinger et al. , 1994). Феволден и др. (1999) оценил значение наследуемости 0,56 для повышения уровня кортизола в плазме, измеренного у взрослой радужной форели после воздействия трех стрессовых событий, каждое из которых происходило с интервалом более 1 месяца. Точно так же Танк и др. (2001) недавно попытались рассчитать оценки наследуемости индуцированного стрессором повышения уровня кортизола в плазме у обыкновенного карпа ( Cyprinus carpio ) и определили, с оговоркой, относительно высокое среднее значение наследуемости 0,60 для андрогенетической стаи. Однако неясно, действительно ли рыбы, демонстрирующие относительно высокую или низкую реакцию на кортикостероиды, «более или менее подвержены стрессу», чем другие, или просто обладают иной способностью реагировать на стрессоры. Различия в физиологических механизмах, которые могли бы объяснить широкие вариации, остаются в значительной степени неизученными, но Поттингер и др. (2000) недавно обнаружили, что высокие уровни кортизола, превышающие 1500 нг/мл у голавля ( Leuciscus cephalus ) после нарушения, связаны с низким сродством к кортикостероидным рецепторам.
Точно так же Танк и др. (2001) недавно попытались рассчитать оценки наследуемости индуцированного стрессором повышения уровня кортизола в плазме у обыкновенного карпа ( Cyprinus carpio ) и определили, с оговоркой, относительно высокое среднее значение наследуемости 0,60 для андрогенетической стаи. Однако неясно, действительно ли рыбы, демонстрирующие относительно высокую или низкую реакцию на кортикостероиды, «более или менее подвержены стрессу», чем другие, или просто обладают иной способностью реагировать на стрессоры. Различия в физиологических механизмах, которые могли бы объяснить широкие вариации, остаются в значительной степени неизученными, но Поттингер и др. (2000) недавно обнаружили, что высокие уровни кортизола, превышающие 1500 нг/мл у голавля ( Leuciscus cephalus ) после нарушения, связаны с низким сродством к кортикостероидным рецепторам.
Факторы развития
Стадия развития рыбы также может влиять на ее реакцию на стрессор. Способность рыб реагировать на возмущение развивается очень рано в жизни. У личинок палтуса ( Scophthalmus maximus ) через 23 дня после вылупления и до метаморфоза наблюдалось повышение уровня кортизола во всем теле после того, как они подвергались воздействию высоких уровней сырой нефти в лабораторных условиях (Stephens 9).0004 и др. , 1997). Pottinger и Mosuwe (1994) определили, что ось HPI как у радужной, так и у кумжи реагирует на острый стресс уже через 5 недель после вылупления. Барри и др. (1995 a ) впоследствии определили, что радужная форель может вызывать значительную реакцию кортизола в плазме на острый стрессор в течение 2 недель после вылупления, за 1 неделю до начала кормления. Барри и др. (1995 b ) также отметили, что, хотя рыба не реагировала на стрессор сразу после вылупления, межпочечная ткань на этой стадии была способна секретировать кортизол при стимуляции АКТГ in vitro, , предполагая, что может быть короткий период после вылупления, когда ось HPI еще не функционирует.
Способность рыб реагировать на возмущение развивается очень рано в жизни. У личинок палтуса ( Scophthalmus maximus ) через 23 дня после вылупления и до метаморфоза наблюдалось повышение уровня кортизола во всем теле после того, как они подвергались воздействию высоких уровней сырой нефти в лабораторных условиях (Stephens 9).0004 и др. , 1997). Pottinger и Mosuwe (1994) определили, что ось HPI как у радужной, так и у кумжи реагирует на острый стресс уже через 5 недель после вылупления. Барри и др. (1995 a ) впоследствии определили, что радужная форель может вызывать значительную реакцию кортизола в плазме на острый стрессор в течение 2 недель после вылупления, за 1 неделю до начала кормления. Барри и др. (1995 b ) также отметили, что, хотя рыба не реагировала на стрессор сразу после вылупления, межпочечная ткань на этой стадии была способна секретировать кортизол при стимуляции АКТГ in vitro, , предполагая, что может быть короткий период после вылупления, когда ось HPI еще не функционирует. Рыбы с более быстрым темпом развития могут быть способны вызвать стрессовую реакцию гораздо раньше. Стаутхарт и др. (1998) наблюдали, что ось HPI у эмбрионов карпа, измеренная по кортизолу во всем теле, активировалась и вызывала реакцию кортизола через 50 часов после оплодотворения, за 6 часов до вылупления, когда икра подвергалась механическому давлению. Высокое содержание кортизола в эмбрионах или личинках может фактически повлиять на качество личинок. Маккормик (1998, 1999) обнаружили, что повышенный уровень кортизола у самок ласточек ( Pomacentrus amboinensis ), перенесенный в яичный желток, может привести к вылуплению личинок меньшего размера. Неизвестно, будет ли эндогенно продуцируемый кортизол, возникающий в результате стресса на этой стадии жизни, оказывать аналогичное негативное влияние на ранний рост личинок, хотя Weil et al. (2001) продемонстрировали положительную корреляцию между скоростью восстановления циркулирующего кортизола и скоростью роста у молоди радужной форели.
Рыбы с более быстрым темпом развития могут быть способны вызвать стрессовую реакцию гораздо раньше. Стаутхарт и др. (1998) наблюдали, что ось HPI у эмбрионов карпа, измеренная по кортизолу во всем теле, активировалась и вызывала реакцию кортизола через 50 часов после оплодотворения, за 6 часов до вылупления, когда икра подвергалась механическому давлению. Высокое содержание кортизола в эмбрионах или личинках может фактически повлиять на качество личинок. Маккормик (1998, 1999) обнаружили, что повышенный уровень кортизола у самок ласточек ( Pomacentrus amboinensis ), перенесенный в яичный желток, может привести к вылуплению личинок меньшего размера. Неизвестно, будет ли эндогенно продуцируемый кортизол, возникающий в результате стресса на этой стадии жизни, оказывать аналогичное негативное влияние на ранний рост личинок, хотя Weil et al. (2001) продемонстрировали положительную корреляцию между скоростью восстановления циркулирующего кортизола и скоростью роста у молоди радужной форели.
Имеются ограниченные данные, свидетельствующие о том, что у рыб наблюдается постоянное усиление реакции на стресс по мере их развития, но, по-видимому, они проявляют повышенную реакцию в периоды метаморфоза. Анадромные лососевые рыбы, например, оказываются особенно чувствительными к определенным факторам стресса, особенно к физическим нарушениям, в период трансформации молоди в смолт, время физиологических метаморфоз, во время которого молодь лосося готовится к входу в морскую воду. Бартон и др. (1985 a ) сообщили о двукратном увеличении реакции кортизола в плазме через 1 час после кратковременного воздействия стрессора на молодь кижуча ( Oncorhynchus kisutch ) в течение 3–4-месячного периода трансформации парр-смолта в качестве молодь рыб переходит с пресноводного на морское существование. Мауле и др. (1987) отметили, что смолты кижуча также оказываются особенно чувствительными к стрессовым факторам во время этой трансформации, а Shrimpton and Randall (1994) пришли к выводу, что дополнительный стресс у смоляющихся рыб может также нарушать некоторые необходимые физиологические изменения, происходящие в это время. По мере взросления рыбы первичные реакции на стресс могут на самом деле уменьшаться по величине, возможно, в результате снижения порога регуляторной обратной связи с наступлением половозрелости (Pottinger 9).0004 и др. , 1995).
По мере взросления рыбы первичные реакции на стресс могут на самом деле уменьшаться по величине, возможно, в результате снижения порога регуляторной обратной связи с наступлением половозрелости (Pottinger 9).0004 и др. , 1995).
Факторы окружающей среды
Почти все испытанные факторы окружающей среды могут влиять на степень реакции рыб на стрессоры. К внешним факторам относятся температура акклиматизации (Strange, 1980; Davis et al. , 1984; Barton and Schreck, 1987; Davis and Parker, 1990), соленость (Strange and Schreck, 1980; Mazik et al. , 1991; Barton). и Zitzow, 1995), время суток (Davis et al. , 1984; Barton et al. , 1986), длина волны света (Volpato and Barreto, 2001) и даже цвет фона резервуаров (Gilham and Baker, 1985). Факторы внутренней среды, включая состояние питания рыб (Barton и др., , 1988) и наличие болезней (Barton и др., , 1986), также могут влиять на величину реакции на стресс.
В некоторых случаях стресс-модифицирующие факторы, которые сами по себе вызывают хронический стресс, такие как плохое качество воды или токсиканты, могут фактически усугубить ситуацию (Barton и др. , 1985 b ) или ослаблять (Pickering and Pottinger, 1987; Hontela, 1997; Wilson et al. , 1998) реакцию кортизола на второй стрессор. Постоянная межпочечная активность будет подавлять ось HPI в результате отрицательной обратной связи кортизола, что вызывает ослабление реакции на дополнительные стрессоры. Таким образом, когда рыба, подвергшаяся воздействию хронического стрессора, впоследствии подвергается воздействию второго острого стрессора, кортикостероидная реакция на дополнительный стрессор может быть значительно снижена по сравнению с контрольной группой (Hontela, 19).97). Нарушение межпочечной функции из-за хронического стресса было продемонстрировано in vivo при воздействии на рыб острого физического нарушения после воздействия различных загрязнителей (Hontela et al. , 1992; Wilson et al. , 1998; Norris et al. , 1999; Laflamme и др. , 2000).
, 1992; Wilson et al. , 1998; Norris et al. , 1999; Laflamme и др. , 2000).
Эта явная межпочечная дисфункция также была оценена путем измерения функциональной целостности межпочечной ткани in vitro в качестве биотестирования для мониторинга окружающей среды. Бродер и др. (1997) разработал относительно простой протокол перфузии, а совсем недавно Leblond et al. (2001) описан метод приготовления и использования суспензий межпочечных клеток для количественной оценки степени in vitro стероидогенного ингибирования стимулированной АКТГ межпочечной ткани на клеточном уровне. Эти и подобные подходы использовались этой и другими группами исследователей для оценки механизмов, участвующих в угнетении межпочечной способности после воздействия загрязняющих веществ, включая тяжелые металлы и хлорорганические соединения (Brodeur 9).0004 и др. , 1998 г.; Жирар и др. , 1998 г.; Уилсон и др. , 1998 г. ; Леблон и Хонтела, 1998 г.; Бенгира и Онтела, 2000 г.; Лафламм и др. , 2000).
; Леблон и Хонтела, 1998 г.; Бенгира и Онтела, 2000 г.; Лафламм и др. , 2000).
Повторяющиеся стрессоры
Рыбы могут проявлять кумулятивный ответ на повторяющиеся стрессоры (Carmichael et al. , 1983; Flos et al. , 1988; Maule et al. , 1988). Бартон и др. (1986) обнаружили, что, когда молодь чавычи подвергалась воздействию нескольких стрессоров при обработке, пиковые реакции кортизола после последнего нарушения были кумулятивными. Это явление было продемонстрировано у этого вида на вторичном физиологическом уровне с помощью глюкозы плазмы (Barton и др. , 1986; Mesa, 1994), а также на уровне всего животного, используя в качестве индикатора время реакции, чтобы избежать вредного раздражителя или хищника (Sigismondi and Weber, 1988; Mesa, 1994).
Однако повторное воздействие умеренных стрессоров может снизить чувствительность рыб и ослабить нейроэндокринные и метаболические реакции на последующее воздействие стрессоров (Reid et al. , 1998; см. также последний раздел). Например, Barton и др. (1987) подвергали молодь радужной форели воздействию одного из трех различных кратковременных стрессоров один раз в день в течение 10 недель и в конце этого времени измеряли их реакцию на резкое обращение. Реакция кортизола плазмы была примерно вдвое меньше, чем у наивных, ранее не подвергавшихся стрессу рыб, что указывает на возможную десенсибилизацию оси HPI к повторяющимся нарушениям. Совпадение и значительное снижение реакции уровня глюкозы в плазме в группе лечения, что предполагает участие катехоламиновой реакции, предполагает общее привыкание к повторяющемуся стрессору.
, 1998; см. также последний раздел). Например, Barton и др. (1987) подвергали молодь радужной форели воздействию одного из трех различных кратковременных стрессоров один раз в день в течение 10 недель и в конце этого времени измеряли их реакцию на резкое обращение. Реакция кортизола плазмы была примерно вдвое меньше, чем у наивных, ранее не подвергавшихся стрессу рыб, что указывает на возможную десенсибилизацию оси HPI к повторяющимся нарушениям. Совпадение и значительное снижение реакции уровня глюкозы в плазме в группе лечения, что предполагает участие катехоламиновой реакции, предполагает общее привыкание к повторяющемуся стрессору.
Промежуток времени между дискретными стрессорами, воздействие множественных стрессоров и тяжесть непрерывных стрессоров являются важными факторами, которые, вероятно, будут влиять на реакцию рыб. Если стрессоры, по отдельности или в сочетании, не являются достаточно сильными, чтобы бросить вызов гомеостатическим механизмам рыб за их компенсаторные пределы или навсегда изменить их, что в конечном итоге может привести к смерти, физиологические процессы обычно адаптируются, чтобы компенсировать стресс (Schreck, 1981, 2000). В этих случаях химические показатели крови, такие как кортизол, используемые для оценки стресса, могут казаться «нормальными», и для оценки физиологического состояния рыбы могут потребоваться альтернативные подходы, такие как определение величины реакции на дополнительный острый стрессор.
В этих случаях химические показатели крови, такие как кортизол, используемые для оценки стресса, могут казаться «нормальными», и для оценки физиологического состояния рыбы могут потребоваться альтернативные подходы, такие как определение величины реакции на дополнительный острый стрессор.
РЕЗЮМЕ
Знания и понимание того, что представляет собой стресс у рыб, значительно расширились за последние несколько десятилетий, особенно в области физиологических механизмов и реакций, которые приводят к изменениям в метаболизме и росте, иммунных функциях, репродуктивной способности и нормальном поведении. . Первичные реакции на стресс у актиноптеригий включают ряд гормональных изменений, но особенно изменения уровня циркулирующего кортизола и катехоламинов. Вторичные реакции, которые могут быть вызваны или не быть вызваны непосредственно эндокринной реакцией, включают измеримые изменения уровня глюкозы, лактата или молочной кислоты в крови и основных ионов (9). 0004, например, хлорид, натрий и калий), а также уровни гликогена и БТШ в тканях. Третичные ответы, включая изменения в росте, устойчивости к болезням и поведении, могут быть прямо или косвенно результатом этих первичных и вторичных ответов. Однако многие другие очевидные факторы влияют на характерные реакции рыб на стресс и включают генетические (, например, виды, штаммы), связанные с развитием (, например, стадии жизненного цикла) и экологические (, например, , температура, питание, качество воды). ) факторы.
0004, например, хлорид, натрий и калий), а также уровни гликогена и БТШ в тканях. Третичные ответы, включая изменения в росте, устойчивости к болезням и поведении, могут быть прямо или косвенно результатом этих первичных и вторичных ответов. Однако многие другие очевидные факторы влияют на характерные реакции рыб на стресс и включают генетические (, например, виды, штаммы), связанные с развитием (, например, стадии жизненного цикла) и экологические (, например, , температура, питание, качество воды). ) факторы.
Интерпретация изменений, происходящих в физиологических переменных, может быть более проблематичной, чем реальное измерение ответов, по двум причинам. Во-первых, различные генетические факторы, факторы развития и окружающей среды могут оказывать модифицирующее влияние на величину и продолжительность реакции на стресс. Не зная, в какой степени эти другие факторы могли повлиять на реакцию, трудно интерпретировать биологическую значимость этой реакции в конкретном контексте. Вторым фактором, усложняющим интерпретацию данных, является изменчивость и явное несоответствие между рыбами в ответах разных характеристик биохимии крови. Например, вид, у которого наблюдается наибольшее увеличение реакции кортизола в плазме по сравнению с другими таксонами, может не быть тем же видом, который вызывает наибольшее увеличение вторичной реакции, такой как глюкоза или лактат, при воздействии идентичного стрессора. Таким образом, вид или группа, которые кажутся «наиболее подверженными стрессу», на что указывает один конкретный индикатор или уровень реакции, не обязательно могут отражать ту же самую степень стресса, если измерять ее по другому аспекту реакции.
Вторым фактором, усложняющим интерпретацию данных, является изменчивость и явное несоответствие между рыбами в ответах разных характеристик биохимии крови. Например, вид, у которого наблюдается наибольшее увеличение реакции кортизола в плазме по сравнению с другими таксонами, может не быть тем же видом, который вызывает наибольшее увеличение вторичной реакции, такой как глюкоза или лактат, при воздействии идентичного стрессора. Таким образом, вид или группа, которые кажутся «наиболее подверженными стрессу», на что указывает один конкретный индикатор или уровень реакции, не обязательно могут отражать ту же самую степень стресса, если измерять ее по другому аспекту реакции.
Реакция на стрессор представляет собой динамический процесс, и физиологические измерения, проводимые в течение определенного периода времени, являются лишь репрезентативными мгновенными «моментальными снимками» этого процесса. Значительная задержка, в зависимости от уровня и типа реакции, может происходить от начального восприятия стрессора ЦНС до времени, когда уровень кортизола плазмы или другой интересующий признак достигает пикового уровня реакции. Таким образом, измерение кортизола в плазме само по себе может не обязательно отражать степень стресса, испытываемого рыбой в данный момент, а, скорее, отражать степень ранней или первоначальной реакции.
Таким образом, измерение кортизола в плазме само по себе может не обязательно отражать степень стресса, испытываемого рыбой в данный момент, а, скорее, отражать степень ранней или первоначальной реакции.
Оценка факторов, влияющих на величину, продолжительность и восстановление кортизола и других физиологических изменений у рыб во время реакции на стресс, важна для правильной интерпретации экспериментальных данных и разработки эффективных программ биологического мониторинга. Кроме того, понимание тенденций в изменениях, происходящих у рыб в ответ на стрессоры, часто может дать подсказки, которые помогут связать физиологические реакции особей с изменениями продуктивности, проявляющимися на уровне популяции, которые могут повлиять на их здоровье и выживаемость.
Таблица 1. Примеры средних (± стандартная ошибка) концентраций кортизола в плазме у выбранной молоди пресноводных рыб до и через 1 час после того, как они подверглись идентичному 30-секундному всплытию с воздуха (обработка стрессора). *
*
Открыть в новой вкладке
Таблица 1. Примеры средних (± стандартная ошибка) концентраций кортизола в плазме у выбранной молоди пресноводных рыб до и через 1 час после того, как они подверглись идентичному 30-секундному всплытию с воздуха (обработка стрессора). *
Открыть в новой вкладке
Открыть в новой вкладкеСкачать слайд
Рис. 1. Физические, химические и другие воспринимаемые стрессоры воздействуют на рыб, вызывая физиологические и связанные с ними эффекты, которые группируются как первичные, вторичные и третичные реакции или реакции всего животного. В некоторых случаях первичные и вторичные реакции, в свою очередь, могут напрямую влиять на вторичные и третичные реакции соответственно, как показано стрелками
1
Из Симпозиума Стресс — больше, чем болезнь? Сравнительный взгляд на стресс и адаптацию , представленный на ежегодном собрании Общества интегративной и сравнительной биологии 3–7 января 2001 г. в Чикаго, штат Иллинойс.
в Чикаго, штат Иллинойс.
2
Эл. Клиффу Саммерсу за организацию этого симпозиума, и я благодарен Обществу интегративной и сравнительной биологии и Управлению исследований и последипломного образования Университета Южной Дакоты за их поддержку.
Ссылки
Адамс
,
С. М.
(ред.)
1990
. Биологические индикаторы стресса у рыб . Серия 8 симпозиумов Американского общества рыболовства, Бетесда, Мэриленд.
Avella
,
M.
, CB Schreck и P. Prunet.
1991
. Концентрация пролактина и кортизола в плазме стрессового кижуча, Oncorhynchus kisutch , в пресной или соленой воде.
Общий комп. Эндокринол
,
81
21
-27.
Barnett
,
C.W.
и N.W. Pankhurst.
1998
. Влияние обычных лабораторных и хозяйственных методов на реакцию на стресс зеленой камбалы Rhombosolea tapirina (Günther, 1862).
Аквакультура
,
162
313
-329.
Барри
,
Т. П.
, Дж. А. Мэлисон, Дж. А. Хелд и Дж. Дж. Пэрриш.
1995
. Онтогенез стрессовой реакции кортизола у личинок радужной форели.
Общий комп. Эндокринол
,
97
57
-65.
Барри
,
Т. П.
, М. Очиаи и Дж. А. Мэлисон.
А. Мэлисон.
1995
. In vitro Влияние АКТГ на внутрипочечный кортикостероидогенез во время раннего развития личинок радужной форели.
Общий комп. Эндокринол
,
99
382
-387.
Бартон
,
Б. А.
1997
. Стресс у рыб: прошлое, настоящее и будущее — историческая перспектива. В Г. К. Ивама, А. Д. Пикеринг, Дж. П. Самптер и К. Б. Шрек (ред.), Стресс и здоровье рыб в аквакультуре, , стр. 1–33. соц. Эксп. биол. Сем. сер. 62, Кембриджский университет. Press, Кембридж, Великобритания
Бартон
,
Б. А.
2000
. Лососевые рыбы различаются по своим реакциям кортизола и глюкозы на стресс при обращении и транспортировке.
Северная Америка Дж. Аквакульт
Аквакульт
,
62
12
-18.
Barton
,
B. A.
, H. Bollig, B. L. Hauskins и C. R. Jansen.
2000
. Ювенильный бледный ( Scaphirhynchus albus ) и гибридный бледный × лопатоносый ( S. albus × platornychus ) осетры проявляют низкую физиологическую реакцию на резкое обращение и жесткое ограничение свободы.
Комп. Биохим. Физиол
,
126А
125
-134.
Barton
,
B. A.
и W. P. Dwyer.
1997
. Физиологическое стрессовое воздействие постоянного и импульсного электрошока на молодь форели.
Дж. Фиш Биол
Фиш Биол
,
51
998
-1008.
Бартон
,
Б. А.
и Г. К. Ивама.
1991
. Физиологические изменения у рыб в результате стресса в аквакультуре с акцентом на реакцию и эффекты кортикостероидов.
Энн. Rev. Fish Dis
,
1
3
-26.
Бартон
,
Б. А.
, Р. Э. Питер и К. Р. Пауленку.
1980
. Уровни кортизола в плазме мальков радужной форели ( Salmo gairdneri ) в состоянии покоя, а также при обработке, заключении, транспортировке и хранении.
Кан. Дж. Фиш. Аква. Наука
,
37
805
-811.
Barton
,
B.A.
, A.B. Rahn, G. Feist, H. Bollig и CB Schreck.
1998
. Реакция на физиологический стресс пресноводного веслоноса ( Polyodon spathula ) к острым физическим расстройствам.
Комп. Биохим. Физиол
,
120А
355
-363.
Barton
,
B.A.
и C.B. Schreck.
1987
. Влияние температуры акклиматизации на межпочечный и углеводный стресс у молоди чавычи ( Oncorhynchus tshawytscha ).
Аквакультура
,
62
299
-310.
Бартон
,
Б. А.
, К. Б. Шрек и Л. Д. Бартон.
Б. Шрек и Л. Д. Бартон.
1987
. Влияние хронического введения кортизола и ежедневного острого стресса на рост, физиологические состояния и реакцию на стресс у молоди радужной форели.
Дис. Аква. Орг
,
2
173
-185.
Barton
,
B.A.
, C.B. Schreck, R.D. Ewing, A.R. Hemmingsen и R. Patino.
1985
. Изменения кортизола плазмы при стрессе и смолтификации у кижуча, Oncorhynchus kisutch .
Общий комп. Эндокринол
,
59
468
-471.
Barton
,
B. A.
, C. B. Schreck и L. G. Fowler.
1988
. Голодание и содержание диеты влияют на вызванные стрессом изменения уровня глюкозы и кортизола в плазме у молоди чавычи.
Голодание и содержание диеты влияют на вызванные стрессом изменения уровня глюкозы и кортизола в плазме у молоди чавычи.
Прогр. Fish-Cult
,
50
16
-22.
Barton
,
B. A.
, C. B. Schreck и L. A. Sigismondi.
1986
. Множественные острые нарушения вызывают кумулятивные физиологические стрессовые реакции у молоди чавычи.
Пер. Являюсь. Рыбы. Соц
,
115
245
-251.
Бартон
,
Б. А.
, Г. Вайнер и С. Б. Шрек.
1985
. Влияние предшествующего воздействия кислоты на физиологические реакции молоди радужной форели ( Salmo gairdneri ) на острый стресс при обращении.
Кан. Дж. Фиш. Аква. Наука
,
42
710
-717.
Barton
,
B. A.
и R. E. Zitzow.
1995
. Физиологические реакции молоди судака на стресс при восстановлении в соленой воде.
Прогр. Fish-Cult
,
57
267
-276.
Беланже
,
Дж. М.
, Дж. Х. Сон, К. Д. Лаугеро, Г. П. Моберг, С. И. Дорошов, С. Э. Ланкфорд и Дж. Дж. Чех мл.
1206 900. Влияние краткосрочного управления стрессом и инъекций АКТГ на уровень кортизола в плазме у культивируемого белого осетра, Acipenser transmontanus .
Аквакультура
,
203
165
-176.
Бенгуира
,
С.
и А. Онтела.
2000
. Адренокортикотропин- и циклический аденозин-3′,5′-монофосфат-стимулированная секреция кортизола в межпочечной ткани радужной форели, подвергшейся воздействию соединений ДДТ in vitro.
Окружающая среда. Токсикол. Хим
,
19
842
-847.
Брэдфорд
,
К. С.
, М. С. Фитцпатрик и К. Б. Шрек.
1992
. Доказательства сверхкороткопетлевой обратной связи в АКТГ-индуцированном интерренальном стероидогенезе у кижуча: острое самовыражение секреции кортизола in vitro.
Общий комп. Эндокринол
,
87
292
-299.
Brodeur
,
JC
, C. Daniel, AC Ricard и A. Hontela.
1998
. Реакция in vitro на АКТГ межпочечной ткани радужной форели ( Oncorhynchus mykiss ) подвергается воздействию кадмия.
Аква. Токсикол
,
42
103
-113.
Brodeur
,
JC
, C. Girard и A. Hontela.
1997
. Использование перифузии для оценки in vitro функциональной целостности межпочечной ткани у рыб из загрязненных мест.
Окружающая среда. Токсикол. Хим
,
16
2171
-2178.
Коричневый
,
Дж. А.
А.
1993
. Эндокринные реакции на загрязнители окружающей среды. В Дж. К. Рэнкин и Ф. Б. Дженсен (ред.), Экофизиология рыб, , стр. 276–296. Рыба Рыба. сер. 9, Чепмен и Холл, Лондон.
Браун
,
S.
, К. Федорук и Дж. Г. Илз.
1978
. Физическая травма из-за инъекции или удаления крови вызывает временное повышение уровня тироксина в плазме у радужной форели, Салмо гэрднери .
Кан. Дж. Зоол
,
56
1998
-2003.
Кэрнс
,
В. В.
, П. В. Ходсон и Дж. О. Нриагу. (ред.)
1984
. Воздействие загрязняющих веществ на рыболовство . Уайли, Нью-Йорк.
Кармайкл
,
Г. Дж.
, Г. А. Ведемейер, Дж. П. Маккрарен и Дж. Л. Миллард.
1983
. Физиологические последствия стресса при обращении и буксировке малоротого окуня.
Прогр. Fish-Cult
,
45
110
-113.
Carragher
,
JF
и JP Sumpter.
1990
. Влияние кортизола на секрецию половых стероидов культивируемыми фолликулами яичников радужной форели.
Общий комп. Эндокринол
,
77
403
-407.
Carragher
,
Дж. Ф.
, Дж. П. Самптер, Т. Г. Поттингер и А. Д. Пикеринг.
Г. Поттингер и А. Д. Пикеринг.
1989
. Вредное воздействие имплантации кортизола на репродуктивную функцию у двух видов форели, Salmo trutta L. и Salmo gairdneri Richardson.
Общий комп. Эндокринол
,
76
310
-321.
Chrousos
,
Г. П.
1998
. Стрессоры, стресс и нейроэндокринная интеграция адаптивного ответа.
Энн. Академик Нью-Йорка наука
,
851
311
-335.
Congleton
,
JL
, WJ LaVoie, CB Schreck и LE Davis.
2000
. Показатели стресса у мигрирующей молоди чавычи и стальноголового лосося дикого и рыбоводного происхождения до и после перевозки баржей.
Пер. Являюсь. Рыбы. Соц
,
129
946
-961.
Дэвис
,
K.B.
и N.C. Parker.
1990
. Физиологический стресс у полосатого окуня: влияние температуры акклиматизации.
Аквакультура
,
91
349
-358.
Дэвис
,
К.Б.
, М.А. Саттл и Н.К. Паркер.
1984
. Биотические и абиотические влияния на ритм кортикостероидных гормонов у канального сома.
Пер. Являюсь. Рыбы. Соц
,
113
414
-421.
Дональдсон
,
Э. М.
М.
1981
. Гипофизарно-межпочечная ось как индикатор стресса у рыб. В году нашей эры Пикеринг (ред.), Стресс и рыба, стр. 11–47. Академик Пресс, Нью-Йорк.
Fevolden
,
SE
, T. Refstie и KH Røed.
1991
. Селекция на стрессовую реакцию с высоким и низким уровнем кортизола у атлантического лосося (9).0004 Salmo salar ) и радужная форель ( Oncorhynchus mykiss ).
Аквакультура
,
95
53
-65.
Fevolden
,
SE
и KH Røed.
1993
. Кортизол и иммунные характеристики у радужной форели ( Oncorhynchus mykiss ), отобранной по высокой или низкой устойчивости к стрессу.
Дж. Фиш Биол
,
43
919
-930.
Февольден
,
Ю.-В.
, К. Х. Рёд, К. Т. Фьялестад и Дж. Штейн.
1999
. Уровни лизоцима и кортизола после стресса у взрослой радужной форели: наследственность и генетические корреляции.
Дж. Фиш Биол
,
54
900
-910.
Flos
,
R.
, Л. Рейг, П. Торрес и Л. Торт.
1988
. Первичные и вторичные стрессовые реакции на сортировку и выборку радужной форели, Salmo gairdneri .
Аквакультура
,
71
99
-106.
Fritsche
,
R.
, С. Г. Рейд, С. Томас и С. Ф. Перри.
1993
. Опосредованное серотонином высвобождение катехоламинов у радужной форели, Oncorhynchus mykiss .
Дж. Экспл. Биол
,
178
191
-204.
Фрайер
,
Дж. Н.
и Р. Э. Питер.
1977
. Гипоталамический контроль секреции АКТГ у золотых рыбок. III. Исследования имплантатов гипоталамического кортизола.
Общий комп. Эндокринол
,
33
215
-225.
Gamperl
,
А.К.
, М. М. Виджаян и Р.Г. Бутилье.
М. Виджаян и Р.Г. Бутилье.
1994
. Экспериментальный контроль уровня гормона стресса у рыб: методы и приложения.
Rev. Fish Biol. Рыба
,
4
215
-255.
Гилхэм
,
И. Д.
и Б. И. Бейкер.
1985
. Черный фон облегчает реакцию костистых рыб на стресс.
Дж. Эндокринол
,
105
99
-105.
Жирар
,
C.
, JC Brodeur и A. Hontela.
1998
. Реакция межпочечной ткани желтого окуня ( Perca flavescens ) из загрязненных участков на пробу с АКТГ in vivo.
Кан. Дж. Фиш. Аква. Наука
Дж. Фиш. Аква. Наука
,
55
438
-450.
Haddy
,
J. A.
и NW Pankhurst.
1999
. Стресс-индуцированные изменения концентрации половых стероидов в плазме крови черного леща.
Дж. Фиш Биол
,
55
1304
-1316.
Hanson
,
RC
и WR Fleming.
1979
. Уровни кортизола в сыворотке молоди боуфина, Amia calva : эффекты гипофизэктомии, заместительной гормональной терапии и солености окружающей среды.
Комп. Биохим. Физиол
,
63А
499
-502.
Пустошь
,
D.D.
, NJ Bernier, JW Heath и GK Iwama.
1993
. Влияние генетики, окружающей среды и взаимодействия на рост и реакцию на стресс мальков чавычи ( Oncorhynchus tshawytscha ).
Кан. Дж. Фиш. Аква. Наука
,
50
435
-442.
Хемре
,
Г.-И.
, Г. Ламберсен и Ø. Ложь.
1991
. Влияние пищевых углеводов на реакцию трески на стресс (9).0004 Gadus morhua ).
Аквакультура
,
95
319
-328.
Хонтела
,
А.
1997
. Эндокринные и физиологические реакции рыб на ксенобиотики: роль глюкокортикостероидных гормонов.
Эндокринные и физиологические реакции рыб на ксенобиотики: роль глюкокортикостероидных гормонов.
Rev. Toxicol
,
1
1
-46.
Hontela
,
A.
, Дж. Б. Расмуссен, К. Оде и Г. Шевалье.
1992
. Нарушенная реакция кортизола на стресс у рыб из среды, загрязненной ПАУ, ПХД и ртутью.
Арх. Окружающая среда. Контам. Токсикол
,
22
278
-283.
Бездельник
,
Д. Р.
и М. Дж. О’Халлоран.
1970
. Стероиды хондростана: Идентификация межпочечной ткани у американского осетра, Acipenser oxyrhynchus Mitchill, гистологическими и гистохимическими методами.
Дж. Эндокринол
,
48
621
-626.
Бездельник
,
Д. Р.
и Б. Траскотт.
1966
. 1α-гидроксикортикостерон из хрящевых рыб: новый надпочечниковый стероид в крови.
Дж. Рыба. Рез. Доска может
,
23
615
-619.
Бездельник
,
Д. Р.
и Б. Траскотт.
1967
. 1α-Гидроксикортикостерон: синтез in vitro и свойства внутрипочечного стероида в крови хрящевых рыб (Род Raja ).
Стероиды
,
9
457
-477.
Бездельник
,
Д. Р.
и Б. Траскотт.
1972
. Кортикостероиды в рыбе. В Д. Р. Идлер (ред.), Стероиды у немлекопитающих позвоночных, , стр. 126–252. Академик Пресс, Нью-Йорк.
Iwama
,
GK
, JC McGeer и NJ Bernier.
1992
. Влияние поголовья и плотности выращивания на стрессовую реакцию молоди кижуча ( Oncorhynchus kisutch ).
ICES Mar. Sci. Симп
,
194
67
-83.
Iwama
,
G.K.
, A.D. Pickering, J.P. Sumpter и C.B. Schreck.(ed.)
1997
. Стресс и здоровье рыб в аквакультуре . соц. Эксп. биол. Сем. сер. 62. Кембриджский университет. Press, Cambridge, UK
соц. Эксп. биол. Сем. сер. 62. Кембриджский университет. Press, Cambridge, UK
Iwama
,
GK
, PT Thomas, RB Forsyth и MM Vijayan.
1998
. Экспрессия белков теплового шока у рыб.
Rev. Fish Biol. Рыба
,
8
35
-56.
Какидзава
,
С.
, Т. Канеко, С. Хасэгава и Т. Хирано.
1995
. Влияние кормления, голодания, фоновой адаптации, острого стресса и изнурительных упражнений на концентрацию соматлактина в плазме у радужной форели.
Общий комп. Эндокринол
,
98
137
-146.
Лафламм
,
Ж. -С.
-С.
, Ю. Куйяр, П. Г. К. Кэмпбелл и А. Хонтела.
2000
. Внутрипочечная секреция металлотионеина и кортизола в зависимости от воздействия Cd, Cu и Zn у желтого окуня, Perca flavescens из озер Абитиби.
Кан. Дж. Фиш. Аква. Наука
,
57
1692
-1700.
Леблон
,
В. С.
, М. Биссон и А. Хонтела.
2001
. Ингибирование секреции кортизола в рассеянных клетках головной почки радужной форели ( Oncorhynchus mykiss ) эндосульфаном, хлорорганическим пестицидом.
Общий комп. Эндокринол
,
121
48
-56.
Леблон
,
В. С.
С.
и А. Хонтела.
1999
. Влияние in vitro воздействия кадмия, ртути, цинка и 1-(2-хлорфенил)-1-(4-хлорфенил)-2,2-дихлорэтана на стероидогенез диспергированными интерренальными клетками радужной форели ( Oncorhynchus mykiss ) .
Токсикол. заявл. Фармакол
,
157
16
-22.
Maule
,
A.G.
, C.B. Schreck, C.S. Bradford и B.A. Barton.
1988
. Физиологические последствия сбора и транспортировки мигрирующей молоди чавычи мимо плотин на реке Колумбия.
Пер. Являюсь. Рыбы. Соц
,
117
245
-261.
Maule
,
A. G.
G.
, CB Schreck и S.L. Kaattari.
1987
. Изменения в иммунной системе кижуча ( Oncorhynchus kisutch ) при трансформации парра в корюшку и после имплантации кортизола.
Кан. Дж. Фиш. Аква. Наука
,
44
161
-166.
Мазо
,
М. М.
, Ф. Мазо и Э. М. Дональдсон.
1977
. Первичные и вторичные эффекты стресса у рыб.
Пер. Являюсь. Рыбы. Соц
,
106
201
-212.
Мазик
,
PM
, B.A. Simco и N.C. Parker.
1991
. Влияние жесткости воды и солей на выживаемость и физиологические характеристики полосатого окуня во время и после транспортировки.
Пер. Являюсь. Рыбы. Соц
,
120
121
-126.
Маккормик
,
М. И.
1998
. Материнский стресс, вызванный поведением рыб, влияет на качество потомства с помощью гормонального механизма.
Экология
,
79
1873
-1883.
Маккормик
,
М. И.
1999
. Экспериментальная проверка влияния материнских гормонов на качество личинок коралловых рифовых рыб.
Экология
,
118
412
-422.
McDonald
,
DG
, MD Goldstein и C. Mitton.
Mitton.
1993
. Реакция выращенной в заводских условиях ручьевой и озерной форели на транспортный стресс.
Пер. Являюсь. Рыбы. Соц
,
122
1127
-1138.
Меса
,
М. Г.
1994
. Влияние множественных острых стрессоров на способность избегания хищников и физиологию молоди чавычи.
Пер. Являюсь. Рыбы. Соц
,
123
786
-793.
Моммзен
,
Т. П.
, М. М. Виджаян и Т. В. Мун.
1999
. Кортизол у костистых рыб: динамика, механизмы действия и регуляция метаболизма.
Rev. Fish Biol. Рыба
,
9
211
-268.
Морган
,
Дж. Д.
, С. К. Балфри, М. М. Виджаян и Г. К. Ивама.
1996
. Физиологические реакции на воздействие гипосолевого раствора, а также стресс при обращении и ограничении у молодых дельфинов (mahimahi: Coryphaena hippurus ).
Кан. Дж. Фиш. Аква. Наука
,
53
1736
-1740.
Нанди
,
Дж.
1962
. Строение межпочечной железы костистых рыб.
Унив. Калифорния Опубликовано. Зоол
,
65
129
-212.
Ниими
,
А. Дж.
1990
. Обзор биохимических методов и других показателей для оценки здоровья рыб в водных экосистемах, содержащих токсичные химические вещества.
J. Great Lakes Res
,
16
529
-541.
Noga
,
EJ
, JH Kerby, W. King, D.P. Aucoin и F. Giesbrecht.
1994
. Количественное сравнение стрессовой реакции полосатого окуня ( Morone saxatilis ) и гибридный полосатый окунь ( Morone saxatilis × Morone chrysops и Morone saxatilis × Morone americana ).
Ам. Дж. Вет. Рез
,
55
405
-409.
Норрис
,
Д. О.
, С. Донахью, Р. М. Дорес, Дж. К. Ли, Т. А. Мальдонадо, Т. Рут и Дж. Д. Вудлинг.
1999
. Нарушение реакции коры надпочечников на стресс у кумжи, Salmo trutta , обитающий в загрязненных металлами водах реки Игл, штат Колорадо.
Общий комп. Эндокринол
,
113
1
-8.
Верли
,
Ø.
, Т. Г. Поттингер, Т. Р. Каррик, Э. Оверли и С. Винберг.
2002
. Различия в поведении между радужной форелью, отобранной по высокой и низкой реакции на стресс.
Дж. Экспл. Биол
,
205
391
-395.
Панкхерст
,
СЗ
и М. Дедуал.
1994
. Влияние отлова и восстановления на уровни кортизола, лактата и гонадных стероидов в плазме в естественной популяции радужной форели.
Дж. Фиш Биол
,
45
1013
-1025.
Панкхерст
,
N. W.
и Д. Ф. Шарплс.
1992
. Влияние отлова и удержания на концентрацию кортизола в плазме у луциана, Pagrus auratus .
австр. J. Mar. Freshwater Res
,
43
345
-356.
Пикеринг
,
А. Д.
(ред.)
1981
. Стресс и рыба . Академик Пресс, Нью-Йорк.
Пикеринг
,
А. Д.
1993
. Эндокринно-индуцированная патология у стрессированных лососевых рыб.
Рыба. Рез
,
17
35
-50.
Пикеринг
,
А. Д.
Д.
1998
. Стрессовые реакции выращиваемой рыбы. В К. Д. Блэк и А. Д. Пикеринг (ред.), Биология выращиваемой рыбы, , стр. 222–255. Sheffield Academic Press, Sheffield, UK
Pickering
,
AD
, и TG Pottinger.
1987
. Плохое качество воды подавляет реакцию кортизола лососевых рыб на обращение и содержание в неволе.
Дж. Фиш Биол
,
30
363
-374.
Пикеринг
,
AD
, Т. Г. Поттингер, Дж. Каррагер и Дж. П. Самптер.
1987
. Влияние острого и хронического стресса на уровень репродуктивных гормонов в плазме половозрелых самцов кумжи, Salmo trutta L.
Gen. Comp. Эндокринол
,
68
249
-259.
Pottinger
,
T. G.
, PHM Balm и AD Pickering.
1995
. Половая зрелость изменяет реакцию гипофизарно-межпочечной оси на стресс у самцов радужной форели.
Общий комп. Эндокринол
,
98
311
-320.
Поттингер
,
Т. Г.
, Т. Р. Кэррик, А. Эпплби и У. Э. Йоманс.
2000
. Высокий уровень кортизола в крови и низкое сродство к рецепторам кортизола: является ли голавль, Leuciscus cephalus , устойчивым к кортизолу костистым скелетом?
Общий комп. Эндокринол
,
120
108
-117.
Pottinger
,
T. G.
и T. A. Moran.
1993
. Различия кортизола плазмы и динамики кортизона при стрессе у двух линий радужной форели (9).0004 Oncorhynchus mykiss ).
Дж. Фиш Биол
,
43
121
-130.
Pottinger
,
T. G.
, T. A. Moran и J. A. W. Morgan.
1994
. Первичные и вторичные показатели стресса у потомства радужной форели ( Oncorhynchus mykiss ), отобранного по высокой и низкой стрессоустойчивости.
Дж. Фиш Биол
,
44
149
-163.
Pottinger
,
T. G.
G.
и E. Mosuwe.
1994
. Кортикостероидогенный ответ мальков и мальков кумжи и радужной форели на стресс окружающей среды в «критический период».
Общий комп. Эндокринол
,
95
350
-362.
Pottinger
,
T. G.
, A. D. Pickering и M. A. Hurley.
1992
. Согласованность реакции на стресс особей двух линий радужной форели, Oncorhynchus mykiss .
Аквакультура
,
103
275
-289.
Pottinger
,
T. G.
, P. Prunet и A. D. Pickering.
1992
. Влияние стресса в условиях изоляции на уровни циркулирующего пролактина у радужной форели ( Oncorhynchus mykiss ) в пресной воде.
Влияние стресса в условиях изоляции на уровни циркулирующего пролактина у радужной форели ( Oncorhynchus mykiss ) в пресной воде.
Общий комп. Эндокринол
,
88
454
-460.
Рэнд-Уивер
,
М.
, Т. Г. Поттингер и Дж. П. Самптер.
1993
. Концентрация соматолактина в плазме у лососевых рыб повышается при стрессе.
Дж. Эндокринол
,
138
509
-515.
Рэндалл
,
Д. Дж.
и С. Ф. Перри.
1992
. Катехоламины. In WS Hoar and DJ Randall (eds.), Fish physiology, Vol. 12Б, стр. 255–300. Академик Пресс, Нью-Йорк.
Рейд
,
С. Г.
, Н. Дж. Бернье и С. Ф. Перри.
1998
. Реакция на адренергический стресс у рыб: контроль накопления и высвобождения катехоламинов.
Комп. Биохим. Физиол
,
120С
1
-27.
Рейд
,
С. Г.
, М. М. Виджаян и С. Ф. Перри.
1996
. Модуляция накопления и высвобождения катехоламинов гипофизарно-межпочечной осью у радужной форели ( Oncorhynchus mykiss ).
Дж. Комп. Физиол
,
165Б
665
-676.
Rotllant
,
J.
, PHM Balm, NM Ruane, J. Pérez-Sánchez, SE Wendelaar Bonga и L. Tort.
Pérez-Sánchez, SE Wendelaar Bonga и L. Tort.
2000
. Гипофизарные пептиды, производные проопиомеланокортина, и гипоталамо-гипофизарно-межпочечная активность у дорады ( Sparus aurata ) при длительном скученном стрессе: дифференциальная регуляция высвобождения адренокортикотропного гормона и α-меланоцитостимулирующего гормона кортикотропин-рилизинг-гормоном и тиротропин-рилизинг-гормоном .
Общий комп. Эндокринол
,
119
152
-163.
Руане
,
N.M.
, SE Wendelaar Bonga и PHM Balm.
1999
. Различия между радужной форелью и кумжей в регуляции гипофизарно-межпочечной оси и физиологических показателях во время содержания.
Общий комп. Эндокринол
,
113
210
-219.
Sangalang
,
G. B.
, M. Weisbart и D. R. Idler.
1971
. Стероиды хондростана: Кортикостероиды и тестостерон в плазме американского атлантического осетра, Acipenser oxyrhynchus Mitchill.
Дж. Эндокринол
,
50
413
-421.
Шрек
,
ЦБ
1981
. Стресс и компенсация у костистых рыб: реакция на социальные и физические факторы. В г. н.э. Пикеринг (ред.), Стресс и рыба, стр. 295–321. Академик Пресс, Нью-Йорк.
Шрек
,
ЦБ
2000
. Накопление и долгосрочные последствия стресса у рыб. В Г. П. Моберг и Дж. А. Менч (ред. ), Биология стресса у животных, , стр. 147–158. CABI Publishing, Wallingford, UK
), Биология стресса у животных, , стр. 147–158. CABI Publishing, Wallingford, UK
Selye
,
H.
1973
. Эволюция концепции стресса.
Ам. Наука
,
61
692
-699.
Селье
,
Х.
1974
. Стресс без дистресса . Макклелланд Стюарт, Торонто.
Шримптон
,
Дж. М.
и Д. Дж. Рэндалл.
1994
. Снижение регуляции кортикостероидных рецепторов в жабрах кижуча из-за стресса и лечения кортизолом.
Ам. Дж. Физиол
,
267
Р
432
-R438.
Sigismondi
,
L. A.
и L. J. Weber.
1988
. Изменение времени реакции избегания у молоди чавычи, подвергшейся множественным острым стрессам при обращении.
Пер. Являюсь. Рыбы. Соц
,
117
196
-201.
Стивенс
,
С. М.
, Дж. А. Браун и С. К. Франклинг.
1997
. Стрессовые реакции личинок палтуса, Scopthalmus maximus L., на воздействие сублетальных концентраций нефтяных углеводородов.
Рыбная физиол. Биохим
,
17
433
-439.
Stouthart
,
AJHX
, ECHET Lucassen, FJC van Strien, PHM Balm, RAC Lock и SE Wendelaar Bonga.
1998
. Стресс-реакция гипофизарно-интерпочечной оси на ранних стадиях жизни карпа ( Cyprinus carpio ).
Дж. Эндокринол
,
157
127
-137.
Странный
,
Р. Дж.
1980
. Температура акклиматизации влияет на концентрацию кортизола и глюкозы у подвергнутых стрессу канальных сомов.
Пер. Являюсь. Рыбы. Соц
,
109
298
-303.
Странный
,
Р. Дж.
и К. Б. Шрек.
1980
. Морская вода и изоляция изменяют выживаемость и концентрацию кортизола у молоди чавычи. Копейя 1980: 351–353.
Странный
,
Р. Дж.
Дж.
, К. Б. Шрек и Р. Д. Юинг.
1978
. Концентрация кортизола в изолированной молоди чавычи ( Oncorhynchus tshawytscha ).
Пер. Являюсь. Рыбы. Соц
,
107
812
-819.
Самптер
,
Дж. П.
1997
. Эндокринология стресса. В Г. К. Ивама, А. Д. Пикеринг, Дж. П. Самптер и С. Б. Шрек (ред.), Стресс и здоровье рыб в аквакультуре, , стр. 95–118. соц. Эксп. биол. Сем. сер. 62, Кембриджский университет. Press, Cambridge, UK
Tank
,
M.W.T.
, K.-J. Вермёлен, Х. Бовенхейс и Х. Комен.
2001
. Наследственность реакции кортизола на стресс у андрогенетических карпов (9). 0004 Cyprinus carpio L).
0004 Cyprinus carpio L).
Аквакультура
,
199
283
-294.
Томас
,
П.
и Л. Робертсон.
1991
. Плазменные реакции кортизола и глюкозы на стресс у красной барабанной перепонки ( Sciaenops ocellatus ) на воздействие стрессоров на мелководье и на анестезию MS-222, сульфатом хинальдина и метомидатом.
Аквакультура
,
96
69
-86.
Tort
,
L.
, Д. Монтеро, Л. Робайна, Х. Фернандес-Паласиос и М. С. Искьердо.
2001
. Стабильность стрессовой реакции на повторяющиеся манипуляции у дорады Sparus aurata Linnaeus, 1758.
Aquacult. Рез
,
32
593
-598.
Виджаян
,
М. М.
и Т. В. Мун.
1994
. Стресс-реакция и исчезновение кортикостероидов и глюкозы в плазме у морского костистого морского ворона.
Кан. Дж. Зул
,
72
379
-386.
Volpato
,
G. L.
и Р. Э. Баррето.
2001
. Экологический синий свет предотвращает стресс у рыб нильской тиляпии.
Браз. Дж. Мед. биол. Рез
,
34
1041
-1045.
Waring
,
CP
, RM Stagg и MG Poxton.
1996
. Физиологические реакции на обращение с палтусом.
Дж. Фиш Биол
,
48
161
-173.
Wedemeyer
,
G. A.
, B. A. Barton и D. J. McLeay.
1990
. Стресс и акклиматизация. В CB Schreck и PB Moyle (ред.), Методы биологии рыб, стр. 451–489. Американское рыболовное общество, Бетесда, Мэриленд.
Wedemeyer
,
G. A.
и D. J. McLeay.
1981
. Методы определения устойчивости рыб к стрессорам окружающей среды. В году нашей эры Пикеринг (ред.), Стресс и рыба, стр. 247–275. Академик Пресс, Нью-Йорк.
Weil
,
L. S.
S.
, Т. П. Барри и Дж. А. Мэлисон.
2001
. Быстрый рост радужной форели коррелирует с быстрым снижением концентрации кортизола после стресса.
Аквакультура
,
193
373
-380.
Венделаар Бонга
,
Ю. Е.
1997
. Реакция рыб на стресс.
Физиол.
,
77
591
-625.
Уилсон
,
Дж. М.
, М. М. Виджаян, К. Дж. Кеннеди, Г. К. Ивама и Т. В. Мун.
1998
. Бета-нафтофлавон устраняет межпочечную чувствительность к стимуляции АКТГ у радужной форели.
Дж. Эндокринол
,
157
63
-70.
Винберг
,
S.
, А. Нильссон, П. Хилланд, В. Содерстом и Г. Э. Нильссон.
1997
. Серотонин как регулятор гипоталамо-гипофизарно-межпочечной активности костистых рыб.
Неврологи. Буквы
,
230
113
-116.
Winberg
,
S.
и Г. Э. Нильссон.
1993
. Роль моноаминовых нейротрансмиттеров мозга в агонистическом поведении и реакциях на стресс, особенно у рыб.
Комп. Биохим. Физиол
,
106С
597
-614.
Вудворд
,
С. С.
и Р.
 ..
.. Том 1. Защитные психологические механизмы…
Том 1. Защитные психологические механизмы… Большинство исследователей
не относит эту стадию к стрессу, с этим
нужно согласиться, т.к. никакой реакции
в это время пока нет.
Большинство исследователей
не относит эту стадию к стрессу, с этим
нужно согласиться, т.к. никакой реакции
в это время пока нет. Активация
процессов глюконеогенеза и образование
глюкозы в печени. Пермиссивное действие
по отношению к глюкагону и адреналину
приводит к увеличению распада гликогена,
что так же увеличивает уровень глюкозы
в крови. Подавление транспорта глюкозы
в мышечной и жировой ткани. Повышение
уровня глюкозы в крови приводит к
выделению инсулина.
Активация
процессов глюконеогенеза и образование
глюкозы в печени. Пермиссивное действие
по отношению к глюкагону и адреналину
приводит к увеличению распада гликогена,
что так же увеличивает уровень глюкозы
в крови. Подавление транспорта глюкозы
в мышечной и жировой ткани. Повышение
уровня глюкозы в крови приводит к
выделению инсулина.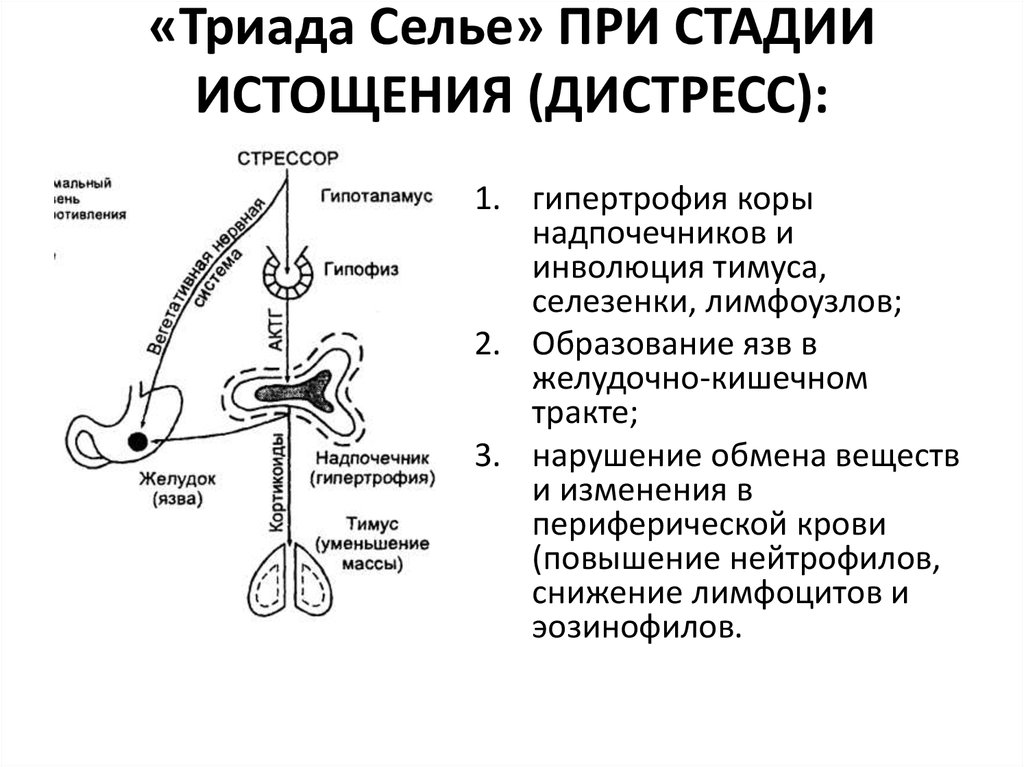
 С другой стороны, дистресс — это стресс, который оказывает негативное или плохое воздействие на организм. Именно стресс вызывает тревогу или чувство неудовольствия. Стресс обычно негативно влияет на нашу работоспособность и может привести к психическим и физическим проблемам.
С другой стороны, дистресс — это стресс, который оказывает негативное или плохое воздействие на организм. Именно стресс вызывает тревогу или чувство неудовольствия. Стресс обычно негативно влияет на нашу работоспособность и может привести к психическим и физическим проблемам. Хронический стресс возникает в результате длительного воздействия стрессоров. Хронические стрессоры могут быть не такими сильными, как острые стрессоры, но они более вредны, чем острые стрессоры. Это связано с тем, что следствием хронического стресса является накопленное воздействие стрессора в течение длительного времени. Хронический стресс влияет не только на физическое здоровье, но и на психическое здоровье. Эффекты возникают из-за накопленного стресса.
Хронический стресс возникает в результате длительного воздействия стрессоров. Хронические стрессоры могут быть не такими сильными, как острые стрессоры, но они более вредны, чем острые стрессоры. Это связано с тем, что следствием хронического стресса является накопленное воздействие стрессора в течение длительного времени. Хронический стресс влияет не только на физическое здоровье, но и на психическое здоровье. Эффекты возникают из-за накопленного стресса. Некоторые основные эффекты на системы организма:
Некоторые основные эффекты на системы организма: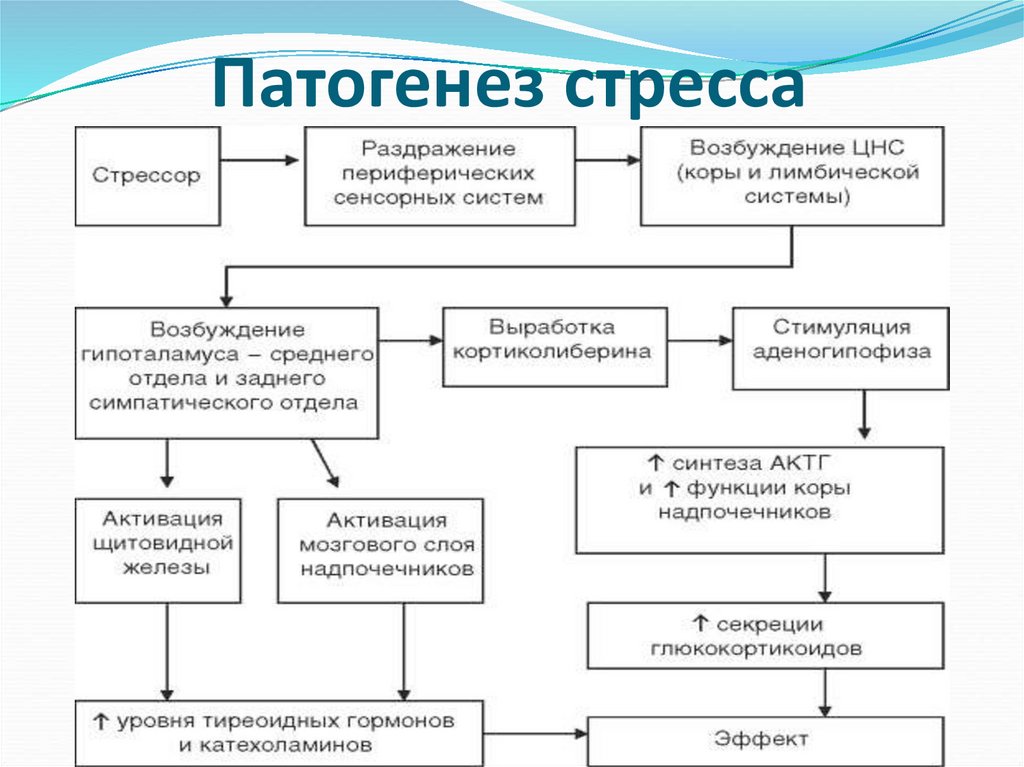
 По данным Tropy и соавт., стресс может вызывать повышение потребности организма в кислороде, спазм коронарных (сердечных) сосудов и электрическую нестабильность в проводящей системе сердца [14]. Хронический стресс также приводит к повышению уровня холестерина в крови. Постоянно высокий уровень холестерина и других жировых веществ в крови может вызвать атеросклероз, а иногда и стать причиной сердечного приступа. Кортизол также играет роль в накоплении брюшного жира, что приводит к ожирению. Профессиональный стресс также оказывает существенное влияние на возникновение ИБС [15].
По данным Tropy и соавт., стресс может вызывать повышение потребности организма в кислороде, спазм коронарных (сердечных) сосудов и электрическую нестабильность в проводящей системе сердца [14]. Хронический стресс также приводит к повышению уровня холестерина в крови. Постоянно высокий уровень холестерина и других жировых веществ в крови может вызвать атеросклероз, а иногда и стать причиной сердечного приступа. Кортизол также играет роль в накоплении брюшного жира, что приводит к ожирению. Профессиональный стресс также оказывает существенное влияние на возникновение ИБС [15].
 Провоспалительные цитокины возвращаются в ЦНС и вызывают симптомы усталости, недомогания, снижения аппетита и вялости, которые обычно ассоциируются с депрессией [18].
Провоспалительные цитокины возвращаются в ЦНС и вызывают симптомы усталости, недомогания, снижения аппетита и вялости, которые обычно ассоциируются с депрессией [18].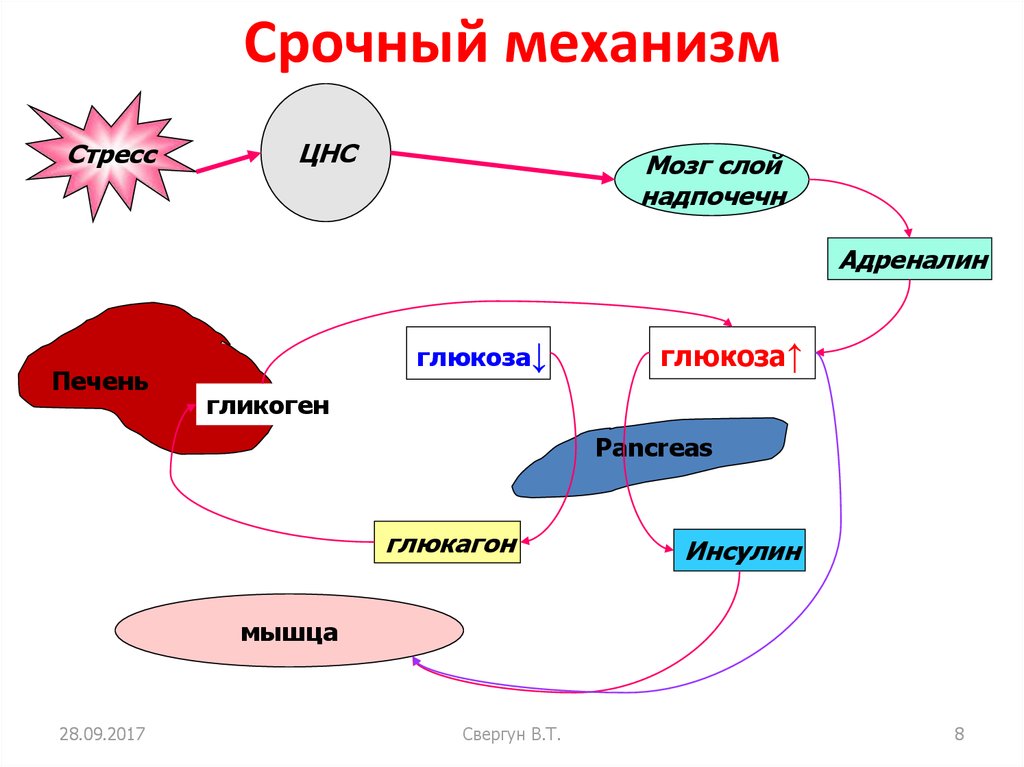 В некоторых случаях стресс также может быть причиной рака. Постоянная активация гипоталамо-гипофизарно-надпочечниковой системы (ГГН) при хроническом стрессе и депрессии, вероятно, ослабляет иммунный ответ и способствует развитию и прогрессированию некоторых видов рака [21]. Исследования показали, что стресс может способствовать колонизации костей клетками рака молочной железы.
В некоторых случаях стресс также может быть причиной рака. Постоянная активация гипоталамо-гипофизарно-надпочечниковой системы (ГГН) при хроническом стрессе и депрессии, вероятно, ослабляет иммунный ответ и способствует развитию и прогрессированию некоторых видов рака [21]. Исследования показали, что стресс может способствовать колонизации костей клетками рака молочной железы.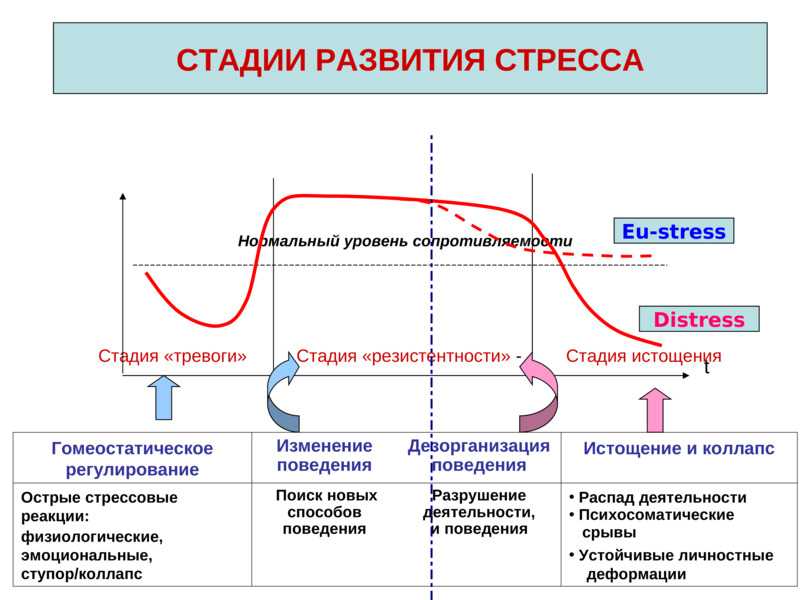 Люди, живущие в стрессовых условиях, более склонны к курению, что может привести к респираторным заболеваниям и даже к раку. Люди с аналогичным стрессом более уязвимы к употреблению алкоголя, что имеет свои последствия.
Люди, живущие в стрессовых условиях, более склонны к курению, что может привести к респираторным заболеваниям и даже к раку. Люди с аналогичным стрессом более уязвимы к употреблению алкоголя, что имеет свои последствия. Некоторым людям трудно, когда им нужно путешествовать или даже когда им нужно посетить какую-то вечеринку или мероприятие. Поэтому очень важно знать, что вызывает стресс в вашей жизни. Как только вы определите источники, вы сможете планировать управление ими. Вы можете управлять своим уровнем стресса, внося небольшие изменения в свой распорядок дня и уделяя время себе. Вот некоторые изменения образа жизни:
Некоторым людям трудно, когда им нужно путешествовать или даже когда им нужно посетить какую-то вечеринку или мероприятие. Поэтому очень важно знать, что вызывает стресс в вашей жизни. Как только вы определите источники, вы сможете планировать управление ими. Вы можете управлять своим уровнем стресса, внося небольшие изменения в свой распорядок дня и уделяя время себе. Вот некоторые изменения образа жизни: Диета с низким гликемическим индексом помогает поддерживать стабильный уровень глюкозы, который необходим вашему мозгу, чтобы он мог эффективно работать и справляться с повседневной жизнью. Во время стресса гормон стресса снижает иммунитет, и организм становится более восприимчивым к простуде и другим инфекциям. Продукты, богатые витаминами и антиоксидантами, могут помочь вам укрепить вашу иммунную систему. Витамины B и D необходимы для здоровой иммунной системы во время стресса. Следовательно, сбалансированная диета, включающая молочные продукты с низким содержанием жира, свежие фрукты и овощи, бобовые, орехи, семена и достаточное количество воды, может помочь вам справиться с негативными последствиями стресса. Следует избегать «фаст-фудов», таких как пицца, гамбургер, выпечка и т. д., поскольку они не только повышают уровень холестерина в организме, но также могут привести к ожирению и различным заболеваниям.
Диета с низким гликемическим индексом помогает поддерживать стабильный уровень глюкозы, который необходим вашему мозгу, чтобы он мог эффективно работать и справляться с повседневной жизнью. Во время стресса гормон стресса снижает иммунитет, и организм становится более восприимчивым к простуде и другим инфекциям. Продукты, богатые витаминами и антиоксидантами, могут помочь вам укрепить вашу иммунную систему. Витамины B и D необходимы для здоровой иммунной системы во время стресса. Следовательно, сбалансированная диета, включающая молочные продукты с низким содержанием жира, свежие фрукты и овощи, бобовые, орехи, семена и достаточное количество воды, может помочь вам справиться с негативными последствиями стресса. Следует избегать «фаст-фудов», таких как пицца, гамбургер, выпечка и т. д., поскольку они не только повышают уровень холестерина в организме, но также могут привести к ожирению и различным заболеваниям. Есть несколько способов, которыми упражнения помогают. Упражнения — один из самых распространенных и самых простых способов снижения стресса. Регулярные физические упражнения — это способ оставаться физически и умственно активным и здоровым. Физические упражнения не только снижают уровень гормонов стресса — адреналина и кортизола, высвобождаемых во время реакции на стресс, но также стимулируют выработку серотонина и эндорфинов, которые помогают снять стресс и улучшить настроение. Физические упражнения расслабляют напряженные мышцы и расслабляют тело. Улучшает дыхание и помогает расслабиться. Для хорошего здоровья очень необходим крепкий сон. Когда вы занимаетесь физическими упражнениями, это утомляет вас физически, что приводит к крепкому сну. Хороший сон — это ключ к тому, чтобы избавиться от беспокойства и сохранять спокойствие. Упражнения делают вас активными, а активность — это способ расслабиться. Он избавляет от стрессов и напряжения повседневной жизни. Установлено, что люди, регулярно занимающиеся физическими упражнениями, менее подвержены стрессу.
Есть несколько способов, которыми упражнения помогают. Упражнения — один из самых распространенных и самых простых способов снижения стресса. Регулярные физические упражнения — это способ оставаться физически и умственно активным и здоровым. Физические упражнения не только снижают уровень гормонов стресса — адреналина и кортизола, высвобождаемых во время реакции на стресс, но также стимулируют выработку серотонина и эндорфинов, которые помогают снять стресс и улучшить настроение. Физические упражнения расслабляют напряженные мышцы и расслабляют тело. Улучшает дыхание и помогает расслабиться. Для хорошего здоровья очень необходим крепкий сон. Когда вы занимаетесь физическими упражнениями, это утомляет вас физически, что приводит к крепкому сну. Хороший сон — это ключ к тому, чтобы избавиться от беспокойства и сохранять спокойствие. Упражнения делают вас активными, а активность — это способ расслабиться. Он избавляет от стрессов и напряжения повседневной жизни. Установлено, что люди, регулярно занимающиеся физическими упражнениями, менее подвержены стрессу. Не всегда нужно ходить в спортзал для упражнений; даже ходьба — отличный способ улучшить свое психическое здоровье и общую физическую форму. Упражнения также снижают уровень холестерина и укрепляют иммунную систему. Регулярные физические упражнения улучшают работу сердца, легких и кровообращение.
Не всегда нужно ходить в спортзал для упражнений; даже ходьба — отличный способ улучшить свое психическое здоровье и общую физическую форму. Упражнения также снижают уровень холестерина и укрепляют иммунную систему. Регулярные физические упражнения улучшают работу сердца, легких и кровообращение.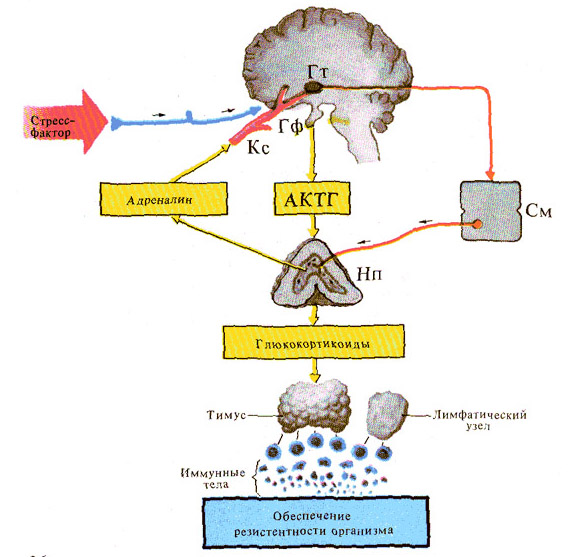 Когда ваш разум отключается от ваших проблем, вы чувствуете себя расслабленным. Медитация может помочь вам освежить и перезарядить свое тело и позволит лучше контролировать свои мысли, заботы и тревоги.
Когда ваш разум отключается от ваших проблем, вы чувствуете себя расслабленным. Медитация может помочь вам освежить и перезарядить свое тело и позволит лучше контролировать свои мысли, заботы и тревоги.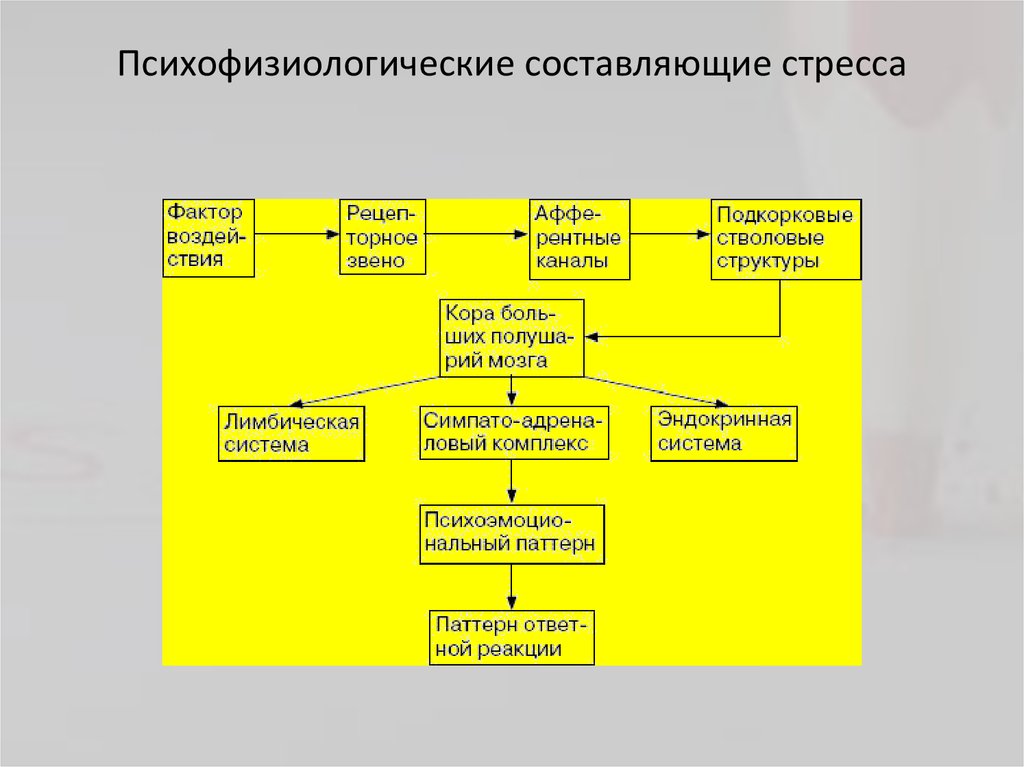 Это не событие, а то, как вы его интерпретируете, вызывает стресс. Позитивный настрой — лучший способ уменьшить стресс. В любой плохой ситуации всегда есть что-то хорошее. Важно то, что мы можем это обнаружить и сделать частью своей жизни. Если у вас есть эта способность, вы никогда не будете чувствовать стресс. Доказано, что смех снижает уровень гормонов стресса кортизола и адреналина, повышает уровень серотонина (гормона счастья) и высвобождает обезболивающие эндорфины. Он также расслабляет мышцы, снижает кровяное давление и укрепляет иммунную систему. Смех — это простой способ снять стресс.
Это не событие, а то, как вы его интерпретируете, вызывает стресс. Позитивный настрой — лучший способ уменьшить стресс. В любой плохой ситуации всегда есть что-то хорошее. Важно то, что мы можем это обнаружить и сделать частью своей жизни. Если у вас есть эта способность, вы никогда не будете чувствовать стресс. Доказано, что смех снижает уровень гормонов стресса кортизола и адреналина, повышает уровень серотонина (гормона счастья) и высвобождает обезболивающие эндорфины. Он также расслабляет мышцы, снижает кровяное давление и укрепляет иммунную систему. Смех — это простой способ снять стресс. Lexington Books, Лэнхем, Мэриленд, США.
Lexington Books, Лэнхем, Мэриленд, США. ДЖАМА 298: 1722.
ДЖАМА 298: 1722.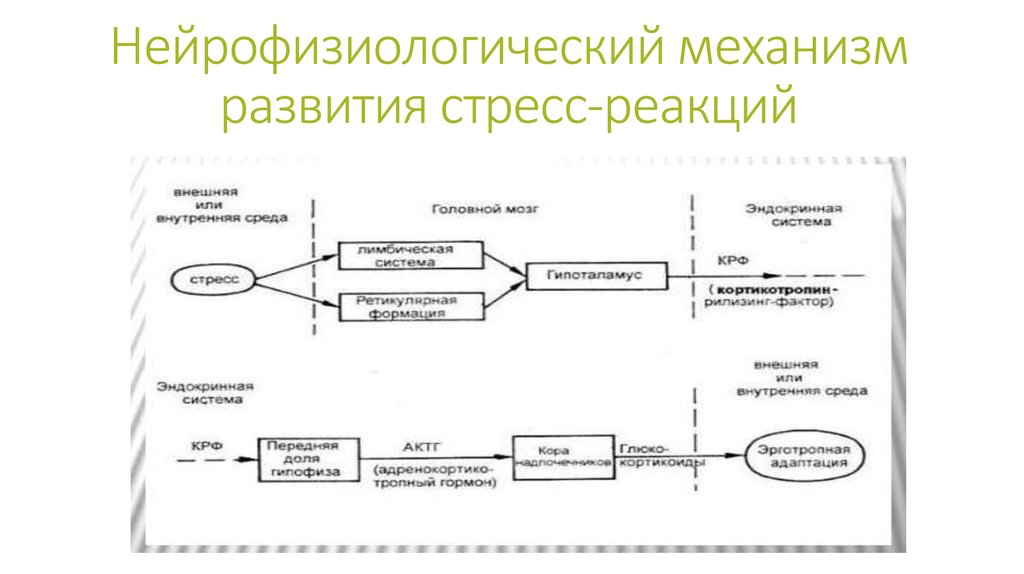 Ланцет Онкол 5: 617-625.
Ланцет Онкол 5: 617-625.