Причины и лечение инсульта в МЦ Для всей семьи Иркутск
Главная / Причины и лечение инсульта
Одной из самых распространённых болезней во всей неврологии всегда был инсульт. Это заболевание, если не убивает человека, то вполне может сделать из него инвалида. Ну и естественно, эта болезнь рекордсмен по выведению всех функций тела человека из строя.
Но, если человек смог пережить инсульт головного мозга, благодаря своевременному лечению, то нежелательных последствий заболевания можно избежать при должной реабилитации. Однако чтобы вовсе избежать заболевания, необходимо знать причины его появления. Некоторые, например, считают что инсульт, это психосоматика, что не лишено смысла, ведь различные стрессы серьёзно увеличивают шансы его появления.
Одним из самых распространённых названий инсульта в обиходе, является «удар». Название такое ему дано не просто так, ведь он буквально бьёт по вашим мозгам. В момент, когда кровь перестаёт поступать к мозгу, та часть мозга, где не хватает кислорода, начинает попросту отмирать. И даже при том, что нервные клетки имеют свойство восстанавливаться, но оставляемые рубцы, дают о себе знать, в различных дисфункциях организма. Так какие же у этого заболевания существуют факторы риска?
И даже при том, что нервные клетки имеют свойство восстанавливаться, но оставляемые рубцы, дают о себе знать, в различных дисфункциях организма. Так какие же у этого заболевания существуют факторы риска?
Какие факторы риска?
Причины, от которых возникает риск инсульта, отличаются друг от друга, и в каждом из видов заболевания, они различны, как и их этиология. Всего, заболевание делят на два типа:
• Ишемический инсульт появляется лишь в том случае, если приток крови к головному мозгу блокируется тромбом. Риск инсульта такого типа наибольший, ведь до 90 процентов всех инсультов, зарегистрированных по всему миру, это ишемические.
• Более редким инсультом считается геморрагический, факторы риска инсульта этого типа, составляют всего 10 процентов, от общего числа. Он уже возникает не просто от того, что к мозгу блокируется приток крови, а от внутричерепного кровоизлияния.
Какие функции человеческого тела, нарушаются при инсульте?
При том, что инсульт головного мозга приписывают к неврологическим заболеваниям, повреждения ЦНС ведут к нарушениям всей жизнедеятельности человека. В зависимости от курса реабилитации, пройденного человеком, и скорости оказания первой помощи, последствия могут оказаться как очень тяжёлыми, так и относительно лёгкими. Например, риск инсульта несёт с собой как возможное нарушения моторики, так и речи, всё зависит от отдела мозга, в котором он произошёл. Очень часто, после пережитого и лечения инсульта, у пациентов долгое время не проходят боли и параличи.
В зависимости от курса реабилитации, пройденного человеком, и скорости оказания первой помощи, последствия могут оказаться как очень тяжёлыми, так и относительно лёгкими. Например, риск инсульта несёт с собой как возможное нарушения моторики, так и речи, всё зависит от отдела мозга, в котором он произошёл. Очень часто, после пережитого и лечения инсульта, у пациентов долгое время не проходят боли и параличи.
Как распознать инсульт?
Главные факторы риска инсульта состоят в том, что как бы не был умён человек, и сколько бы у него не было познаний в медицине, самостоятельно понять, что у тебя произошёл инсульт практически невозможно, ведь повреждения идут у головного мозга. Но даже человеку со стороны, далеко не так просто распознать в обычной хандре и недомоганиях инсульт, если у него нет должной подготовки. Но если, своевременно успеть оценить ситуацию и как можно быстрее оказать первую помощь пациенту, то это может сильно помочь тому уменьшить последствия и облегчить работу врачу по лечению инсульта, а часто и просто выжить.
Симптоматика заболевания
Симптомы инсульта головного мозга хорошо известны тем, что их возникновения практически молниеносны и у них есть своя психосоматика. Так что, когда вы видите, что с вашим знакомым происходит нечто из описанного, не теряйте ни секунды времени:
• Риск инсульта очень ярко выражен, при неожиданных паралитических припадках, и онемениях всего тела человека. Часто это проявляется лишь с одной стороны, с которой и происходит кровоизлияние в кору головного мозга;
• Внезапно появляются запинки и другие речевые проблемы, или человек вовсе теряет сознание;
• Симптомами развития могут быть и возникновения дефектов зрения, причём как в одном, так и сразу в двух глазах;
• Бывает и потеря мелкой моторики, неожиданное головокружение и потеря осознания реальности;
• Резкая и беспричинная головная боль, также один из факторов его развития.
Какие правила неотложной помощи при инсульте головного мозга?
Естественно, что если вы наблюдаете у человека признаки развития инсульта, и уверенны в том, что случился удар, то главным вашим действием, которое спасёт ему жизнь, будет вызвать скорую. Чем быстрее человек окажется в больнице, тем больше шансов что он выживет, и возможно даже не получит серьёзных повреждений головного мозга в результате развития болезни.
Чем быстрее человек окажется в больнице, тем больше шансов что он выживет, и возможно даже не получит серьёзных повреждений головного мозга в результате развития болезни.
Основные причины возникновения инсульта
Различные стрессовые ситуации и психосоматика
Любая реабилитация, проходимая после лечения инсульта, направленна на восстановления психологического баланса, как одного из главных факторов выздоровления. Большие стрессы, различные фобии, и всё подобное, всё больше может приближать больных к инсульту.
Именно поэтому у этого заболевания изучается психосоматика, ведь люди которые часто находятся в стрессовых ситуациях, переживают и в целом более эмоциональны, часто имеют не только аритмию и атеросклероз, но и более опасные заболевания. Поэтому следует исключить все причины возникновения инсульта из своей жизни, и контролировать не только физическое состояние, но и эмоциональное. Ведь этиология у этого заболевания обширная.
Вредные привычки
Никотин, содержащийся в табачных изделиях, просто убивает лёгкие и сосуды курильщика, и это не секрет. Вот только мало кто знает, что от него страдают сосуды по всему телу, и в мозгу включительно. Помимо этого, вредные компоненты сигарет также повышают холестерин в нашей крови, а тот в свою очередь часто закупоривает сосуды. И в итоге всего это может привести к инсульту. Однако темпы развития табачной индустрии не даёт людям задуматься о своём здоровье.
Вот только мало кто знает, что от него страдают сосуды по всему телу, и в мозгу включительно. Помимо этого, вредные компоненты сигарет также повышают холестерин в нашей крови, а тот в свою очередь часто закупоривает сосуды. И в итоге всего это может привести к инсульту. Однако темпы развития табачной индустрии не даёт людям задуматься о своём здоровье.
Алкоголь не является таким абсолютным злом как никотин, пусть этанол это и яд, но вреден он для организма только при превышении нормы. От него страдает не только печень, но и множество других органов, включая мозг, клетки которого буквально отмирают. Ну, а в ключе причин инсульта, самым опасным спутником алкоголя является гипертония. Это может быть первой ступенью, к данному заболеванию.
Ожирение
В нашем современном мире, время стало на вес золота, и его экономят на всём, увы даже на такой важной вещи, как питание. Люди по-быстрому перекусывают, не следя за балансом белков и жиров. Ну, а ведя малоактивный образ жизни, не тяжело таким образом набрать и лишнего веса, но мы никогда не думаем про последствия. А чем большая масса тела, тем больше напрягается ваша сердечная мышца, чтобы гонять кровь по организму. И это уже не говоря про всё тот же холестерин, который может закупорить сосуды, что является началом развития болезни. Поэтому профилактика ожирения, хорошая терапия инсульта.
А чем большая масса тела, тем больше напрягается ваша сердечная мышца, чтобы гонять кровь по организму. И это уже не говоря про всё тот же холестерин, который может закупорить сосуды, что является началом развития болезни. Поэтому профилактика ожирения, хорошая терапия инсульта.
К тому же, в первую очередь организм стремиться донести кислород до жировых клеток, и лишь позже до всего остального организма, за исключением мозга. И это подтверждает статистика, говорящая о том, что на людей с лишним весом приходиться наибольшее количество инсультов.
Инфаркт миокарда
В случае, если у пациента до этого был инфаркт миокарда во время которого образовывался пристеночный тромб, это в разы увеличивает ваши шансы на инсульт. Ведь наибольшую опасность представляет не столько сам тромб, как те эмболы что, отрываясь от него, путешествуют по организму, пока не доберутся в итоге до мозга, закупоривая сосуды. И это может привести к недостатку кислорода в мозгу.
Каковы риски?
Чем старше становиться человек, тем больше проявляется риск того, что у него произойдёт развития инсульт и причины для этого самые разные. Однако если раньше это говорилось про всех людей, старше 50, то сейчас инсульта опустился на порог, практически в 10 лет. Как только, человек пресекает отметку в 55 лет, каждое десятилетие, прожитое ним, увеличивает шанс получения инсульта более чем в 2 раза.
Однако если раньше это говорилось про всех людей, старше 50, то сейчас инсульта опустился на порог, практически в 10 лет. Как только, человек пресекает отметку в 55 лет, каждое десятилетие, прожитое ним, увеличивает шанс получения инсульта более чем в 2 раза.
Все близкие для больного люди, должны долгое время оберегать его и заботиться о взрослом человеке, практически как о годовалом ребёнке, ведь организм на время, а иногда и навсегда, теряет множество различных функций.
Однако, насколько бы быстро вы не реагировали, и насколько хорошей не была бы медицинская помощь, но предупреждение болезни всегда лучше чем её лечение. Так что необходимо внимательно следить за состоянием своего здоровья, постоянно наблюдаться у врачей, и проводиться профилактика инсульта, тем более, если вы находитесь в зоне риска, ведь тот самый день бывает, наступит неожиданно и без причины.
Как это выглядит с физиологической точки зрения?
Какие у инсульта причины и какая психосоматика? Инсульты головного мозга возникают лишь, если сосуд, который снабжает кислородом мозг, вдруг порвался или закупорился.
Гемморагический инсульт в несколько раз опаснее ишемического. Разрываются чаще всего дефектные сосуды, и предпосылками к инсульту может служить, например атеросклероз, или гипертония. И здесь опасна не только гибель клеток, но и то, что вытекшая кровь, начинает сдавливать большое количество тканей коры головного мозга, а инсульт в итоге развития просто убивает целые области мозга.
И часто, перед инсультом нарушается кровяной обмен всего головного мозга, это и есть основные его причины. Поэтому профилактика включает в себя предотвращение подобного. Часто, это происходит задолго до самого удара, возможно даже за целые месяцы. Также, очень опасной предпосылкой являются транзисторные ишемические атаки, которые на какое-то время останавливают поступление крови к коре головного мозга. Соответственно, из-за подобных проблем, мозг попросту не способен нормально выполнять свои функции.
ТИА возможно даже спутать с инсультом, вот только в отличие от него, оно проходит менее чем за 15 минут. Как правило, здесь даже справляется сам организм человека, который без стороннего вмешательства восстанавливает все свои функции в полной мере.
Как правило, здесь даже справляется сам организм человека, который без стороннего вмешательства восстанавливает все свои функции в полной мере.
Так как у нас различные участки головного мозга, отвечают за совершенно разные части нашей жизнедеятельности, в зависимости от места разрыва сосуда, меняется и эффект такого инсульта. И поскольку, правая часть мозга управляет левой стороной тела, и наоборот, зеркально тому, какая сторона повредилась, на теле происходят нарушения функционирования.
Реабилитационные процедуры и лечение инсульта
В реабилитации очень часто используется такая способность нервных клеток, как перенятые функции других нейронов. Таким образом, такие вот подмены позволяют помочь головному мозгу в тех местах, где он слаб, пока происходит регенерация, тем самым восстановив нормальное функционирование нервной системы. Но дабы, эти помощники смогли нормально работать в совершенно незнакомой среде, необходимо активно улучшать их при помощи специальных реабилитационных упражнений.
Это и делают в специальных реабилитационных центрах и при индивидуальных занятиях. Именно это и может помочь человеку окончательно излечиться и предотвращать развития и последствия заболевания. Это своеобразная профилактика.
Психосоматика инсульта: взгляд на проблему
Резюме. Проблеме когнитивных и психосоматических нарушений при инсульте была посвящена отдельная секция Научно-образовательного форума «Академия инсульта», проходившего 1–3 ноября 2012 г. в Киеве
В большинстве случаев врачи-интернисты уделяют недостаточно внимания инициальным формам цереброваскулярной патологии (ЦВП), прогрессирование которой увеличивает бремя когнитивных расстройств в украинском обществе и повышает риск возникновения острых сосудистых катастроф. О начальных проявлениях, обусловливающих прогрессирование хронических форм ЦВП, которые в дальнейшем реализуют более высокий риск развития острых нарушений мозгового кровообращения и формируют синдром когнитивных расстройств, рассказал Сергей Сова, доцент Клиники профессиональных заболеваний Национального медицинского университета им. А.А. Богомольца, советник директора Института эпидемиологии и инфекционных заболеваний им. Л.В. Громашевского НАМН Украины.
А.А. Богомольца, советник директора Института эпидемиологии и инфекционных заболеваний им. Л.В. Громашевского НАМН Украины.
Сегодня благодаря применению современных стратегий коррекции модифицируемых факторов риска сердечно-сосудистой патологии наблюдается тенденция к снижению частоты развития ее острых форм. При этом за последние 10 лет в 2 раза увеличилось количество больных с хроническими формами ЦВП, манифестирующими клиникой когнитивных нарушений. В последние годы >90% ЦВП приходится на медленнопрогрессирующие нарушения мозгового кровообращения (дисциркуляторную энцефалопатию — ДЭП).
С. Сова напомнил, что для эффективного решения проблемы дефицита мозгового кровообращения очень важно оценивать и воздействовать на функционирование всех органов и систем, влияющих на состояние мозговой гемоперфузии. Так, 80% очерченных клинических форм ДЭП вызваны артериальной гипертензией и атеросклеротическим поражением сосудов головного мозга. Более редкими причинами ДЭП являются венозная дисциркуляция, а также такие гемодинамические причины, как нарушения сердечного ритма и насосной функции сердца. Кроме этого, следует учитывать состояния, приводящие к гиперкоагуляции и тромбообразованию. Это, прежде всего, наличие метаболического синдрома, состояние гепатобилиарной системы, органов эндокринной системы, системного иммунитета и др.
Кроме этого, следует учитывать состояния, приводящие к гиперкоагуляции и тромбообразованию. Это, прежде всего, наличие метаболического синдрома, состояние гепатобилиарной системы, органов эндокринной системы, системного иммунитета и др.
Считается, что ДЭП — заболевание, присущее лицам пожилого возраста. Однако за последние 20 лет наметилась серьезная тенденция к омоложению этой патологии. Сегодня ⅓ пациентов с хроническими формами ЦВП — лица трудоспособного возраста. Причина этого видится в растущей невротизации и метаболизации современного общества.
Как подчеркнул С. Сова, формирование и рост расстройств тревожно-депрессивного спектра приводит к развитию и накоплению метаболических нарушений уже в молодом возрасте. Это, в свою очередь, инициирует каскад патогенетических процессов, приводящих к поражению сосудистой стенки церебральных артерий. Исследование Global Burden of Disease Study (1990–2008) показало, что со средины 1990-х годов на втором месте среди причин неявки на работу (показатель DALY) после сердечно-сосудистой патологии — психические расстройства (прежде всего тревога и депрессия).
Среди ведущих причин невротизации докладчик выделил постоянное пребывание в состоянии «боевой готовности» для достижения кратковременных фрагментарных целей («крысиные бега»), истощающих энергетический потенциал головного мозга и приводящих к развитию психоэмоциональных, когнитивных, вторично-сосудистых и соматических расстройств. Из медицинской практики докладчика: у ≈70% амбулаторных пациентов определяют расстройства психосоматического характера (головная боль напряжения, функциональная диспепсия, синдром раздраженного кишечника, миофасциальный синдром, вегетативно-сосудистая дисфункция и т.д.).
Невротизации общества способствуют нарушения в системе отношений мать — ребенок с закладкой и формированием базальных страхов, что в дальнейшем приводит к развитию патологического типа реагирования и к развитию психоэмоциональной и психосоматической патологии.
Сверхпороговые стрессовые воздействия и/или их хронизация (утрата близких, дорожно-транспортные происшествия, природные катаклизмы, перенесенные заболевания) часто являются разрешающими факторами в развитии невротических расстройств.
Хронизации и соматизации неврозов способствует неосведомленность пациентов о наличии у них психической дисфункции, а также недиагностирование интернистами эмоциональной составляющей соматических нарушений, которая часто является первичной по отношению к соматической дисфункции. На прием к врачу общей практики и узкому специалисту больные приходят с соматическими жалобами (головная, абдоминальная боль, изжога), не акцентируя внимание на эмоциональных нарушениях, снижении настроения, ангедонии. Отдельными проблемами являются психалгия и хронический болевой синдром, часто маскирующие тревожно-депрессивную патологию. Негативное отношение со стороны медицинского персонала к больным с невротическими расстройствами, а также недостаточность и неэффективность психо- и фармакотерапии эмоциональных нарушений также являются немаловажными факторами, препятствующими излечению и достижению стойкой ремиссии у этой когорты пациентов.
Докладчик подчеркнул, что невротические расстройства характеризуются перестройкой рецепторного комплекса центральной нервной системы, развитием медиаторного дисбаланса с дисфункцией гипоталамо-гипофизарно-надпочечниковой оси, повышением уровня катехоламинов и связанного с этим нарушения гомеостаза с последующей метаболизацией — развитием метаболического синдрома (дислипопротеидемия, артериальная гипертензия, гипергликемия, абдоминальное ожирение, стеатоз печени, гиперурикемия, гиперкоагуляция). Патологический гомеостаз, в свою очередь, ведет к развитию и прогрессированию атеросклеротического процесса и артериальной гипертензии — основных причин развития цереброваскулярной дисциркуляции.
Патологический гомеостаз, в свою очередь, ведет к развитию и прогрессированию атеросклеротического процесса и артериальной гипертензии — основных причин развития цереброваскулярной дисциркуляции.
Согласно отечественной классификации, к ранним формам цереброваскулярной дисфункции относят начальные проявления недостаточности мозгового кровообращения (НПНМК) и ДЭП І стадии. НПНМК характеризуются развитием когнитивных и психоэмоциональных расстройств, выявляемых при опросе, а также с помощью психодиагностических шкал и тестов. ДЭП І стадии характеризуется углублением психоэмоциональных нарушений и когнитивной дисфункции до степени легкого когнитивного расстройства с появлением рассеянной неврологической симптоматики, не укладывающейся в очерченный неврологический синдромокомплекс (последнее характерно для II стадии заболевания).
Диагноз ДЭП устанавливают при клинических признаках поражения головного мозга (неврологических, когнитивных, психоэмоциональных) и сердечно-сосудистого заболевания (атеросклероза, артериальной гипертензии и др. ), наличии между ними причинно-следственной связи и прогрессирующего течения цереброваскулярной дисфункции. При этом наличие сердечно-сосудистого заболевания и поражение головного мозга должны быть подтверждены инструментально.
), наличии между ними причинно-следственной связи и прогрессирующего течения цереброваскулярной дисфункции. При этом наличие сердечно-сосудистого заболевания и поражение головного мозга должны быть подтверждены инструментально.
С. Сова напомнил, что уровень кровотока, обеспечивающий нормальное функционирование цикла Кребса в нейроцитах головного мозга составляет 55, при хронической мозговой гипоперфузии — 20–25, при остром нарушении мозгового кровообращения — <12 мл/мин/100 г мозгового вещества в течение 2–3 ч. Вследствие нарушения мозгового кровообращения наступает энергетический дефицит, который запускает глутаматный каскад повреждения с развитием оксидантного стресса, запуском процессов апоптоза и воспаления в эндотелии сосудов.
Докладчик подчеркнул, что лечение при ДЭП должно оказывать воздействие на все этиологические факторы, способствующие развитию метаболического синдрома, атеросклероза, нарушению насосной функции сердца, и включать длительную (≥4 мес) коррекцию психоэмоциональных и когнитивных расстройств. При лечении психоэмоциональных и когнитивных расстройств, связанных с цереброваскулярной дисгемией, необходимо применение психофармакологических и нейрометаболических средств.
При лечении психоэмоциональных и когнитивных расстройств, связанных с цереброваскулярной дисгемией, необходимо применение психофармакологических и нейрометаболических средств.
Юлия Ермолова,
фото Сергея Бека
Cryptogenic stroke | Shamalov | Neurology, Neuropsychiatry, Psychosomatics
1. Adams HP, Bendixen BH, Kappelle LJ, et al. Classification of subtype of acute ischemic stroke: definitions for use in a multicenter clinical trial. Stroke. 1993;24(1):35–41. DOI:http://dx.doi.org/10.1161/01.STR.24.1.35.
2. Bogousslavsky J, Van Melle G, Regli F. The Lausanne Stroke Registry: analysis of 1,000 consecutive patients with first stroke. Stroke. 1988;19(():1083–92.
3. Touboul PJ, Elbaz A, Koller C, et al. Common carotid artery intima-media thickness and ischemic stroke subtypes: the GENIC casecontrol study. The GENIC Investigators. Circulation. 2000;102(3):313–8. DOI: http://dx.doi.org/10.1161/01.CIR.102.3.313.
4. Amarenco P, Bogousslavsky J, Caplan LR, et al. Classification of stroke subtypes. Cerebrovascular Dis. 2009;27(5):493–501. DOI: 10.1159/000210432. Epub 2009 Apr 3.
5. Amarenco P, Bogousslavsky J, Caplan LR, et al. New Approach to Stroke Subtyping: The A-S-C-O (Phenotypic) Classification of Stroke. Cerebrovascular Dis. 2009;27(5):502–8. DOI: 10.1159/000210433. Epub 2009 Apr 3.
6. Суслина ЗА, Верещагин НВ, Пирадов МА. Подтипы ишемических нарушений мозгового кровообращения: диагностика и лечение. Consilium Medicum. 2001;3(5):218–21. [Suslina ZA, Vereshchagin NV, Piradov MA. Subtypes of ischemic violations of brain blood circulation: diagnostics and treatment. Consilium Medicum. 2001;3(5):218–21. (In Russ.)].
7. Guercini F, Acciarresi M, Agnelli G, Paciaroni M. Cryptogenic stroke: time to determine aetiology. J Thromb Haemost. 2008;6(4):549–54. DOI: 10.1111/j.1538-7836.2008.02903.x. Epub 2008 Jan 15.
8. Sacco RL, Ellenberg JH, Mohr JP, et al. Infarcts of undetermined cause: the NINCDS Stroke Data Bank. Ann Neurol. 1989;25(4):382–90. DOI:http://dx.doi.org/10.1002/ana.410250410.
Ann Neurol. 1989;25(4):382–90. DOI:http://dx.doi.org/10.1002/ana.410250410.
9. Palomeras SE, Fossas FP, Cano OAT, Sanz CP. Cryptogenic infarct. A follow-up period of 1
10. year study. Neurologia. 2009;24(5):304–8.10. Kistler JP. The risk of embolic stroke. Another piece of the puzzle. N Engl J Med. 1994;331(22):1517–9. DOI: http://dx.doi.org/10.1056/NEJM199412013312211.
11. Liebeskind A, Chinichian A, Schechter MM. The moving embolus seed during serial cerebral angiography. Stroke.1971;2(5):440–3. DOI: http://dx.doi.org/10.1161/01.STR.2.5.440.
12. Santamarina E, Penalba A, Garcia-Berrocoso T, et al. Biomarker level improves the diagnosis of embolic source in ischemic stroke of unknown origin. J Neurol. 2012;259(12):2538–45. DOI: 10.1007/s00415-012-6532-4. Epub 2012 May 17.
13. Sharifkazemi MB, Aslani A, Zamirian M, Moaref AR. Signifi cance of aortic atheroma in elderly patients with ischemic stroke. A hospital-based study and literature review. Clin Neurol Neurosurg. 2007;109(4):311–6. DOI:http://dx.doi.org/10.1016/j.clineuro.2006.12.003.
2007;109(4):311–6. DOI:http://dx.doi.org/10.1016/j.clineuro.2006.12.003.
14. Grotta JC. Clinical practice. Carotid stenosis. N Engl J Med. 2013;(369):1143–50.
15. Hart RG. Cardiogenic embolism to the brain. Lancet. 1992;339(8797):589–94. DOI: http://dx.doi.org/10.1016/0140-6736(92)90873-2.
16. Hart RG, Diener HC, Coutts SB. Embolic strokes of undetermined source: the case for a new clinical construct. Lancet Neurol. 2014;13(4):429–38. DOI: 10.1016/S1474-4422(13)70310-7.
17. Finsterer J. Management of cryptogenic stroke. Acta Neurol Belg. 2010;110(2):135–47.
18. Mas J-L, Arquizan C, Lamy C, et al.; Patent Foramen Ovale and Atrial Septal Aneurysm Study Group. Recurrent cerebrovascular events associated with patent foramen ovale, atrial septal aneurysm, or both. N Engl J Med. 2001;(345):1740–6. DOI:http://dx.doi.org/10.1056/NEJMoa011503.
19. Homma S, DiTullio MR, Sacco RL, et al.; PICSS Investigators. Age as a determinant of adverse events in medically treated cryptogenic stroke patients with patent foramen ovale. Stroke. 2004;35(9):2145–9. DOI: http://dx.doi.org/10.1161/01.STR.0000135773.24116.18. Epub 2004 Jul 1.
Stroke. 2004;35(9):2145–9. DOI: http://dx.doi.org/10.1161/01.STR.0000135773.24116.18. Epub 2004 Jul 1.
20. Arauz A, Murillo L, Marquez JM, et al. Long-term risk of recurrent stroke in young cryptogenic stroke patients with and without patent foramen ovale. Int J Stroke. 2012;7(8):631–4. DOI: 10.1111/j.1747-4949.2011.00641.x. Epub 2011 Oct 6.
21. Albers GW, Amarenco P, Easton JD, et al. Antithrombotic and thrombolytic therapy for ischemic stroke (8th editionn). Chest. 2008;133(6 Suppl):630S–669S. DOI:10.1378/chest.08-0720.
22. Adams RJ, Albers G, Alberts MJ, et al.; American Heart Association; American Stroke Association. Update to the AHA/ASA recommendations for the prevention of stroke in patients with stroke and transient ischemic attack. Stroke. 2008;39(5):1647–52.DOI: 10.1161/STROKEAHA.107.189063. Epub 2008 Mar 5.
23. European Stroke Organisation (ESO) Executive Committee; ESO Writing Committee. Guidelines for management of ischaemic stroke and transient ischaemic attack 2008. Cerebrovasc Dis. 2008;25(5):457–507. DOI: 10.1159/000131083. Epub 2008 May 6.
Cerebrovasc Dis. 2008;25(5):457–507. DOI: 10.1159/000131083. Epub 2008 May 6.
24. Furie KL, Kasner SE, Adams RJ, et al.; American Heart Association Stroke Council, Council on Cardiovascular Nursing, Council on Clinical Cardiology, Interdisciplinary Council on Quality of Care and Outcomes Research. Guidelines for the prevention of stroke in patients with stroke or transient ischemic attack: a guideline for healthcare professionals from the american heart association/american
25. stroke ssociation. Stroke. 2011;42(1):227–76. DOI: 10.1161/STR.0b013e3181f7d043. Epub 2010 Oct 21.
26. Lansberg MG, O’Donnell MJ, Khatri P, et al. Antithrombotic and thrombolytic therapy for ischemic stroke: antithrombotic therapy and prevention of thrombosis, 9th ed: American College of chest Physicians evidence-based clinical practice guidelines. Chest. 2012;141 (2 Suppl):e601S–36S.
27. DOI: 10.1378/chest.11-2302.
28. Lindsay P, Bayley M, Hellings C, et al.; Canadian Stroke Strategy Best Practices; Standards Writing Group on behalf of the Canadian Stroke Strategy. Canadian Best Practice Recommendations for stroke care (update 2008). Can Med Assoc J. 2008;179 (suppl):1–25. DOI: http://dx.doi.org/10.
Canadian Best Practice Recommendations for stroke care (update 2008). Can Med Assoc J. 2008;179 (suppl):1–25. DOI: http://dx.doi.org/10.
29. /cmaj.081148.R2.
30. Jauch EC, Saver JL, Adams HP Jr, et al.; American Heart Association Stroke Council; Council on Cardiovascular Nursing; Council on Peripheral Vascular Disease; Council on Clinical Cardiology.Guidelines for the early management of patients with acute ischemic stroke: a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke. 2013;44:870–947. DOI: http://dx.doi.org/10.1161/STR.0b013e318284056a.
31. Kernan WN, Ovbiagele B, Black HR, et al.; American Heart Association Stroke Council, Council on Cardiovascular and Stroke Nursing, Council on Clinical Cardiology, Council on Peripheral Vascular Disease. Guidelines for the Prevention of Stroke in Patients With Stroke and Transient Ischemic Attack. A Guideline for Healthcare Professionals From the American Heart Association/American Stroke
32. Association. Stroke. 2014;45(7):2160–236. DOI: 10.1161/STR.0000000000000024. Epub 2014 May 1.
Association. Stroke. 2014;45(7):2160–236. DOI: 10.1161/STR.0000000000000024. Epub 2014 May 1.
33. Mohr JP, Thompson JLP, Lazar RM, et al.; Warfarin-Aspirin Recurrent Stroke Study Group. A comparison of warfarin and aspirin for the prevention of recurrent ischemic stroke. N Engl J Med. 2001;345(20):1444–51. DOI:http://dx.doi.org/10.1056/NEJMoa011258.
34. Sacco RL, Prabhakaran S, Thompson JLP, et al.; WARSS Investigators. Comparison of warfarin versus aspirin for the prevention of recurrent stroke or death: subgroup analyses from the Warfarin-Aspirin Recurrent Stroke Study. Cerebrovasc Dis. 2006;22(1):4–12. DOI: http://dx.doi.org/10.1159/000092331. Epub 2006 Mar 27.
35. Homma S, Sacco RL, Di Tullio MR, et al.; PFO in Cryptogenic Stroke Study (PICSS) Investigators. Effect of medical treatment in stroke patients with patent foramen ovale: patent foramen ovale in Cryptogenic Stroke Study. Circulation. 2002;105(22):2625–31. DOI: http://dx.doi.org/10.1161/01.CIR.0000017498.88393. 44.
44.
36. Longstreth WT Jr, Kronmal RA, Thompson JLP, et al. Amino terminal pro-B-type natriuretic peptide, secondary stroke prevention, and choice of antithrombotic therapy. Stroke. 2013;44(3):714–9. DOI: 10.1161/STROKEAHA.112.675942. Epub 2013 Jan 22.
37. Connolly S, Pogue J, Hart R, et al.; ACTIVE Writing Group of the ACTIVE Investigators. Clopidogrel plus aspirin versus oral anticoagulation for atrial fi brillation in the Atrial fi brillation Clopidogrel Trial with Irbesartan for prevention of Vascular Events (ACTIVE W): a randomised controlled trial. Lancet. 2006;367(9526):1903–12. DOI: http://dx.doi.org/10.1016/S0140-6736(06)68845-4.
38. Connolly SJ, Eikelboom J, Joyner C, et al.; AVERROES Steering Committee and Investigators. Apixaban in patients with atrial fibrillation. N Engl J Med. 2011;364(9):806–17. DOI: 10.1056/NEJMoa1007432. Epub 2011 Feb 10.
39. Homma S, Thompson JLP, Pullicino PM, et al.; WARCEF Investigators. Warfarin and aspirin in patients with heart failure and sinus rhythm. N Engl J Med. 2012;366(20):1859–69. DOI: 10.1056/NEJMoa1202299. Epub 2012 May 2.
N Engl J Med. 2012;366(20):1859–69. DOI: 10.1056/NEJMoa1202299. Epub 2012 May 2.
40. Chatterjee S, Sardar P, Biondi-Zoccai G, Kumbhani DJ. New oral anticoagulants and the risk of intracranial hemorrhage. Traditional and Bayesian meta-analysis and mixed treatment comparison of randomized trials of new oral anticoagulants in atrial fibrillation. JAMA Neurol. 2013;70(12):1486–90. DOI: 10.1001/jamaneurol.2013.4021.
41. Kearon C, Kahn SR, Agnelli G, et al. Antithrombotic therapy for venous thromboembolic disease: American College of Chest Physicians Evidence-based Clinical Practice Guidelines (8th edn). Chest. 2008;133(suppl 6):454S–545S. DOI: 10.1378/chest.08-0658.
42. Brighton TA, Eikelboom JW, Mann K, et al.; ASPIRE Investigators. Low-dose aspirin for preventing recurrent venous thromboembolism. N Engl J Med. 2012;367(21):1979–87. DOI: 10.1056/NEJMoa1210384. Epub 2012 Nov 4.
43. Halkes PH, van Gijn J, Kappelle LJ, et al.; ESPRIT Study Group. Medium intensity oral anticoagulants versus aspirin after cerebral ischaemia of arterial origin (ESPRIT): a randomised controlled trial. Lancet Neurol. 2007;6(2):115–24. DOI:http://dx.doi.org/10.1016/S1474-4422(06)70685-8.
Lancet Neurol. 2007;6(2):115–24. DOI:http://dx.doi.org/10.1016/S1474-4422(06)70685-8.
44. Ferrari E, Vidal R, Chevallier T,Baudouy M. Atherosclerosis of the thoracic aorta and aortic debris as a marker of poor prognosis: benefit of oral anticoagulants. J Am Coll Cardiol. 1999;33(5):1317–22. DOI: http://dx.doi.org/10.1016/S0735-1097(99)00003-0.
45. Dressler FA, Craig WR, Castello R, Labovitz AJ. Mobile aortic atheroma and systemic emboli: efficacy of anticoagulation and influence of plaque morphology on recurrent stroke. J Am Coll Cardiol. 1998;31(1):134–8. DOI: http://dx.doi.org/10.1016/S0735-1097(97)00449-X.
46. Di Tullio MR, Russo C, Jin Z, et al.; Patent Foramen Ovale in Cryptogenic Stroke Study Investigators. Aortic arch plaques and risk of recurrent stroke and death. Circulation. 2009;119(7):2376–82. DOI: 10.1161/CIRCULATIONAHA.108.811935. Epub 2009 Apr 20.
47. Halkes PH, van Gijn J, Kappelle LJ, et al.; ESPRIT Study Group. Medium intensity oral anticoagulants versus aspirin after cerebral ischaemia of arterial origin (ESPRIT): a randomised controlled trial. Lancet Neurol. 2007;6(2):115–24. DOI:http://dx.doi.org/10.1016/S1474-4422(06)70685-8.
Lancet Neurol. 2007;6(2):115–24. DOI:http://dx.doi.org/10.1016/S1474-4422(06)70685-8.
48. The Stroke Prevention in Reversible Ischemia Trial (SPIRIT) Study Group. A randomized trial of anticoagulants versus aspirin after cerebral ischemia of presumed arterial origin. Ann Neurol 1997; 42: 857–65. DOI: http://dx.doi.org/10.1002/ana.410420606.
49. Granger CB, Alexander JH, McMurray JJV, et al, and the ARISTOTLE Committees and Investigators. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med. 2011;365(11):981–92. DOI:
50. 1056/NEJMoa1107039. Epub 2011 Aug 27.
51. Connolly SJ, Ezekowitz MD, Yusuf S, et al.; RE-LY Steering Committee and Investigators. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med. 2009;361(12):1139–5. DOI:10.1056/NEJMoa0905561. Epub 2009 Aug 30.
52. Diener H-C. Rationale, objectives and design of a secondary stroke prevention study of dabigatran etexilate versus acetylsalicylic acid in patients with embolic stroke of undetermined source (RE-SPECT-ESUS). Abstracts of the European Stroke Conference. Cerebrovasc Dis. 2014;37(suppl 1):1–2.
Abstracts of the European Stroke Conference. Cerebrovasc Dis. 2014;37(suppl 1):1–2.
53. Meissner I, Khandheria BK, Heit JA, et al. Patent foramen ovale: innocent or guilty? Evidence from a prospective population-based study. J Am Coll Cardiol. 2006;47(2):440–5. DOI: http://dx.doi.org/10.1016/j.jacc.2005.10.044. Epub 2005 Dec 6.
54. Srivastava TN, Payment MF. Images in clinical medicine. Paradoxical embolism-thrombus in transit through a patent foramen ovale. N Engl J Med. 1997;337(10):681. DOI: http://dx.doi.org/10.1056/NEJM
55.
56. Overell JR, Bone I, Lees KR. Interatrial septal abnormalities and stroke: a meta-analysis of case-control studies. Neurology. 2000;55(8):1172–9. DOI: http://dx.doi.org/10.1212/WNL.55.8.1172.
57. Olsen TS, Skriver EB, Herning M. Cause of cerebral infarction in the carotid territory. Its relation to the size and the location of the infarct and to the underlying vascular lesion. Stroke. 1985;16(3):459–66. DOI: http://dx.doi.org/10. 1161/01.STR.16.3.459.
1161/01.STR.16.3.459.
58. Freilinger TM, Schindler A, Schmidt C, et al. Prevalence of nonstenosing, complicated atherosclerotic plaques in cryptogenic stroke. JACC Cardiovasc Imaging. 2012;5(4):397–405. DOI: 10.1016/j.jcmg.2012.01.012.
59. Schwarz F, Bayer-Karpinska A, Poppert H, et al. Serial carotid MRI identifies rupture of a vulnerable plaque resulting in amaurosis fugax. Neurology. 2013;80(12):1171–2. DOI: 10.1212/WNL.0b013e31828869ad.
Нейропсихиатрия инсульта
от Vani Rao, M.D.
- ВВЕДЕНИЕ
- Патофизиология инсульта
- Распространенность Пост -инсульта.
- Постинсультный психоз
- Резюме
| Введение |
Определение инсульта (WHO Stroke, 1989) следующим образом: За последнее десятилетие произошло снижение заболеваемости и смертности, вероятно, вторичное благодаря улучшению мер по лечению гипертонии, уменьшению курения и лучшему управлению факторами сердечно-сосудистых заболеваний. Тем не менее, это по-прежнему 3-я ведущая причина смерти с заболеваемостью 500 000 в год, 1/3 из которых умирает каждый год. Дополнительные эпидемиологические факторы включают: Ишемические инсульты вызываются нарушением кровоснабжения головного мозга. Атеросклероз вызывает сужение кровеносных сосудов, а окклюзия сосудов может возникать в результате тромбоза или эмболии, что приводит к инфарктам. Факторы риска инсульта включают : (наверху страницы) |
| Распространенность постинсультных нервно-психических расстройств |
Нейропсихиатрические (НС) расстройства часто встречаются после инсульта. • Депрессия: 35% (вверху страницы) |
| после инсульта депрессии | ||||||||
• Введение 1) Измерение — различные шкалы, начиная от шкал, используемых самостоятельно, и заканчивая структурированными психологическими интервью 2) Источник – пациенты обследуются в стационаре или в рамках обследования по месту жительства? Средняя распространенность среди госпитализированных пациентов с острым инсультом составляла 30-40% по сравнению с 10-20% в выборке населения. 3) Продолжительность – пациенты, обследованные в остром постинсультном периоде или через много месяцев после инсульта. Самое важное сообщение состоит в том, что существуют противоречивые данные о факторах риска постинсультной депрессии . В приведенной ниже таблице представлены эти факторы, хотя те из них, которые указаны как последовательные, не являются стопроцентными.
(верхняя часть раздела) Диагностика
Критерии легкой депрессии DSV IV требуют наличия более 2, но менее 5 депрессивных симптомов, включая подавленное настроение или потерю интереса. Критерии большой депрессии DSM IV Наличие депрессивного настроения в течение 2 недель или более плюс > 4 из следующих : месяцев до 1 года, тогда как продолжительность малой депрессии составляет несколько лет. В исследовании, проведенном Robinson et al. в 1990-х годах по сравнению депрессивных и недепрессивных людей, у большинства депрессивных людей были эти нейро-вегетативные и психологические симптомы депрессии по сравнению с не депрессивными складками. В 1991, Fedoroff et al., изучали частоту депрессивных симптомов как у пациентов с депрессией, так и у недепрессивных пациентов с инсультом. (верхняя часть секции) Симптомы основных основных симптомов :
АНХЕДОНИЯ |
| Тревога после инсульта |
Распространенность ПСА составляет около 20%, при этом у большинства пациентов с ПСА также имеется СД.
Анатомические корреляты:
Исследование 288 пациентов ( Castillo, Robinson et al 1995 ) показало, что тревожная депрессия (AD) была связана с поражениями левого полушария, а тревога только с поражениями правого полушария Факторы риска ПСА:
В исследовании Shimoda and Robinson, включавшем 142 пациента с ГТР и депрессией, у 18 из них к концу 2-летнего периода наблюдались более значительные нарушения АДЛ по сравнению с одним лишь ПСД. Сочетанное заболевание ПСД и ГТР приводило к более длительной продолжительности ПСД, чем отдельное ПСД, и эта длительная депрессия может привести к более плохим физическим и социальным последствиям. Лечение ПСА (верхняя часть страницы) |
| Катастрофические реакции после инсульта |
задачи, которые были возможны раньше. Это не редкость у пациентов с инсультом. У 19% из 62 последовательных пациентов с острым инсультом была обнаружена CR ( Starkstein et al, 1993 ). Катастрофическая реакция связана с поражением PSD и базальных ганглиев и может быть феноменом высвобождения из-за подкоркового повреждения. Часто сочетается с экспрессивной афазией. Лечение состоит из профилактических и поддерживающих мер. |
| Патологический аффект |
Другие названия: Эмоциональное недержание; постинсультная эмоциональность Лечение : Антидепрессанты и стабилизаторы настроения использовались для лечения патологического смеха и патологического плача. Однако необходимы дополнительные исследования в этой области. (верхняя часть страницы) |
| Постинсультный психоз |
Психоз — редкое осложнение после инсульта. Rabins и соавт. провели скрининг всех лиц старше 60 лет, перенесших инсульт, за 9-летний период (n=1191). Только у 5 больных выявлен психоз. У всех были правые лобно-теменные поражения и подкорковая атрофия по сравнению с 5 соответствующими контрольными группами. У 3 из 5 были постинсультные приступы. Ни у одного из 5 непсихотических контролей не было судорог. Лечение состоит из нейролептиков или противосудорожных препаратов. (верхняя часть страницы) |
| Резюме |
(наверху страницы) |
410-550-0925
Независимо от того, путешествуете ли вы по стране или по всему миру, в Johns Hopkins вам будет легко получить доступ к услугам мирового класса.
Восстановление двигательной функции у больных, перенесших ишемический инсульт | Старчина
1. Фейгин В. Глобальные, региональные и национальные годы жизни с поправкой на инвалидность (Dalys) для 315 заболеваний и травм и ожидаемая продолжительность здоровой жизни (Хейл), 1990–2015 гг. : систематический анализ исследования глобального бремени болезней, 2015 г. , Ланцет. 2016; 388:1603-58. doi: 10.1016/S0140-6736(16)31460-X
: систематический анализ исследования глобального бремени болезней, 2015 г. , Ланцет. 2016; 388:1603-58. doi: 10.1016/S0140-6736(16)31460-X
2. Парфенов В.А., Хасанова Д.Р. Ишемический инсульт. Москва: МИА; 2012. 288 с. (на рус.).
3. O’Donnell MJ, Chin SL, Rangarajan S, et al. Глобальные и региональные эффекты потенциально поддающихся изменению факторов риска, связанных с острым инсультом, в 32 странах (INTERSTROKE): исследование случай-контроль. Ланцет. 2016; 388:761-75. doi: 10.1016/S0140-6736(16)30506-2
4. Meijer R, Plotnik M, Zwaaftink EG, et al. Выраженное нарушение двусторонней координации походки у пациентов, перенесших инсульт: отличается ли этот дефицит от асимметрии? Когортное исследование. J Neuroeng Rehabil. 2011;8:23. дои: 10.1186/1743-0003-8-23
5. Verdecchia P, Staessen JA, Angeli F, et al. Обычный и жесткий контроль систолического артериального давления у недиабетических пациентов с гипертонией (Cardio-Sis): открытое рандомизированное исследование. Ланцет. 2009;374:525-33. doi: 10.1016/S0140-6736(09)61340-4
Ланцет. 2009;374:525-33. doi: 10.1016/S0140-6736(09)61340-4
6. Bath PM, Scutt P, Blackburn DJ, et al. Интенсивное снижение кровяного давления и снижение уровня липидов в сравнении с рекомендациями у пациентов с предшествующим инсультом: основные результаты пилотного рандомизированного контролируемого исследования «Профилактика снижения когнитивных функций после инсульта» (PODCAST). ПЛОС Один. 2017;12(1):e0164608. doi: 10.1371/journal.pone.0164608
7. Rothwell PM, Howard SC, Spence JD, за сотрудничество специалистов по каротидной эндартерэктомии. Взаимосвязь между артериальным давлением и риском инсульта у пациентов с симптоматической окклюзионной болезнью сонных артерий. Инсульт. 2003;34:2583-92. doi: 10.1161/01.STR.0000094424.38761.56
8. Сотрудничество исследователей антитромботических препаратов. Совместный метаанализ рандомизированных исследований антитромбоцитарной терапии для предотвращения смерти, инфаркта миокарда и инсульта у пациентов с высоким риском. БМЖ. 2002;324:71-86. дои: 10.1136/bmj.324.7329.71
БМЖ. 2002;324:71-86. дои: 10.1136/bmj.324.7329.71
9. Diener HC, Weimar C. Обновление профилактики вторичного инсульта. Трансплантация нефролового циферблата. 2009; 24:1718-24. doi: 10.1093/ndt/gfp068
10. Руководящий комитет CAPRIE. Рандомизированное слепое исследование клопидогреля по сравнению с аспирином у пациентов с риском ишемических событий (CAPRIE). Ланцет. 1996; 348:1329-39. doi: 10.1016/S0140-6736(96)09457-3
11. Diener HC, Cunha L, Forbes C, et al. Европейское исследование профилактики инсульта, 2: дипиридамол и ацетилсалициловая кислота для вторичной профилактики инсульта. J Neurol Sci. 1996;143:1-13. doi: 10.1016/S0022-510X(96)00308-5
12. 2016 Руководство ESC по лечению мерцательной аритмии, разработанное в сотрудничестве с EACTS Целевой группой по лечению мерцательной аритмии Европейского общества кардиологов (ESC). Европейское сердце J. 2016; 50 (5): e1-e88.
13. Амаренко П., Лабреш Дж., Лавалль П., Тубул П.-Дж. Статины в профилактике инсульта и каротидного атеросклероза: систематический обзор и метаанализ. Инсульт. 2004;35:2902-9. doi: 10.1161/01.STR.0000147965.52712.fa
Инсульт. 2004;35:2902-9. doi: 10.1161/01.STR.0000147965.52712.fa
14. Wannamethee SG, Shaper AG, Whincup PH, Walker M. Отказ от курения и риск инсульта у мужчин среднего возраста. ДЖАМА. 1995; 274: 155-60. doi: 10.1001/jama.1995.03530020073035
15. Barnes JN. Упражнения, когнитивная функция и старение. Adv Physiol Educ. 2015;39(2):55-62. doi: 10.1152/advan.00101.2014
16. Canevelli M, Lucchini F, Quarata F, et al. Питание и деменция: данные для профилактических подходов? Питательные вещества. 2016;8(3): 144. doi: 10.3390/nu8030144
17. Баумгартнер Р., Оеш Л., Сарикая Х. Парадокс ожирения и инсульт. Праксис (Берн).2016; 105(14):835-41. doi: 10.1024/1661-8157/a002408
18. Winstein CJ, Stein J, Arena R, et al. Руководство по реабилитации и восстановлению после инсульта у взрослых. Руководство для медицинских работников Американской кардиологической ассоциации/Американской ассоциации инсульта. Инсульт. 2016; 47:e98-e169. doi: 10.1161/STR.0000000000000098
19. Pollock A, Baer G, Campbell P, et al. Подходы к физической реабилитации для восстановления функций и подвижности после инсульта. Кокрановская система баз данных, ред. 2014 г.; (4): Ст. № CD001920. doi: 10.1002/14651858.CD001920.pub3
Pollock A, Baer G, Campbell P, et al. Подходы к физической реабилитации для восстановления функций и подвижности после инсульта. Кокрановская система баз данных, ред. 2014 г.; (4): Ст. № CD001920. doi: 10.1002/14651858.CD001920.pub3
20. Дамулин И.В., Екушева Е.В. Постинсультные процессы нейропластичности. Неврология, Нейропсихиатрия, Психосоматика = Неврология, Нейропсихиатрия, Психосоматика. 2014;6(3):69-74. doi: 10.14412/2074-2711-2014-3-69-74
21. Mayo NE, Fellows LK, Scott SC, et al. Продольный взгляд на апатию и ее последствия после инсульта. Инсульт. 2009;40:3299-307. doi: 10.1161/STROKEAHA.109.554410
22. Duncan F, Kutlubaev MA, Dennis MS, et al. Усталость после инсульта: систематический обзор ассоциаций с нарушением физической формы. Инт J Инсульт. 2012;7:157-62. дои: 10.1111/j.1747-4949.2011.00741.x
23. Gebruers N, Vanroy C, Truijen S, et al. Мониторинг физической активности после инсульта: систематический обзор мер, основанных на акселерометрии. Arch Phys Med Rehabil. 2010;91: 288-97. doi: 10.1016/j.apmr.2009.10.025
Arch Phys Med Rehabil. 2010;91: 288-97. doi: 10.1016/j.apmr.2009.10.025
24. Lincoln NB, Brinkmann N, Cunningham S, et al. Тревога и депрессия после инсульта: 5-летнее наблюдение. Реабилитация инвалида. 2013;35:140-5. doi: 10.3109/09638288.2012.691939
25. Вербицкая С.В., Парфенов В.А., Решетников В.А. Постинсультные когнитивные нарушения (результаты 5-летнего наблюдения). Неврология, Нейропсихиатрия, Психосоматика = Неврология, Нейропсихиатрия, Психосоматика. 2018;10(1):37-42. дои: 10.14412/2074-2711-2018-1-37-42
26. Гадиди В., Кац-Лёрер М., Кармели Э., Борнштейн Н.М. Отдаленные исходы после инсульта: предикторы ограничения активности и ограничения участия. Arch Phys Med Rehabil. 2011 г.; 92:1802-8. doi: 10.1016/j.apmr.2011.06.014
27. Kim JH, Sim WS, Won BH. Эффективность голеностопных ортезов типа эластичных лент в отношении постурального контроля у пациентов пожилого возраста, перенесших инсульт, определяемая с помощью комбинированного измерения индекса стабильности и коэффициента нагрузки на тело. Clin Intervent Aging. 2015;10:1839-47. doi: 10.2147/CIA.S92888
Clin Intervent Aging. 2015;10:1839-47. doi: 10.2147/CIA.S92888
28. Tiozzo E, Youbi M, Dave K, et al. Аэробные, силовые и когнитивные упражнения после инсульта. Инсульт. 2015;46:2012-6. doi: 10.1161/STROKEAHA.114.006649
29. Francisco GE, Boake C. Улучшение скорости ходьбы при постинсультной спастической гемиплегии после интратекальной терапии баклофеном: предварительное исследование. Arch Phys Med Rehabil. 2003;84:1194-9. doi: 10.1016/S0003-9993(03)00134-5
30. Shaw LC, Price CIM, van Wijck FMJ, et al. Испытание ботулинического токсина для верхней конечности после инсульта (BoTULS): влияние на ухудшение, ограничение активности и боль. Инсульт. 2011 г.; 42:1371-9. doi: 10.1161/STROKEAHA.110.582197
31. Ward AB, Wissel J, Borg J, et al. Достижение функциональной цели у пациентов с постинсультной спастичностью: исследование экономической спастичности BOTOX® (BEST). J Rehabil Med. 2014;46:504-13. doi: 10.2340/16501977-1817
32. Толмачева В.А. Постинсультная спастичность: индивидуальный подход к лечению. Неврология, Нейропсихиатрия, Психосоматика = Неврология, Нейропсихиатрия, Психосоматика. 2016;8(4):71-6. дои: 10.14412/2074-2711-2016-4-71-76.
Неврология, Нейропсихиатрия, Психосоматика = Неврология, Нейропсихиатрия, Психосоматика. 2016;8(4):71-6. дои: 10.14412/2074-2711-2016-4-71-76.
33. Ding D, Lawson KD, Kolbe-Alexander TL, et al. Экономическое бремя отсутствия физической активности: глобальный анализ основных неинфекционных заболеваний. Ланцет. 2016; 388:1311-24. doi: 10.1016/S0140-6736(16)30383-X
34. Rist PM, Capistrant BD, Mayeda ER, et al. Физическая активность, но не индекс массы тела, предсказывает меньшую инвалидность до и после инсульта. Неврология. 2017;88:1718-26. doi: 10.1212/WNL.0000000000003888
35. Reinholdsson M, Palstam A, Sunnerhagen KS. Физическая активность до инсульта может влиять на тяжесть острого инсульта (часть PAPSIGOT). Неврология. 2018 16 октября; 91(16): е1461-е1467. Epub 2018 Sep 19.
36. Wang Y, Li M, Dong F, et al. Индуцированная физическими нагрузками защита при ишемических сердечно-сосудистых и цереброваскулярных заболеваниях. Int J Clin Exp Med. 2015;8:19859-66.
37. Миддлтон Л.Э., Корбетт Д., Брукс Д. и соавт. Физическая активность в профилактике ишемического инсульта и улучшении исходов: описательный обзор. Neurosci Biobehav Rev. 2013; 37: 133-7. doi: 10.1016/j.neubiorev.2012.11.011
38. Firth N, Barker RN, Hayward KS, et al. Безопасность и эффективность препаратов, способствующих восстановлению двигательной функции после инсульта: систематический обзор рандомизированных контролируемых исследований. J Rehabil Med. 201925 февраля [Epub перед печатью].
39. Bustamante A, Giralt D, Garcia-Bonilla L, et al. Цитиколин в доклинических моделях инсульта на животных: метаанализ показывает оптимальный нейропротекторный профиль и недостающие шаги для перехода к клиническим испытаниям инсульта. Дж. Нейрохим. 2012;123(2):217-25. doi: 10.1111/j.1471-4159.2012.07891.x
40. Gutierrez-Fernandez M, Rodriguez-Frutos B, Fuentes B, et al. Лечение ЦДФ-холином индуцирует экспрессию маркеров пластичности мозга при инсульте у экспериментальных животных. Нейрохим Инт. 2012;60:310-7. doi: 10.1016/j.neuint.2011.12.015
Нейрохим Инт. 2012;60:310-7. doi: 10.1016/j.neuint.2011.12.015
41. Пирадов М.А., Сергеев Д.В., Кротенкова М.В. Применение цераксона в остром периоде полушарного ишемического инсульта: клиническая и КТ оценка перфузии. Анналы клинической и экспериментальной неврологии = Анналы клинической и экспериментальной неврологии. 2012;(3):31-6.
42. Secades JJ, Alvarez-Sabin J, Castillo J, et al. Цитиколин при остром ишемическом инсульте: систематический обзор и формальный метаанализ рандомизированных, двойных слепых и плацебо-контролируемых исследований. J Инсульт Цереброваскулярная дис. 2016;25(8):1984-96. doi: 10.1016/j.jstrokecerebrovasdis.2016.04.010
43. Kan T, et al. Оценка лекарственного эффекта ЦДФхолина при последствиях инсульта многоцентровым двойным слепым методом – в центре исследования методом оценки восстановления функции гемиплегии 12. Jap J Clin Exper Med. 1976; 53:3781.
44. Хазама Т., Хасегава Т., Уэда С., Сакума А. Оценка влияния ЦДФ-холина на постинсультную гемиплегию с использованием двойного слепого контролируемого исследования. Оценено по новой оценочной шкале выздоровления при гемиплегии. Int J Neurosci. 1980; 11:211. doi: 10.3109/00207458009147587
Оценено по новой оценочной шкале выздоровления при гемиплегии. Int J Neurosci. 1980; 11:211. doi: 10.3109/00207458009147587
45. Ueda S, Hasegawa T, Ando K, et al. Оценка фармакологического эффекта инъекции ЦДФ-холина при постинсультной гемиплегии. Двойное слепое сравнительное исследование с использованием функционального теста на гемиплегию (метод оценки 12 баллов). Страйдс Мед. 1994; 170:297-314.
Тревога у пациентов с острым ишемическим инсультом: факторы риска и влияние на функциональное состояние
Введение
Тревога преобладает после инсульта и возникает примерно у четверти выживших после инсульта (1, 2). Постинсультная тревожность (ПСА) может оказывать негативное влияние на качество жизни (КЖ) лиц, перенесших инсульт, влияя на их реабилитацию (3). Кроме того, одно проспективное исследование показало, что тяжелые симптомы тревоги были связаны с повышенным риском инсульта, независимо от других факторов риска (4). Несмотря на высокую распространенность тревоги после инсульта, понимание ПСА ограничено.
Факторы риска, связанные с ПСА, включают депрессию (5–7), когнитивные нарушения (5, 8), утомляемость (9), возраст (10–12), женский пол (10, 12), локализацию поражения (13, 14) , и нарушение сна (9, 15), указывая на то, что ПСА может быть многофакторным. Помимо стресса, вызванного острым ишемическим инсультом, следует также учитывать биологические механизмы ПСА. Связанные с тревогой нейронные цепи охватывают широкий спектр структур мозга, включая подкорковое белое вещество и лимбическую систему (16, 17). Методы нейровизуализации, например, магнитно-резонансная томография (МРТ), позволяют точно локализовать инфаркт. Таким образом, изучение нейровизуализационных коррелятов ПСА может быть полезным для понимания патофизиологии ПСА. Тем не менее, в нескольких исследованиях оценивалась связь между ПСА и нейровизуализационными параметрами. Можно предположить гипотезу ПСА о локализации поражения, поскольку инфаркт может повредить структуры мозга, связанные с тревогой. Недавно было проведено крупномасштабное МРТ-исследование с участием 239пациентам с инсультом, но связи между локализацией поражения головного мозга и уровнем ПСА обнаружено не было (18). Таким образом, основные патофизиологические механизмы развития ПСА остаются неясными.
Таким образом, основные патофизиологические механизмы развития ПСА остаются неясными.
Функциональный статус, включая способность выполнять повседневные действия (ADL) и качество жизни, является важным результатом инсульта во многих исследованиях (3, 19, 20). Однако в нескольких исследованиях изучалось последующее влияние ПСА в острой фазе на качество жизни пациентов и функциональные исходы в хронической стадии.
Это проспективное исследование преследовало две цели. Первая цель состояла в том, чтобы исследовать связанные клинические и МРТ факторы риска ПСА, проверяя гипотезу ПСА о локализации поражения. Вторая цель состояла в том, чтобы изучить влияние ПСА на ADL и QOL пациентов после ишемического инсульта. Мы предположили, что поражения в определенных местах (например, в структурах, связанных с эмоциональной модуляцией) с большей вероятностью могут привести к ПСА. Тяжесть ПСА в острой стадии является важным фактором, независимо способствующим ухудшению ADL и QOL в хронической стадии.
Методы
Участники и условия
Пациенты с впервые или рецидивирующим острым ишемическим инсультом, поступившие в отделение неврологии Народной больницы Дунгуань в период с июля 2013 г. по июнь 2014 г., были обследованы для участия в этом исследовании. Пациентов включали в исследование, если они соответствовали следующим критериям: 1) возраст от 40 до 80 лет; 2) перенес острый, первый или повторный ишемический инсульт, произошедший в течение 7 дней до поступления; если у них был предыдущий инсульт, оценка по модифицированной шкале Рэнкина до индексного инсульта была <2. Пациенты были исключены, если они 1) имели серьезное неврологическое заболевание, кроме инсульта, например, болезнь Паркинсона, опухоль головного мозга или рассеянный склероз; 2) при поступлении не было МРТ или некачественные МРТ; 3) перенес тяжелый инсульт, получивший суммарный балл по шкале инсульта Национального института здоровья (NIHSS) ≥15; 4) имели тяжелую афазию (определяемую как лучший языковой суббалл NIHSS ≥2) или дизартрию; 5) имели тяжелые когнитивные нарушения, определяемые общим баллом по краткой шкале оценки психического состояния (MMSE) <17; 6) имели в анамнезе тревожные расстройства, депрессию, токсикоманию/зависимость или другие психические расстройства до индексного инсульта; 7) имели сопутствующие тяжелые заболевания сердца, легких, почек, печени или злокачественные опухоли. Это исследование было проведено в соответствии с рекомендациями Хельсинкской декларации Всемирной медицинской ассоциации. Протокол исследования был одобрен Комитетом по этике Народной больницы Дунгуань. Бланки согласия были получены от пациентов или их законных представителей.
Это исследование было проведено в соответствии с рекомендациями Хельсинкской декларации Всемирной медицинской ассоциации. Протокол исследования был одобрен Комитетом по этике Народной больницы Дунгуань. Бланки согласия были получены от пациентов или их законных представителей.
Сбор демографических и клинических данных
Демографические данные пациентов (возраст, пол и уровень образования) и клинические характеристики, включая сосудистые факторы риска (например, артериальная гипертензия, сахарный диабет, гиперлипидемия и курение в анамнезе) и предшествующий анамнез инсульта, были получены из медицинских записи. Тяжесть инсульта оценивалась NIHSS по медицинским записям.
Оценка ПСА
Китайская версия Шкалы оценки тревожности Гамильтона (HARS) из 14 пунктов (21, 22) использовалась для оценки симптомов тревоги у всех участников на острой стадии, когда они были стабильны с медицинской точки зрения (5–14 дней). после индексного инсульта) и при последующем наблюдении через 3 мес. Оценку клинической тревожности проводили два обученных невролога (WL и HW), которые не знали результатов МРТ выживших после инсульта. Китайская версия HARS из 14 пунктов широко использовалась в китайской популяции, а также у китайских пациентов с инсультом (22), что свидетельствует о хорошей надежности и достоверности. ПСА в этом исследовании определялся по шкале HARS ≥14 (22). HARS повторно проводился через 3 месяца после инсульта теми же оценщиками. ПСА определялся как показатель HARS ≥14 через 3 месяца после инсульта. Если у пациентов исходно диагностировали тревожность и они получали противотревожное лечение, у них также диагностировали наличие ПСА, даже если их оценка по шкале HARS была ниже 14.
Оценку клинической тревожности проводили два обученных невролога (WL и HW), которые не знали результатов МРТ выживших после инсульта. Китайская версия HARS из 14 пунктов широко использовалась в китайской популяции, а также у китайских пациентов с инсультом (22), что свидетельствует о хорошей надежности и достоверности. ПСА в этом исследовании определялся по шкале HARS ≥14 (22). HARS повторно проводился через 3 месяца после инсульта теми же оценщиками. ПСА определялся как показатель HARS ≥14 через 3 месяца после инсульта. Если у пациентов исходно диагностировали тревожность и они получали противотревожное лечение, у них также диагностировали наличие ПСА, даже если их оценка по шкале HARS была ниже 14.
Оценка другого психологического статуса в острой стадии инсульта
Китайская версия шкалы MMSE (баллы варьируются от 0 до 30, при этом более низкие баллы указывают на больший дефицит) (23) использовалась для измерения основных когнитивных функций у двух обученных неврологи (WL и HW). Они также применяли китайскую версию Шкалы оценки депрессии Гамильтона (HDRS) из 24 пунктов (22, 24), которая использовалась для оценки тяжести депрессивных симптомов, с внутренним постоянным коэффициентом Кронбаха α = 0,88–0,9.9 (22).
Они также применяли китайскую версию Шкалы оценки депрессии Гамильтона (HDRS) из 24 пунктов (22, 24), которая использовалась для оценки тяжести депрессивных симптомов, с внутренним постоянным коэффициентом Кронбаха α = 0,88–0,9.9 (22).
Оценка функционального состояния через 3 месяца после инсульта
Два эксперта использовали шкалу ADL Лоутона (25) и китайскую версию шкалы качества жизни, характерной для инсульта (SSQOL) (26). Шкала Lawton ADL, содержащая шесть пунктов, оценивающих самообслуживание, и восемь пунктов, оценивающих инструментальную деятельность, использовалась для измерения функционального уровня пациентов с инсультом. Каждый пункт оценивался от 1 до 4, а общий балл ADL рассчитывался путем суммирования баллов по всем пунктам. Более высокие баллы указывают на более низкую производительность. Каппа тест-ретест китайской версии шкалы Lawton ADL составляет 0,502 (22). Китайская версия шкалы SSQOL, которая использовалась для оценки качества жизни пациентов и показала хорошую надежность и валидность, состоит из 49вопросы сгруппированы в 12 доменов с оценками от 1 (худший результат) до 5 (лучший результат). Внутренняя согласованная надежность высокая (α Кронбаха = 0,76) (26, 27).
Внутренняя согласованная надежность высокая (α Кронбаха = 0,76) (26, 27).
Перед первым интервью два невролога отобрали 10 пациентов с ишемическим инсультом, чтобы проверить межнациональную надежность инструментов оценки. Коэффициенты внутриклассовой корреляции (ICC) вышеуказанных шкал между двумя оценщиками варьировались от 0,83 до 0,91.
Оценка магнитно-резонансной томографии
МРТ было выполнено с использованием 1,5-Тл томографа (Achieva Phillip Medical System, Best, Нидерланды) в течение 7 дней после индексного инсульта. Последовательности МРТ-сканирования включали диффузионно-взвешенную визуализацию (DWI), последовательности градиентного эха и T1- и T2-взвешенные последовательности восстановления инверсии с ослаблением жидкости. Квалифицированный невролог (YL), который был ослеплен клинической информацией о пациенте, оценил переменные МРТ следующим образом:
1. Инфаркты: расположение, количество и объем острых инфарктов были исследованы в DWI. Места острых инфарктов обозначали по отделам головного мозга следующим образом: лобные, теменные, височные и затылочные доли; мозолистое тело; коронарное излучение; центр полуовальный; внутренняя капсула; базальный ганглий; таламус; мозговой ствол; и мозжечок. Если у пациента были инфаркты более чем в двух местах, оба места будут регистрироваться как наличие. Белое вещество полушария головного мозга (CHWM) определялось как любая супратенториальная структура белого вещества, включая мозолистое тело, лучистую коронарную часть, полуовальный центр и внутреннюю капсулу.
Если у пациента были инфаркты более чем в двух местах, оба места будут регистрироваться как наличие. Белое вещество полушария головного мозга (CHWM) определялось как любая супратенториальная структура белого вещества, включая мозолистое тело, лучистую коронарную часть, полуовальный центр и внутреннюю капсулу.
2. Общий объем был рассчитан путем умножения общей площади на сумму толщины среза и зазора. Регистрировали также количество старых лакунарных инфарктов.
3. Поражения белого вещества (WMLs). Степень WML оценивали по четырехбалльной шкале Fazekas et al. (28). Глубокая гиперинтенсивность белого вещества (DWMH) и перивентрикулярная гиперинтенсивность (PVH) оценивались на изображениях с инверсионным восстановлением с ослаблением жидкости (FLAIR).
4. Отношение желудочков к мозгу (VBR). VBR является индикатором глобальной атрофии головного мозга (29). Был выбран срез, показывающий наибольшую вертикальную длину бокового желудочка в середине. VBR определяли как отношение диаметра ширины бокового желудочка к ширине головного мозга по той же линии (30).
5. Медиальная височная атрофия (MTLA). MTLA измеряли по шкале Шелтена (31). Эта визуальная оценочная шкала дает стандартные изображения с различной степенью атрофии MTL на коронарных срезах МРТ, в диапазоне от 0 до 4, от «нет атрофии» до «тяжелая атрофия». Оценка MTLA определялась с использованием суммы левой и правой средних височных долей.
Мероприятия по оценке внутриэкспертной надежности проводились у 10 пациентов одним и тем же специалистом по МРТ в двух временных точках (интервал ≥2 месяцев). Как сообщалось в нашем предыдущем исследовании (32), внутриэкспертная согласованность измерений МРТ была от хорошей до отличной.
Статистический анализ
Все статистические тесты проводились с использованием SPSS для Windows (выпуск 16.0, SPSS Inc., Чикаго, Иллинойс, США). В острой стадии инсульта все пациенты были разделены на две группы, с ПСА и без ПСА, в соответствии с пороговым значением HARS. Демографические и клинические переменные сравнивались между группами с ПСА и без ПСА с использованием χ 2 , два независимых теста t или тест Манна-Уитни U , в зависимости от ситуации, для выявления потенциальных предикторов. Переменные с P < 0,1 в одномерных сравнениях были введены как независимые переменные в множественный пошаговый логистический регрессионный анализ с ПСА в качестве зависимой переменной. Те же статистические процедуры были выполнены через 3 месяца после инсульта. Впоследствии были выполнены множественные линейные регрессии для изучения влияния HARS в острой стадии на ADL и SSQOL через 3 месяца после инсульта (ADL и SSQOL использовались в качестве зависимых переменных) после поправки на возраст, пол, NIHSS и HDRS. Уровень значимости был установлен на уровне 0,05 (двусторонний).
Переменные с P < 0,1 в одномерных сравнениях были введены как независимые переменные в множественный пошаговый логистический регрессионный анализ с ПСА в качестве зависимой переменной. Те же статистические процедуры были выполнены через 3 месяца после инсульта. Впоследствии были выполнены множественные линейные регрессии для изучения влияния HARS в острой стадии на ADL и SSQOL через 3 месяца после инсульта (ADL и SSQOL использовались в качестве зависимых переменных) после поправки на возраст, пол, NIHSS и HDRS. Уровень значимости был установлен на уровне 0,05 (двусторонний).
Результаты
Всего было госпитализировано и обследовано 435 пациентов в возрасте от 40 до 80 лет с острым ишемическим инсультом. Двести девятнадцать пациентов (50,3%) соответствовали критериям исследования и были включены в исследование. По сравнению с теми, кто был исключен, участвующие пациенты были моложе (61,4 ± 11,2 против 64,8 ± 12,7 лет; P <0,001), имели более низкий балл по шкале NIHSS при поступлении (медиана 3,0 [диапазон 0–15] против . 5,0 (0–35), P < 0,001), но имели сопоставимую частоту мужского пола (73,1% против . 68,1%; P = 0,252).
5,0 (0–35), P < 0,001), но имели сопоставимую частоту мужского пола (73,1% против . 68,1%; P = 0,252).
Демографические и клинические характеристики
Исследовательская когорта состояла из 219 пациентов, которые соответствовали критериям исследования (таблица 1). Один пациент умер, а трое пациентов были потеряны для последующего наблюдения до 3-месячной оценки. В острой стадии и через 3 месяца после индексного инсульта у 34 (15,5%) и 33 (15,1%) пациентов был расценен ПСА соответственно. По сравнению с пациентами без ПСА пациенты с ПСА чаще были женщинами и имели более тяжелые симптомы депрессии (таблица 1). Никакие переменные МРТ существенно не отличались между двумя группами, хотя пациенты с ПСА имели тенденцию к большему количеству инфарктов CHWM как в острой стадии, так и через 3 месяца после инсульта ( P = 0,075 и P = 0,071 соответственно; Таблица 2).
Таблица 1 Сравнение демографических и клинических переменных между группами с ПСА и без ПСА.
Таблица 2 Сравнение переменных МРТ между группами ПСА и без ПСА.
Корреляты постинсультной тревожности в острой стадии инсульта
HDRS, пол и острые инфаркты у CHWM оценивали с помощью множественной логистической регрессии. HDRS (отношение шансов [OR] = 1,269, 95% ДИ = 1,182–1,364, P < 0,001) и острые инфаркты при ХБВ (ОШ = 2,902, 95% ДИ = 1,052–8,007, P = 0,040) были значимыми коррелятами ПСА в острой стадии инсульта ( Таблица 3).
Таблица 3 Корреляты ПСА в острой стадии ишемического инсульта.
Корреляты постинсультной тревожности через 3 месяца после инсульта
HDRS, пол, NIHSS, MMSE и острые инфаркты у CHWM оценивали с помощью множественной логистической регрессии. HDRS (ОШ = 1,232, 95% ДИ = 1,150–1,320, P <0,001), женский пол (ОШ = 3,214, 95% ДИ = 1,124–9,189, P = 0,029) и острые инфаркты при ХБВ (ОШ = 2,904, 95% ДИ = 1,033–8,162, P = 0,043) достоверно коррелировал с уровнем ПСА (табл. 4).
4).
Таблица 4 Корреляты ПСА через 3 месяца после инсульта.
Влияние тревоги в острой стадии на повседневную активность и качество жизни, характерное для инсульта, через 3 месяца после инсульта ADL и SSQOL через 3 месяца после инсульта (таблица 5). Пациенты с ПСА в острой стадии с большей вероятностью имели более низкие показатели ADL и SSQOL через 3 месяца после инсульта.
Таблица 5 Влияние ПСА в острой стадии на ADL и SSQOL через 3 месяца после инсульта.
Анализ чувствительности после исключения пациентов с инсультом в анамнезе
Анализы, включающие только пациентов с впервые в жизни инсультом, приведены в дополнительных таблицах. Острые инфаркты при CHWM оставались значимым коррелятом ПСА на острой стадии, но не через 3 месяца после инсульта. Оценка HARS на острой стадии значительно способствовала ухудшению ADL и SSQOL через 3 месяца после инсульта после поправки на возраст, пол, NIHSS и HDRS.
Обсуждение
В этом проспективном и лонгитюдном исследовании мы обнаружили, что частота ПСА в острой стадии и через 3 месяца после ишемического инсульта легкой и средней степени тяжести составила 15,5% и 15,1% соответственно. HDRS и острые инфаркты при CHWM коррелировали с уровнем ПСА как в острой стадии, так и через 3 месяца после инсульта. Тяжесть ПСА была важным показателем как для ADL, так и для SSQOL. Насколько нам известно, исследования, изучающие влияние ПСА на функциональное состояние, очень ограничены. Наше исследование представляет собой значительный вклад в литературу о значении ПСА.
HDRS и острые инфаркты при CHWM коррелировали с уровнем ПСА как в острой стадии, так и через 3 месяца после инсульта. Тяжесть ПСА была важным показателем как для ADL, так и для SSQOL. Насколько нам известно, исследования, изучающие влияние ПСА на функциональное состояние, очень ограничены. Наше исследование представляет собой значительный вклад в литературу о значении ПСА.
Тревожные симптомы были обычным явлением после инсульта. По данным метаанализа, уровень ПСА затрагивает 25% выживших после инсульта (1). Резюме исследований ПСА показано в таблице 6. В нашем исследовании мы использовали HARS для оценки симптомов тревоги с отсечкой среднего значения HARS ≥14 и обнаружили, что частота ПСА составляла около 15% у лиц, перенесших инсульт, что было ниже, чем у большинства пациентов. предыдущие исследования (33–37). Это может быть связано с включением выборки инсульта с относительно легким неврологическим дефицитом (медиана NIHSS, 4) и исключением тяжелых неврологических дефицитов или афазии. Пациенты, исключенные из этого исследования, могут быть более склонны к ПСА. Различия в инструментах оценки PSA также могут способствовать различиям между нашими результатами и предыдущими исследованиями.
Пациенты, исключенные из этого исследования, могут быть более склонны к ПСА. Различия в инструментах оценки PSA также могут способствовать различиям между нашими результатами и предыдущими исследованиями.
Таблица 6 Резюме исследований, оценивающих корреляты или распространенность тревоги у пациентов с ишемическим инсультом.
Внезапное возникновение неврологического дефицита может вызвать стресс или тревогу у пациентов, перенесших инсульт. Мы оценивали ПСА в двух временных точках, включая острую стадию (5–14 дней) и месяцы после инсульта. Временная точка 5–14 дней была выбрана для первой временной точки, потому что именно в этот период пациенты обычно стабильны с медицинской точки зрения. Временная точка в 3 месяца была выбрана, поскольку острые последствия стресса, связанного с неблагоприятным жизненным событием, могли уменьшиться, и эта временная точка обычно использовалась в предыдущих исследованиях (5, 13). Поскольку ПСА может быть многофакторным, мы собрали всесторонние данные, насколько это возможно, включая клинические, физические, психологические и нейровизуализационные переменные. Настоящее исследование показало, что ПСА была в значительной степени связана с ПСА как на острой стадии, так и через 3 месяца после инсульта, что указывает на то, что ПСА и ПСА могут иметь общий патофизиологический механизм. Эта коморбидность была подтверждена другими исследованиями (2, 5, 37).
Настоящее исследование показало, что ПСА была в значительной степени связана с ПСА как на острой стадии, так и через 3 месяца после инсульта, что указывает на то, что ПСА и ПСА могут иметь общий патофизиологический механизм. Эта коморбидность была подтверждена другими исследованиями (2, 5, 37).
Имеющиеся клинические данные о взаимосвязи между уровнем ПСА и локализацией поражения противоречивы. Танг и др. (13) обнаружили, что пациенты с острым инфарктом лобной доли чаще имеют ПСА. Как и в других исследованиях (8, 18, 40), мы не смогли найти ни одного очага поражения, который был бы напрямую связан с ПСА. Тем не менее, мы обнаружили, что у пациентов с острым инфарктом в СНИМ чаще наблюдался ПСА в острой стадии инсульта, а также через 3 месяца после инсульта. Ранее об этом открытии не сообщалось. CHWM включает широкий спектр областей связанных нервных волокон в полушарии головного мозга, например, мозолистое тело, лучистый венец, полуовальный центр и внутреннюю капсулу. Нервные цепи, связанные с регуляцией эмоций, широко распространены в полушариях головного мозга, таких как лобно-подкорковые цепи или лимбическая система (41, 42). Аномалии белого вещества головного мозга также связаны с развитием тревоги (17). Таким образом, острые поражения CHWM являются логическими потенциальными факторами, влияющими на ПСА. Однако широкий диапазон OR в CHWM в прогнозировании PSA указывает на то, что этот предварительный вывод следует тщательно повторить в дальнейших исследованиях. Кроме того, после исключения пациентов с инсультом в анамнезе СНВ способствовал повышению уровня ПСА только в острой стадии, но не через 3 месяца после инсульта.
Аномалии белого вещества головного мозга также связаны с развитием тревоги (17). Таким образом, острые поражения CHWM являются логическими потенциальными факторами, влияющими на ПСА. Однако широкий диапазон OR в CHWM в прогнозировании PSA указывает на то, что этот предварительный вывод следует тщательно повторить в дальнейших исследованиях. Кроме того, после исключения пациентов с инсультом в анамнезе СНВ способствовал повышению уровня ПСА только в острой стадии, но не через 3 месяца после инсульта.
Роль CHWM в развитии PSA остается неясной. В последнее время исследования были сосредоточены на поражениях, затрагивающих нейронную сеть или цепи, а не на отдельных участках. Форнито и др. (43) сообщили, что нарушение функциональной нейронной сети может быть более важным, чем локализация поражения, для объяснения ПСА. Вичентини и др. (12) сообщили, что ПСА не был связан с локализацией инфаркта, но коррелировал с нарушением сети режима по умолчанию (DMN) в головном мозге. Соответственно, изучение влияния целостности мозговых сетей или нейронных цепей, а не одного места на ПСА, может стать еще одним направлением дальнейших исследований.
Тяжесть ПСА в острой стадии была обратно пропорциональна эффективности ADL в этом исследовании. Шульц и др. (10) сообщили, что ассоциация тревоги и нарушений в АДЛ присутствовала только при начальной оценке (в острой стадии ишемического инсульта) с независимыми эффектами только у женщин. Можно предположить, что пациенты с ПСА могут иметь плохую приверженность к реабилитационным мероприятиям из-за значительного снижения как физической, так и умственной энергии, что, в свою очередь, ухудшает выполнение АДЛ.
Инсульт часто снижает уровень качества жизни, связанного со здоровьем (HRQOL), у выживших. Наше исследование показало, что тяжесть ПСА в острой стадии в значительной степени способствовала снижению SSQOL через 3 месяца после инсульта. ПСА может снижать физическую и умственную энергию, мотивацию и активность, что затем обратно влияет на КЖСЗ. Поперечное исследование также показало, что более низкое качество жизни было связано с более высокими уровнями физической инвалидности, тревоги и депрессии, а также снижением социального взаимодействия (44). Таким образом, оценка и вмешательство ПСА, а также PSD в острой стадии могут быть полезными для прогнозирования исходов функционального статуса.
Таким образом, оценка и вмешательство ПСА, а также PSD в острой стадии могут быть полезными для прогнозирования исходов функционального статуса.
У нашего исследования есть несколько сильных сторон. Во-первых, мы провели личное интервью для оценки функциональных и психологических показателей, о чем редко сообщалось в других исследованиях. Во-вторых, мы получили исчерпывающие данные МРТ от всех участников. Однако в нашем исследовании было также несколько ограничений. Во-первых, в исследование были включены только пациенты с ишемическим инсультом легкой и средней степени тяжести без тяжелых когнитивных нарушений и афазии, что ограничивает обобщение наших результатов. Во-вторых, мы не собирали лекарства или реабилитацию после выписки, хотя большинство пациентов посещали неврологов или терапевтов в поликлиниках. В-третьих, мы использовали только инструмент скрининга (HDRS), а не стандартное психиатрическое интервью для определения ПСА, поскольку в нашей больнице нет достаточного количества специалистов-психиатров. Наконец, связь между ПСА и КЖ или ADL не указывает на причинно-следственную связь из-за дизайна исследования.
Наконец, связь между ПСА и КЖ или ADL не указывает на причинно-следственную связь из-за дизайна исследования.
В целом тревога часто встречается на острой и хронической стадиях ишемического инсульта с легким или умеренным неврологическим дефицитом. Гипотеза ПСА о локализации поражения может иметь значение, но остается неопределенной. ПСА в острой стадии может оказывать существенное влияние на ADL и HRQOL у пациентов с инсультом в хронической стадии. Раннее выявление симптомов тревоги может способствовать функциональному восстановлению и улучшению качества жизни у пациентов с инсультом. Тщательная оценка ПСА должна быть интегрирована в клиническую помощь пациентам с инсультом.
Заявление об этике
Это исследование было проведено в соответствии с рекомендациями «Руководящих принципов для комитетов по этике, которые рассматривают биомедицинские исследования, Всемирная организация здравоохранения (2000 г.), Комитет по этике Народной больницы Дунгуань» с письменного информированного согласия всех субъектов. Все субъекты дали письменное информированное согласие в соответствии с Хельсинкской декларацией. Протокол был одобрен «Комитетом по этике Народной больницы Дунгуань».
Все субъекты дали письменное информированное согласие в соответствии с Хельсинкской декларацией. Протокол был одобрен «Комитетом по этике Народной больницы Дунгуань».
Вклад авторов
YC и WX разработали исследование. WL, JQ и GL провели скрининг и собрали пациентов. WL и HW провели психологическую оценку. Компания XF разработала и обучила оценку МРТ. YL оценил переменные МРТ. WL и YC написали рукопись.
Финансирование
Это исследование финансировалось Фондом медицинских научных исследований провинции Гуандун, Китай (№ гранта: B2011349).
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Ссылки
1. Campbell Burton CA, Murray J, Holmes J, Astin F, Greenwood D, Knapp P. Частота беспокойства после инсульта: систематический обзор и метаанализ обсервационных исследований. Int J Stroke (2013) 8(7):545–59. doi: 10.1111/j.1747-4949.2012.00906.x
Int J Stroke (2013) 8(7):545–59. doi: 10.1111/j.1747-4949.2012.00906.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
2. Райт Ф., Ву С., Чун Х.И., Мид Г. Факторы, связанные с постинсультной тревогой: систематический обзор и метаанализ. Лечение инсульта (2017) 2017:2124743. doi: 10.1155/2017/2124743
Полный текст CrossRef | Google Scholar
3. Танг В.К., Лау К.Г., Мок В., Унгвари Г.С., Вонг К.С. Влияние тревоги на качество жизни после инсульта, связанное со здоровьем: поперечное исследование. Arch Phys Med Rehabil (2013) 94(12):2535–41. doi: 10.1016/j.apmr.2013.07.012
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
4. Lambiase MJ, Kubzansky LD, Thurston RC. Проспективное исследование тревоги и инсульта. Инсульт (2014) 45 (2): 438–43. doi: 10.1161/STROKEAHA.113.003741
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
5. Баркер-Колло С. Л. Депрессия и тревога через 3 месяца после инсульта: распространенность и корреляты. Arch Clin Neuropsychol (2007) 22(4):519–31. doi: 10.1016/j.acn.2007.03.002
Л. Депрессия и тревога через 3 месяца после инсульта: распространенность и корреляты. Arch Clin Neuropsychol (2007) 22(4):519–31. doi: 10.1016/j.acn.2007.03.002
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
6. Schottke H, Giabbiconi CM. Постинсультная депрессия и постинсультная тревожность: распространенность и предикторы. Int Psychogeriatr (2015) 27(11):1805–12. doi: 10.1017/S1041610215000988
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
7. Уайт Дж. Х., Аттиа Дж., Штурм Дж., Картер Дж., Мэджин П. Предикторы депрессии и тревоги у выживших после инсульта в сообществе: когортное исследование. Disabil Rehabil (2014) 36 (23): 1975–82. doi: 10.3109/09638288.2014.884172
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
8. Fure B, Wyller TB, Engedal K, Thommessen B. Эмоциональные симптомы при остром ишемическом инсульте. Int J Geriatr Psychiatry (2006) 21(4):382–7. doi: 10.1002/gps.1482
doi: 10.1002/gps.1482
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
9. Галлиган Н.Г., Хеви Д., Коэн Р.Ф., Харбисон Дж.А. Выяснение связи между тревогой, депрессией и усталостью после инсульта. J Health Psychol (2016) 21(12):2863–71. doi: 10.1177/135
15587140
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
10. Шульц С.К., Кастильо К.С., Косьер Дж.Т., Робинсон Р.Г. Генерализованная тревога и депрессия.
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
11. Карод-Артал Ф.Дж., Феррейра С.Л., Ризотто Д.С., Менезес М.С. Постинсультная депрессия: распространенность и детерминанты у пациентов с инсультом в Бразилии. Cerebrovasc Dis (2009) 28(2):157–65. doi: 10.1159/000226114
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
12. Vicentini JE, Weiler M, Almeida SRM, de Campos BM, Valler L, Li LM. Симптомы депрессии и тревоги связаны с нарушением сети пассивного режима при подостром ишемическом инсульте. Brain Imaging Behav (2017) 11(6):1571–80. doi: 10.1007/s11682-016-9605-7
Симптомы депрессии и тревоги связаны с нарушением сети пассивного режима при подостром ишемическом инсульте. Brain Imaging Behav (2017) 11(6):1571–80. doi: 10.1007/s11682-016-9605-7
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
13. Тан В.К., Чен И., Лу Дж., Лян Х., Чу В.К., Тонг Мок В.К., Лобные инфаркты и тревога при инсульте. Инсульт (2012) 43(5):1426–8. doi: 10.1161/STROKEAHA.111.640482
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
14. Астром М. Генерализованное тревожное расстройство у больных, перенесших инсульт. Ход (1996) 27(2):270–5. doi: 10.1161/01.STR.27.2.270
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
15. Leppävuori A, Pohjasvaara T, Vataja R, Kaste M, Erkinjuntti T. Генерализованные тревожные расстройства через три-четыре месяца после ишемического инсульта. Cerebrovasc Dis (2003) 16(3):257–64. doi: 10.1159/000071125
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
16.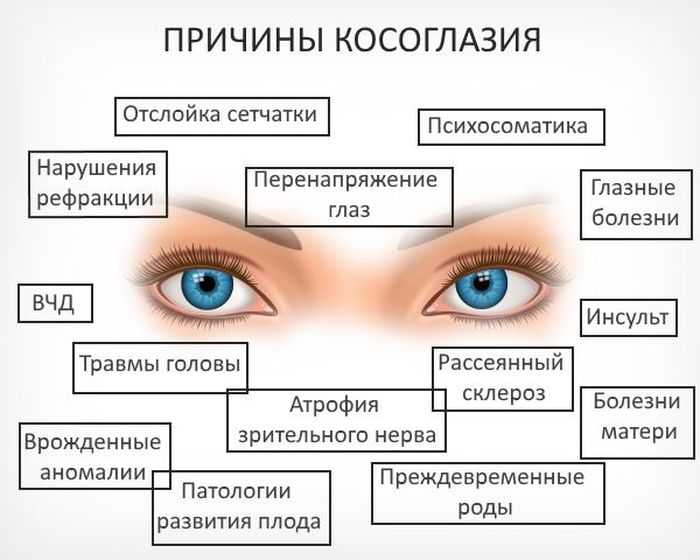 Allsop SA, Vander Weele CM, Wichmann R, Tye KM. Оптогенетические взгляды на взаимосвязь между поведением, связанным с тревогой, и социальным дефицитом.
Allsop SA, Vander Weele CM, Wichmann R, Tye KM. Оптогенетические взгляды на взаимосвязь между поведением, связанным с тревогой, и социальным дефицитом.
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
17. Westlye LT, Bjørnebekk A, Grydeland H, Fjell AM, Walhovd KB. Связь личностной черты, связанной с тревогой, с микроструктурой белого вещества головного мозга: диффузионно-тензорная визуализация и предотвращение вреда. Arch General Psychiatry (2011) 68 (4): 369–77. doi: 10.1001/archgenpsychiatry.2011.24
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
18. Liu Z, Cai Y, Zhang X, Zhu Z, He J. Высокий уровень малонового диальдегида и антиоксидантных ферментов в сыворотке крови связан с постинсультной тревожностью. Neurol Sci (2018) 39(6):999–1007. doi: 10.1007/s10072-018-3287-4
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
19.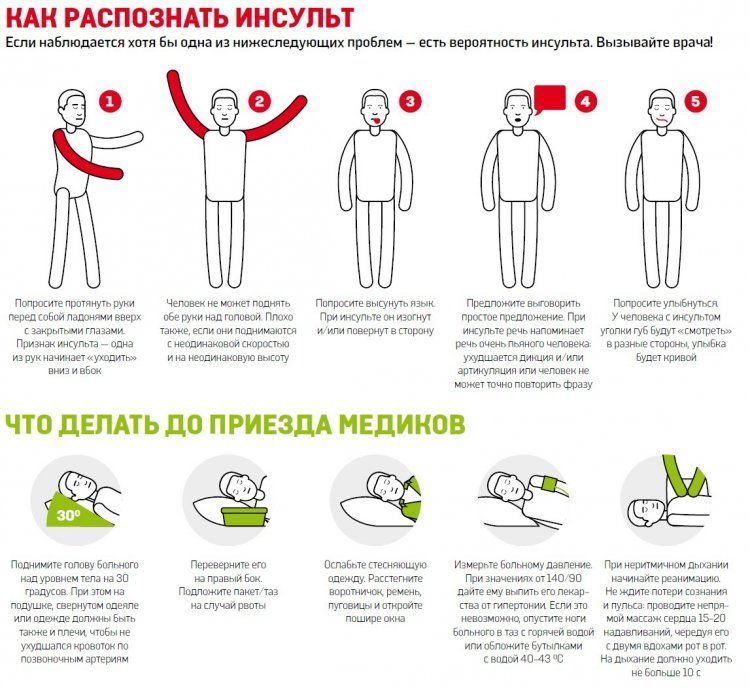 Раджу Р.С., Сарма П.С., Пандиан Д.Д. Психосоциальные проблемы, качество жизни и функциональная независимость среди выживших после инсульта в Индии. Инсульт (2010) 41(12):2932–7. doi: 10.1161/STROKEAHA.110.596817
Раджу Р.С., Сарма П.С., Пандиан Д.Д. Психосоциальные проблемы, качество жизни и функциональная независимость среди выживших после инсульта в Индии. Инсульт (2010) 41(12):2932–7. doi: 10.1161/STROKEAHA.110.596817
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
20. Чон Б.О., Кан Х.Дж., Пэ К.И., Ким С.В., Ким Дж.М., Шин И.С. и др. Детерминанты качества жизни в острой стадии после инсульта. Psychiatry Investig (2012) 9(2):127–33. doi: 10.4306/pi.2012.9.2.127
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
21. Гамильтон М. Оценка тревожных состояний рейтингом. Br J Med Psychol (1959) 32(1):50–5. дои: 10.1111/j.2044-8341.1959.tb00467.x
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
22. Чжан МЮ. Депрессия и тревога. В: Чжан МЮ, редактор.
Google Scholar
23. Katzman R, Zhang MY, Ouang-Ya-Qu, Wang ZY, Liu WT, Yu E, et al. Китайская версия мини-обследования психического состояния; влияние неграмотности в исследовании деменции в Шанхае. Дж Клин Эпидемиол (1988) 41(10):971–8. doi: 10.1016/0895-4356(88)
Katzman R, Zhang MY, Ouang-Ya-Qu, Wang ZY, Liu WT, Yu E, et al. Китайская версия мини-обследования психического состояния; влияние неграмотности в исследовании деменции в Шанхае. Дж Клин Эпидемиол (1988) 41(10):971–8. doi: 10.1016/0895-4356(88)
-0
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
24. Гамильтон М. Шкала оценки депрессии. J Neurol Neurosurg Psychiatry (1960) 23:56–62. doi: 10.1136/jnnp.23.1.56
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
25. Lawton MP, Brody EM. Оценка пожилых людей: самоподдерживающая и инструментальная деятельность повседневной жизни. Геронтолог (1969) 9(3):179–86. doi: 10.1093/geront/9.3_Part_1.179
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
26. Уильямс Л.С., Вайнбергер М., Харрис Л.Е., Кларк Д.О., Биллер Дж. Разработка шкалы качества жизни для инсульта. Инсульт (1999) 30(7):1362–9. doi: 10.1161/01. STR.30.7.1362
STR.30.7.1362
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
27. Tang WK, Chen YK, Lu JY, Chu WC, Mok VCT, Ungvari GS, et al. Церебральные микрокровоизлияния и депрессия при лакунарном инсульте. Инсульт (2011) 42(9):2443–6. doi: 10.1161/STROKEAHA.111.614586
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
28. Fazekas F, Chawluk JB, Alavi A, Hurtig HI, Zimmerman RA. Аномалии МР-сигнала при 1,5 Тл при деменции Альцгеймера и нормальном старении. AJR Am J Roentgenol (1987) 149(2):351–6. doi: 10.2214/ajr.149.2.351
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
29. Papageorgiou C, Ziroyannis P, Vathylakis J, Grigoriadis A, Hatzikonstantinou V, Capsalakis Z. Сравнительное исследование атрофии головного мозга с помощью компьютерной томографии при хронической почечной недостаточности и хроническом гемодиализе. Acta Neurol Scand (1982) 66(3):378–85. doi: 10. 1111/j.1600-0404.1982.tb06859.x
1111/j.1600-0404.1982.tb06859.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
30. Викторофф Дж., Мак В.Дж., Графтон С.Т., Шрайбер С.С., Чуй Х.К. Способ повышения межэкспериментальной достоверности визуального контроля МРТ головного мозга при деменции. Неврология (1994) 44(12):2267–76. doi: 10.1212/WNL.44.12.2267
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
31. Galton CJ, Gomez-Anson B, Antoun N, Scheltens P, Patterson K, Graves M, et al. Шкала оценки височной доли: приложение к болезни Альцгеймера и лобно-височной деменции. J Neurol Neurosurg Psychiatry (2001) 70(2):165–73. doi: 10.1136/jnnp.70.2.165
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
32. Chen YK, Qu JF, Xiao WM, Li WY, Li W, Fang XW и др. Внутричерепной атеросклероз и постинсультная депрессия у китайских пациентов с ишемическим инсультом. J Stroke Cerebrovasc Dis (2016) 25(4):998–1004. doi: 10.1016/j.jstrokecerebrovasdis.2015.12.038
doi: 10.1016/j.jstrokecerebrovasdis.2015.12.038
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
33. De Wit L, Putman K, Baert I, Lincoln NB, Angst F, Beyens H, et al. Тревога и депрессия в первые полгода после инсульта. Disabil Rehabil (2008) 30 (24): 1858–66. doi: 10.1080/09638280701708736
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
34. Вулетич В., Сапина Л., Лозерт М., Лезаич З., Морович С. Тревожные и депрессивные симптомы при остром ишемическом инсульте. Acta Clin Croat (2012) 51(2):243–6. doi: 10.1016/j.jstrokecerebrovasdis.2018.09.037
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
35. D’Aniello GE, Scarpina F, Mauro A, Mori I, Castelnuovo G, Bigoni M, et al. Особенности тревоги и психологического благополучия у хронических постинсультных больных. J Neurol Sci (2014) 338(1–2):191–6. doi: 10.1016/j.jns.2014.01.005
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
36. Wu C, Ren W, Cheng J, Zhu B, Jin Q, Wang L, et al. Связь между уровнями витамина D в сыворотке крови и риском постинсультной тревожности. Медицина (Балтимор) (2016) 95(18):e3566. doi: 10.1097/MD.0000000000003566
Wu C, Ren W, Cheng J, Zhu B, Jin Q, Wang L, et al. Связь между уровнями витамина D в сыворотке крови и риском постинсультной тревожности. Медицина (Балтимор) (2016) 95(18):e3566. doi: 10.1097/MD.0000000000003566
CrossRef Full Text | Google Scholar
37. Lincoln NB, Brinkmann N, Cunningham S, Dejaeger E, De Weerdt W, Jenni W, et al. Тревога и депрессия после инсульта: 5-летнее наблюдение. Disabil Rehabil (2013) 35(2):140–5. doi: 10.3109/09638288.2012.691939
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
38. Chun HY, Whiteley WN, Dennis MS, Mead GE, Carson AJ. Тревога после инсульта: важность подтипирования. Инсульт (2018) 49 (3): 556–64. doi: 10.1161/STROKEAHA.117.020078
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
39. Брумфилд Н.М., Скулар А., Уэлш П., Уолтерс М., Эванс Дж.Дж. Постинсультная тревожность широко распространена среди населения, особенно среди социально неблагополучных и молодых людей, перенесших инсульт. Int J Stroke (2015) 10(6):897–902. doi: 10.1111/ijs.12109
Int J Stroke (2015) 10(6):897–902. doi: 10.1111/ijs.12109
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
40. Шарп М., Хоутон К., Хаус А., Молинье А., Сандеркок П., Бэмфорд Дж. и др. Расстройства настроения у лиц, перенесших инсульт в течение длительного времени: ассоциации с локализацией и объемом поражения головного мозга. Psychol Med (1990) 20(4):815–28. doi: 10.1017/S0033291700036503
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
41. Jiao Q, Ding J, Lu G, Su L, Zhang Z, Wang Z и др. Повышенный дисбаланс активности лобно-подкорковых цепей у подростков с большой депрессией. PLoS One (2011) 6(9):e25159. doi: 10.1371/journal.pone.0025159
CrossRef Full Text | Google Scholar
42. Калхун Г.Г., Тай К.М. Разрешение нейронных цепей тревоги. Nat Neurosci (2015) 18(10):1394–404. doi: 10.1038/nn.4101
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
43.


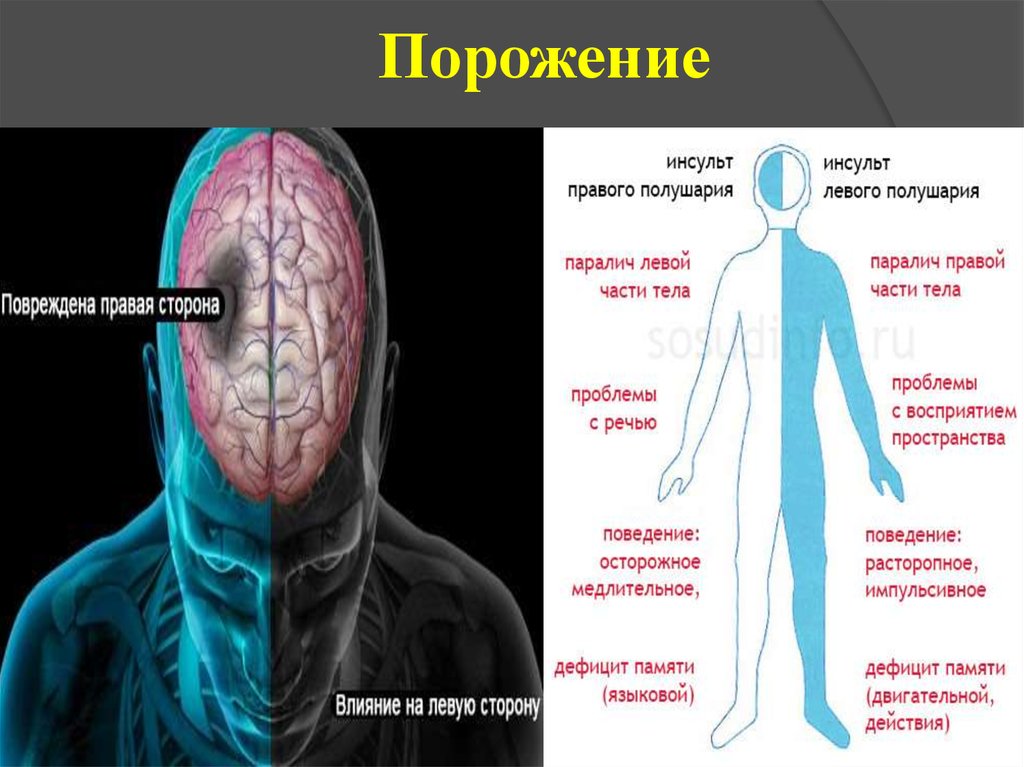 Можно увидеть весь спектр психических заболеваний. Наиболее распространенными являются: депрессия, тревога, эмоциональная несдержанность и катастрофические реакции.
Можно увидеть весь спектр психических заболеваний. Наиболее распространенными являются: депрессия, тревога, эмоциональная несдержанность и катастрофические реакции. Такой широкий диапазон распространенности обусловлен вариациями в трех областях.
Такой широкий диапазон распространенности обусловлен вариациями в трех областях. Тем не менее, Критерии большой депрессии DSM IV можно надежно использовать для диагностики большого ПСД.
Тем не менее, Критерии большой депрессии DSM IV можно надежно использовать для диагностики большого ПСД. За исключением раннего утреннего пробуждения, все нейровегетативные и психологические симптомы депрессии достоверно чаще встречались у больных с депрессивным настроением по сравнению с лицами без депрессивного настроения. Даже если принять во внимание частоту неспецифических симптомов среди недепрессивных пациентов, частота большой депрессии снизилась всего на 2% с 23 до 21 [9].0003
За исключением раннего утреннего пробуждения, все нейровегетативные и психологические симптомы депрессии достоверно чаще встречались у больных с депрессивным настроением по сравнению с лицами без депрессивного настроения. Даже если принять во внимание частоту неспецифических симптомов среди недепрессивных пациентов, частота большой депрессии снизилась всего на 2% с 23 до 21 [9].0003
 Не поддерживается MA
Не поддерживается MA  ЖИЗНЕННАЯ СИТУАЦИЯ и ЛИЧНОСТЬ СПОСОБСТВУЮТ ДЕПРЕССИИ.
ЖИЗНЕННАЯ СИТУАЦИЯ и ЛИЧНОСТЬ СПОСОБСТВУЮТ ДЕПРЕССИИ.  Нортриптилин (НТП) по сравнению с плацебо 4–6 недель. NTP efficacious
Нортриптилин (НТП) по сравнению с плацебо 4–6 недель. NTP efficacious Тяжесть побочных эффектов психотропных средств объясняет нежелание многих врачей назначать антидепрессанты.
Тяжесть побочных эффектов психотропных средств объясняет нежелание многих врачей назначать антидепрессанты. Currier и соавт. обнаружили, что у 19 из 20 пожилых ПСП «заметно или умеренно» улучшилось. Ни у одного из пациентов не было обострений инсульта или новых нейродефицитов.
Currier и соавт. обнаружили, что у 19 из 20 пожилых ПСП «заметно или умеренно» улучшилось. Ни у одного из пациентов не было обострений инсульта или новых нейродефицитов. 2003 ). Три причины:
2003 ). Три причины:
 Через три года после инсульта ГТР ассоциировался как с кортикальной, так и с подкорковой атрофией.
Через три года после инсульта ГТР ассоциировался как с кортикальной, так и с подкорковой атрофией. Эффект буспирона (частичный агонист серотонина) у этой популяции не изучался.
Эффект буспирона (частичный агонист серотонина) у этой популяции не изучался.
