Психология. Эмоции и чувства. Тест для самопроверки – пройти тест онлайн бесплатно
Авторам
8-800-333-85-44
Оформить заявку
Вход
- Справочник
- Онлайн-калькуляторы
- Тесты с ответами
Выполним любые типы работ
- Дипломные работы
- Курсовые работы
- Рефераты
- Контрольные работы
- Отчет по практике
- Эссе
Психология
Психология
Психология
Психология
Психология
Психология
Психология
Психология
Психология
Контрольная работа
от 1 дня /
от 100 руб
Курсовая работа
от 5 дней /
от 1800 руб
Дипломная работа
от 7 дней /
от 7950 руб
Реферат
от 1 дня /
от 700 руб
Онлайн-помощь
от 1 дня /
от 300 руб
Оставляй заявку — и мы пройдем все тесты за тебя!
Психология.
 Эмоции и чувства. Тест для самопроверки
Эмоции и чувства. Тест для самопроверки1. То, что эмоциональные переживания и соответствующие им органические изменения порождаются одновременно и их источником является гипоталамус, утверждает теория эмоций …
Джемса — Ланге
К.Изарда
П.В. Симонова
2. Основанием разделения эмоций на стенические и астенические является (ются)…
мобилизация ресурсов организма
потребности
сила и длительность проявлений
знак
3. Устойчивой склонностью человека воспринимать угрозу своему «Я» в разных ситуациях характеризуется такое его эмоциональное состояние, как …
настроение
стресс
тревога
гнев
4. Процесс передачи эмоционального состояния между индивидами без решающего смыслового влияния, называется …
внушением
идентификацией
заражением
подражанием
5. Более или менее длительное эмоциональное состояние, окрашивающее все поведение человека называется ….
собственной эмоцией
аффектом
настроением
чувством
6. Переживание собственной неспособности оказаться на высоте тех требований, которые человек предъявляет к самому себе, переживание не удовлетворенности собой – это…
горе
стыд
гнев
страх
7. Сильное, стойкое, длительное чувство, которое захватывает человека и владеет им, называется …
аффектом
страстью
настроением
чувством
8. В том, что стойкие переживания направляют наше поведение, поддерживают его, заставляют преодолевать встречающиеся на пути преграды, выражается … функция чувств.
экспрессивная (выразительная)
сигнальная
регуляторная
интерферирующая
9. Эмоциональные процессы и состояния в жизни организма выполняют функцию (и):
только приспособительную
только мобилизационную
только приспособительную и интегративную
приспособительную, мобилизационную и интегративную
10. Сильное эмоциональное состояние взрывного характера, влияющее на всю личность, характеризующееся бурным протеканием, изменением сознания и нарушением волевого контроля – это …
Сильное эмоциональное состояние взрывного характера, влияющее на всю личность, характеризующееся бурным протеканием, изменением сознания и нарушением волевого контроля – это …
аффект
страсть
фрустрация
стресс
11. Положительное эмоциональное переживание возникает, когда реальные результаты деятельности соответствуют ожидаемым, а отрицательные — когда не соответствуют, согласно теории…
П.К.Анохина
когнитивного консонанса
когнитивного диссонанса
Ч.Дарвина
12. Эмоции связаны с определенными физиологическими реакциями согласно …теории эмоций
информационной
периферической
кибернетической
когнитивной
13. Первопричинами возникновения эмоциональных состояний являются изменения физиологического характера, происходящие в организме согласно теории …
Джемса — Ланге
К.Изарда
П.К.Анохина
14. Эмоции, как оценка величины потребности и вероятности ее удовлетворения в данный момент рассматриваются в …
биологической концепции эмоций Ч. Дарвина
Дарвина
биологической теории эмоций П.К.Анохина
информационной теории эмоций П.В.Симонов
теории эмоций Джемса — Ланге
15. Чувства, связанные с познавательной деятельностью, называются … чувствами
моральными
интеллектуальными
эстетическими
практическими
16. Показателем аффекта является …
незначительное изменение сознании
нарушение контроля воли за своими действиями
сохранение самообладания
сохранение контроля воли за своими действиями
17. Постижение эмоциональных состояний другого человека в форме сопереживания и сочувствия называется …
идентификацией
эмпатией
симпатией
18. Чувства, связанные с переживанием прекрасного или уродливого в окружающем мире называются…
познавательные
эстетические
моральные
практические
Категория: Психология
Поделитесь знаниями!
Индикаторы — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 36199
Цели обучения
- Объяснить изменение цвета индикаторов.

- Определить кислотные константы диссоциации К a или К ai индикаторов.
Индикаторы – это вещества, растворы которых меняют цвет из-за изменения pH. Их называют кислотно-щелочными индикаторами. Обычно это слабые кислоты или основания, но их сопряженные основания или кислоты имеют разные цвета из-за различий в их спектрах поглощения. Знаете ли вы, что окраска цветков гортензии зависит от pH почвы, в которой они растут? 9-}\) доминирует цвет, тогда как цвет из-за \(\mathrm{\color{Blue} HIn}\) доминирует, если \(\ce{[H+]} < \dfrac{K_{\large\textrm{ai}} {10}\). Приведенное выше уравнение показывает, что изменение цвета является наиболее чувствительным, когда \(\ce{[H+]} = K_{\large\textrm{ai}}\) в числовом значении.
Определим p K ai = — log( K ai ), а значение p K ai также является значением pH, при котором цвет индикатора наиболее чувствителен к изменениям pH . 9-}] = [\ mathrm{\color{Blue} HIn}]\). Другими словами, когда pH такой же, как p K ai , количество кислотных и основных форм равно. Когда две формы имеют одинаковую концентрацию, изменение цвета наиболее заметно.
9-}] = [\ mathrm{\color{Blue} HIn}]\). Другими словами, когда pH такой же, как p K ai , количество кислотных и основных форм равно. Когда две формы имеют одинаковую концентрацию, изменение цвета наиболее заметно.
Цвета веществ делают мир прекрасным. Благодаря цветам и структурам цветы, растения, животные и минералы демонстрируют свои уникальные черты. Многие индикаторы извлекаются из растений. Например, сок краснокочанной капусты и пигменты чая показывают разные цвета при разном pH. Цвет чая темнеет в щелочном растворе, но становится светлее при добавлении лимонного сока. Сок краснокочанной капусты окрашивается в синий цвет в щелочном растворе, но в кислом растворе он имеет ярко выраженный красный цвет.
| Имя | Кислотный краситель | pH Диапазон изменения цвета | Основной цвет | ||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Метилвиолет | Желтый | 0,0 — 1,6 | Синий | ||||||||||||||||||||||||||||||||||||||||||||
| Тимоловый синий | Красный | 1,2 — 2,8 | Желтый | ||||||||||||||||||||||||||||||||||||||||||||
| Метиловый оранжевый | Красный | 3,2 — 4,4 | Желтый | ||||||||||||||||||||||||||||||||||||||||||||
| Бромкрезоловый зеленый | Желтый | 3,8 — 5,4 | Синий | ||||||||||||||||||||||||||||||||||||||||||||
| Метиловый красный | Красный | 4,8–6,0 | Желтый | ||||||||||||||||||||||||||||||||||||||||||||
| Лакмус | Красный | 5,0–8,0 | Синий | ||||||||||||||||||||||||||||||||||||||||||||
| Бромтимоловый синий | Желтый | 6,0 — 7,6 | Синий | ||||||||||||||||||||||||||||||||||||||||||||
| Тимоловый синий | Желтый | 8,0 — 9,6 | Синий | ||||||||||||||||||||||||||||||||||||||||||||
| Фенолфталеин | Бесцветный | 8,2 — 10,0 | Розовый | ||||||||||||||||||||||||||||||||||||||||||||
| Тимолфталеин | Бесцветный | 9,4 — 10,6 | Синий | ||||||||||||||||||||||||||||||||||||||||||||
| Ализарин желтый R | Желтый | 10,1 — 12,0 9{-6}\)) с 0,100 М \(\ce{NaOH}\) раствором.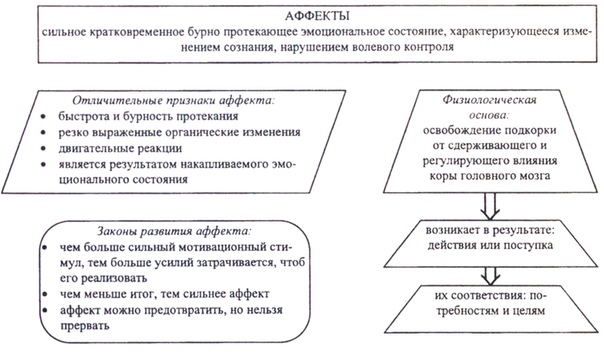 РастворСначала следует оценить рН в точке эквивалентности, при которой раствор составляет 0,0500 М \(\ce{NaA}\). Это проблема гидролиза, но следующий метод использует общий принцип равновесия. \[\begin{array}{ccccccc} Если мы умножим числитель и знаменатель на \(\ce{[H+]}\), переставим члены, заметим, что \(\ce{[H+][OH-]} = K_{\large\textrm w}\ ), и по определению 9{-6}\\ Фенолфталеин в таблице выше имеет p K ai значение 9,7, что является ближайшим значением рН к точке эквивалентности в данном титровании. Этот индикатор бесцветен в кислом растворе, но при pH > 8 появляется светло-розовый цвет. Цвет становится более ИНТЕНСИВНО-РОЗОВЫМ по мере повышения pH. Парад интенсивностей цвета показан ниже: Точка эквивалентности наступает, когда цвет изменяется наиболее быстро, а не когда раствор изменил цвет. Цвета индикаторного раствораИндикаторы постепенно меняют цвет при различных pH. Предположим, что кислая форма имеет синий цвет, а основная форма — красный цвет. Ниже показано изменение цвета при разных pH. Цвет фона влияет на их внешний вид и наше восприятие.
Длинный растянутый цвет в середине последней строки имеет одинаковую интенсивность СИНЕГО и КРАСНОГО. Вопросы
Решения
Авторы и авторствоИндикаторы распространяются под лицензией CC BY-NC-SA 4.0 и были созданы, изменены и/или курированы LibreTexts.
Кислотно-щелочные индикаторы: определение и примерыЗнаете ли вы, что если вы добавите листья краснокочанной капусты в блендер с горячей водой и смешаете до получения фиолетового сока капусты, вы на самом деле сделаете свой собственный кислотно-щелочной базовый индикатор ? Краснокочанная капуста содержит флавинов, молекулу антоциана, которая меняет цвет при смешивании с кислотой или основанием. Если добавить к нему кислоту, то капустный сок станет красным, а если добавить к нему основание, он изменит цвет с фиолетового на голубовато-зеленый! Довольно интересно, правда? А теперь давайте погрузимся в мир кислотно-щелочных индикаторов!
Определение кислотно-щелочного индикатораВо-первых, нам нужно определить, что такое кислотно-щелочной индикатор. Кислотно-щелочной индикатор представляет собой вещество, которое демонстрирует явное наблюдаемое изменение (обычно изменение цвета) при изменении pH водного раствора. Индикаторы представляют собой слабые кислоты или основания. Индикатор (HIn) частично диссоциирует в воде с образованием H + 9{-}_{(aq)}$$ Где,
Что довольно интересно в индикаторах, так это то, что цвет HIn (водн. В основном цвет индикатора зависит от относительных концентраций HIn и In —. Раствор будет иметь цвет более низкой формы pH, HIn, если большинство молекул индикатора существует в форме HIn. Точно так же раствор будет иметь цвет В — , если большинство молекул индикатора существует в форме В — .
Если вы еще не знакомы с кислотно-основным титрованием, прочитайте » Кислотно-щелочное титрование » сначала, а затем вернитесь к этому пункту, чтобы продолжить обучение! Индикаторы могут использоваться по-разному: они могут использоваться для обозначения конечной точки кислотно-щелочного титрования, а также для оценки pH раствора!Кислотно-основные индикаторы помогают химикам узнать, когда достигнута конечная точка титрования . Конечная точка называется точкой, в которой индикатор меняет цвет. Обычно он близок к pH точки эквивалентности. Давайте рассмотрим пример, включающий титрование слабой кислотой/сильным основанием . При титровании слабой кислоты/сильного основания мы знаем, что точка эквивалентности будет немного выше, чем pH 7. Таким образом, чтобы иметь возможность определить, когда точка эквивалентности будет достигнута, мы можем использовать индикатор, который меняет цвет вокруг этот диапазон рН. Фенолфталеин является индикатором, обычно используемым при титровании слабой кислоты/сильного основания, поскольку он меняет цвет при рН около 8,2.
Рассмотрим еще один индикатор. Meth yl red — индикатор, изменяющий цвет в диапазоне pH от 4,2 до 6,3. Метиловый красный является отличным индикатором при титровании слабого основания сильной кислотой, потому что pH титрования слабого основания/сильной кислоты в точке эквивалентности немного меньше 7, поэтому точка эквивалентности попадает в интервал pH! Возможно, вы уже слышали или даже использовали лакмусовую бумагу в своей химической лаборатории. Litmus представляет собой кислотно-щелочной индикатор, изготовленный из лишайника, обычно используемый для проверки наличия кислот и оснований. Синяя лакмусовая бумажка используется, чтобы показать присутствие кислоты. Чтобы определить приблизительный рН раствора, мы можем использовать универсальный индикатор , состоящий из смеси нескольких индикаторов. Например, если мы хотим определить pH отбеливателя, мы можем добавить пару капель универсального индикатора в образец отбеливателя и отметить изменение цвета. Затем мы могли бы сравнить изменение цвета со шкалой pH, чтобы найти приблизительное значение pH. Рис. 2: Шкала рН — StudySmarter Originals. Теории кислотно-основных индикаторовТеперь, когда мы знаем, что такое кислотно-щелочные индикаторы, давайте рассмотрим некоторые теории, связанные с ними! Есть две теории, с которыми вы должны быть знакомы: теория Оствальда и теория хиноноидов . Теория Оствальда была предложена в 1891 году и основана на теории кислот и оснований Аррениуса. Кислоты Аррениуса донат H + в H 2 O, повышающие концентрацию ионов водорода в водном растворе. Основания Аррениуса донатируют ОН — в Н 2 О, повышая концентрацию ионов гидроксида. Согласно теории Оствальда , кислотно-основным индикатором может быть либо слабая органическая кислота, либо слабое органическое основание. Изменение цвета индикатора происходит из-за частичной ионизации индикатора и различных цветов, которые имеют неионизированная форма и сопряженная основная (ионизированная) форма. Вторая теория, Хиноноидная теория , основан на представлении о том, что кислотно-основные индикаторы существуют в двух таутомерных формах (бензоидной и хиноноидной), и эти две формы имеют разные цвета. Один таутомер существует в кислой среде, а другой — в щелочной. Итак, изменение окраски происходит за счет превращения одного таутомера в другой при изменении рН раствора. Рис. 3: Структурные изменения фенолфталеина — оригиналы StudySmarter. Ограничения кислотно-основных индикаторовКак мы узнали выше, индикаторы имеют разные цвета в зависимости от их формы (HIn или In — ). Ограничением кислотно-основных индикаторов является их диапазон рН. Индикаторы меняют цвет только в определенном диапазоне pH, поэтому вам необходимо знать их диапазоны pH, чтобы иметь возможность выбрать подходящий индикатор для кислотно-щелочного титрования.
Таблица кислотно-основных индикаторов рН конечной точки. Помните, что цвет при более низком рН — это цвет слабой кислоты или основания, а цвет при более высоком рН — это цвет их сопряженной формы. Например, бромтимоловый синий имеет желтый цвет при более низком pH (HIn) и синий цвет при более высоком pH (In — ). Тем не менее, в конечном итоге цвет стал каким-то бирюзовым! Давайте решим несколько задач! Какой кислотно-основной индикатор вы бы выбрали для титрования сильной кислоты/сильного основания? При титровании сильных кислот/сильных оснований точка эквивалентности находится при pH 7. Следовательно, наиболее подходящим индикатором для этого типа титрования будет бромтимоловый синий . Если вы решили провести титрование слабой кислоты/сильного основания, что из следующего вы бы использовали в качестве индикатора? метиловый оранжевый, бромтимоловый синий или фенолфталеин? При титровании слабыми кислотами/сильными основаниями точка эквивалентности имеет pH больше 7. Поэтому нам нужно выбрать индикатор с диапазоном pH больше 7.
Из трех индикаторов наиболее подходящим для использования в слабокислотном/сильноосновном титровании является фенолфталеин , потому что весь его диапазон pH больше 7. Цвета кислотно-основных индикаторовКаждый индикатор имеет свой диапазон pH и разные цвета! Во-первых, давайте посмотрим на изображение ниже, на котором показаны цвета некоторых распространенных индикаторов. Мы можем использовать это изображение для решения некоторых задач! Давайте посмотрим на некоторые примеры! Какой цвет будет иметь фенолфталеин в растворе аммиака? Аммиак имеет рН около 11-12. Итак, глядя на изображение выше, мы знаем, что при этом конкретном pH фенолфталеин будет иметь фуксия розовый цвет! Какого цвета будет метиловый оранжевый в растворе с рН 2? Согласно изображению выше, при рН 2 метиловый оранжевый будет иметь красный цвет! Знаете ли вы, что цветы гортензии считаются природными индикаторами? Эти цветы имеют синий цвет при выращивании в кислых почвах и розово-красные в почвах с щелочным pH! Другие типы природных индикаторов включают красные и розовые розы, голубой ирис и даже некоторые фрукты и овощи, такие как клубника и свекла! Теперь я надеюсь, что вы чувствуете себя более уверенно при выборе кислотно-основных индикаторов! Кислотно-основные индикаторы – основные выводы
| |||||||||||||||||||||||||||||||||||||||||||||

 Неправильное использование индикаторов приведет к неточности результатов титрования.
Неправильное использование индикаторов приведет к неточности результатов титрования. Если раствор имеет цвет, соответствующий этому, pH будет таким же, как p K ai индикатора, при условии, что сопряженные формы индикатора имеют СИНИЙ и КРАСНЫЙ цвета.
Если раствор имеет цвет, соответствующий этому, pH будет таким же, как p K ai индикатора, при условии, что сопряженные формы индикатора имеют СИНИЙ и КРАСНЫЙ цвета.


 ) (т.е. более низкая форма pH) и сопряженное основание В — (водн.) (т.е. форма с более высоким рН) различаются на .
) (т.е. более низкая форма pH) и сопряженное основание В — (водн.) (т.е. форма с более высоким рН) различаются на .  В идеале индикатор должен изменить цвет в точке эквивалентности.Однако вблизи точки эквивалентности изменения pH происходят быстро, и дополнительная капля титранта может изменить рН на несколько единиц.
В идеале индикатор должен изменить цвет в точке эквивалентности.Однако вблизи точки эквивалентности изменения pH происходят быстро, и дополнительная капля титранта может изменить рН на несколько единиц.
 При наличии кислоты синяя лакмусовая бумажка становится красной! Точно так же красная лакмусовая бумажка становится синей в присутствии основания!
При наличии кислоты синяя лакмусовая бумажка становится красной! Точно так же красная лакмусовая бумажка становится синей в присутствии основания!



