Хроническая боль и центральная сенситизация при иммуновоспалительных ревматических заболеваниях: патогенез, клинические проявления, возможность применения таргетных базисных противовоспалительных препаратов | Каратеев
1. Насонов ЕЛ, редактор. Российские клинические рекомендации. Ревматология. Москва: ГЭОТАР-Медиа; 2017. 446 с. ISBN 978-5-9704-4261-6.
2. Лила АМ, Насонов ЕЛ, Коротаева ТВ. Псориатический артрит: патогенетические особенности и инновационные методы терапии. Научно-практическая ревматология. 2018;56(6):685-91. doi: 10.14412/1995-4484-2018-685-691
3. Lee YC. Effect and treatment of chronic pain in inflammatory arthritis. Curr Rheumatol Rep. 2013 Jan;15(1):300. doi: 10.1007/s11926-012-0300-4
4. Borenstein D, Altman R, Bello A, et al. American College of Rheumatology Pain Management Task Force. Report of the American College of Rheumatology Pain Management Task Force. Arthritis Care Res (Hoboken). 2010 May;62(5):590-9. doi: 10.1002/acr.20005
5. Eriksson JK, Johansson K, Askling J, Neovius M. Costs for hospital care, drugs and lost work days in incident and prevalent rheumatoid arthritis: how large, and how are they distributed? Ann Rheum Dis. 2015 Apr;74(4):648-54. doi: 10.1136/annrheumdis-2013-204080. Epub 2013 Dec 9.
Eriksson JK, Johansson K, Askling J, Neovius M. Costs for hospital care, drugs and lost work days in incident and prevalent rheumatoid arthritis: how large, and how are they distributed? Ann Rheum Dis. 2015 Apr;74(4):648-54. doi: 10.1136/annrheumdis-2013-204080. Epub 2013 Dec 9.
6. Huscher D, Mittendorf T, von Hinüber U, et al. Evolution of cost structures in rheumatoid arthritis over the past decade. Ann Rheum Dis. 2015 Apr;74(4):738-45. doi: 10.1136/annrheumdis-2013-204311. Epub 2014 Jan 9.
7. Jobski K, Luque Ramos A, Albrecht K, Hoffmann F. Pain, depressive symptoms and medication in German patients with rheumatoid arthritis – results from the linking patient-reported outcomes with claims data for health services research in rheumatology (PROCLAIR) study. Pharmacoepidemiol Drug Saf. 2017 Jul;26(7):766-74. doi: 10.1002/pds.4202. Epub 2017 Mar 26.
8. Salaffi F, Giacobazzi G, Di Carlo M. Chronic Pain in Inflammatory Arthritis: Mechanisms, Metrology, and Emerging Targets – A Focus on the JAK-STAT Pathway. Pain Res Manag. 2018 Feb 7;2018:8564215. doi: 10.1155/2018/8564215.eCollection 2018.
Pain Res Manag. 2018 Feb 7;2018:8564215. doi: 10.1155/2018/8564215.eCollection 2018.
9. Lee YC, Cui J, Lu B, et al. Pain persists in DAS28 rheumatoid arthritis remission but not in ACR/EULAR remission: a longitudinal observational study. Arthritis Res Ther. 2011 Jun 8;13(3):R83. doi: 10.1186/ar3353
10. Ishida M, Kuroiwa Y, Yoshida E, et al. Residual symptoms and disease burden among patients with rheumatoid arthritis in remission or low disease activity: a systematic literature review. Mod Rheumatol. 2018 Sep;28(5):789-99. doi: 10.1080/14397595.2017.1416940. Epub 2018 Jan 11.
11. Kilic G, Kilic E, Nas K, et al. Residual symptoms and disease burden among patients with psoriatic arthritis: is a new disease activity index required? Rheumatol Int. 2019 Jan;39(1):73-81. doi: 10.1007/s00296-018-4201-3. Epub 2018 Nov 13.
12. Van Mens LJJ, van de Sande MGH, van Kuijk MGH, et al. Ideal target for psoriatic arthritis? Comparison of remission and low disease activity states in a real-life cohort.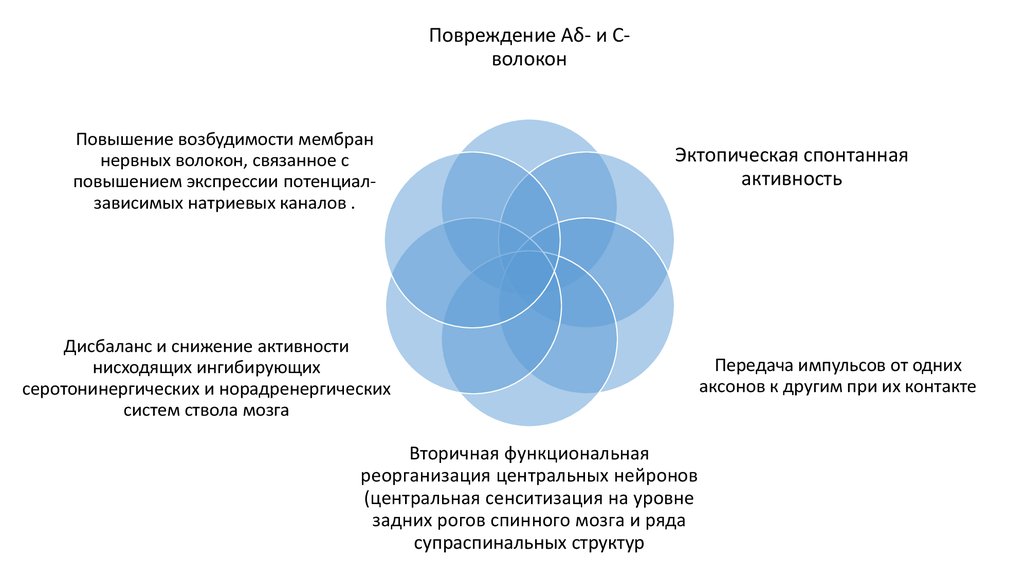 Ann Rheum Dis. 2017;77(2):251-7. doi: 10.1136/annrheumdis-2017-211998
Ann Rheum Dis. 2017;77(2):251-7. doi: 10.1136/annrheumdis-2017-211998
13. Kotas ME, Medzhitov R. Homeostasis, inflammation, and disease susceptibility. Cell. 2015 Feb 26;160(5):816-27. doi: 10.1016/j.cell.2015.02.010
14. Kato J, Svensson CI. Role of extracellular damage-associated molecular pattern molecules (DAMPs) as mediators of persistent pain. Prog Mol Biol Transl Sci. 2015;131:251-79. doi: 10.1016/bs.pmbts.2014.11.014. Epub 2015 Jan 30.
15. Zhang H, Li F, Li WW, et al. The inflammasome as a target for pain therapy. Br J Anaesth. 2016 Dec;117(6):693-707.
16. Smith-Edwards KM, DeBerry JJ, Saloman JL, et al. Profound alteration in cutaneous primary afferent activity produced by inflammatory mediators. Elife. 2016 Nov 2;5. pii: e20527. doi: 10.7554/eLife.20527
17. Lukacs M, Haanes KA, Majlath Z, et al. Dural administration of inflammatory soup or Complete Freund’s Adjuvant induces activation and inflammatory response in the rat trigeminal ganglion. J Headache Pain.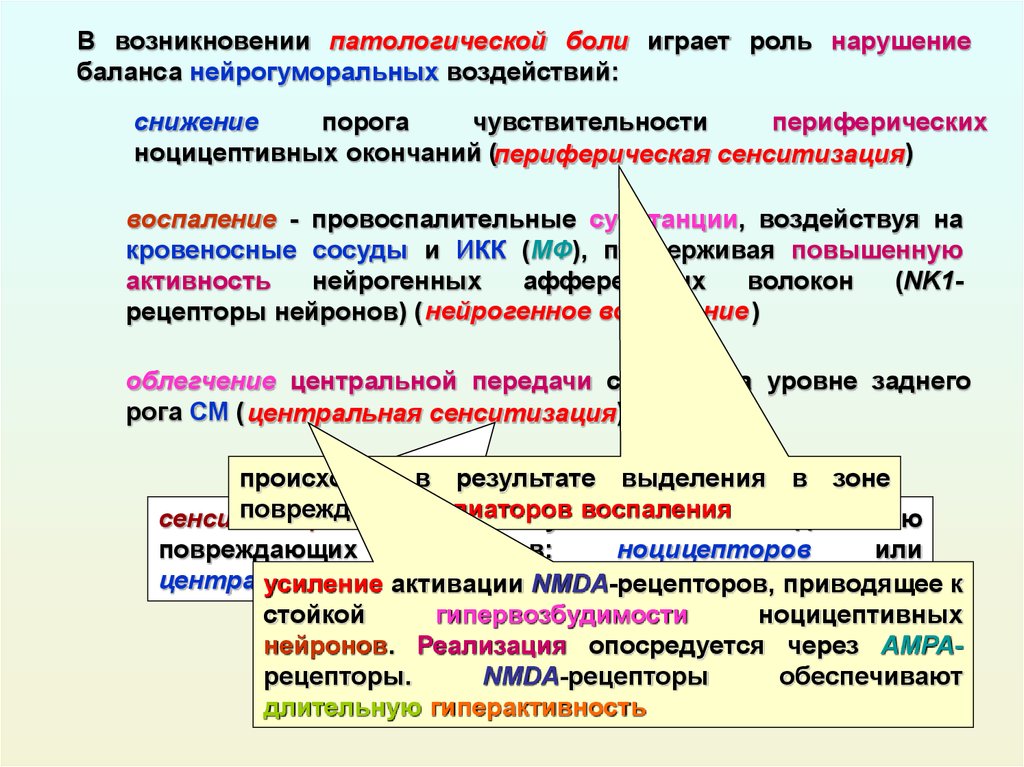 2015;16:564. doi: 10.1186/s10194-015-0564-y. Epub 2015 Sep 2.
2015;16:564. doi: 10.1186/s10194-015-0564-y. Epub 2015 Sep 2.
18. Zhang A, Lee YC. Mechanisms for Joint Pain in Rheumatoid Arthritis (RA): from Cytokines to Central Sensitization. Curr Osteoporos Rep. 2018 Oct;16(5):603-10. doi: 10.1007/s11914-018-0473-5
19. Schaible HG. Nociceptive neurons detect cytokines in arthritis. Arthritis Res Ther. 2014;16(5):470. doi: 10.1186/s13075-014-0470-8
20. Gouin O, L’Herondelle K, Lebonvallet N, et al. TRPV1 and TRPA1 in cutaneous neurogenic and chronic inflammation: proinflammatory response induced by their activation and their sensitization. Protein Cell. 2017 Sep;8(9):644-61. doi: 10.1007/s13238-017-0395-5. Epub 2017 Mar 31.
21. Habib AM, Wood JN, Cox JJ. Sodium channels and pain. Handb Exp Pharmacol. 2015;227:39-56. doi: 10.1007/978-3-662-46450-2_3
22. Lahoria R, Pittock SJ, Gadoth A, et al. Clinical-pathologic correlations in voltage-gated Kv1 potassium channel complex-subtyped autoimmune painful polyneuropathy. Muscle Nerve.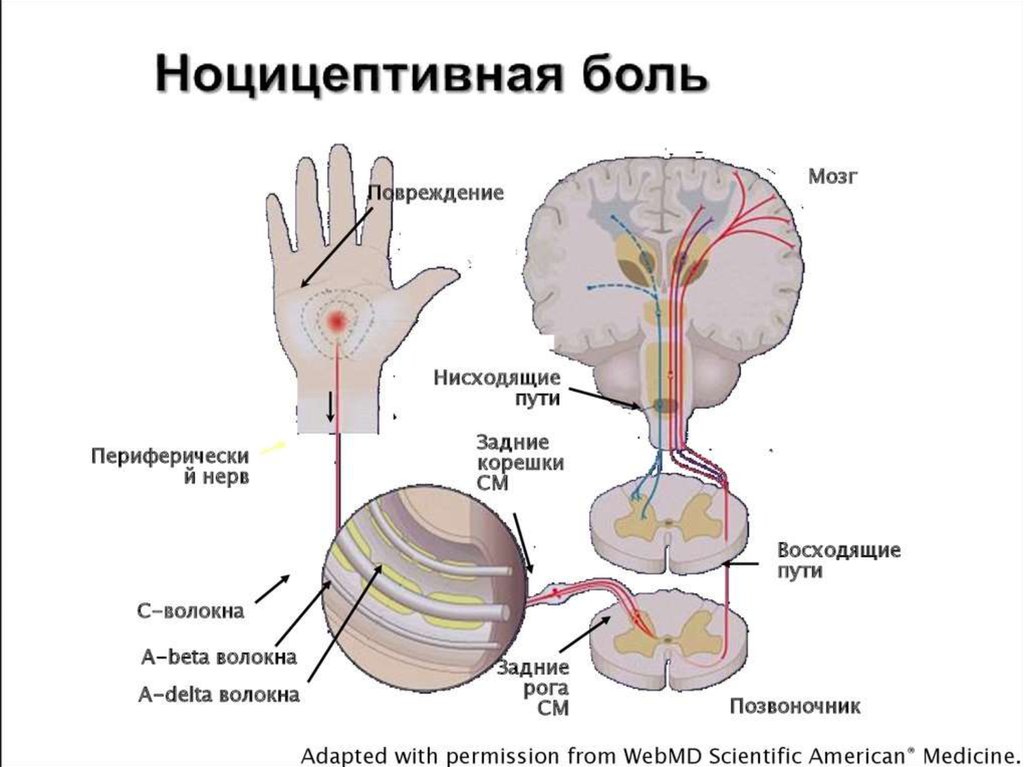 2017 Apr;55(4):520-5. doi: 10.1002/mus.25371. Epub 2017 Feb 13.
2017 Apr;55(4):520-5. doi: 10.1002/mus.25371. Epub 2017 Feb 13.
23. Sekiguchi F, Tsubota M, Kawabata A. Involvement of VoltageGated Calcium Channels in Inflammation and Inflammatory Pain. Biol Pharm Bull. 2018;41(8):1127-34. doi: 10.1248/bpb.b18-00054
24. Hong L, Pathak MM, Kim IH, et al. Voltage-sensing domain of voltage-gated proton channel Hv1 shares mechanism of block with pore domains. Neuron. 2013 Jan 23;77(2):274-87. doi: 10.1016/j.neuron.2012.11.013
25. Deval E, Gasull X, Noёl J, et al. Acid-sensing ion channels (ASICs): pharmacology and implication in pain. Pharmacol Ther. 2010 Dec;128(3):549-58. doi: 10.1016/j.pharmthera.2010.08.006. Epub 2010 Aug 31.
26. Gong N, Park J, Luo ZD. Injury-induced maladaptation and dysregulation of calcium channel α2 δsubunit proteins and its contribution to neuropathic pain development. Br J Pharmacol. 2018 Jun;175(12):2231-43. doi: 10.1111/bph.13930. Epub 2017 Aug 1.
27. Palhares MR, Silva JF, Rezende MJS, et al. Synergistic antinociceptive effect of a calcium channel blocker and a TRPV1 blocker in an acute pain model in mice.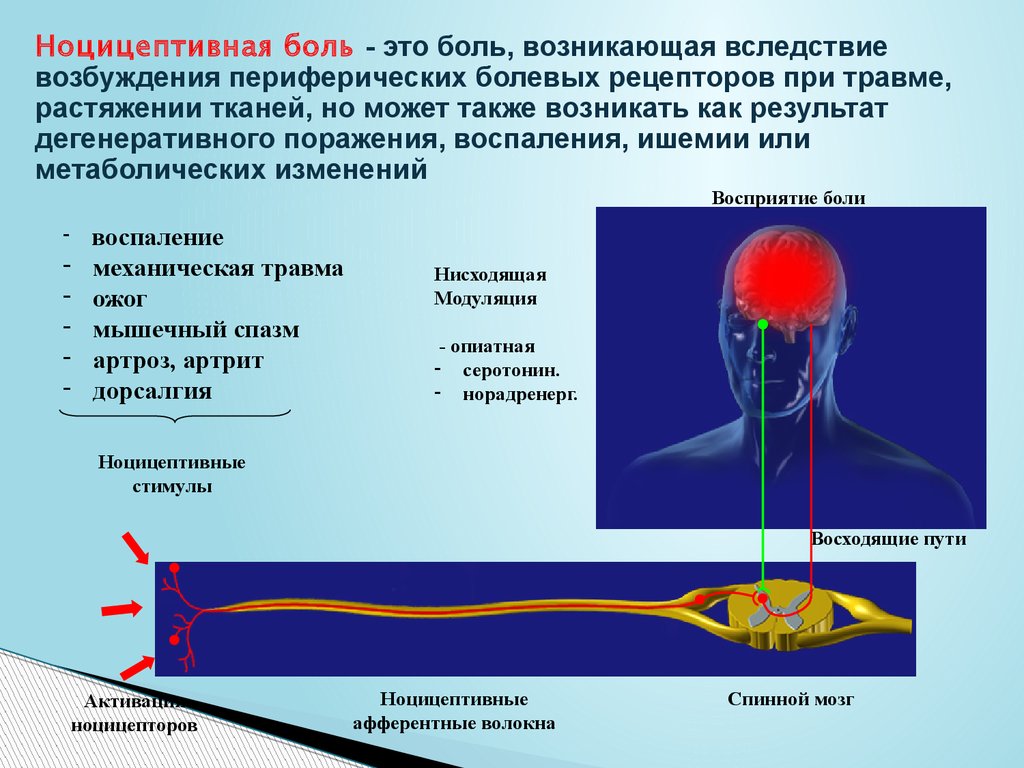 Life Sci. 2017 Aug 1;182:122-8. doi: 10.1016/j.lfs.2017.06.018. Epub 2017 Jun 16.
Life Sci. 2017 Aug 1;182:122-8. doi: 10.1016/j.lfs.2017.06.018. Epub 2017 Jun 16.
28. Richter F, Natura G, Loeser S, et al. Tumor necrosis factor (TNF) causes persistent sensitization of joint nociceptors for mechanical stimuli. Arthritis Rheum. 2010;62:3806-14. doi: 10.1002/art.27715
29. Watkins LR, Wiertelak EP, Goehler LE, et al. Characterization of cytokine-induced hyperalgesia. Brain Res. 1994;654:15-26. doi: 10.1016/0006-8993(94)91566-0
30. Ebbinghaus M, Uhlig B, Richter F, et al. The role of interleukin-1βin arthritic pain: main involvement in thermal but not in mechanical hyperalgesia in rat antigen-induced arthritis. Arthritis Rheum. 2012;64:3897-907. doi: 10.1002/art.34675
31. Richter F, Natura G, Ebbinghaus M, et al. Interleukin-17 sensitizes joint nociceptors for mechanical stimuli and contributes to arthritic pain through neuronal IL-17 receptors in rodents. Arthritis Rheum. 2012;64:4125-34. doi: 10.1002/art.37695
32. Arendt-Nielsen L, Morlion B, Perrot S, et al. Assessment and manifestation of central sensitisation across different chronic pain conditions. Eur J Pain. 2018 Feb;22(2):216-41. doi: 10.1002/ejp.1140. Epub 2017 Nov 5.
Assessment and manifestation of central sensitisation across different chronic pain conditions. Eur J Pain. 2018 Feb;22(2):216-41. doi: 10.1002/ejp.1140. Epub 2017 Nov 5.
33. Chen G, Zhang YQ, Qadri YJ, et al. Microglia in Pain: Detrimental and Protective Roles in Pathogenesis and Resolution of Pain. Neuron. 2018 Dec 19;100(6):1292-311. doi: 10.1016/j.neuron.2018.11.009
34. Bianchi M, Martucci C, Ferrario P, et al. Increased Tumor Necrosis Factor- and Prostaglandin E2 Concentrations in the Cerebrospinal Fluid of Rats with Inflammatory Hyperalgesia: The Effects of Analgesic Drugs. Anest Analg. 2007;104:949-54. doi: 10.1213/01.ane.0000258060.89380.27
35. McCrory C, Fitzgerald D. Spinal prostaglandin formation and pain perception following thoracotomy: a role for cyclooxygenase-2. Chest. 2004 Apr;125(4):1321-7. doi: 10.1378/chest.125.4.1321
36. Zhang JC, Yao W, Dong C, et al. Blockade of interleukin-6 receptor in the periphery promotes rapid and sustained antidepressant actions: a possible role of gut-microbiota-brain axis. Transl Psychiatry. 2017 May 30;7(5):e1138. doi: 10.1038/tp.2017.112
Transl Psychiatry. 2017 May 30;7(5):e1138. doi: 10.1038/tp.2017.112
37. Wakabayashi H, Kato S, Nagao N, et al. Interleukin-6 Inhibitor Suppresses Hyperalgesia Without Improvement in Osteoporosis in a Mouse Pain Model of Osteoporosis.Calcif Tissue Int. 2019 Jan 21. doi: 10.1007/s00223-019-00521-4 [Epub ahead of print].
38. Vazquez E, Kahlenbach J, Segond von Banchet G, et al. Spinal interleukin-6 is an amplifier of arthritic pain in the rat. Arthritis Rheum. 2012 Jul;64(7):2233-42. doi: 10.1002/art.34384
39. Kawasaki Y, Zhang L, Cheng JK, Ji RR. Cytokine mechanisms of central sensitization: distinct and overlapping role of interleukin-1beta, interleukin-6, and tumor necrosis factor-alpha in regulating synaptic and neuronal activity in the superficial spinal cord. J Neurosci. 2008 May 14;28(20):5189-94. doi: 10.1523/JNEUROSCI.3338-07.2008
40. Abbott NJ. Astrocyte-endothelial interactions and blood-brain barrier permeability. J Anat. 2002 Jun;200(6):629-38. doi: 10.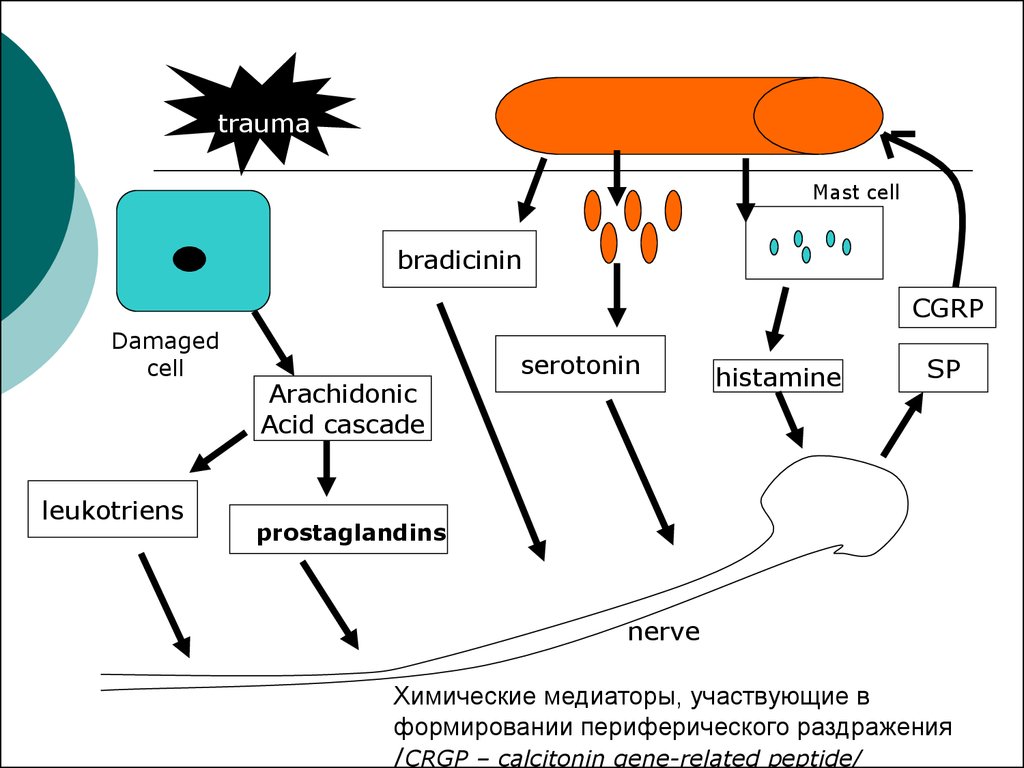 1046/j.1469-7580.2002.00064.x
1046/j.1469-7580.2002.00064.x
41. Eskilsson A, Mirrasekhian E, Dufour S. Immune-induced fever is mediated by IL-6 receptors on brain endothelial cells coupled to STAT3-dependent induction of brain endothelial prostaglandin synthesis. J Neurosci. 2014 Nov 26;34(48):15957-61. doi: 10.1523/JNEUROSCI.3520-14.2014
42. König C, Morch E, Eitner A. Involvement of Spinal IL-6 TransSignaling in the Induction of Hyperexcitability of Deep Dorsal Horn Neurons by Spinal Tumor Necrosis Factor-Alpha. J Neurosci. 2016 Sep 21;36(38):9782-91. doi: 10.1523/JNEUROSCI.4159-15.2016
43. Wilhelms DB, Kirilov M, Mirrasekhian E. Deletion of prostaglandin E2 synthesizing enzymes in brain endothelial cells attenuates inflammatory fever. J Neurosci. 2014 Aug 27;34(35):11684-90. doi: 10.1523/JNEUROSCI.1838-14.2014
44. Garbuzova-Davis S, Ehrhart J, Sanberg PR, Borlongan CV. Potential Role of Humoral IL-6 Cytokine in Mediating ProInflammatory Endothelial Cell Response in Amyotrophic Lateral Sclerosis. Int J Mol Sci. 2018 Jan 31;19(2). pii: E423. doi: 10.3390/ijms19020423
Int J Mol Sci. 2018 Jan 31;19(2). pii: E423. doi: 10.3390/ijms19020423
45. Rochfort KD, Cummins PM. The blood-brain barrier endothelium: a target for pro-inflammatory cytokines. Biochem Soc Trans. 2015 Aug;43(4):702-6. doi: 10.1042/BST20140319. Epub 2015 Aug 3.
46. George MD, Giles JT, Katz PP, et al. Impact of Obesity and Adiposity on Inflammatory Markers in Patients With Rheumatoid Arthritis. Arthritis Care Res (Hoboken). 2017 Dec;69(12):1789-98. doi: 10.1002/acr.23229. Epub 2017 Nov 6.
47. Dar L, Tiosano S, Watad A, et al. Are obesity and rheumatoid arthritis interrelated? Int J Clin Pract. 2018 Jan;72(1). doi: 10.1111/ijcp.13045. Epub 2017 Dec 12.
48. Mullen M, Gonzalez-Perez RR. Leptin-Induced JAK/STAT Signaling and Cancer Growth. Vaccines (Basel). 2016 Jul 26;4(3). pii: E26. doi: 10.3390/vaccines4030026
49. Abella V, Scotece M, Conde J, et al. Leptin in the interplay of inflammation, metabolism and immune system disorders. Nat Rev Rheumatol. 2017 Feb;13(2):100-9. doi: 10.1038/nrrheum.2016.209. Epub 2017 Jan 5.
doi: 10.1038/nrrheum.2016.209. Epub 2017 Jan 5.
50. Chang KT, Lin YL, Lin CT, et al. Leptin is essential for microglial activation and neuropathic pain after preganglionic cervical root avulsion. Life Sci. 2017 Oct 15;187:31-41. doi: 10.1016/j.lfs.2017.08.016. Epub 2017 Aug 16.
51. Fatel ECS, Rosa FT, Simao ANC, Dichi I. Adipokines in rheumatoid arthritis. Adv Rheumatol. 2018 Aug 15;58(1):25. doi: 10.1186/s42358-018-0026-8
52. Hozumi J, Sumitani M, Nishizawa D, et al. Resistin Is a Novel Marker for Postoperative Pain Intensity. Anesth Analg. 2018 Apr 11. doi: 10.1213/ANE.0000000000003363 [Epub ahead of print].
53. Bas S, Finckh A, Puskas GJ, et al. Adipokines correlate with pain in lower limb osteoarthritis: different associations in hip and knee. Int Orthop. 2014 Dec;38(12):2577-83. doi: 10.1007/s00264-014-2416-9. Epub 2014 Jul 9.
54. Da Cruz Fernandes IM, Pinto RZ, Ferreira P, Lira FS. Low back pain, obesity, and inflammatory markers: exercise as potential treatment. J Exerc Rehabil. 2018 Apr 26;14(2):168-74. doi: 10.12965/jer.1836070.035. eCollection 2018 Apr.
J Exerc Rehabil. 2018 Apr 26;14(2):168-74. doi: 10.12965/jer.1836070.035. eCollection 2018 Apr.
55. Gonzalez FJ, Xie C, Jiang C. The role of hypoxia-inducible factors in metabolic diseases. Nat Rev Endocrinol. 2018 Dec;15(1):21-32. doi: 10.1038/s41574-018-0096-z
56. Agarwal V, Singh R, Wiclaf, et al. A clinical, electrophysiological, and pathological study of neuropathy in rheumatoid arthritis. Clin Rheumatol. 2008 Jul;27(7):841-4. doi: 10.1007/s10067-007-0804-x. Epub 2007 Dec 15.
57. Karaca Umay E, Gurcay E, Karsli PB, Cakci A. Sensory disturbance and polyneuropathy in rheumatoid arthritis patients with foot deformity. Rev Bras Reumatol Engl Ed. 2016 MayJun;56(3):191-7. doi: 10.1016/j.rbre.2015.08.010. Epub 2015 Sep 8.
58. Sim MK, Kim DY, Yoon J, et al. Assessment of peripheral neuropathy in patients with rheumatoid arthritis who complain of neurologic symptoms. Ann Rehabil Med. 2014 Apr;38(2):249-55. doi: 10.5535/arm.2014.38.2.249. Epub 2014 Apr 29.
59. Филатова ЕС, Эрдес ШФ. Полиневропатия при ревматоидном артрите: значение в патогенезе болевого синдрома. Русский медицинский журнал. 2017;(7):470-3.
Полиневропатия при ревматоидном артрите: значение в патогенезе болевого синдрома. Русский медицинский журнал. 2017;(7):470-3.
60. Narayanaswami P, Chapman KM, Yang ML, Rutkove SB. Psoriatic arthritis-associated polyneuropathy: a report of three cases. J Clin Neuromuscul Dis. 2007 Sep;9(1):248-51. doi: 10.1097/CND.0b013e31814839d6
61. Vladimirova N, Jespersen A, Bartels EM, et al. Pain Sensitisation in Women with Active Rheumatoid Arthritis: A Comparative Cross-Sectional Study. Arthritis. 2015;2015:434109. doi: 10.1155/2015/434109. Epub 2015 Jul 21.
62. Wang D, Couture R, Hong Y. Activated microglia in the spinal cord underlies diabetic neuropathic pain. Eur J Pharmacol. 2014 Apr 5;728:59-66. doi: 10.1016/j.ejphar.2014.01.057. Epub 2014 Feb 6.
63. Greig M, Tesfaye S, Selvarajah D, Wilkinson ID. Insights into the pathogenesis and treatment of painful diabetic neuropathy. Handb Clin Neurol. 2014;126:559-78. doi: 10.1016/B978-0-444-53480-4.00037-0
64. Harth M, Nielson WR. Pain and affective distress in arthritis: relationship to immunity and inflammation. Expert Rev Clin Immunol. 2019 Jan 23. doi: 10.1080/1744666X.2019.1573675 [Epub ahead of print].
Pain and affective distress in arthritis: relationship to immunity and inflammation. Expert Rev Clin Immunol. 2019 Jan 23. doi: 10.1080/1744666X.2019.1573675 [Epub ahead of print].
65. Luque Ramos A, Redeker I, Hoffmann F, et al. Comorbidities in Patients with Rheumatoid Arthritis and Their Association with Patient-reported Outcomes: Results of Claims Data Linked to Questionnaire Survey. J Rheumatol. 2019 Jan 15. pii: jrheum.180668. doi: 10.3899/jrheum.180668 [Epub ahead of print].
66. Husni ME. Comorbidities in Psoriatic Arthritis. Rheum Dis Clin North Am. 2015 Nov;41(4):677-98. doi: 10.1016/j.rdc.2015.07.008. Epub 2015 Sep 5.
67. Лисицына ТА, Вельтищев ДЮ. Психические расстройства у больных ревматическими заболеваниями: диагностика и лечение. Научно-практическая ревматология. 2015;53(5):512-21. doi: 10.14412/1995-4484-2015-512-521
68. Liberman AC, Trias E, da Silva Chagas L, et al. Neuroimmune and Inflammatory Signals in Complex Disorders of the Central Nervous System. Neuroimmunomodulation. 2018 Dec 5:1-25. doi: 10.1159/000494761 [Epub ahead of print].
Neuroimmunomodulation. 2018 Dec 5:1-25. doi: 10.1159/000494761 [Epub ahead of print].
69. Kohler O, Krogh J, Mors O, Benros ME. Inflammation in Depression and the Potential for Anti-Inflammatory Treatment. Curr Neuropharmacol. 2016;14(7):732-42. doi: 10.2174/1570159X14666151208113700
70. Maes M, Anderson G, Kubera M, Berk M. Targeting classical IL-6 signalling or IL-6 trans-signalling in depression? Expert Opin Ther Targets. 2014 May;18(5):495-512. doi: 10.1517/14728222.2014.888417. Epub 2014 Feb 19.
71. Valkanova V, Ebmeier KP, Allan CL. CRP, IL-6 and depression: a systematic review and meta-analysis of longitudinal studies. J Affect Disord. 2013 Sep 25;150(3):736-44. doi: 10.1016/j.jad.2013.06.004. Epub 2013 Jul 17.
72. Howren MB, Lamkin DM, Suls J. Associations of depression with C-reactive protein, IL-1, and IL-6: a meta-analysis. Psychosom Med. 2009 Feb;71(2):171-86. doi: 10.1097/PSY.0b013e3181907c1b. Epub 2009 Feb 2.
73. Steyaert A, Lavand’homme P Prevention and Treatment of Chronic Postsurgical Pain: A Narrative Review. Drugs. 2018 Mar;78(3):339-54. doi: 10.1007/s40265-018-0866-x
Drugs. 2018 Mar;78(3):339-54. doi: 10.1007/s40265-018-0866-x
74. Gan TJ. Poorly controlled postoperative pain: prevalence, consequences, and prevention. J Pain Res. 2017 Sep 25;10:2287-98. doi: 10.2147/JPR.S144066. eCollection 2017.
75. Clark J, Nijs J, Yeowell G, Goodwin PC. What Are the Predictors of Altered Central Pain Modulation in Chronic Musculoskeletal Pain Populations? A Systematic Review. Pain Physician. 2017 Sep;20(6):487-500.
76. Martins Rocha T, Pimenta S, Bernardo A, et al. Determinants of non-nociceptive pain in Rheumatoid Arthritis. Acta Reumatol Port. 2018 Oct-Dec;43(4):291-303.
77. Rifbjerg-Madsen S, Christensen AW, Christensen R, et al. Pain and pain mechanisms in patients with inflammatory arthritis: A Danish nationwide cross-sectional DANBIO registry survey. PLoS One. 2017 Jul 7;12(7):e0180014. doi: 10.1371/journal.pone.0180014. eCollection 2017.
78. Lee YC, Bingham CO 3rd, Edwards RR, et al. Association Between Pain Sensitization and Disease Activity in Patients With Rheumatoid Arthritis: A Cross-Sectional Study. Arthritis Care Res (Hoboken). 2018 Feb;70(2):197-204. doi: 10.1002/acr.23266
Arthritis Care Res (Hoboken). 2018 Feb;70(2):197-204. doi: 10.1002/acr.23266
79. Andersson ML, Svensson B, Bergman S. Chronic widespread pain in patients with rheumatoid arthritis and the relation between pain and disease activity measures over the first 5 years. J Rheumatol. 2013 Dec;40(12):1977-85. doi: 10.3899/jrheum.130493. Epub 2013 Nov 1.
80. Bilberg A, Bremell T, Bjersing J, Mannerkorpi K. High prevalence of widespread pain in women with early rheumatoid arthritis. Scand J Rheumatol. 2018 Nov;47(6):447-54. doi: 10.1080/03009742.2018.1447683. Epub 2018 Jul 5.
81. Kapoor SR, Hider SL, Brownfield A. Fibromyalgia in patients with rheumatoid arthritis: driven by depression or joint damage? Clin Exp Rheumatol. 2011 Nov-Dec;29(6 Suppl 69):S88-91. Epub 2012 Jan 3.
82. Clauw DJ. Fibromyalgia: a clinical review. JAMA. 2014 Apr 16;311(15):1547-55. doi: 10.1001/jama.2014.3266
83. Dougados M, Perrot S. Fibromyalgia and central sensitization in chronic inflammatory joint diseases. Joint Bone Spine. 2017 Oct;84(5):511-3. doi: 10.1016/j.jbspin.2017.03.001. Epub 2017 Mar 12.
Joint Bone Spine. 2017 Oct;84(5):511-3. doi: 10.1016/j.jbspin.2017.03.001. Epub 2017 Mar 12.
84. Macfarlane GJ, Kronisch C, Dean LE, et al. EULAR revised recommendations for the management of fibromyalgia. Ann Rheum Dis. 2017 Feb;76(2):318-28. doi: 10.1136/annrheumdis-2016-209724. Epub 2016 Jul 4.
85. Provan SA, Austad C, Halsaa V, et al. Fibromyalgia in patients with rheumatoid arthritis. A 10-year follow-up study, results from the Oslo Rheumatoid Arthritis Register. Clin Exp Rheumatol. 2019 Jan 8 [Epub ahead of print].
86. Shah K, Paris M, Mellars L, et al. Real-world burden of comorbidities in US patients with psoriatic arthritis. RMD Open.2017 Dec 28;3(2):e000588. doi: 10.1136/rmdopen-2017-000588. eCollection 2017.
87. Marchesoni A, De Marco G, Merashli M, et al. The problem in differentiation between psoriatic-related polyenthesitis and fibromyalgia. Rheumatology (Oxford).2018 Jan 1;57(1):32-40. doi: 10.1093/rheumatology/kex079
88. Lee YC, Lu B, Boire G, et al. Incidence and predictors of secondary fibromyalgia in an early arthritis cohort. Ann Rheum Dis. 2013 Jun;72(6):949-54. doi: 10.1136/annrheumdis-2012-201506. Epub 2012 Jul 11.
Incidence and predictors of secondary fibromyalgia in an early arthritis cohort. Ann Rheum Dis. 2013 Jun;72(6):949-54. doi: 10.1136/annrheumdis-2012-201506. Epub 2012 Jul 11.
89. Salaffi F, Gerardi MC, Atzeni F, et al. The influence of fibromyalgia on achieving remission in patients with long-standing rheumatoid arthritis. Rheumatol Int. 2017 Dec;37(12):2035-42. doi: 10.1007/s00296-017-3792-4. Epub 2017 Sep 5.
90. Lage-Hansen PR, Chrysidis S, Lage-Hansen M, et al. Concomitant fibromyalgia in rheumatoid arthritis is associated with the more frequent use of biological therapy: a cross-sectional study. Scand J Rheumatol. 2016 Jan;45(1):45-8. doi: 10.3109/03009742.2015.1046484. Epub 2015 Jul 16.
91. Silverman S, Dukes EM, Johnston SS, et al. The economic burden of fibromyalgia: comparative analysis with rheumatoid arthritis. Curr Med Res Opin. 2009 Apr;25(4):829-40. doi: 10.1185/03007990902728456
92. Fuggle NR, Howe FA, Allen RL, et al. New insights into the impact of neuro-inflammation in rheumatoid arthritis.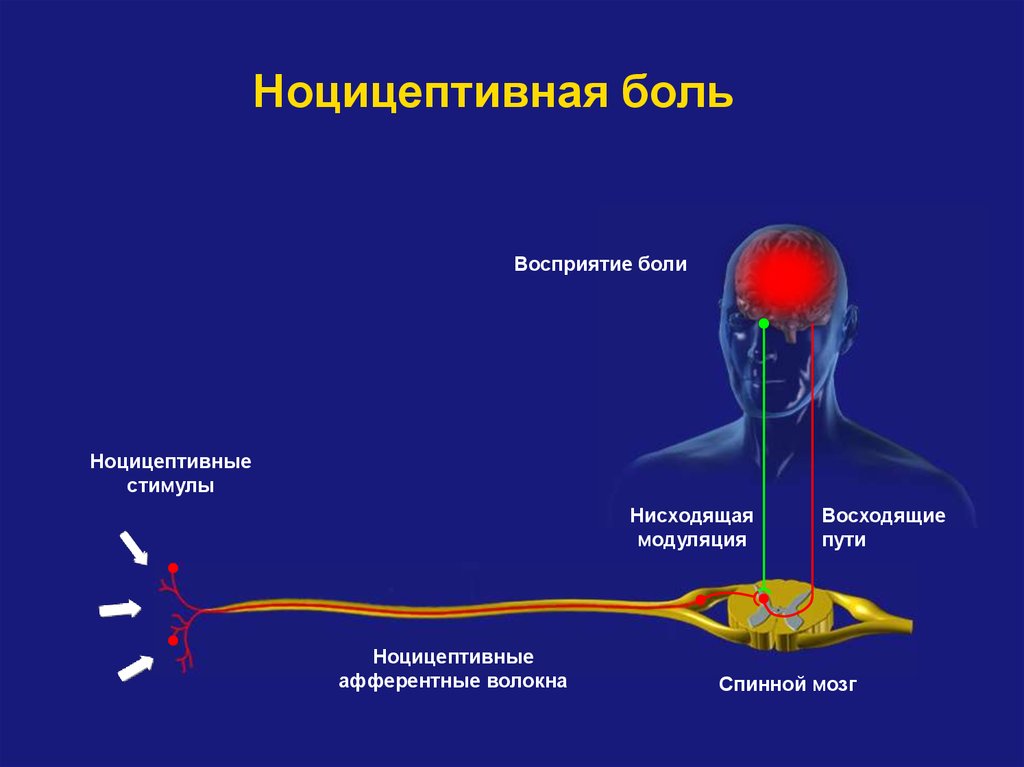 Front Neurosci. 2014 Nov 6;8:357. doi: 10.3389/fnins.2014.00357. eCollection 2014.
Front Neurosci. 2014 Nov 6;8:357. doi: 10.3389/fnins.2014.00357. eCollection 2014.
93. Jones AK, Huneke NT, Lloyd DM, et al. Role of functional brain imaging in understanding rheumatic pain. Curr Rheumatol Rep. 2012 Dec;14(6):557-67. doi: 10.1007/s11926-012-0287-x
94. Burgmer M, Pogatzki-Zahn E, Gaubitz M, et al. Fibromyalgia unique temporal brain activation during experimental pain: a controlled fMRI Study. J Neural Transm (Vienna). 2010 Jan;117(1):123-31. doi: 10.1007/s00702-009-0339-1. Epub 2009 Nov 25.
95. Eisenberger NI, Inagaki TK, Rameson LT, et al. An fMRI study of cytokine-induced depressed mood and social pain: the role of sex differences. Neuroimage. 2009 Sep;47(3):881-90. doi: 10.1016/j.neuroimage.2009.04.040. Epub 2009 Apr 17.
96. Schrepf A, Kaplan CM, Ichesco E, et al. A multi-modal MRI study of the central response to inflammation in rheumatoid arthritis. Nat Commun. 2018 Jun 8;9(1):2243. doi: 10.1038/s41467-018-04648-0
97. Wartolowska K, Hough MG, Jenkinson M, et al. Structural changes of the brain in rheumatoid arthritis. Arthritis Rheum. 2012 Feb;64(2):371-9. doi: 10.1002/art.33326
Structural changes of the brain in rheumatoid arthritis. Arthritis Rheum. 2012 Feb;64(2):371-9. doi: 10.1002/art.33326
98. Насонов ЕЛ. Прогресс ревматологии в начале XXI века. Современная ревматология. 2014;8(3):4-8. doi: 10.14412/1996-7012-2014-3-4-8
99. Насонов ЕЛ, редактор. Генно-инженерные биологические препараты в лечении ревматоидного артрита. Москва: ИМА-ПРЕСС; 2013. 549 с.
100. Her M, Kavanaugh A. Patient-reported outcomes in rheumatoid arthritis. Curr Opin Rheumatol. 2012 May;24(3):327-34. doi: 10.1097/BOR.0b013e3283521c64
101. Rendas-Baum R, Bayliss M, Kosinski M, et al. Measuring the effect of therapy in rheumatoid arthritis clinical trials from the patient’s perspective.Curr Med Res Opin. 2014 Jul;30(7):1391-403. doi: 10.1185/03007995.2014.896328. Epub 2014 Apr 9.
102. Jansen JP, Buckley F, Dejonckheere F, Ogale S. Comparative efficacy of biologics as monotherapy and in combination with methotrexate on patient reported outcomes (PROs) in rheuma-toid arthritis patients with an inadequate response to conventional DMARDs – a systematic review and network meta-analysis. Health Qual Life Outcomes. 2014 Jul 3;12:102. doi: 10.1186/1477-7525-12-102
Health Qual Life Outcomes. 2014 Jul 3;12:102. doi: 10.1186/1477-7525-12-102
103. Srirangan S, Choy EH. The role of interleukin 6 in the pathophysiology of rheumatoid arthritis. Ther Adv Musculoskelet Dis. 2010 Oct;2(5):247-56. doi: 10.1177/1759720X10378372
104. Smolen JS, Aletaha D. Interleukin-6 receptor inhibition with tocilizumab and attainment of disease remission in rheumatoid arthritis: the role of acute-phase reactants. Arthritis Rheum. 2011 Jan;63(1):43-52. doi: 10.1002/art.27740
105. Teitsma XM, Marijnissen AK, Bijlsma JW, et al. Tocilizumab as monotherapy or combination therapy for treating active rheumatoid arthritis: a meta-analysis of efficacy and safety reported in randomized controlled trials. Arthritis Res Ther. 2016 Sep 22;18(1):211. doi: 10.1186/s13075-016-1108-9
106. Navarro G, Taroumian S, Barroso N, et al. Tocilizumab in rheumatoid arthritis: a meta-analysis of efficacy and selected clinical conundrums. Semin Arthritis Rheum. 2014 Feb;43(4):458-69.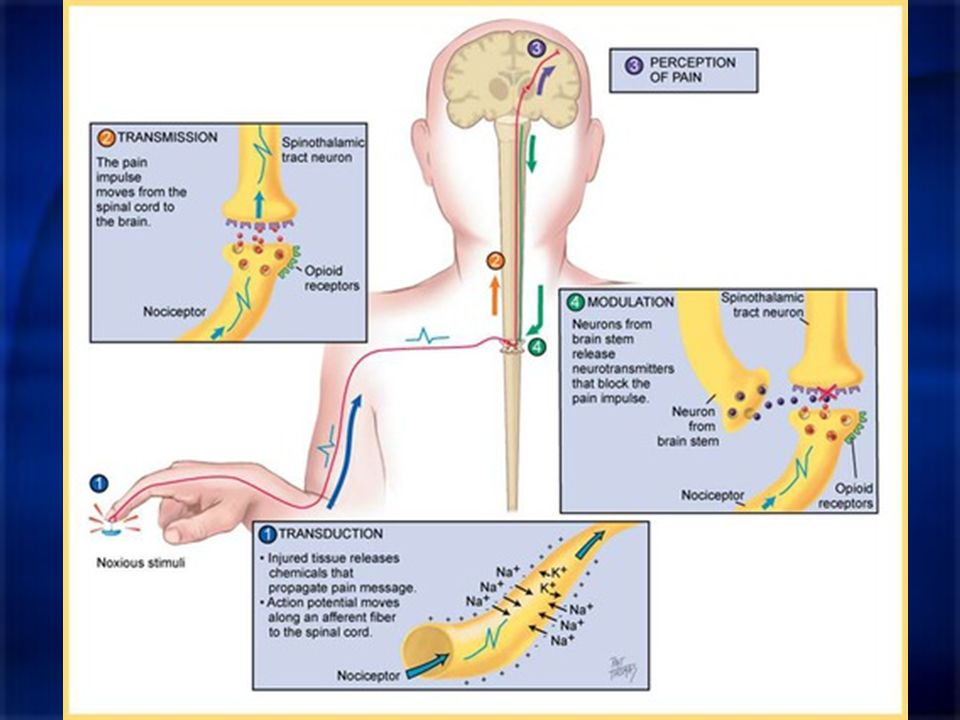 doi: 10.1016/j.semarthrit.2013.08.001. Epub 2013 Nov 18.
doi: 10.1016/j.semarthrit.2013.08.001. Epub 2013 Nov 18.
107. Strand V, Burmester GR, Ogale S, et al. Improvements in healthrelated quality of life after treatment with tocilizumab in patients with rheumatoid arthritis refractory to tumour necrosis factor inhibitors: results from the 24-week randomized controlled RADIATE study. Rheumatology (Oxford). 2012 Oct;51(10):1860-9. Epub 2012 Jun 28.
108. Yazici Y, Curtis JR, Ince A, et al. Efficacy of tocilizumab in patients with moderate to severe active rheumatoid arthritis and a previous inadequate response to disease-modifying antirheumatic drugs: the ROSE study. Ann Rheum Dis. 2012 Feb;71(2):198-205. doi: 10.1136/ard.2010.148700. Epub 2011 Sep 26.
109. Панасюк ЕЮ, Амирджанова ВН, Авдеева АС и др. Опыт применения тоцилизумаба у больных ревматоидным артритом (по данным многоцентрового исследования ЛОРНЕТ). Научно-практическая ревматология. 2013;51(2):104-10. doi: 10.14412/1995-4484-2013-635
110. Панасюк ЕЮ, Амирджанова ВН, Александрова ЕН и др. Быстрый эффект тоцилизумаба при ревматоидном артрите. Научно-практическая ревматология. 2011;49(4):11-6. doi: 10.14412/1995-4484-2011-55
Быстрый эффект тоцилизумаба при ревматоидном артрите. Научно-практическая ревматология. 2011;49(4):11-6. doi: 10.14412/1995-4484-2011-55
111. Choy EH, Bernasconi C, Aassi M, et al. Treatment of Rheumatoid Arthritis With Anti-Tumor Necrosis Factor or Tocilizumab Therapy as First Biologic Agent in a Global Comparative Observational Study. Arthritis Care Res (Hoboken). 2017 Oct;69(10):1484-94. doi: 10.1002/acr.23303. Epub 2017 Sep 6.
112. Насонов ЕЛ. Новые подходы к фармакотерапии ревматоидного артрита: тофацитиниб. Научно-практическая ревматология. 2014;52(2):209-21. doi: 10.14412/1995-4484-2014-209-221
113. Yan Z, Gibson SA, Buckley JA, et al. Role of the JAK/STAT signaling pathway in regulation of innate immunity in neuroinflammatory diseases. Clin Immunol. 2018 Apr;189:4-13. doi: 10.1016/j.clim.2016.09.014. Epub 2016 Oct 3.
114. Banerjee S, Biehl A, Gadina M, et al. JAK-STAT Signaling as a Target for Inflammatory and Autoimmune Diseases: Current and Future Prospects. Drugs. 2017 Apr;77(5):521-46. doi: 10.1007/s40265-017-0701-9
Drugs. 2017 Apr;77(5):521-46. doi: 10.1007/s40265-017-0701-9
115. Liu Y, Gibson SA, Benveniste EN, Qin H. Opportunities for Translation from the Bench: Therapeutic Intervention of the JAK/STAT Pathway in Neuroinflammatory Diseases. Crit Rev Immunol. 2015;35(6):505-27. doi: 10.1615/CritRevImmunol.2016015517
116. Tsuda M, Kohro Y, Yano T, et al. JAK-STAT3 pathway regulates spinal astrocyte proliferation and neuropathic pain maintenance in rats. Brain. 2011 Apr;134(Pt 4):1127-39. doi: 10.1093/brain/awr025. Epub 2011 Mar 2.
117. Dominguez E, Rivat C, Pommier B, et al. JAK/STAT3 pathway is activated in spinal cord microglia after peripheral nerve injury and contributes to neuropathic pain development in rat. J Neurochem. 2008 Oct;107(1):50-60. doi: 10.1111/j.1471-4159.2008.05566.x. Epub 2008 Jul 12.
118. Ding CP, Guo YJ, Li HN, et al. Red nucleus interleukin-6 participates in the maintenance of neuropathic pain through JAK/STAT3 and ERK signaling pathways. Exp Neurol.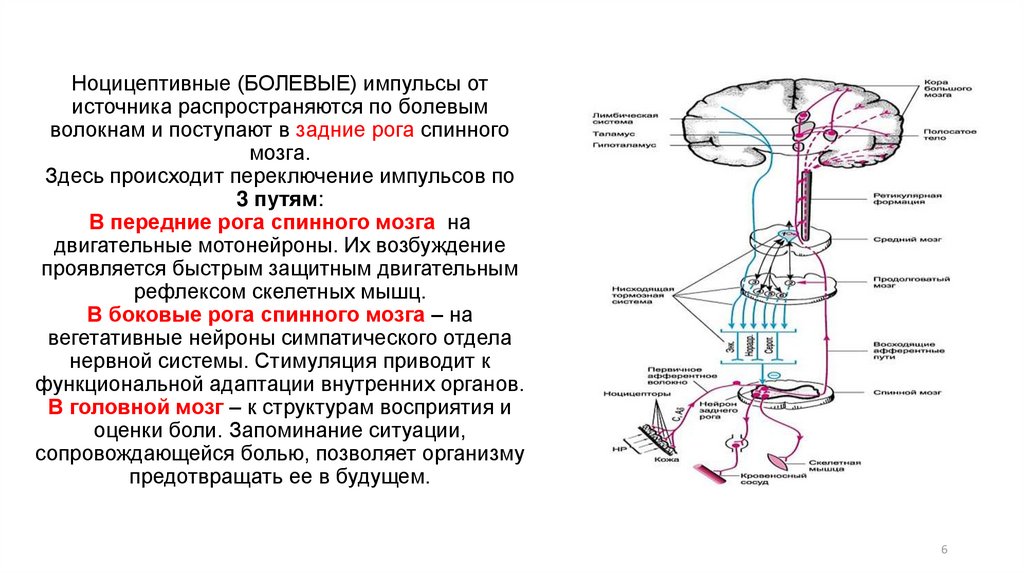 2018 Feb;300:212-21. doi: 10.1016/j.expneurol.2017.11.012. Epub 2017 Nov 26.
2018 Feb;300:212-21. doi: 10.1016/j.expneurol.2017.11.012. Epub 2017 Nov 26.
119. Garbers C, Aparicio-Siegmund S, Rose-John S. The IL-6/gp130/STAT3 signaling axis: recent advances towards specific inhibition. Curr Opin Immunol. 2015 Jun;34:75-82. doi: 10.1016/j.coi.2015.02.008. Epub 2015 Mar 6.
120. Kojima H, Inoue T, Kunimoto H, Nakajima K. IL-6-STAT3 signaling and premature senescence. JAKSTAT. 2013 Oct 1;2(4):e25763. doi: 10.4161/jkst.25763. Epub 2013 Jul 22.
121. Malemud CJ. The role of the JAK/STAT signal pathway in rheumatoid arthritis. Ther Adv Musculoskelet Dis. 2018 Jun;10(5-6):117-27. doi: 10.1177/1759720X18776224. Epub 2018 May 19.
122. Singh JA, Hossain A, Tanjong Ghogomu E, et al. Biologics or tofacitinib for rheumatoid arthritis in incomplete responders to methotrexate or other traditional disease-modifying anti-rheumatic drugs: a systematic review and network meta-analysis. Cochrane Database Syst Rev. 2016 May 13;(5):CD012183. doi: 10.1002/14651858.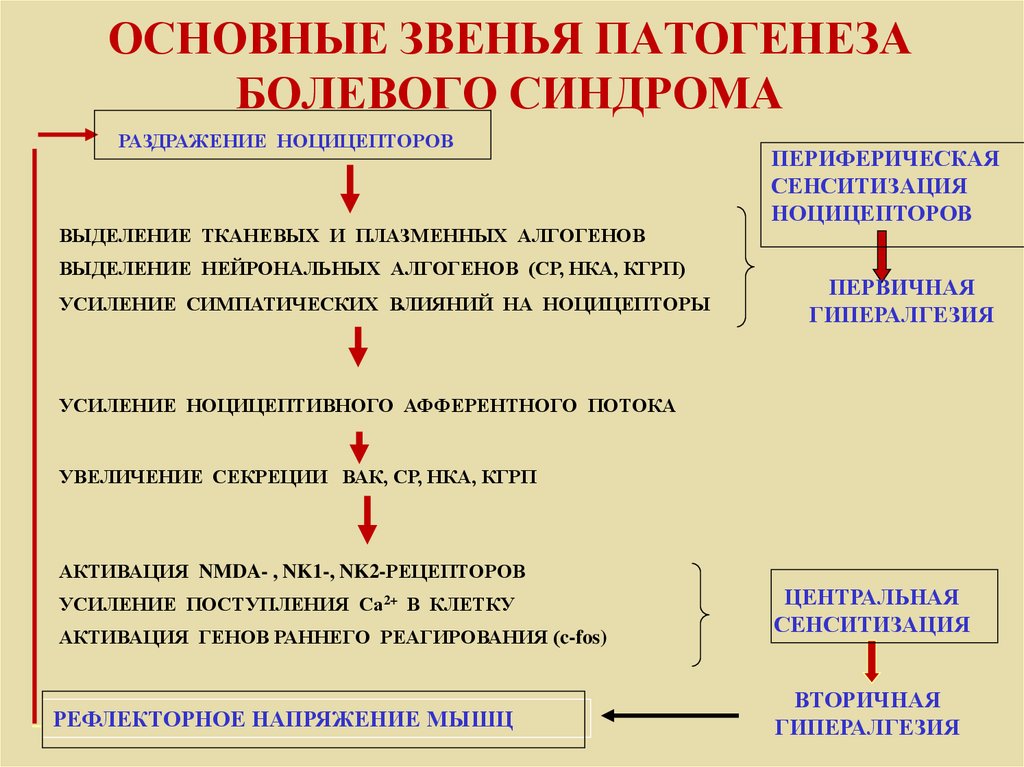 CD012183
CD012183
123. Bergrath E, Gerber RA, Gruben D, et al. Tofacitinib versus Biologic Treatments in Moderate-to-Severe Rheumatoid Arthritis Patients Who Have Had an Inadequate Response to Nonbiologic DMARDs: Systematic Literature Review and Network MetaAnalysis.Int J Rheumatol. 2017;2017:8417249. doi: 10.1155/2017/8417249. Epub 2017 Mar 9.
124. Zhang X, Liang F, Yin X, et al. Tofacitinib for acute rheumatoid arthritis patients who have had an inadequate response to diseasemodifying antirheumatic drug (DMARD): a systematic review and meta-analysis. Clin Rheumatol. 2014 Feb;33(2):165-73. doi: 10.1007/s10067-013-2452-7. Epub 2014 Jan 4.
125. Cohen SB, Tanaka Y, Mariette X, et al. Long-term safety of tofacitinib for the treatment of rheumatoid arthritis up to 8.5 years: integrated analysis of data from the global clinical trials. Ann Rheum Dis. 2017 Jul;76(7):1253-62. doi: 10.1136/annrheumdis-2016-210457. Epub 2017 Jan 31.
126. Gladman D, Rigby W, Azevedo VF, et al. Tofacitinib for Psoriatic Arthritis in Patients with an Inadequate Response to TNF Inhibitors.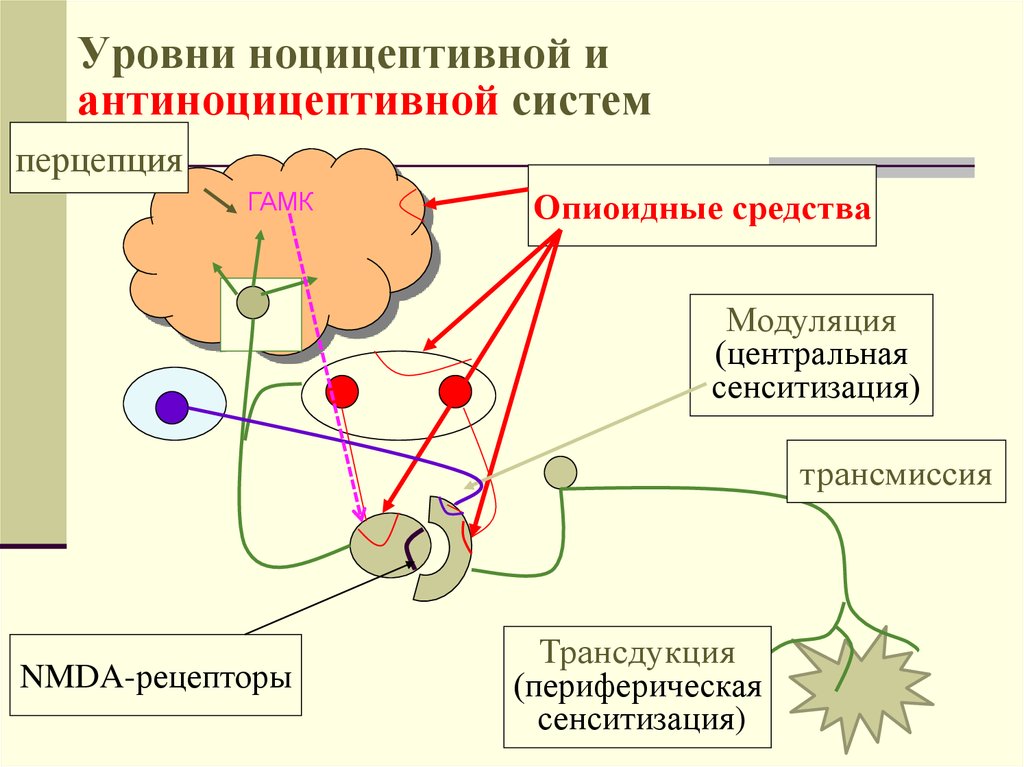 N Engl J Med. 2017 Oct 19;377(16):1525-36. doi: 10.1056/NEJMoa1615977
N Engl J Med. 2017 Oct 19;377(16):1525-36. doi: 10.1056/NEJMoa1615977
127. Wang TS, Tsai TF. Tofacitinib in psoriatic arthritis. Immunotherapy. 2017 Nov;9(14):1153-63. doi: 10.2217/imt-2017-0087. Epub 2017 Oct 2.
128. Boyce EG, Vyas D, Rogan EL, et al. Impact of tofacitinib on patient outcomes in rheumatoid arthritis – review of clinical studies. Patient Relat Outcome Meas. 2016 Jan 14;7:1-12. doi: 10.2147/PROM.S62879. eCollection 2016.
129. Wallenstein GV, Kanik KS, Wilkinson B, et al. Effects of the oral Janus kinase inhibitor tofacitinib on patient-reported outcomes in patients with active rheumatoid arthritis: results of two Phase 2 randomised controlled trials. Clin Exp Rheumatol. 2016 MayJun;34(3):430-42. Epub 2016 Apr 28.
130. Kremer JM, Bloom BJ, Breedveld FC, et al. The safety and efficacy of a JAK inhibitor in patients with active rheumatoid arthritis: Results of a double-blind, placebo-controlled phase IIa trial of three dosage levels of CP-690,550 versus placebo.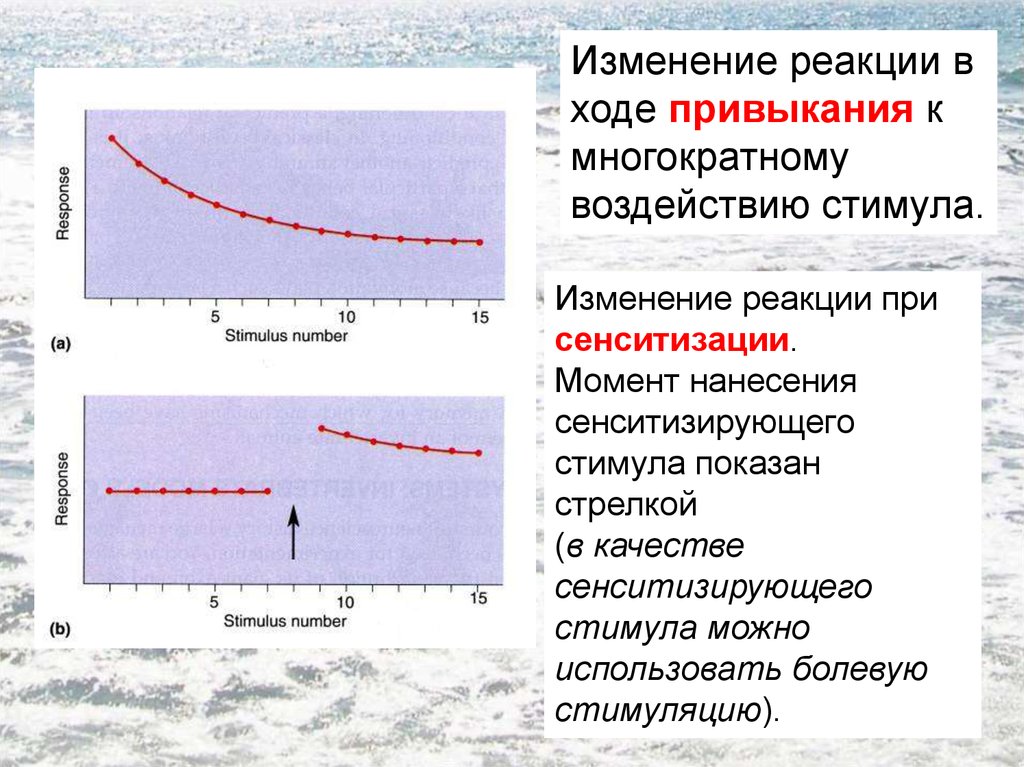 Arthritis Rheum. 2009 Jul;60(7):1895-905. doi: 10.1002/art.24567
Arthritis Rheum. 2009 Jul;60(7):1895-905. doi: 10.1002/art.24567
Дисфункция височно-нижнечелюстного сустава при хронической мигрени
Орофациальная боль, связанная с заболеванием области височно-нижнечелюстного сустава, встречается у 10–26% взрослого населения. При этом у женщин она наблюдается в 1,5 раза чаще, чем у мужчин [1]. Дисфункция височно-нижнечелюстного сустава (ДВНЧС) — самая частая причина хронической боли в лице неодонтогенного происхождения. Традиционно ДВНЧС рассматривалась в качестве суставной патологии и последствия подвывиха нижней челюсти, артрита, артроза или травмы височно-нижнечелюстного сустава, а также окклюзионных нарушений [2, 3]. Однако в 2014 г. были приняты Диагностические критерии ДВНЧС для клинического применения, которые классифицируют ДВНЧС на группы болевой и внутрисуставной патологии [4]. Соответственно, у пациента может наблюдаться болевая или внутрисуставная патология, либо их сочетание.
Нередко на фоне ДВНЧС возникает орофациальная боль. От 50 до 70% пациентов с ДВНЧС
жалуются на боли в области жевательных мышц,
а у 25% этих пациентов данные мышцы становятся основным источником боли [5]. В отсутствие
дисфункции самого сустава болевые синдромы
обычно представлены миалгией вследствие миофасциального болевого синдрома в жевательных
и височных мышцах. Пациенты отмечают боль
в височной и околоушной области, как и в области самого сустава. При миофасциальном болевом
синдроме развиваются также отраженные боли.
От 50 до 70% пациентов с ДВНЧС
жалуются на боли в области жевательных мышц,
а у 25% этих пациентов данные мышцы становятся основным источником боли [5]. В отсутствие
дисфункции самого сустава болевые синдромы
обычно представлены миалгией вследствие миофасциального болевого синдрома в жевательных
и височных мышцах. Пациенты отмечают боль
в височной и околоушной области, как и в области самого сустава. При миофасциальном болевом
синдроме развиваются также отраженные боли.
Причины формирования миогенных расстройств в жевательных мышцах до сих пор недостаточно изучены. Так, не обнаружено прямой
связи между тяжестью бруксизма и развитием миофасциальной боли. Как следствие, спорной представляется роль стискивания и скрежетания
зубами в возникновении и поддержании боли
в жевательных мышцах [6]. Помимо окклюзионной
дисгармонии (часто провоцирует развитие как миофасциальной боли, так и ДВНЧС), во многих случаях этиологический фактор ДВНЧС не очевиден.
Многие авторы указывают на частое наличие ДВНЧС у пациентов с головной болью (ГБ). У больных с ДВНЧС наиболее частой первичной формой ГБ выступает мигрень (55,3%), распространенность ГБ напряжения составляет 30,2% [7]. Отношение шансов наличия любой ГБ у пациентов с ДВНЧС равно 7,05 (95% доверительный интервал (ДИ) 3,65–13,6; p=0,000), мигрени — 2,7 (95% ДИ 1,5–5,06; p=0,001). M.C. Gonçalves и соавт. показали, что у женщин с мигренью распространенность ДВНЧС в 3 раза выше (91,3% при хронической мигрени (ХМ) и 86,8% при эпизодической мигрени (ЭМ)), чем в отсутствие мигрени (33,3%) [8]. В исследовании A. da Silva Jr. и соавт. распространенность ДВНЧС у пациентов с хронической ежедневной ГБ была 58,1% [9].
Эти данные свидетельствуют о том, что распространенность ДВНЧС при ГБ значительно превышает общепопуляционный показатель. Причина
такой высокой распространенности ДВНЧС неясна, а механизмы коморбидности этих заболеваний
мало изучены.
Материал и методы
В исследовании приняли участие 84 пациента с ХМ
и 42 пациента с ЭМ. Диагноз устанавливался специалистом по ГБ в соответствии с диагностическими критериями Международной классификации
головной боли 3-го пересмотра, бета-версия [10].
ДВНЧС определялась согласно Диагностическим
критериям ДВНЧС для клинического применения
(2014) [4] — современному стандарту диагностики
данного заболевания. Эти критерии основаны на
данных анамнеза и клинического осмотра (пальпации височных и жевательных мышц) и не требуют
обязательного проведения визуализационных исследований.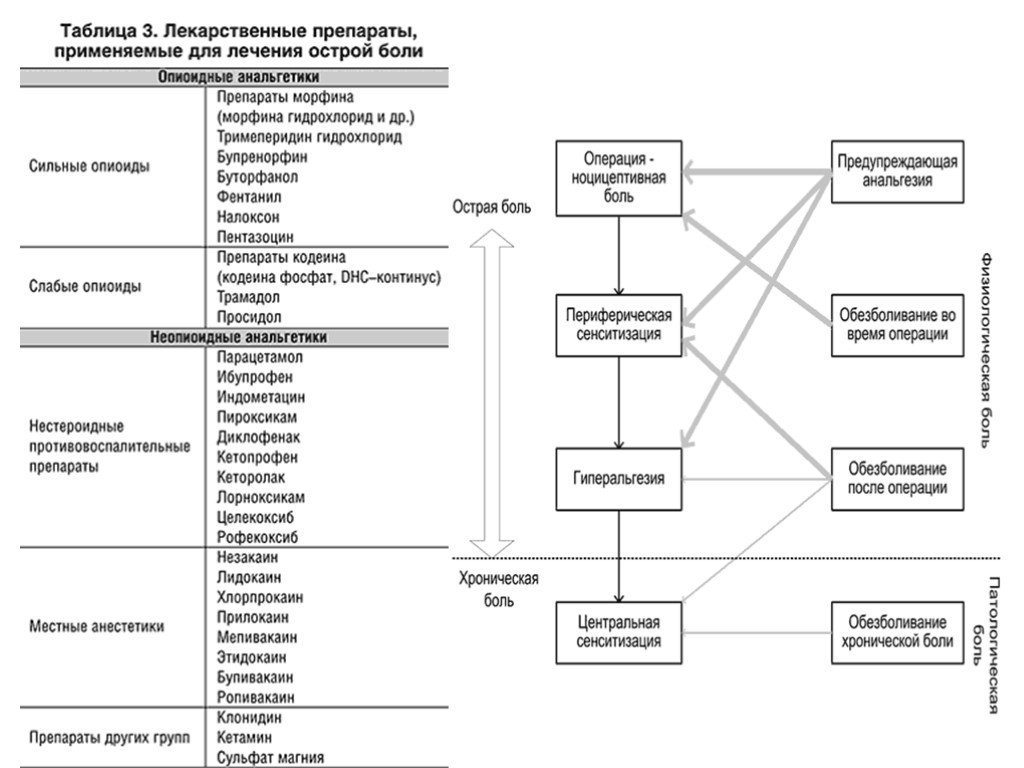
1. Данные анамнеза (оба из нижеперечисленного):
- боль в области челюсти, виска, уха или кпереди от уха;
- боль изменяется при движении нижней челюсти, жевании или парафункциональной активности.
2. Данные осмотра (все из нижеперечисленного):
- подтверждение локализации боли в области жевательной и/или височной мышц;
- воспроизведение боли при пальпации жевательной или височной мышцы;
- распространение боли за пределы пальпируемого участка в пределах пальпируемой мышцы (миофасциальный болевой синдром) или за пределы пальпируемой мышцы (миофасциальный болевой синдром с отражением боли).
В данной работе рентгенологическое и томографическое исследование височно-нижнечелюстного сустава не выполнялось.
Всем пациентам был проведен неврологический
осмотр для исключения вторичного характера ГБ. Выраженность депрессии и тревоги оценивалась
при помощи Госпитальной шкалы тревоги и депрессии (HADS) [11]. Диагноз бруксизма устанавливался в соответствии с минимальными критериями Международной классификации расстройств
сна (ICSD-R) [12].
Выраженность депрессии и тревоги оценивалась
при помощи Госпитальной шкалы тревоги и депрессии (HADS) [11]. Диагноз бруксизма устанавливался в соответствии с минимальными критериями Международной классификации расстройств
сна (ICSD-R) [12].
Все участники исследования подписали протокол информированного согласия в соответствии с требованиями Хельсинкской декларации. Исследование было одобрено локальным комитетом по этике при Сеченовском университете.
Данные анализировались при помощи программного обеспечения Statistica 10. Для сравнения показателей между группами использовался тест Манна — Уитни, для сравнения частот — точный тест Фишера. Различия считались статистически значимыми при р< 0,05. Все значения приведены в виде среднего±стандартное отклонение.
Результаты
Клинико-демографические характеристики пациентов с ЭМ и ХМ были сопоставимы
(табл. 1). Средняя частота ГБ в группе ХМ составила
25,1±4,8 дня в месяц, в группе ЭМ — 5,3±3,5.
Для изучения распространенности и структуры ДВНЧС пациенты были разделены на подгруппы в зависимости от частоты ГБ: 22 пациента, у которых регистрировали до 4 дней ГБ в месяц, составили группу редкой ЭМ (РЭМ), 95 пациентов, у которых частота ГБ превышала 10 дней в месяц, были отнесены к группе частой ЭМ (ЧЭМ) и ХМ (ЧЭМ+ХМ). Это связано с тем, что у пациентов с ЧЭМ, так же как и при ХМ, выявляются признаки центральной сенситизации и дисфункции антиноцицептивных систем [13]. Кроме того, по данным Z. Katsarava и соавт., вероятность хронизации мигрени в течение следующего года у больных с ЭМ (частота ГБ от 10 до 14 дней в месяц) в 10 раз выше по сравнению с пациентами с более низкой частотой мигрени [14].
Уровень тревоги по шкале HADS в группе
ХМ был выше, чем при ЭМ, и соответствовал
субклинической выраженности тревоги (9±4,7
и 6,7±4,4 балла соответственно, р=0,02). Уровень
депрессии при ХМ также превышал данный показатель при ЭМ (6,9±3,5 и 4,1±3,4 балла соответственно, р=0,00), однако в обеих группах указывал
на отсутствие достоверно выраженных клинических симптомов депрессии.
В структуре ДВНЧС в обеих группах преобладала болевая патология, представленная миофасциальным болевым синдромом. В общей группе участников исследования распространенность ДВНЧС составила 39,6%, при этом болевая форма — 39,6%, суставная патология — 10,3% (табл. 2). У 10,3% пациентов выявлено сочетание болевого расстройства и внутрисуставной патологии.
Распространенность ДВНЧС была более высокой в группе ХМ, по сравнению с таковой при ЭМ
(52,4 против 28,6%, р=0,02). В группе ХМ выявлена
статистически значимо более высокая распространенность болевой формы ДВНЧС. Еще более выраженные различия наблюдались при сравнении
подгрупп РЭМ и ЧЭМ+ХМ (18,2 и 51,6% соответственно, р<0,009) (см. табл. 2). Вместе с тем статистически значимых различий в распространенности внутрисуставной формы ДВНЧС в группах
ЭМ и ХМ, а также в подгруппах РЭМ и ЧЭМ+ХМ
не обнаружено. В нашей популяции внутрисуставная форма ДВНЧС не встречалась отдельно, только
в сочетании с болевой формой.
Распространенность бруксизма в группе РЭМ составила 18%, что соответствует наблюдаемой в данной группе частоте ДВНЧС (18,2%, р>0,05). Частота бруксизма в подгруппах РЭМ и ЧЭМ+ХМ значимо не различалась (см. табл. 2). В группе ЧЭМ+ХМ распространенность бруксизма была статистически значимо ниже распространенности ДВНЧC (30,5 и 51,6% соответственно, p=0,005). Все участники исследования не отмечали травмы области височно-нижнечелюстного сустава в анамнезе.
Статистически значимого влияния уровня тревоги на наличие ДВНЧС не выявлено. Уровень тревоги у пациентов с ЭМ и ХМ с ДВНЧС и без ДВНЧС не различался (8,1±4,1 балла и 8,3±4,7 балла соответственно, р=0,8).
Обсуждение
Хронические боли в лице — проблема, давно привлекающая внимание специалистов разных профилей.
Причиной такой боли во многих случаях выступает
миофасциальный болевой синдром лица. Его этиологическими факторами, в свою очередь, могут
быть парафункция жевательных мышц (бруксизм),
окклюзионная дисгармония, ДВНЧС, ортопедические нарушения, психологические особенности
личности. Среди провоцирующих факторов выделяют стоматологические вмешательства, острый
и хронический стресс, травмы челюстно-лицевой
области [15].
Среди провоцирующих факторов выделяют стоматологические вмешательства, острый
и хронический стресс, травмы челюстно-лицевой
области [15].
Сегодня миофасциальный болевой синдром лица принято рассматривать в рамках ДВНЧС и относить к группе болевой патологии [4]. Это означает, что у пациента боль в лице может быть вызвана гипертонусом и миофасциальным болевым синдромом в жевательных мышцах без патологии структур самого сустава. Эволюционируют и наши представления о патогенезе этого широко распространенного заболевания. Появились первые работы ведущих зарубежных исследователей хронической боли, в которых высказаны предположения о возможной «центральной» причине ДВНЧС — дисфункции систем контроля боли [16].
Распространенность ДВНЧС высока при различных формах первичной ГБ, особенно при мигрени. В частности, A. da Silva Jr. и соавт. показали, что ДВНЧС встречается у 67,1% пациентов с ГБ [17].
И в нашем исследовании у пациентов с тяжелой ХМ (средняя частота ГБ составила 25 дней
в месяц) распространенность ДВНЧС была очень
высокой — 52,4%. При этом распространенность
ДВНЧС у пациентов с РЭМ не превышала таковую в общей популяции (10–26%) [1]. Таким образом, при ХМ распространенность ДВНЧС значимо
превышала аналогичный показатель у пациентов
с ЭМ и у пациентов, не страдающих ГБ. Обращает
на себя внимание также повышение распространенности ДВНЧС по мере увеличения количества
дней мигрени в месяц — различия в частоте ДВНЧС
наиболее выражены при сравнении между пациентами с РЭМ и пациентами с ЧЭМ и ХМ. Поскольку
нет данных о том, что пациенты с ХМ более часто
страдают окклюзионными и другими стоматологическими нарушениями, чем больные ЭМ, такая
высокая распространенность ДВНЧС у пациентов
с частой мигренью может быть обусловлена не периферическими, а центральными причинами.
При этом распространенность
ДВНЧС у пациентов с РЭМ не превышала таковую в общей популяции (10–26%) [1]. Таким образом, при ХМ распространенность ДВНЧС значимо
превышала аналогичный показатель у пациентов
с ЭМ и у пациентов, не страдающих ГБ. Обращает
на себя внимание также повышение распространенности ДВНЧС по мере увеличения количества
дней мигрени в месяц — различия в частоте ДВНЧС
наиболее выражены при сравнении между пациентами с РЭМ и пациентами с ЧЭМ и ХМ. Поскольку
нет данных о том, что пациенты с ХМ более часто
страдают окклюзионными и другими стоматологическими нарушениями, чем больные ЭМ, такая
высокая распространенность ДВНЧС у пациентов
с частой мигренью может быть обусловлена не периферическими, а центральными причинами.
Это предположение базируется и на результатах
нашего исследования. В частности, мы не выявили
убедительных данных о существовании других причин такой высокой распространенности ДВНЧС
при ХМ. Например, наличие бруксизма может объяснить достаточно высокую распространенность
ДВНЧС только при ЭМ с редкими приступами, но
не у пациентов с частой и ежедневной мигренью,
поскольку ее частота в данной группе значительно
ниже распространенности ДВНЧС. Мы также не
выявили статистически значимого влияния уровня
тревоги на наличие ДВНЧС.
Например, наличие бруксизма может объяснить достаточно высокую распространенность
ДВНЧС только при ЭМ с редкими приступами, но
не у пациентов с частой и ежедневной мигренью,
поскольку ее частота в данной группе значительно
ниже распространенности ДВНЧС. Мы также не
выявили статистически значимого влияния уровня
тревоги на наличие ДВНЧС.
В обширном исследовании в общей популяции
с использованием современных критериев диагностики ДВНЧС было показано, что 58% случаев
приходится на болевую форму и 42% — на внутрисуставную патологию [18]. У всех наших пациентов
с мигренью распространенность внутрисуставной
патологии была значительно ниже, чем в общей
популяции. У пациентов с РЭМ и в еще большей
степени у пациентов с ЧЭМ и ХМ доминировала
болевая патология, представленная миофасциальным болевым синдромом в жевательных и/или
височных мышцах. При этом частота встречаемости внутрисуставной патологии не различалась
у пациентов с ЭМ и ХМ. Все различия касались исключительно болевого расстройства.
Все различия касались исключительно болевого расстройства.
На основе полученных данных мы предполагаем несколько патофизиологических механизмов коморбидности ХМ и ДВНЧС.
Напряженные и болезненные жевательные
мышцы становятся источником поступления ноцицептивных импульсов в центральную нервную
систему, то есть источником периферической сенситизации. Жевательные мышцы иннервируются
тройничным нервом, импульсы от них поступают в тригемино-цервикальную систему, вызывая
развитие центральной сенситизации. Хорошо известно, что данный феномен лежит в основе хронизации боли (в частности, мигрени) [19]. В соответствии с современными представлениями
о хронической ГБ, в основе ее патогенеза могут
лежать два основных механизма — сенситизация
ноцицептивных структур и снижение активности
антиноцицептивных отделов центральной нервной
системы. Центральная сенситизация выступает одним из основных механизмов поддержания боли
в хроническом состоянии, при ее наличии утрачивается зависимость от периферических пусковых
факторов, развивается резистентность к терапии.
Эта гипотеза соответствует находкам D.A. Gonçalves и соавт., которые на примере 300 пациентов с головной и орофациальной болью показали, что самый высокий риск наличия хронической ежедневной ГБ и мигрени выявляется именно при болевой форме ДВНЧС, то есть при вовлечении исключительно жевательной группы мышц [20]. Это может свидетельствовать о заинтересованности ноцицептивных путей с периферии, которые формируют центральную сенситизацию. Кроме того, наличие миофасциального болевого синдрома лица в жевательных и височных мышцах может быть причиной внутрисуставной патологии при ДВНЧС, наряду с окклюзионными и другими нарушениями.
Мышечная дисфункция в жевательных мышцах
может также быть отражением центральной сенситизации — фактора хронизации мигрени. У многих
пациентов с ДВНЧС отсутствует корреляция между тяжестью боли в лице и наличием структурной
патологии в тканях. Это говорит о том, что при
мигрени и ДВНЧС причиной боли могут служить
общие факторы патогенеза — центральные и/или
периферические.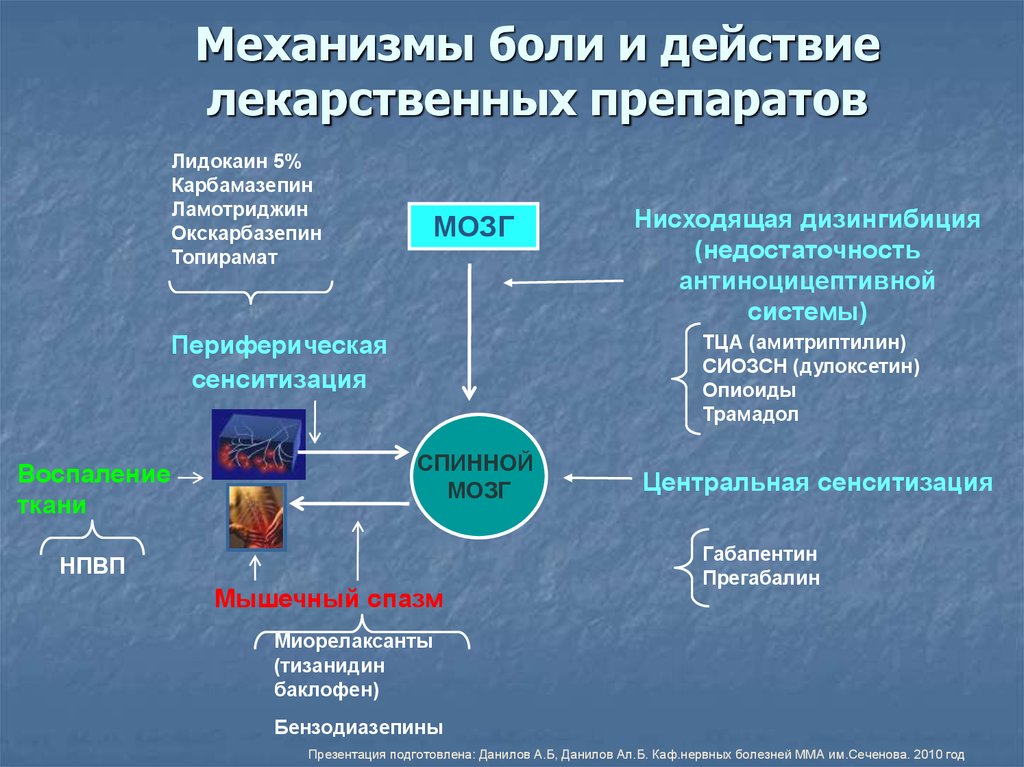 Таким образом, боль при ДВНЧС
может быть вызвана нарушением обработки болевых импульсов в центральной нервной системе.
По данным L.B. Campi и соавт., наличие гипералгезии и аллодинии в зонах иннервации тройничного
нерва и за их пределами у женщин с болевой формой ДВНЧС указывает на наличие центральной
сенситизации [21]. T.C. Chaves и соавт. установили,
что у пациентов с ДВНЧС и мигренью отмечается
более выраженная гипералгезия (особенно в отдаленных точках) и аллодиния по сравнению с пациентами, страдающими ДВНЧС либо мигренью.
Как предположили авторы, наличие ДВНЧС и мигрени может отражать высокую интенсивность
и устойчивость феномена центральной сенситизации у данных пациентов [22]. Временнáя суммация
боли от температурного воздействия, отмеченная
другими исследователями при миофасциальной
форме ДВНЧС, отражает наличие феномена windup в ноцицептивных нейронах спинного мозга
и относится к проявлениям центральной сенситизации [23].
Таким образом, боль при ДВНЧС
может быть вызвана нарушением обработки болевых импульсов в центральной нервной системе.
По данным L.B. Campi и соавт., наличие гипералгезии и аллодинии в зонах иннервации тройничного
нерва и за их пределами у женщин с болевой формой ДВНЧС указывает на наличие центральной
сенситизации [21]. T.C. Chaves и соавт. установили,
что у пациентов с ДВНЧС и мигренью отмечается
более выраженная гипералгезия (особенно в отдаленных точках) и аллодиния по сравнению с пациентами, страдающими ДВНЧС либо мигренью.
Как предположили авторы, наличие ДВНЧС и мигрени может отражать высокую интенсивность
и устойчивость феномена центральной сенситизации у данных пациентов [22]. Временнáя суммация
боли от температурного воздействия, отмеченная
другими исследователями при миофасциальной
форме ДВНЧС, отражает наличие феномена windup в ноцицептивных нейронах спинного мозга
и относится к проявлениям центральной сенситизации [23].
Таким образом, распространенность миофасциальной формы ДВНЧС при частой ЭМ и ХМ превышает таковую при редкой ЭМ и не может объясняться исключительно такими традиционно изучаемыми факторами, как окклюзионные нарушения, парафункциональная активность, травмы височно-нижнечелюстного сустава, а также эмоциональные расстройства. У пациентов с ХМ болезненность жевательных мышц может свидетельствовать о нарушении антиноцицептивных функций, то есть быть отражением центральной сенситизации и нарушения нисходящего контроля боли. В этом случае даже нормальные проприоцептивные импульсы от жевательных мышц воспринимаются как болевые, а напряжение в них является следствием активации моторной коры при центральной сенситизации.
Основным ограничением настоящего исследования следует считать отсутствие оценки структурных изменений скелета (безусловно, важного фактора развития ДВНЧС [3]), а также окклюзионных
нарушений у наших пациентов с мигренью. При
этом отметим: нам не удалось найти данные о большей распространенности ортопедических или окклюзионных нарушений при ХМ. В этой связи мы
исходили из того, что более высокая распространенность ДВНЧС у данных пациентов по сравнению с ЭМ может объясняться другими причинами.
Необходимы дальнейшие исследования, которые
смогут пролить свет на механизмы коморбидности
ХМ и ДВНЧС.
При
этом отметим: нам не удалось найти данные о большей распространенности ортопедических или окклюзионных нарушений при ХМ. В этой связи мы
исходили из того, что более высокая распространенность ДВНЧС у данных пациентов по сравнению с ЭМ может объясняться другими причинами.
Необходимы дальнейшие исследования, которые
смогут пролить свет на механизмы коморбидности
ХМ и ДВНЧС.
Заключение
У большого числа пациентов неотъемлемым компонентом патогенеза ХМ выступает ДВНЧС, поэтому пациентов с ХМ необходимо обследовать
на предмет наличия нарушений в области височно-нижнечелюстного сустава. ДВНЧС способствует хронификации мигрени путем усиления центральной сенситизации, а ХМ, в свою очередь, за
счет центральной сенситизации может участвовать
в возникновении миофасциального болевого синдрома в жевательных и височных мышцах, развитии болевой формы ДВНЧС и, возможно, в более
позднее время — в формировании внутрисуставной
патологии.
Лечение ДВНЧС может улучшить результаты лечения ХМ — заболевания, традиционно представляющего сложности для терапии. Необходимы дальнейшие исследования, направленные на изучение эффективности комплексного подхода при ХМ, в частности, с добавлением инъекций ботулотоксина типа А в жевательные и височные мышцы для коррекции ДВНЧС. Высокая коморбидность ХМ и ЧЭМ с ДВНЧС позволяет предполагать, что эффективность лечения мигрени может зависеть от наличия ДВНЧС и ее клинической формы, а лечение ДВНЧС может стать важным компонентом программы лечения ХМ, особенно у пациентов с рефрактерной мигренью.
Литература
1. Macfarlane TV, Blinkhorn AS, Davies RM,
Kincey J, Worthington HV. Oro-facial pain
in the community: prevalence and associated impact. Community Dent Oral Epidemiol. 2002;30(1):52—60. doi: 10.1034/j.1600-
0528.2002.300108.x.
2. Ханахок ХЮ, Скорикова ЛA.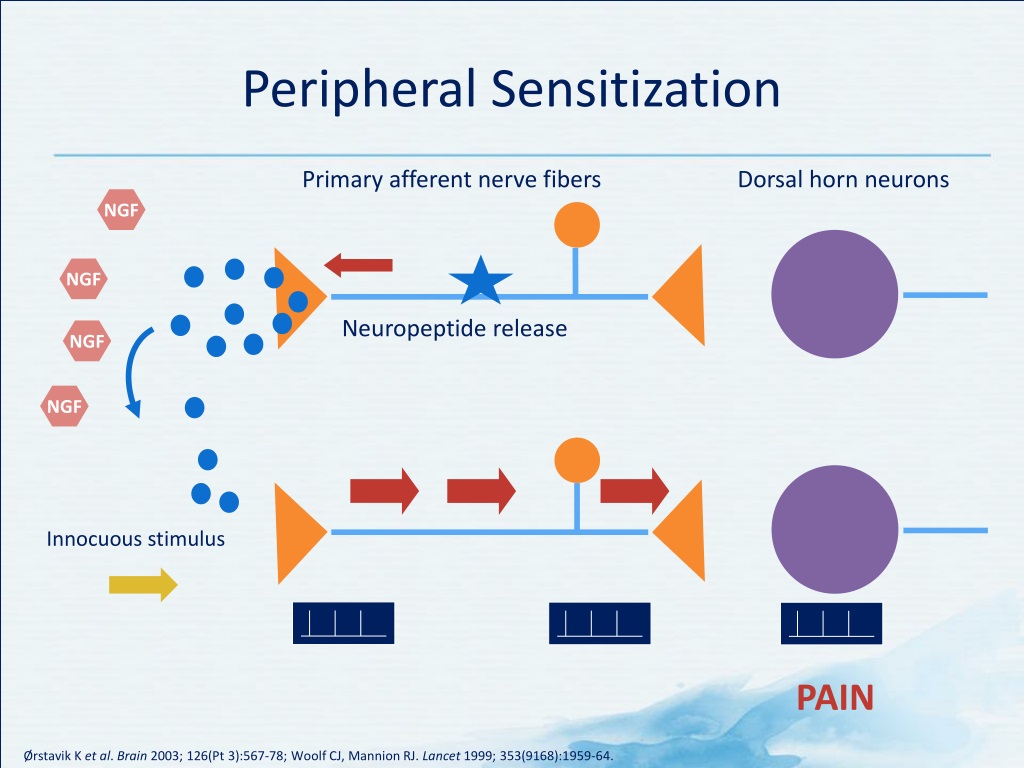 Мышечно-суставные дисфункции височно-нижнечелюстного сустава при общесоматических заболеваниях. Международный
журнал прикладных и фундаментальных
исследований. 2014;(2):194—6. Доступно
на: https://applied-research.ru/ru/article/
view?id=4724.
Мышечно-суставные дисфункции височно-нижнечелюстного сустава при общесоматических заболеваниях. Международный
журнал прикладных и фундаментальных
исследований. 2014;(2):194—6. Доступно
на: https://applied-research.ru/ru/article/
view?id=4724.
3.Орлова ОР, Мингазова ЛР, Вейн AM. Миофасциальный болевой синдром лица: новые
аспекты клиники, патогенеза и лечения. Новое в стоматологии. 2003;(1):26—9.
4. Schiffman E, Ohrbach R, Truelove E, Look J,
Anderson G, Goulet JP, List T, Svensson P, Gonzalez Y, Lobbezoo F, Michelotti A, Brooks SL,
Ceusters W, Drangsholt M, Ettlin D, Gaul C,
Goldberg LJ, Haythornthwaite JA, Hollender L,
Jensen R, John MT, De Laat A, de Leeuw R, Maixner W, van der Meulen M, Murray GM, Nixdorf DR,
Palla S, Petersson A, Pionchon P, Smith B, Visscher CM, Zakrzewska J, Dworkin SF; International RDC/TMD Consortium Network, International
association for Dental Research; Orofacial Pain
Special Interest Group, International Association for the Study of Pain. Diagnostic Criteria
for Temporomandibular Disorders (DC/TMD) for
Clinical and Research Applications: recommendations of the International RDC/TMD Consortium Network and Orofacial Pain Special Interest
Group. J Oral Facial Pain Headache. 2014;28(1):
6–27. doi: 10.11607/jop.1151.
Diagnostic Criteria
for Temporomandibular Disorders (DC/TMD) for
Clinical and Research Applications: recommendations of the International RDC/TMD Consortium Network and Orofacial Pain Special Interest
Group. J Oral Facial Pain Headache. 2014;28(1):
6–27. doi: 10.11607/jop.1151.
5.Alkhiary Y, El-Zawahry M, Moubarak A. Masticatory laterality: parameter for evaluating
TMD. J Appl Sci Res. 2013;9(4):2890—900.
6. Svensson P, Jadidi F, Arima T, Baad-Hansen L, Sessle BJ. Relationships between craniofacial pain
and bruxism. J Oral Rehabil. 2008;35(7):524—47.
doi: 10.1111/j.1365-2842.2008.01852.x.
7. Franco AL, Gonçalves DA, Castanharo SM, Speciali JG, Bigal ME, Camparis CM. Migraine is the
most prevalent primary headache in individuals with temporomandibular disorders. J Orofac Pain. 2010;24(3):287—92.
8.Gonçalves MC, Florencio LL, Chaves TC, Speciali JG, Bigal ME, Bevilaqua-Grossi D. Do
women with migraine have higher prevalence of temporomandibular disorders? Braz
J Phys Ther./19-1.jpg) 2013;17(1):64—8. doi: http://dx.doi.
org/10.1590/S1413-35552012005000054.
2013;17(1):64—8. doi: http://dx.doi.
org/10.1590/S1413-35552012005000054.
9. da Silva A Jr, Costa EC, Gomes JB, Leite FM,
Gomez RS, Vasconcelos LP, Krymchantowski A,
Moreira P, Teixeira AL. Chronic headache and
comorbidities: a two-phase, population-based,
cross-sectional study. Headache. 2010;50(8):
1306–12. doi: 10.1111/j.1526-4610.2010.01620.x.
10.Headache Classification Committee of the International Headache Society (IHS). The International Classification of Headache Disorders,
3rd ed. (beta version). Cephalalgia. 2013;33(9):
629–808. doi: 10.1177/0333102413485658.
11. Zigmond AS, Snaith RP. The hospital anxiety
and depression scale. Acta Psychiatr Scand.
1983;67(6):361—70. doi: 10.1111/j.1600-
0447.1983.tb09716.x.
12.American Academy of Sleep Medicine. International classification of sleep disorders,
revised: Diagnostic and coding manual. Chicago, Illinois: American Academy of Sleep
Medicine; 2001. 208 p.
208 p.
13.Латышева НВ, Филатова ЕГ. Центральная
сенситизация у пациентов с хронической
ежедневной головной болью. Практическая
неврология и нейрореабилитация. 2008;(3):
29–35.
14. Katsarava Z, Buse DC, Manack AN, Lipton RB.
Defining the differences between episodic migraine and chronic migraine. Curr Pain Headache Rep. 2012;16(1):86—92. doi: 10.1007/
s11916-011-0233-z.
15.Орлова ОР, Мингазова ЛР, Моренкова АЭ,
Вейн AM. Феноменология лицевых болей. Вестник практической неврологии.
2002;5:21—2.
16. List T, Jensen RH. Temporomandibular
disorders: Old ideas and new concepts.
Cephalalgia. 2017;37(7):692—704. doi:
10.1177/0333102416686302.
17. Silva Jr AA, Brandão KV, Faleiros BE, Tavares RM,
Lara RP, Januzzi E, Carvalho AB, Carvalho EM,
Gomes JB, Leite FM, Alves BM, Gómez RS, Teixeira AL. Temporo-mandibular disorders are
an important comorbidity of migraine and
may be clinically difficult to distinguish them
from tension-type headache. Arq Neuropsiquiatr. 2014;72(2):99—103. doi: 10.1590/0004-
282X20130221.
Arq Neuropsiquiatr. 2014;72(2):99—103. doi: 10.1590/0004-
282X20130221.
18. Svechtarov V, Nencheva-Svechtarova N, Uzunov Ts. Analysis of chronic temporomandibular
disorders based on the latest diagnostic criteria. Acta Medica Bulgarica. 2015;XLII(1):49—55.
19. Filatova E, Latysheva N, Kurenkov A. Evidence
of persistent central sensitization in chronic
headaches: a multi-method study. J Headache
Pain. 2008;9(5):295—300. doi: 10.1007/s10194-
008-0061-7.
20.Gonçalves DA, Camparis CM, Speciali JG, Franco AL, Castanharo SM, Bigal ME. Temporomandibular disorders are differentially associated
with headache diagnoses: a controlled study.
Clin J Pain. 2011;27(7):611—5. doi: 10.1097/AJP.
0b013e31820e12f5.
21. Campi LB, Jordani PC, Tenan HL, Camparis CM,
Gonçalves DA. Painful temporomandibular
disorders and central sensitization: implications for management — a pilot study. Int
J Oral Maxillofac Surg. 2017;46(1):104—10. doi:
10.1016/j.ijom.2016.07.005.
doi:
10.1016/j.ijom.2016.07.005.
22. Chaves TC, Dach F, Florencio LL, Carvalho GF,
Gonçalves MC, Bigal ME, Speciali JG, Bevilaqua-Grossi D. Concomitant migraine and temporomandibular disorders are associated with
higher heat pain hyperalgesia and cephalic
cutaneous allodynia. Clin J Pain. 2016;32(10):
882–8. doi: 10.1097/AJP.0000000000000369.
23. Cairns BE. Pathophysiology of TMD pain — basic
mechanisms and their implications for pharmacotherapy. J Oral Rehabil. 2010;37(6):391—
410. doi: 10.1111/j.1365-2842.2010.02074.x.
Статьи по теме
- Метод биологической обратной связи в лечении хронической головной боли и коморбидных расстройств
- Дисфункция височно-нижнечелюстного сустава при хронической мигрени
- Центральная регуляции боли у пациентов с заболеванием суставов и подходы к терапии
Видео по теме
- Хроническая боль в спине — перспективы персонализированной терапии
- Нейропатия лицевого нерва
- Симпозиум «Неврология в лицах: От простого к сложному»
Центральная сенсибилизация — Physiopedia
Первоначальный редактор — Натан Бенсон в рамках проекта PPA Pain.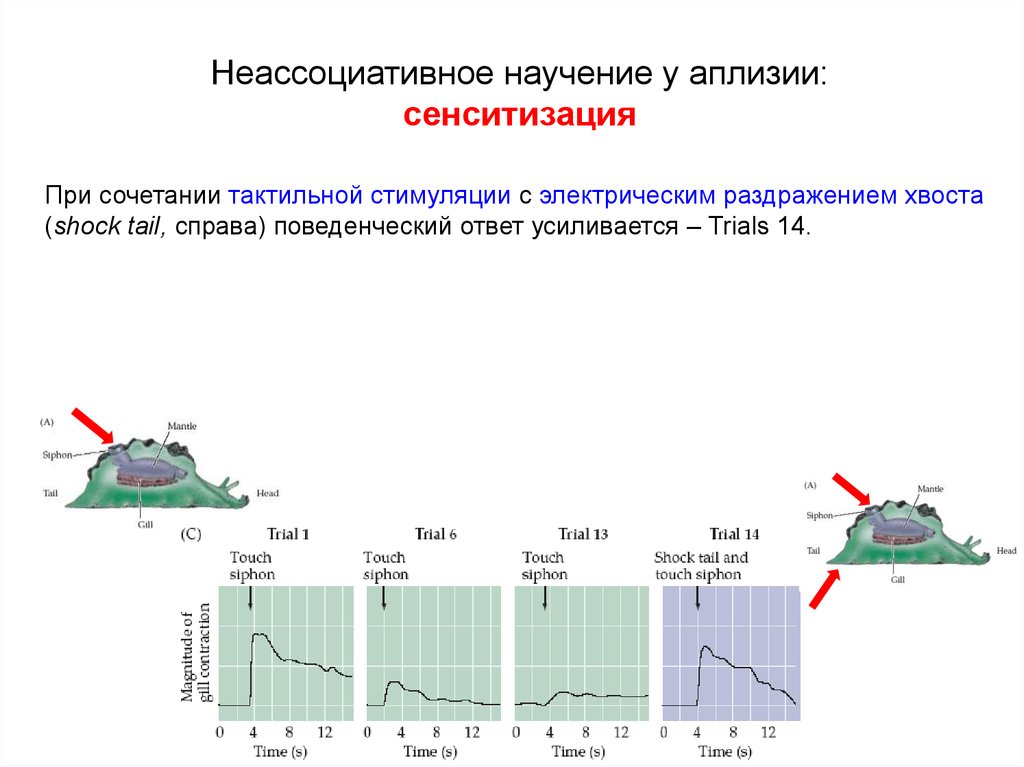
Ведущие участники — Альберто Бертаджиа , Натан Бенсон , Лаура Ритчи , Джо Этертон , Шаймаа Элдиб , Джесс Белл , Учечукву Чуквуэмека , Люсинда Хэмптон , Админ , Мишель Ли , Ким Джексон , Эван Томас , WikiSysop и Клэр Нотт
Содержимое
- 1 Центральная сенсибилизация
- 2 Зависимая от активности Центральная сенсибилизация
- 3 Центральная и периферическая сенсибилизация
- 4 Особенности центральной сенсибилизации
- 4.1 Субъективные признаки
- 4.2 Клинические признаки
- 5 Идентификация в клинических условиях
- 6 Управление центральной сенсибилизацией
- 7 Нефармакологические подходы
- 8 Фармакологические подходы
- 9 Ресурсы
- 10 Каталожные номера
Ноцицепция описывается IASP как нейронный процесс кодирования вредных раздражителей.
Центральная сенсибилизация определяется как повышенная чувствительность ноцицепторов в центральной нервной системе к нормальным или подпороговым афферентным воздействиям [1] , что приводит к:
- Повышенная чувствительность к раздражителям. [2]
- Реакция на безвредные раздражители. [3]
- Усиление болевой реакции на раздражители вне зоны повреждения, расширение рецептивного поля. [4] .
Изображение справа представляет формирование потенциала действия.
Посмотрите приведенный ниже двухминутный видеоролик о центральной сенсибилизации
Международная ассоциация по изучению боли (IASP) описывает центральную сенсибилизацию как
« Повышенная реактивность ноцицептивных нейронов центральной нервной системы на их нормальный или подпороговый афферентный вход играет роль в клеточных изменениях с очевидным увеличением как возбудимость мембраны и синаптическую активность.
Результат этого процесса:
- Рекрутирование дополнительных подпороговых синаптических входов к ноцицепции, что приводит к расширению поля восприимчивости
- Увеличен выход ноцицепции.
- Эффекты этого процесса могут сохраняться после продолжительности первоначального вредного воздействия, что приводит к гиперчувствительности боли к обычно безвредным раздражителям.
- Считается, что он влияет на: облегчение и торможение боли; ингибирование нисходящих путей [6] ; чрезмерная активация восходящих и болеутоляющих путей [7] .
- Упрощенно, это означает, что слишком много входящих сообщений и слишком мало исходящих.
[Нервный синапс, изображенный справа, представляет собой нервно-мышечное соединение (вид вблизи): 1. пресинаптический терминал; 2.сарколемма; 3.синаптические пузырьки; 4.Ацетилхолиновые рецепторы; 5.михондрион}
Использование термина «центральная сенсибилизация» зависит от
- Иногда исключительно к нейропластическим изменениям
- Иногда к сложным и множественным процессам и системам, которые способствуют изменениям в возникновении и восприятии боли [8] [9] [10] .
- Термин был впервые использован в исследовании гиперчувствительности к боли у крыс после повторных вредных раздражителей для описания использования нейронной пластичности, продемонстрированной [11] [8] . Эти центральные изменения, вызванные периферическим вредным раздражителем, были названы «зависимой от активности центральной сенсибилизацией» [2] .
Обсуждение различных описаний и определений можно найти на веб-сайте Body in MInd.
Активность Зависимая Центральная сенсибилизация[править | править источник]
Latremoliere и Woolf описывают изменения, продемонстрированные в исследовании их группы в 1983 году, как «зависимую от активности центральную сенсибилизацию».
- Описывает механизм функциональной синаптической пластичности, вызываемой в нейронах заднего рога под действием ноцицепторов [2] .
- Обнаружено, что для того, чтобы вызвать сенсибилизацию, вредные раздражители должны быть продолжительными, интенсивными и повторяться.
- Изменения можно разделить на две фазы, зависящие от времени: ранняя, короткая фаза, которая зависит от фосфорилирования/независима от транскрипции; более длительная транскрипционно-зависимая фаза [12] (транскрипция — это процесс, при котором последовательность ДНК гена копируется (транскрибируется) с образованием молекулы РНК). [13]
Активация рецептора NMDA является важным шагом в инициировании и поддержании сенсибилизации (N-метил-D-аспартат является рецептором глутамата. Глутамат является широко распространенным возбуждающим нейротрансмиттером в нервной системе).
- В нормальных условиях этот рецепторный канал блокируется ионами Mg 2+ [14] .
- Продолжительное высвобождение ноцицепторами глутамата, вещества P и CGRP приводит к деполяризации мембраны, вытесняя Mg 2+ из рецептора NMDA [14] .
- Это быстро повышает синаптическую эффективность и позволяет Ca 2+ проникать в нейрон, активируя внутриклеточные пути и поддерживая центральную сенсибилизацию [2] .

Центральная и периферическая сенсибилизация[edit | править источник]
Хотя описательно центральная сенсибилизация и периферическая сенсибилизация могут показаться сопоставимыми процессами, они представляют собой совершенно разные процессы и клинические признаки [2] .
1. Периферическая сенсибилизация описывается IASP как
«Повышение реактивности и снижение порога ноцицептивных нейронов на периферии к
стимуляции их рецептивных полей». 042Инициируется, когда периферические окончания ноцицепторов подвергаются воздействию вредных раздражителей, например медиаторов воспаления в поврежденных тканях. Продолжающаяся стимуляция приводит к снижению порога активации и, таким образом, увеличению реактивности ноцицепторов [16] . Как правило, для поддержания сенсибилизации требуется развивающаяся периферическая патология Обычно локализуется в месте повреждения [16] . Влияет на изменение ощущения тепла, но не на механическую чувствительность [2] . 2. Центральная сенсибилизация
- Новые входы рекрутируются в ноцицептивные пути, такие как крупные низкопороговые механорецепторы, классифицируемые как Aβ-волокна.
- Вызывает повышенную чувствительность в невоспаленных тканях и к прикосновению.
г [17] Особенности центральной сенсибилизации[править | править источник]
Опрос опытных клиницистов в опросе, основанном на Delphi, выявил следующие характеристики, описывающие центральную сенсибилизацию в клинических условиях [18] .
Субъективные признаки[править | изменить источник]
- Непропорциональная, немеханическая, непредсказуемая модель провокации боли в ответ на множественные/неспецифические отягчающие/ослабляющие факторы.
- Боль, сохраняющаяся после ожидаемого времени заживления тканей/патологического восстановления.
- Боль, непропорциональная характеру и степени травмы или патологии.
- Обширное, неанатомическое распространение боли.
- История неудачных вмешательств (медикаментозных/хирургических/терапевтических).
- Сильная связь с дезадаптивными психосоциальными факторами (например, негативными эмоциями, низкой самоэффективностью, дезадаптивными убеждениями и болезненным поведением, изменением семейной/рабочей/социальной жизни, медицинским конфликтом).
- Отсутствие ответа на НПВП и/или более высокий ответ на противоэпилептические (например, Лирика)/антидепрессанты (например, амитриптилин).
- Сообщения о спонтанной (т. е. независимой от раздражителя) боли и/или пароксизмальной боли (т. е. о внезапных рецидивах и усилении боли).
- Боль в сочетании с высокими уровнями функциональных нарушений.
- Более постоянная/непрекращающаяся боль.
- Ночная боль/нарушение сна.
- Боль в сочетании с другими дизестезиями (например, жжение, холод, ползание мурашек).
- Гиперпатия или боль высокой интенсивности и раздражительности (т. е. легко провоцируемая, требующая длительного времени для успокоения).
Клинические признаки[править | править источник]
- Непропорциональная, непостоянная, немеханическая/неанатомическая модель провокации боли в ответ на движение/механическое тестирование.
- Положительные результаты гипералгезии (первичной, вторичной) и/или аллодинии, и/или гиперпатии в распределении боли.
- Диффузные/неанатомические области боли/болезненности при пальпации.
- Положительная идентификация различных психосоциальных факторов (например, катастрофизация, поведение избегания страха, дистресс).
Идентификация в клинических условиях[edit | править источник]
В 2009 г. Schäfer et al. [19] предложил классификацию боли в нижней части спины, связанной с ногами, с использованием протокола обследования, который включает, во-первых, субъективную оценку, включая шкалу оценки нейропатических симптомов и признаков Лидса (LANSS) [20] , а во-вторых, физикальное обследование.
(неврологическое обследование, оценка активных движений, провокационные тесты нервной ткани). Основываясь на этой всесторонней оценке, балл LANSS ≥ 12 указывает на центральную сенсибилизацию в их алгоритме классификации.
В 2010 г. Nijs et al. [21] содержит рекомендации, помогающие распознавать центральную сенсибилизацию у пациентов с опорно-двигательным аппаратом.
В своей статье они предполагают, что медицинский диагноз пациента может дать представление о вероятности наличия центральной сенсибилизации (рис. 1), и это в сочетании с наблюдаемыми признаками (рис. 2) может сообщить терапевту о наличии центральной сенсибилизации. сенсибилизация.
рис. 1. Таблица медицинских диагнозов, которые могут свидетельствовать о наличии центральной сенсибилизации, воспроизведена из Nijs et al. [21] . Медицинская диагностика Центральная сенсибилизация является характеристикой этого расстройства. Центральная Сенсибилизация присутствует как подгруппа Хроническая боль в пояснице Х Хронические расстройства, связанные с хлыстовой травмой Х (Под)острые расстройства, связанные с хлыстовой травмой Х Височно-нижнечелюстные заболевания Х Миофасциальный болевой синдром Х Остеоартрит Х Ревматоидный артрит Х Фибромиалгия Х Синдром хронической усталости Х Хроническая головная боль Х Синдром раздраженного кишечника Х
Симптом Характеристика центральной сенсибилизации Может быть связано с центральной сенсибилизацией Гиперчувствительность к яркому свету Х Повышенная чувствительность к прикосновению Х Гиперчувствительность к шуму Х Повышенная чувствительность к пестицидам Х Повышенная чувствительность к механическому давлению Х Повышенная чувствительность к лекарствам Х Повышенная чувствительность к температуре (высокой или низкой) Х Усталость Х Нарушения сна Х Неосвежающий сон Х Проблемы с концентрацией внимания Х Ощущение отека (например, в конечностях) Х Покалывание Х Онемение Х В 2012 г.
Mayer et al. [22] предложил Центральный реестр сенсибилизации (CSI). Клиническая цель этого скринингового инструмента состоит в том, чтобы помочь лучше оценить симптомы, которые, как считается, связаны с КС, чтобы помочь врачам и другим клиницистам в категоризации синдрома, чувствительности, идентификации тяжести и планировании лечения, чтобы помочь минимизировать или, возможно, избежать ненужной диагностики. и лечебные процедуры. CSI продемонстрировал хорошую психометрическую силу, клиническую полезность и валидность исходной конструкции.
Управление центральной сенсибилизации[править | править исходный код]
Центральная сенсибилизация характеризуется отсутствием периферических источников ноцицептивного входа, поэтому представляется более целесообразным использовать лечение по механизму «сверху вниз», активируя нисходящую ноцицептивную обработку вместе с уменьшением нисходящей ноцицептивной фасилитации [23] .
В видеоролике ниже профессор Питер О’Салливан обсуждает некоторые широко распространенные мифы о боли в спине, которые негативно влияют на восприятие и лечение боли в спине.
[24] Немедикаментозные подходы[править | править источник]
1.Обучение пациентов
В случаях центральной сенсибилизации важно:
- изменение дезадаптивного восприятия болезни,
- изменить дезадаптивное восприятие боли,
- переосмыслить боль.
Этого можно достичь с помощью обучения физиологии боли, которое показано, когда:
- клиническая картина характеризуется преобладанием центральной сенсибилизации;
Присутствует- неадекватных восприятия болезни.
Очные занятия по физиологии боли в сочетании с письменными учебными материалами эффективны для изменения восприятия боли и улучшения состояния здоровья у пациентов с различными хроническими скелетно-мышечными болями (т.
и синдром хронической усталости) [25] .
Посмотрите следующее видео от Лоримера Мозли, чтобы увидеть его подход к обучению пациентов тому, как справляться с болью. [26]
[27]
2. Мануальная терапия
Обычно мануальная терапия используется из-за ее периферических эффектов, однако она также оказывает центральное обезболивающее действие [28] [29] [30] активируя нисходящие антиноцицептивные пути на короткий период времени (30 — 35 мин.) [31] [32] . Это ограничивает его клиническое применение при лечении центральной сенсибилизации.
- Некоторые предполагают, что повторные сеансы мануальной терапии могут привести к длительной активации нисходящих антиноцицептивных путей, но доказательств этого механизма пока нет [23] .
- Наоборот, мануальная терапия может также добавить периферические ноцицептивные входы, тем самым ухудшив состояние [23] .
- Поэтому мануальную терапию следует проводить осторожно.
3. Транскраниальная магнитная стимуляция
Повторяющаяся транскраниальная магнитная стимуляция более эффективна для подавления центральных, чем периферических болевых состояний [33] . Он обеспечивает кратковременный обезболивающий эффект за счет стимуляции моторной коры или дорсолатеральной префронтальной коры у пациентов с различными типами хронической боли [33] [34] [35] . Однако точный механизм действия до сих пор не ясен, а клиническая полезность метода ограничена практическими препятствиями (слишком короткий обезболивающий эффект, доступность оборудования, ограниченная несколькими специализированными центрами) [23] .
Фармакологические подходы[править | править источник]
Различные фармакологические методы лечения были опробованы у пациентов с невропатической болью, включая состояния, которые, как известно, включают центральную сенсибилизацию.
Однако некоторые из этих методов лечения все еще находятся на стадии изучения и не получили широкого клинического применения.
- Фармакологические средства, такие как нестероидные противовоспалительные препараты и коксибы, обладают периферическим действием и поэтому не подходят для лечения центральной сенсибилизации у пациентов с хронической болью [36] .
Часто используемые препараты для лечения центральной сенсибилизации включают [23] :
- Ацетаминофен (парацетамол) — в первую очередь действует централизованно, усиливая нисходящие пути торможения. Кроме того, он может оказывать ингибирующее действие на фермент циклооксигеназу в ЦНС
.- Ингибиторы обратного захвата серотонина и норадреналина — активируют норадренергические нисходящие пути вместе с серотонинергическими путями
- Опиоиды — активация опиоидных рецепторов оказывает тормозящее действие, включая пресинаптическое торможение первичных ноцицептивных афферентов и постсинаптическое торможение проецирующих нейронов
- Блокаторы N-метил-D-аспартатных рецепторов (например, кетамин) — блокада возбуждения антагонистами NMDA-рецепторов может ограничивать или уменьшать распространение гипералгезии и аллодинии вследствие сенсибилизации, и, как следствие, антагонисты NMDA-рецепторов могут наблюдаться преимущественно в качестве антигипералгетических или антиаллодинических средств, а не в качестве традиционных анальгетиков
- Габапентин/прегабалин (альфа(2)дельта-лиганды кальциевых каналов) — связываются с субъединицей альфа(2)дельта (a2d) потенциалзависимых Са2+-каналов, которые поддерживают повышенное высвобождение трансмиттеров боли в синапсах между первичными афферентными волокна и чувствительные нейроны второго порядка в условиях хронической боли
- Трамадол — Препарат центрального действия, вызывающий антиноцицепцию у животных и анальгезию у людей.
- «Как объяснить центральную сенсибилизацию пациентам с «необъяснимой» хронической мышечно-скелетной болью: практическое руководство» — статью в открытом доступе можно найти здесь.
- ↑ Лоу А., Нийс Дж., Пуэнтедура Э.Дж. Клиническая перспектива образовательного подхода нейробиологии боли к мануальной терапии. Джей Ман Манип Тер. 2017; 25(3): 160-168.
- ↑ 2.0 2.1 2.2 2.3 2.4 2.5 Вулф С.Дж., Латремольер А. Централ Сенс итизация: Генератор болевой гиперчувствительности за счет пластичности центральной нервной системы. Журнал боли 2009; 10(9):895-926
- ↑ Loeser JD, Treede RD. Киотский протокол базовой терминологии боли IASP. Боль 2008; 137: 473–7.
- ↑ Дхал Дж. Б., Кехлет Х. Послеоперационная боль и ее лечение. В: McMahon SB, Koltzenburg M, редакторы. Уолл и Учебник боли Мелзака. Эльзевир Черчилль Ливингстон; 2006. стр. 635-51.
- ↑ Международная ассоциация изучения боли.
Терминология МАСП. Доступно по адресу: https://www.iasp-pain.org/Education/Content.aspx?ItemNumber=1698#Sensitization. [По состоянию на 19 июля 2020 г.]
- ↑ Meeus M, Nijs J, Van der Wauwer N, Toeback L, Truijen S. Диффузный вредный тормозной контроль задерживается при синдроме хронической усталости: экспериментальное исследование. Боль 2008;139:439-48
- ↑ Meeus M, Nijs J. Центральная сенсибилизация: биопсихосоциальное объяснение хронической распространенной боли у пациентов с фибромиалгией и синдромом хронической усталости. Клиническая ревматология 2007; 26:465-73
- ↑ 8.0 8.1 Вульф CJ. Как назвать усиление ноцицептивных сигналов в ЦНС, способствующих распространенной боли? Боль 2014. Статья в прессе.
- ↑ Ханссон П. ПЕЙН 2014. http://dx.doi.org/10.1016/j.pain.2014.07.016. номер: S0304-3959(14)00335-2
- ↑ Тело в разуме. Все, что вы хотели знать о CENTRAL SENSITIZATION http://www.bodyinmind.org/central-sensitisation/ (по состоянию на 10 июня 2014 г.
)
- ↑ Woolf CJ. Доказательства центрального компонента посттравматической гиперчувствительности к боли. Природа 1983;306;686-688.
- ↑ Вульф CJ, Saltar MW. Нейрональная пластичность: увеличение усиления боли. Наука 2000;288:1765-69.
- ↑ Khan academy: стадии транскрипции. последний доступ 1.6.2020)
- ↑ 14,0 14,1 Майер М.Л., Вестброк Г.Л., Гатри, П.Б. Зависимая от напряжения блокировка Mg2+ ответов NMDA в нейронах спинного мозга. Природа 1984;309:261-263.
- ↑ Международная ассоциация изучения боли. Термины боли: текущий список с определениями и примечаниями по использованию. http://iasp.files.cms-plus.com/Content/ContentFolders/Publications2/ClassificationofChronicPain/Part_III-PainTerms.pdf (по состоянию на 12 июля 2014 г.
- ↑ 16,0 16,1 Хучо Т., Левин Д.Д. Сигнальные пути при сенсибилизации: к биологии ноцицепторных клеток. Нейрон 2007; 55:365-376
- ↑ Дэнни Орчард.
Периферическая и центральная сенсибилизация. Доступно по адресу: http://www.youtube.com/watch?v=YwDMmSwUOOU [последнее обращение 22 ноября 2015 г.]
- ↑ Smart KM, Blake C, Staines A, Doody C. Клинические показатели «ноцицептивной», «периферической невропатической» и «центральной сенсибилизации» как механизмов, основанных на классификации мышечно-скелетной боли. Опрос экспертов-клиницистов Delphi. Мануальная терапия 2010;15:80-7
- ↑ Шефер А., Холл Т., Бриффа К. Классификация боли в нижней части спины в ногах — предлагаемый подход, основанный на патомеханизме. Мануальная терапия. 1 апреля 2009 г .; 14 (2): 222–30.
- ↑ Беннетт М. Шкала боли LANSS: оценка симптомов и признаков невропатии по Лидсу. Боль. 2001 г., май; 92 (1-2): 147–57.
- ↑ 21.0 21.1 Нийс Дж., Ван Хоуденхове Б., Остендорп РАБ. Распознавание центральной сенсибилизации у пациентов со скелетно-мышечной болью: применение нейрофизиологии боли в практике мануальной терапии.
Мануальная терапия 2010;15:135-41
- ↑ Mayer TG, Neblett R, Cohen H, Howard KJ, Choi YH, Williams MJ, et al. Разработка и психометрическая проверка центральной инвентаризации сенсибилизации (CSI). Практика боли. 2012 апр; 12 (4): 276–85.
- ↑ 23,0 23,1 23,2 23,3 23,4 Нийс Дж., Миус М., Ван Остервейк Дж., Руссель Н., Де Кунинг М. , Икманс К. и др. Лечение центральной сенсибилизации у пациентов с «необъяснимой» хронической болью: какие у нас есть варианты? Эксперт Опин Фармаколог. 2011 г., май; 12 (7): 1087–1089.8.
- ↑ Pain-Ed.com. Профессор Питер О’Салливан — Боль в спине — отделяющая факты от вымысла. Доступно по адресу: http://www.youtube.com/watch?v=dlSQLUE4brQ[последний доступ 22 ноября 2015 г.]
- ↑ Nijs J, Wilgen CP van, Oosterwijck JV, Ittersum M van, Meeus M. Как объяснить центральную сенсибилизацию пациентам с «необъяснимой» хронической мышечно-скелетной болью: практические рекомендации.
Мануальная терапия. 2011 1 октября; 16 (5): 413–8.
- ↑ Мозли Л. Приручить зверя. Доступно по адресу https://www.tamethebeast.org/#tame-the-beast (по состоянию на 2 марта 2020 г.).
- ↑ Лоример Мозли. Приручить зверя. Доступно по адресу https://www.youtube.com/watch?time_continue=295&v=ikUzvSph7Z4&feature=emb_logo [последний доступ 03.09.2020].
- ↑ Vicenzino B, Collins D, Wright A. Начальные эффекты мануального физиотерапевтического лечения шейного отдела позвоночника на боль и дисфункцию латеральной эпикондилагии. Боль. 1996 г., ноябрь; 68 (1): 69–74.
- ↑ Bialosky JE, Bishop MD, Robinson ME, Zeppieri G, George SZ. Мануальная терапия позвоночника оказывает непосредственное влияние на чувствительность к термической боли у людей с болью в пояснице: рандомизированное контролируемое исследование. физ. тер. 2009 г.Декабрь; 89 (12): 1292–303.
- ↑ Bialosky JE, Bishop MD, Robinson ME, Barabas JA, George SZ. Влияние ожидания на гипоалгезию, вызванную манипулированием позвоночником: экспериментальное исследование на нормальных субъектах.
BMC Расстройство опорно-двигательного аппарата. 2008; 9:19.
- ↑ Мосс П., Слука К., Райт А. Начальные эффекты мобилизации коленного сустава на гипералгезию при остеоартрите. Мужчина Тер. 2007 г., май; 12 (2): 109–18.
- ↑ Слука К.А., Скиба Д.А., Радхакришнан Р., Липер Б.Дж., Райт А. Мобилизация суставов уменьшает гипералгезию, связанную с хроническим воспалением мышц и суставов у крыс. Джей Пейн. 2006 г., август; 7 (8): 602–7.
- ↑ 33,0 33,1 Леунг А., Донохью М., Сюй Р., Ли Р., Лефошёр Дж.-П., Хедр Э.М. и др. рТМС для подавления нейропатической боли: метаанализ. Джей Пейн. 2009 г., декабрь; 10 (12): 1205–16.
- ↑ Лео Р.Дж., Латиф Т. Повторяющаяся транскраниальная магнитная стимуляция (рТМС) при экспериментально индуцированной и хронической невропатической боли: обзор. Джей Пейн. 2007 г., июнь; 8 (6): 453–9.
- ↑ Lefaucheur JP. Использование повторяющейся транскраниальной магнитной стимуляции (рТМС) при хронической нейропатической боли.
Нейрофизиол клин. 2006 г., июнь; 36 (3): 117–24.
- ↑ Косек Э. Медикаментозное лечение боли. Глава 12. В: Слука К. Механизмы и управление болью для физиотерапевта. IASP Press, Сиэтл; 2009. п. 231-55
Центральная сенсибилизация — Physiopedia
Исходный редактор — Натан Бенсон в рамках проекта PPA Pain.
Ведущие участники — Альберто Бертаджиа , Натан Бенсон , Лаура Ритчи , Джо Этертон , Шаймаа Элдиб , Джесс Белл , Учечукву Чуквумека , Люсинда Хэмптон , Админ , Мишель Ли , Ким Джексон , 9 0009 Эван Томас , WikiSysop и Клэр Нотт
Содержимое
- 1 Центральная сенсибилизация
- 2 Зависимая от активности Центральная сенсибилизация
- 3 Центральная и периферическая сенсибилизация
- 4 Особенности центральной сенсибилизации
- 4.
1 Субъективные признаки
- 4.2 Клинические признаки
- 5 Идентификация в клинических условиях
- 6 Управление центральной сенсибилизацией
- 7 Нефармакологические подходы
- 8 Фармакологические подходы
- 9 Ресурсы
- 10 Каталожные номера
Ноцицепция описывается IASP как нейронный процесс кодирования вредных раздражителей.
Центральная сенсибилизация определяется как повышенная чувствительность ноцицепторов в центральной нервной системе к нормальным или подпороговым афферентным воздействиям [1] в результате:
- Повышенная чувствительность к раздражителям. [2]
- Реакция на безвредные раздражители. [3]
- Усиление болевой реакции на раздражители вне зоны повреждения, расширение рецептивного поля. [4] .
Изображение справа представляет формирование потенциала действия.
Посмотрите приведенный ниже двухминутный видеоролик о центральной сенсибилизации
youtube.com/embed/uGAbimO2wVg?» frameborder=»0″ allowfullscreen=»true»>Международная ассоциация изучения боли (IASP) описывает центральную сенсибилизацию как
« Повышенная чувствительность ноцицептивных нейронов в центральной нервной системе к их нормальному или подпороговому афферентному входу » [5]
9011 0
Нейронная пластичность играет роль в клеточные изменения с очевидным увеличением как возбудимости мембраны, так и синаптической эффективности.Результат этого процесса:
- Рекрутирование дополнительных подпороговых синаптических входов к ноцицепции, что приводит к расширению поля восприимчивости
- Увеличен выход ноцицепции.
- Эффекты этого процесса могут сохраняться после продолжительности первоначального вредного воздействия, что приводит к гиперчувствительности боли к обычно безвредным раздражителям.
- Считается, что он влияет на: облегчение и торможение боли; ингибирование нисходящих путей [6] ; чрезмерная активация восходящих и болеутоляющих путей [7] .
- Упрощенно, это означает, что слишком много входящих сообщений и слишком мало исходящих.
[Нервный синапс, изображенный справа, представляет собой нервно-мышечное соединение (вид вблизи): 1. пресинаптический терминал; 2.сарколемма; 3.синаптические пузырьки; 4.Ацетилхолиновые рецепторы; 5.михондрион}
Использование термина «центральная сенсибилизация» зависит от
- Иногда исключительно к нейропластическим изменениям
- Иногда к сложным и множественным процессам и системам, которые способствуют изменениям в возникновении и восприятии боли [8] [9] [10] .
- Термин был впервые использован в исследовании гиперчувствительности к боли у крыс после повторных вредных раздражителей для описания использования нейронной пластичности, продемонстрированной [11] [8] . Эти центральные изменения, вызванные периферическим вредным раздражителем, были названы «зависимой от активности центральной сенсибилизацией» [2] .
Обсуждение различных описаний и определений можно найти на веб-сайте Body in MInd.
Активность Зависимая Центральная сенсибилизация[править | править источник]
Latremoliere и Woolf описывают изменения, продемонстрированные в исследовании их группы в 1983 году, как «зависимую от активности центральную сенсибилизацию».
- Описывает механизм функциональной синаптической пластичности, вызываемой в нейронах заднего рога под действием ноцицепторов [2] .
- Обнаружено, что для того, чтобы вызвать сенсибилизацию, вредные раздражители должны быть продолжительными, интенсивными и повторяться.
- Изменения можно разделить на две фазы, зависящие от времени: ранняя, короткая фаза, которая зависит от фосфорилирования/независима от транскрипции; более длительная транскрипционно-зависимая фаза [12] (транскрипция — это процесс, при котором последовательность ДНК гена копируется (транскрибируется) с образованием молекулы РНК).
[13]
Активация рецептора NMDA является важным шагом в инициировании и поддержании сенсибилизации (N-метил-D-аспартат является рецептором глутамата. Глутамат является широко распространенным возбуждающим нейротрансмиттером в нервной системе).
- В нормальных условиях этот рецепторный канал блокируется ионами Mg 2+ [14] .
- Продолжительное высвобождение ноцицепторами глутамата, вещества P и CGRP приводит к деполяризации мембраны, вытесняя Mg 2+ из рецептора NMDA [14] .
- Это быстро повышает синаптическую эффективность и позволяет Ca 2+ проникать в нейрон, активируя внутриклеточные пути и поддерживая центральную сенсибилизацию [2] .
Центральная и периферическая сенсибилизация[edit | править источник]
Хотя описательно центральная сенсибилизация и периферическая сенсибилизация могут показаться сопоставимыми процессами, они представляют собой совершенно разные процессы и клинические признаки [2] .
1. Периферическая сенсибилизация описывается IASP как
«Повышение реактивности и снижение порога ноцицептивных нейронов на периферии к
стимуляции их рецептивных полей». 042Инициируется, когда периферические окончания ноцицепторов подвергаются воздействию вредных раздражителей, например медиаторов воспаления в поврежденных тканях. Продолжающаяся стимуляция приводит к снижению порога активации и, таким образом, увеличению реактивности ноцицепторов [16] . Как правило, для поддержания сенсибилизации требуется развивающаяся периферическая патология Обычно локализуется в месте повреждения [16] . Влияет на изменение ощущения тепла, но не на механическую чувствительность [2] . 2. Центральная сенсибилизация
- Новые входы рекрутируются в ноцицептивные пути, такие как крупные низкопороговые механорецепторы, классифицируемые как Aβ-волокна.
- Вызывает повышенную чувствительность в невоспаленных тканях и к прикосновению.

г [17] Особенности центральной сенсибилизации[править | править источник]
Опрос опытных клиницистов в опросе, основанном на Delphi, выявил следующие характеристики, описывающие центральную сенсибилизацию в клинических условиях [18] .
Субъективные признаки[править | изменить источник]
- Непропорциональная, немеханическая, непредсказуемая модель провокации боли в ответ на множественные/неспецифические отягчающие/ослабляющие факторы.
- Боль, сохраняющаяся после ожидаемого времени заживления тканей/патологического восстановления.
- Боль, непропорциональная характеру и степени травмы или патологии.
- Обширное, неанатомическое распространение боли.
- История неудачных вмешательств (медикаментозных/хирургических/терапевтических).
- Сильная связь с дезадаптивными психосоциальными факторами (например, негативными эмоциями, низкой самоэффективностью, дезадаптивными убеждениями и болезненным поведением, изменением семейной/рабочей/социальной жизни, медицинским конфликтом).
- Отсутствие ответа на НПВП и/или более высокий ответ на противоэпилептические (например, Лирика)/антидепрессанты (например, амитриптилин).
- Сообщения о спонтанной (т. е. независимой от раздражителя) боли и/или пароксизмальной боли (т. е. о внезапных рецидивах и усилении боли).
- Боль в сочетании с высокими уровнями функциональных нарушений.
- Более постоянная/непрекращающаяся боль.
- Ночная боль/нарушение сна.
- Боль в сочетании с другими дизестезиями (например, жжение, холод, ползание мурашек).
- Гиперпатия или боль высокой интенсивности и раздражительности (т. е. легко провоцируемая, требующая длительного времени для успокоения).
Клинические признаки[править | править источник]
- Непропорциональная, непостоянная, немеханическая/неанатомическая модель провокации боли в ответ на движение/механическое тестирование.
- Положительные результаты гипералгезии (первичной, вторичной) и/или аллодинии, и/или гиперпатии в распределении боли.
- Диффузные/неанатомические области боли/болезненности при пальпации.
- Положительная идентификация различных психосоциальных факторов (например, катастрофизация, поведение избегания страха, дистресс).
Идентификация в клинических условиях[edit | править источник]
В 2009 г. Schäfer et al. [19] предложил классификацию боли в нижней части спины, связанной с ногами, с использованием протокола обследования, который включает, во-первых, субъективную оценку, включая шкалу оценки нейропатических симптомов и признаков Лидса (LANSS) [20] , а во-вторых, физикальное обследование. (неврологическое обследование, оценка активных движений, провокационные тесты нервной ткани). Основываясь на этой всесторонней оценке, балл LANSS ≥ 12 указывает на центральную сенсибилизацию в их алгоритме классификации.

В 2010 г. Nijs et al. [21] содержит рекомендации, помогающие распознавать центральную сенсибилизацию у пациентов с опорно-двигательным аппаратом.
В своей статье они предполагают, что медицинский диагноз пациента может дать представление о вероятности наличия центральной сенсибилизации (рис. 1), и это в сочетании с наблюдаемыми признаками (рис. 2) может сообщить терапевту о наличии центральной сенсибилизации. сенсибилизация.
рис. 1. Таблица медицинских диагнозов, которые могут свидетельствовать о наличии центральной сенсибилизации, воспроизведена из Nijs et al. [21] . Медицинская диагностика Центральная сенсибилизация является характеристикой этого расстройства. Центральная Сенсибилизация присутствует как подгруппа Хроническая боль в пояснице Х Хронические расстройства, связанные с хлыстовой травмой Х (Под)острые расстройства, связанные с хлыстовой травмой Х Височно-нижнечелюстные заболевания Х Миофасциальный болевой синдром Х Остеоартрит Х Ревматоидный артрит Х Фибромиалгия Х Синдром хронической усталости Х Хроническая головная боль Х Синдром раздраженного кишечника Х
Симптом Характеристика центральной сенсибилизации Может быть связано с центральной сенсибилизацией Гиперчувствительность к яркому свету Х Повышенная чувствительность к прикосновению Х Гиперчувствительность к шуму Х Повышенная чувствительность к пестицидам Х Повышенная чувствительность к механическому давлению Х Повышенная чувствительность к лекарствам Х Повышенная чувствительность к температуре (высокой или низкой) Х Усталость Х Нарушения сна Х Неосвежающий сон Х Проблемы с концентрацией внимания Х Ощущение отека (например, в конечностях) Х Покалывание Х Онемение Х В 2012 г.
Mayer et al. [22] предложил Центральный реестр сенсибилизации (CSI). Клиническая цель этого скринингового инструмента состоит в том, чтобы помочь лучше оценить симптомы, которые, как считается, связаны с КС, чтобы помочь врачам и другим клиницистам в категоризации синдрома, чувствительности, идентификации тяжести и планировании лечения, чтобы помочь минимизировать или, возможно, избежать ненужной диагностики. и лечебные процедуры. CSI продемонстрировал хорошую психометрическую силу, клиническую полезность и валидность исходной конструкции.
Управление центральной сенсибилизации[править | править исходный код]
Центральная сенсибилизация характеризуется отсутствием периферических источников ноцицептивного входа, поэтому представляется более целесообразным использовать лечение по механизму «сверху вниз», активируя нисходящую ноцицептивную обработку вместе с уменьшением нисходящей ноцицептивной фасилитации [23] .
В видеоролике ниже профессор Питер О’Салливан обсуждает некоторые широко распространенные мифы о боли в спине, которые негативно влияют на восприятие и лечение боли в спине.
[24] Немедикаментозные подходы[править | править источник]
1.Обучение пациентов
В случаях центральной сенсибилизации важно:
- изменение дезадаптивного восприятия болезни,
- изменить дезадаптивное восприятие боли,
- переосмыслить боль.
Этого можно достичь с помощью обучения физиологии боли, которое показано, когда:
- клиническая картина характеризуется преобладанием центральной сенсибилизации;
Присутствует- неадекватных восприятия болезни.
Очные занятия по физиологии боли в сочетании с письменными учебными материалами эффективны для изменения восприятия боли и улучшения состояния здоровья у пациентов с различными хроническими скелетно-мышечными болями (т.
и синдром хронической усталости) [25] .
Посмотрите следующее видео от Лоримера Мозли, чтобы увидеть его подход к обучению пациентов тому, как справляться с болью. [26]
[27]
2. Мануальная терапия
Обычно мануальная терапия используется из-за ее периферических эффектов, однако она также оказывает центральное обезболивающее действие [28] [29] [30] активируя нисходящие антиноцицептивные пути на короткий период времени (30 — 35 мин.) [31] [32] . Это ограничивает его клиническое применение при лечении центральной сенсибилизации.
- Некоторые предполагают, что повторные сеансы мануальной терапии могут привести к длительной активации нисходящих антиноцицептивных путей, но доказательств этого механизма пока нет [23] .
- Наоборот, мануальная терапия может также добавить периферические ноцицептивные входы, тем самым ухудшив состояние [23] .
- Поэтому мануальную терапию следует проводить осторожно.
3. Транскраниальная магнитная стимуляция
Повторяющаяся транскраниальная магнитная стимуляция более эффективна для подавления центральных, чем периферических болевых состояний [33] . Он обеспечивает кратковременный обезболивающий эффект за счет стимуляции моторной коры или дорсолатеральной префронтальной коры у пациентов с различными типами хронической боли [33] [34] [35] . Однако точный механизм действия до сих пор не ясен, а клиническая полезность метода ограничена практическими препятствиями (слишком короткий обезболивающий эффект, доступность оборудования, ограниченная несколькими специализированными центрами) [23] .
Фармакологические подходы[править | править источник]
Различные фармакологические методы лечения были опробованы у пациентов с невропатической болью, включая состояния, которые, как известно, включают центральную сенсибилизацию.
Однако некоторые из этих методов лечения все еще находятся на стадии изучения и не получили широкого клинического применения.
- Фармакологические средства, такие как нестероидные противовоспалительные препараты и коксибы, обладают периферическим действием и поэтому не подходят для лечения центральной сенсибилизации у пациентов с хронической болью [36] .
Часто используемые препараты для лечения центральной сенсибилизации включают [23] :
- Ацетаминофен (парацетамол) — в первую очередь действует централизованно, усиливая нисходящие пути торможения. Кроме того, он может оказывать ингибирующее действие на фермент циклооксигеназу в ЦНС
.- Ингибиторы обратного захвата серотонина и норадреналина — активируют норадренергические нисходящие пути вместе с серотонинергическими путями
- Опиоиды — активация опиоидных рецепторов оказывает тормозящее действие, включая пресинаптическое торможение первичных ноцицептивных афферентов и постсинаптическое торможение проецирующих нейронов
- Блокаторы N-метил-D-аспартатных рецепторов (например, кетамин) — блокада возбуждения антагонистами NMDA-рецепторов может ограничивать или уменьшать распространение гипералгезии и аллодинии вследствие сенсибилизации, и, как следствие, антагонисты NMDA-рецепторов могут наблюдаться преимущественно в качестве антигипералгетических или антиаллодинических средств, а не в качестве традиционных анальгетиков
- Габапентин/прегабалин (альфа(2)дельта-лиганды кальциевых каналов) — связываются с субъединицей альфа(2)дельта (a2d) потенциалзависимых Са2+-каналов, которые поддерживают повышенное высвобождение трансмиттеров боли в синапсах между первичными афферентными волокна и чувствительные нейроны второго порядка в условиях хронической боли
- Трамадол — Препарат центрального действия, вызывающий антиноцицепцию у животных и анальгезию у людей.
- «Как объяснить центральную сенсибилизацию пациентам с «необъяснимой» хронической мышечно-скелетной болью: практическое руководство» — статью в открытом доступе можно найти здесь.
- ↑ Лоу А., Нийс Дж., Пуэнтедура Э.Дж. Клиническая перспектива образовательного подхода нейробиологии боли к мануальной терапии. Джей Ман Манип Тер. 2017; 25(3): 160-168.
- ↑ 2.0 2.1 2.2 2.3 2.4 2.5 Вулф С.Дж., Латремольер А. Централ Сенс итизация: Генератор болевой гиперчувствительности за счет пластичности центральной нервной системы. Журнал боли 2009; 10(9):895-926
- ↑ Loeser JD, Treede RD. Киотский протокол базовой терминологии боли IASP. Боль 2008; 137: 473–7.
- ↑ Дхал Дж. Б., Кехлет Х. Послеоперационная боль и ее лечение. В: McMahon SB, Koltzenburg M, редакторы. Уолл и Учебник боли Мелзака. Эльзевир Черчилль Ливингстон; 2006. стр. 635-51.
- ↑ Международная ассоциация изучения боли.
Терминология МАСП. Доступно по адресу: https://www.iasp-pain.org/Education/Content.aspx?ItemNumber=1698#Sensitization. [По состоянию на 19 июля 2020 г.]
- ↑ Meeus M, Nijs J, Van der Wauwer N, Toeback L, Truijen S. Диффузный вредный тормозной контроль задерживается при синдроме хронической усталости: экспериментальное исследование. Боль 2008;139:439-48
- ↑ Meeus M, Nijs J. Центральная сенсибилизация: биопсихосоциальное объяснение хронической распространенной боли у пациентов с фибромиалгией и синдромом хронической усталости. Клиническая ревматология 2007; 26:465-73
- ↑ 8.0 8.1 Вульф CJ. Как назвать усиление ноцицептивных сигналов в ЦНС, способствующих распространенной боли? Боль 2014. Статья в прессе.
- ↑ Ханссон П. ПЕЙН 2014. http://dx.doi.org/10.1016/j.pain.2014.07.016. номер: S0304-3959(14)00335-2
- ↑ Тело в разуме. Все, что вы хотели знать о CENTRAL SENSITIZATION http://www.bodyinmind.org/central-sensitisation/ (по состоянию на 10 июня 2014 г.
)
- ↑ Woolf CJ. Доказательства центрального компонента посттравматической гиперчувствительности к боли. Природа 1983;306;686-688.
- ↑ Вульф CJ, Saltar MW. Нейрональная пластичность: увеличение усиления боли. Наука 2000;288:1765-69.
- ↑ Khan academy: стадии транскрипции. последний доступ 1.6.2020)
- ↑ 14,0 14,1 Майер М.Л., Вестброк Г.Л., Гатри, П.Б. Зависимая от напряжения блокировка Mg2+ ответов NMDA в нейронах спинного мозга. Природа 1984;309:261-263.
- ↑ Международная ассоциация изучения боли. Термины боли: текущий список с определениями и примечаниями по использованию. http://iasp.files.cms-plus.com/Content/ContentFolders/Publications2/ClassificationofChronicPain/Part_III-PainTerms.pdf (по состоянию на 12 июля 2014 г.
- ↑ 16,0 16,1 Хучо Т., Левин Д.Д. Сигнальные пути при сенсибилизации: к биологии ноцицепторных клеток. Нейрон 2007; 55:365-376
- ↑ Дэнни Орчард.
Периферическая и центральная сенсибилизация. Доступно по адресу: http://www.youtube.com/watch?v=YwDMmSwUOOU [последнее обращение 22 ноября 2015 г.]
- ↑ Smart KM, Blake C, Staines A, Doody C. Клинические показатели «ноцицептивной», «периферической невропатической» и «центральной сенсибилизации» как механизмов, основанных на классификации мышечно-скелетной боли. Опрос экспертов-клиницистов Delphi. Мануальная терапия 2010;15:80-7
- ↑ Шефер А., Холл Т., Бриффа К. Классификация боли в нижней части спины в ногах — предлагаемый подход, основанный на патомеханизме. Мануальная терапия. 1 апреля 2009 г .; 14 (2): 222–30.
- ↑ Беннетт М. Шкала боли LANSS: оценка симптомов и признаков невропатии по Лидсу. Боль. 2001 г., май; 92 (1-2): 147–57.
- ↑ 21.0 21.1 Нийс Дж., Ван Хоуденхове Б., Остендорп РАБ. Распознавание центральной сенсибилизации у пациентов со скелетно-мышечной болью: применение нейрофизиологии боли в практике мануальной терапии.
Мануальная терапия 2010;15:135-41
- ↑ Mayer TG, Neblett R, Cohen H, Howard KJ, Choi YH, Williams MJ, et al. Разработка и психометрическая проверка центральной инвентаризации сенсибилизации (CSI). Практика боли. 2012 апр; 12 (4): 276–85.
- ↑ 23,0 23,1 23,2 23,3 23,4 Нийс Дж., Миус М., Ван Остервейк Дж., Руссель Н., Де Кунинг М. , Икманс К. и др. Лечение центральной сенсибилизации у пациентов с «необъяснимой» хронической болью: какие у нас есть варианты? Эксперт Опин Фармаколог. 2011 г., май; 12 (7): 1087–1089.8.
- ↑ Pain-Ed.com. Профессор Питер О’Салливан — Боль в спине — отделяющая факты от вымысла. Доступно по адресу: http://www.youtube.com/watch?v=dlSQLUE4brQ[последний доступ 22 ноября 2015 г.]
- ↑ Nijs J, Wilgen CP van, Oosterwijck JV, Ittersum M van, Meeus M. Как объяснить центральную сенсибилизацию пациентам с «необъяснимой» хронической мышечно-скелетной болью: практические рекомендации.
Мануальная терапия. 2011 1 октября; 16 (5): 413–8.
- ↑ Мозли Л. Приручить зверя. Доступно по адресу https://www.tamethebeast.org/#tame-the-beast (по состоянию на 2 марта 2020 г.).
- ↑ Лоример Мозли. Приручить зверя. Доступно по адресу https://www.youtube.com/watch?time_continue=295&v=ikUzvSph7Z4&feature=emb_logo [последний доступ 03.09.2020].
- ↑ Vicenzino B, Collins D, Wright A. Начальные эффекты мануального физиотерапевтического лечения шейного отдела позвоночника на боль и дисфункцию латеральной эпикондилагии. Боль. 1996 г., ноябрь; 68 (1): 69–74.
- ↑ Bialosky JE, Bishop MD, Robinson ME, Zeppieri G, George SZ. Мануальная терапия позвоночника оказывает непосредственное влияние на чувствительность к термической боли у людей с болью в пояснице: рандомизированное контролируемое исследование. физ. тер. 2009 г.Декабрь; 89 (12): 1292–303.
- ↑ Bialosky JE, Bishop MD, Robinson ME, Barabas JA, George SZ. Влияние ожидания на гипоалгезию, вызванную манипулированием позвоночником: экспериментальное исследование на нормальных субъектах.
BMC Расстройство опорно-двигательного аппарата. 2008; 9:19.
- ↑ Мосс П., Слука К., Райт А. Начальные эффекты мобилизации коленного сустава на гипералгезию при остеоартрите. Мужчина Тер. 2007 г., май; 12 (2): 109–18.
- ↑ Слука К.А., Скиба Д.А., Радхакришнан Р., Липер Б.Дж., Райт А. Мобилизация суставов уменьшает гипералгезию, связанную с хроническим воспалением мышц и суставов у крыс. Джей Пейн. 2006 г., август; 7 (8): 602–7.
- ↑ 33,0 33,1 Леунг А., Донохью М., Сюй Р., Ли Р., Лефошёр Дж.-П., Хедр Э.М. и др. рТМС для подавления нейропатической боли: метаанализ. Джей Пейн. 2009 г., декабрь; 10 (12): 1205–16.
- ↑ Лео Р.Дж., Латиф Т. Повторяющаяся транскраниальная магнитная стимуляция (рТМС) при экспериментально индуцированной и хронической невропатической боли: обзор. Джей Пейн. 2007 г., июнь; 8 (6): 453–9.
- ↑ Lefaucheur JP. Использование повторяющейся транскраниальной магнитной стимуляции (рТМС) при хронической нейропатической боли.




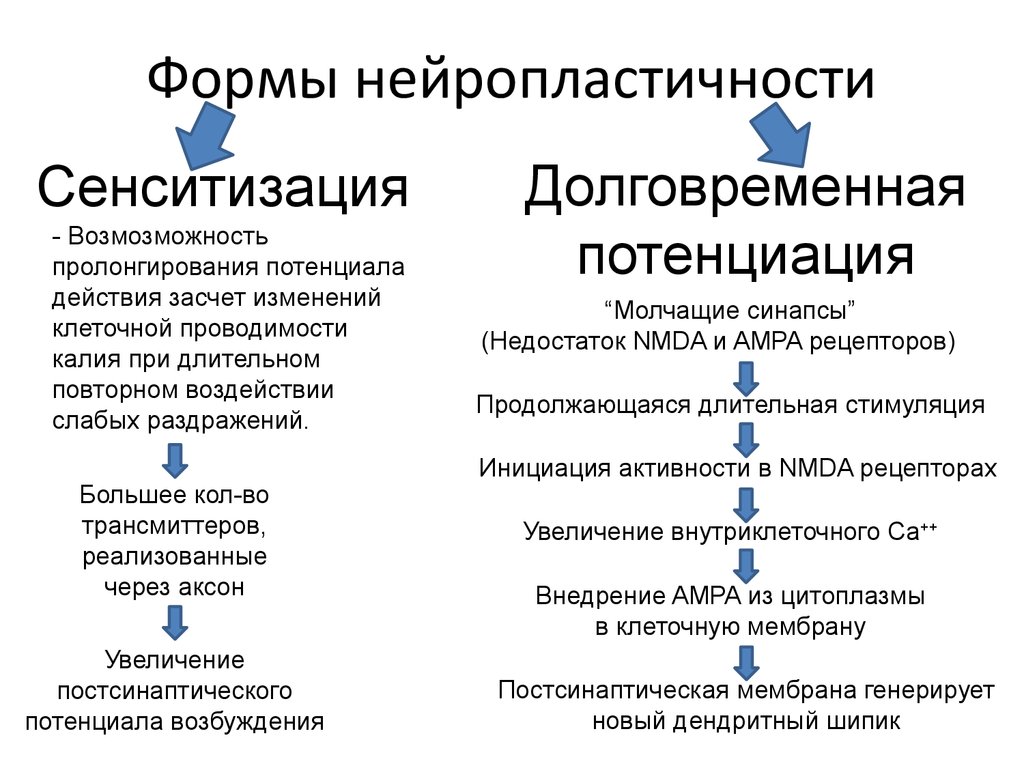

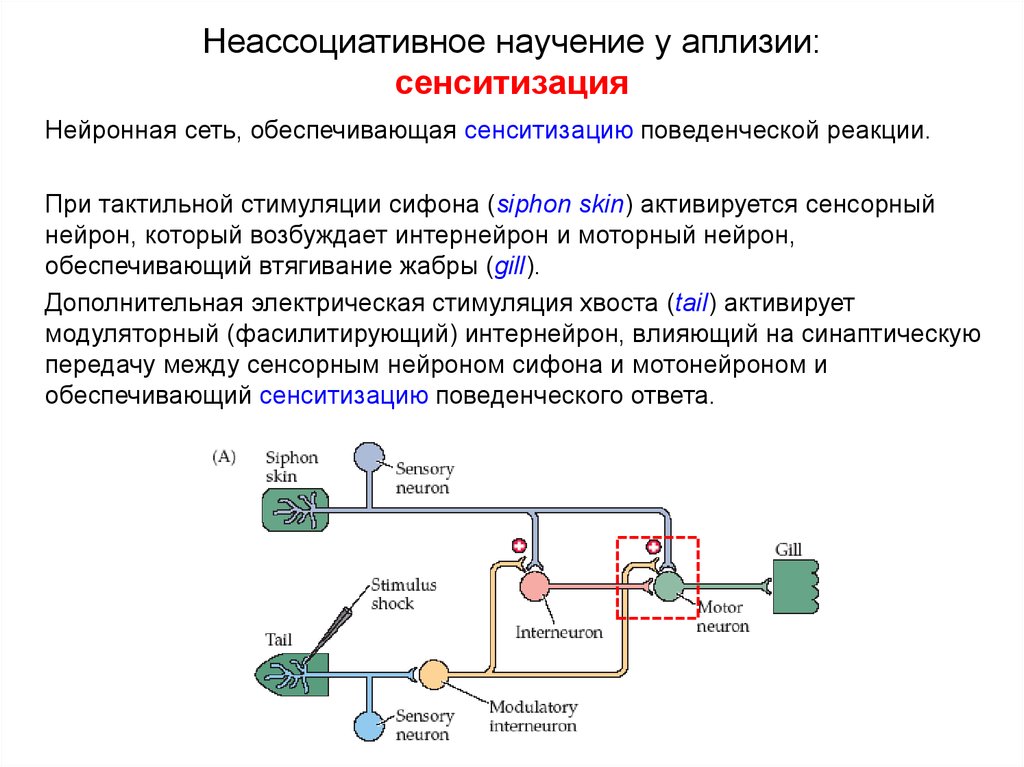 (неврологическое обследование, оценка активных движений, провокационные тесты нервной ткани). Основываясь на этой всесторонней оценке, балл LANSS ≥ 12 указывает на центральную сенсибилизацию в их алгоритме классификации.
(неврологическое обследование, оценка активных движений, провокационные тесты нервной ткани). Основываясь на этой всесторонней оценке, балл LANSS ≥ 12 указывает на центральную сенсибилизацию в их алгоритме классификации. 
 Mayer et al. [22] предложил Центральный реестр сенсибилизации (CSI). Клиническая цель этого скринингового инструмента состоит в том, чтобы помочь лучше оценить симптомы, которые, как считается, связаны с КС, чтобы помочь врачам и другим клиницистам в категоризации синдрома, чувствительности, идентификации тяжести и планировании лечения, чтобы помочь минимизировать или, возможно, избежать ненужной диагностики. и лечебные процедуры. CSI продемонстрировал хорошую психометрическую силу, клиническую полезность и валидность исходной конструкции.
Mayer et al. [22] предложил Центральный реестр сенсибилизации (CSI). Клиническая цель этого скринингового инструмента состоит в том, чтобы помочь лучше оценить симптомы, которые, как считается, связаны с КС, чтобы помочь врачам и другим клиницистам в категоризации синдрома, чувствительности, идентификации тяжести и планировании лечения, чтобы помочь минимизировать или, возможно, избежать ненужной диагностики. и лечебные процедуры. CSI продемонстрировал хорошую психометрическую силу, клиническую полезность и валидность исходной конструкции. 
 и синдром хронической усталости) [25] .
и синдром хронической усталости) [25] .
 Однако некоторые из этих методов лечения все еще находятся на стадии изучения и не получили широкого клинического применения.
Однако некоторые из этих методов лечения все еще находятся на стадии изучения и не получили широкого клинического применения.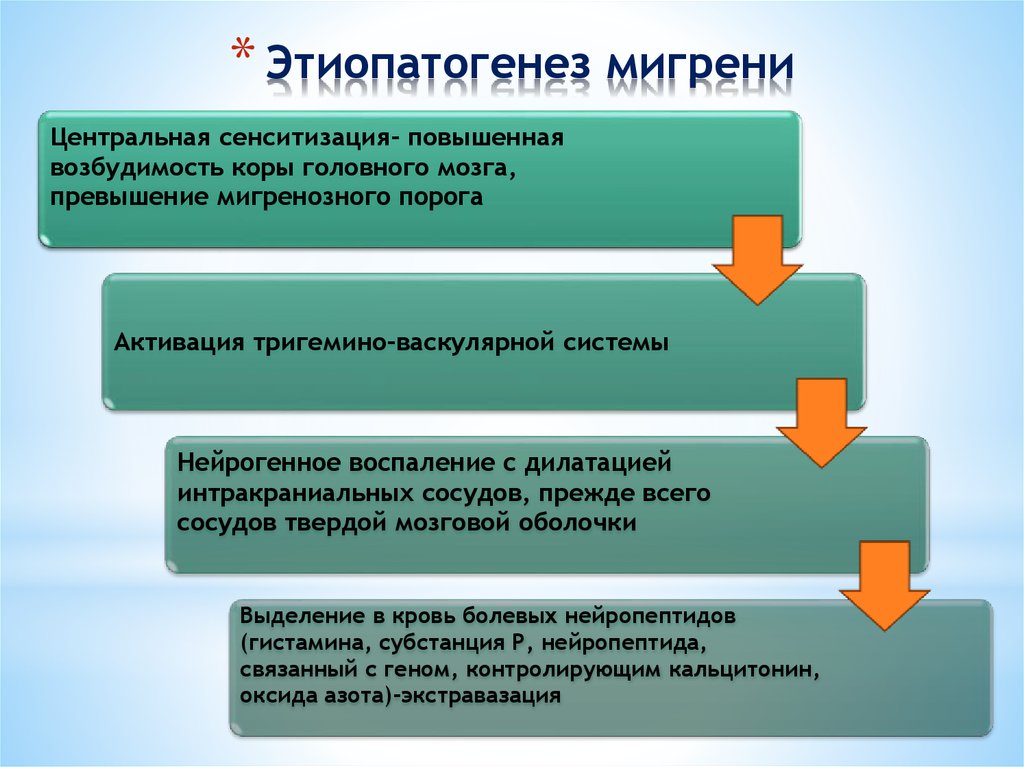
 Терминология МАСП. Доступно по адресу: https://www.iasp-pain.org/Education/Content.aspx?ItemNumber=1698#Sensitization. [По состоянию на 19 июля 2020 г.]
Терминология МАСП. Доступно по адресу: https://www.iasp-pain.org/Education/Content.aspx?ItemNumber=1698#Sensitization. [По состоянию на 19 июля 2020 г.] )
) Периферическая и центральная сенсибилизация. Доступно по адресу: http://www.youtube.com/watch?v=YwDMmSwUOOU [последнее обращение 22 ноября 2015 г.]
Периферическая и центральная сенсибилизация. Доступно по адресу: http://www.youtube.com/watch?v=YwDMmSwUOOU [последнее обращение 22 ноября 2015 г.] Мануальная терапия 2010;15:135-41
Мануальная терапия 2010;15:135-41 Мануальная терапия. 2011 1 октября; 16 (5): 413–8.
Мануальная терапия. 2011 1 октября; 16 (5): 413–8. BMC Расстройство опорно-двигательного аппарата. 2008; 9:19.
BMC Расстройство опорно-двигательного аппарата. 2008; 9:19.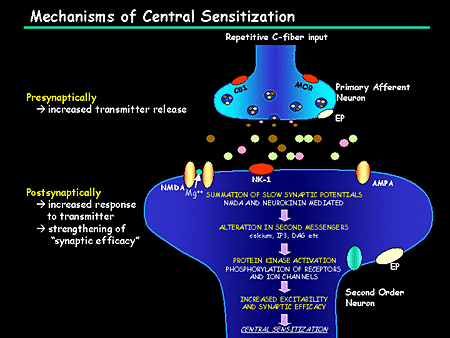 Нейрофизиол клин. 2006 г., июнь; 36 (3): 117–24.
Нейрофизиол клин. 2006 г., июнь; 36 (3): 117–24. 1 Субъективные признаки
1 Субъективные признаки
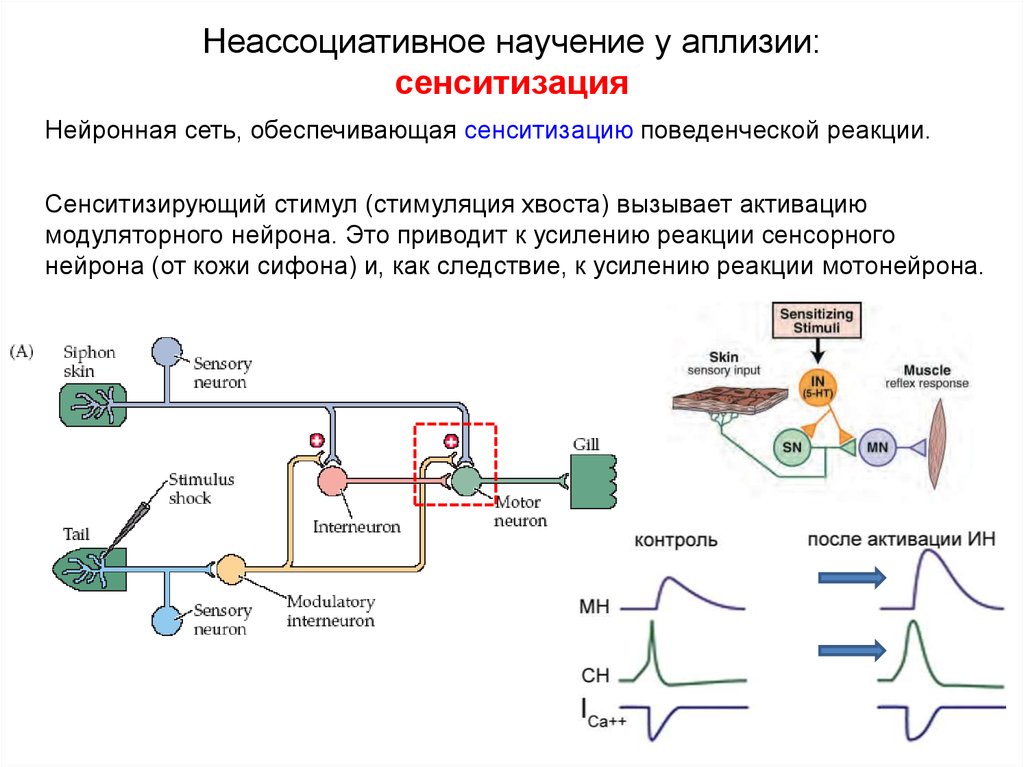
 [13]
[13] 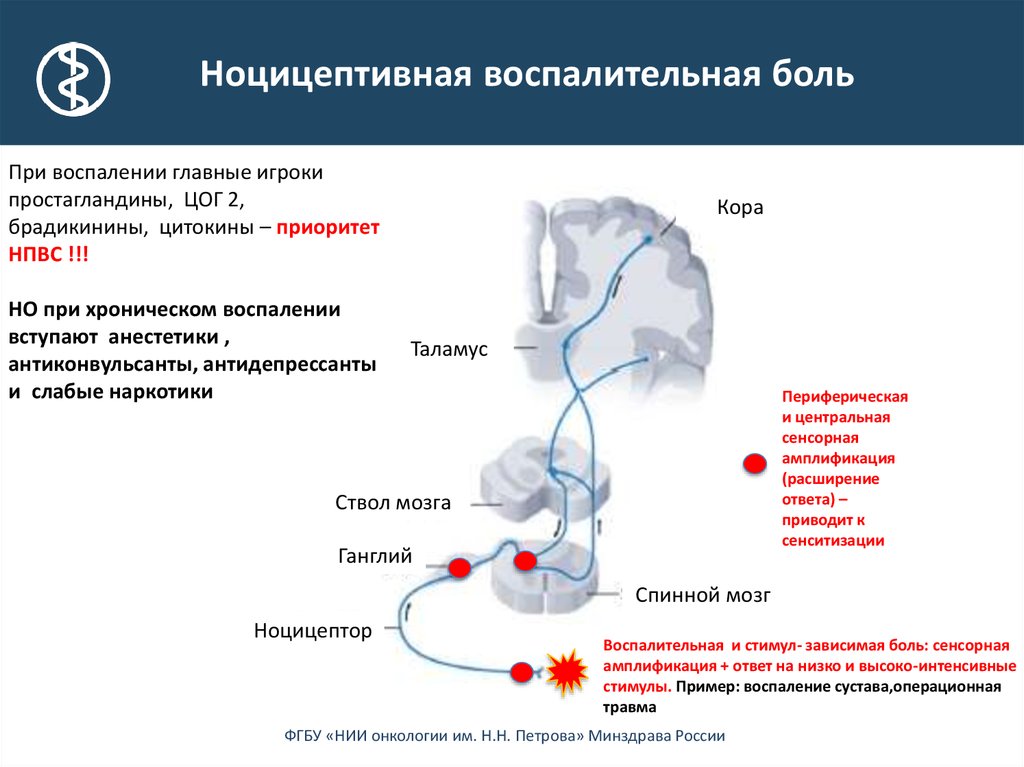



 Mayer et al. [22] предложил Центральный реестр сенсибилизации (CSI). Клиническая цель этого скринингового инструмента состоит в том, чтобы помочь лучше оценить симптомы, которые, как считается, связаны с КС, чтобы помочь врачам и другим клиницистам в категоризации синдрома, чувствительности, идентификации тяжести и планировании лечения, чтобы помочь минимизировать или, возможно, избежать ненужной диагностики. и лечебные процедуры. CSI продемонстрировал хорошую психометрическую силу, клиническую полезность и валидность исходной конструкции.
Mayer et al. [22] предложил Центральный реестр сенсибилизации (CSI). Клиническая цель этого скринингового инструмента состоит в том, чтобы помочь лучше оценить симптомы, которые, как считается, связаны с КС, чтобы помочь врачам и другим клиницистам в категоризации синдрома, чувствительности, идентификации тяжести и планировании лечения, чтобы помочь минимизировать или, возможно, избежать ненужной диагностики. и лечебные процедуры. CSI продемонстрировал хорошую психометрическую силу, клиническую полезность и валидность исходной конструкции. 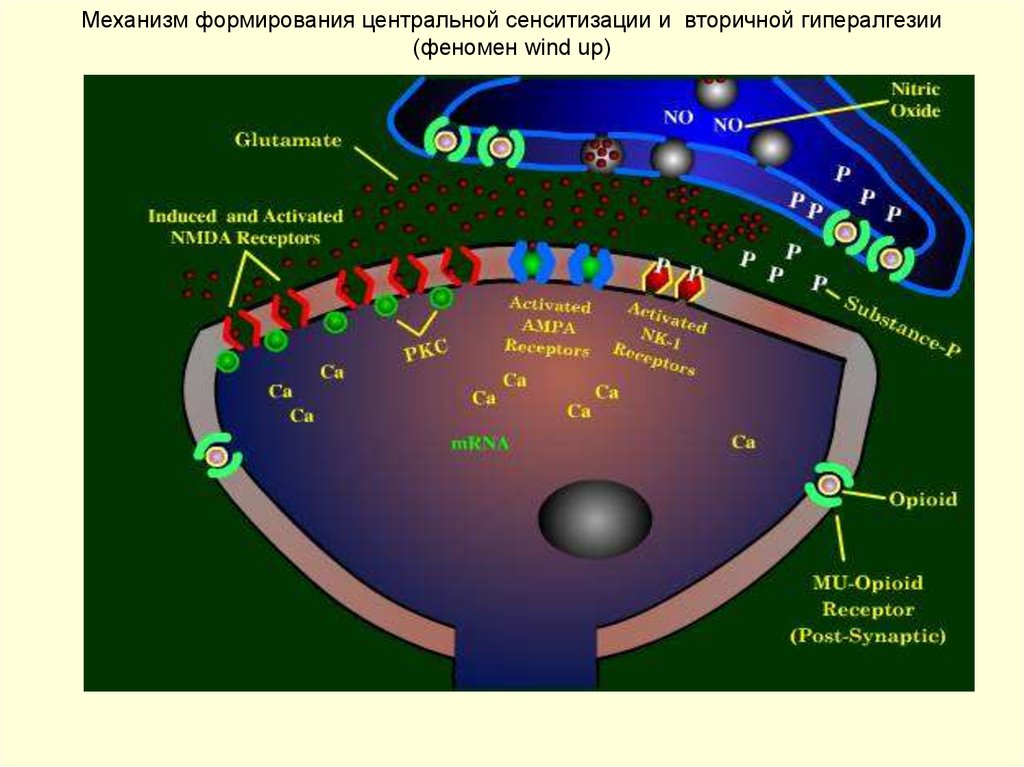
 и синдром хронической усталости) [25] .
и синдром хронической усталости) [25] .
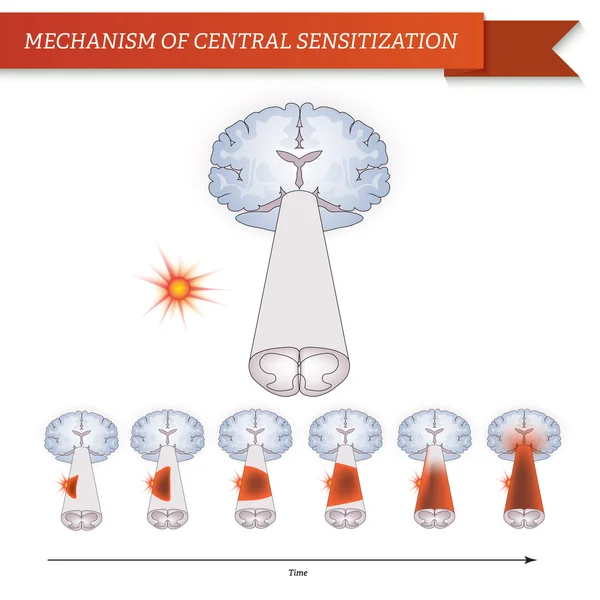 Однако некоторые из этих методов лечения все еще находятся на стадии изучения и не получили широкого клинического применения.
Однако некоторые из этих методов лечения все еще находятся на стадии изучения и не получили широкого клинического применения.
 Терминология МАСП. Доступно по адресу: https://www.iasp-pain.org/Education/Content.aspx?ItemNumber=1698#Sensitization. [По состоянию на 19 июля 2020 г.]
Терминология МАСП. Доступно по адресу: https://www.iasp-pain.org/Education/Content.aspx?ItemNumber=1698#Sensitization. [По состоянию на 19 июля 2020 г.] )
) Периферическая и центральная сенсибилизация. Доступно по адресу: http://www.youtube.com/watch?v=YwDMmSwUOOU [последнее обращение 22 ноября 2015 г.]
Периферическая и центральная сенсибилизация. Доступно по адресу: http://www.youtube.com/watch?v=YwDMmSwUOOU [последнее обращение 22 ноября 2015 г.] Мануальная терапия 2010;15:135-41
Мануальная терапия 2010;15:135-41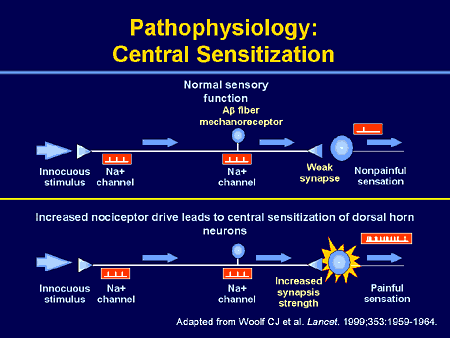 Мануальная терапия. 2011 1 октября; 16 (5): 413–8.
Мануальная терапия. 2011 1 октября; 16 (5): 413–8. BMC Расстройство опорно-двигательного аппарата. 2008; 9:19.
BMC Расстройство опорно-двигательного аппарата. 2008; 9:19.