Строение мажорной и минорной гаммы. Виды мажора и минора
Ладом в музыке называется система устойчивых и неустойчивых звуков, объединённых тяготением к главному центру – тонике. В музыке большинства стран основными ладами являются мажор и минор.
Мажором называется семиступенный лад, устойчивые звуки которого образуют мажорное (большое) трезвучие. Его строение тон-тон-полутон-3 тона-полутон. Минором называется семиступенный лад, устойчивые звуки которого образуют минорное (малое) трезвучие. Его строение тон-полутон-2 тона-полутон-2 тона.
Существуют различные виды мажора и минора: натуральный, гармонический и мелодический.
В
гармоническом мажоре понижается VI
ступень. В связи с этим в таком ладу
возникают характерные интервалы (2ув-7ум
и 4ум-5ув), Уменьшённый вводный септаккорд
на VII
ступени и увеличенное трезвучие на VI
пониженной ступени, а все аккорды
субдоминантовой группы становятся
минорными.
В гармоническом миноре повышается VII ступень. В связи с этим в таком ладу возникают характерные интервалы (2ув-7ум и 4ум-5ув), Уменьшённый вводный септаккорд на VII повышенной ступени и увеличенное трезвучие на III ступени, а все аккорды доминантовой группы становятся мажорными.
В мелодическом миноре повышаются и VI, и VII ступени.
Тональность – это высотное положение лада. Система построения мажорных и минорных тональностей называется кварто-квинтовым кругом. Её принцип состоит в том, что в тональностях, идущих по квинтам вверх (или по квартам вниз) увеличивается количество диезов, а в тональностях, идущих по квинтам вниз (или по квартам вверх) увеличивается количество бемолей.
Гамма – поступенное движение от тоники до её повторения.
Интервалом называется
расстояние между какими-либо объектами
в пространстве (напр.
Мелодическими (в которых звуки взяты последовательно) и гармоническими (в которых звуки взяты одновременно). Нижний звук интервала называется основанием, верхний – вершиной.
Интервал характеризуют 2 величины: ступеневая (количественная) указывает на расстояние между основанием и вершиной и обозначается арабскими цифрами; а тоновая (качественная) уточняет вид интервала – большой, малый, увеличенный, уменьшённый или чистый, и обозначается соответственными буквами.
Интервалы
от примы до октавы (прима, секунда,
терция, кварта, квинта, секста, септима,
октава) называются 
Интервалы, звучащие мелодично и благозвучно, звучание в которых как бы «сливается», называются консонансами. К ним относятся 1ч и 8ч (абсолютные консонансы), 4ч и 5 ч (совершенные консонансы), 3б,м и 6б,м (несовершенные консонансы). Особенность несовершенных консонансов в том, что в них слышно ладовое наклонение (мажор или минор). Интервалы, звучащие резко и неблагозвучно, называются диссонансами. К ним относятся 2м, б, 7м, б и тритон. Степень консонантности интервалов зависит от количества совпадающих обертонов.
Все чистые, большие, малые интервалы и тритон относятся к диатоническим, все увеличенные, уменьшённые, дважды увеличенные и дважды уменьшённые интервалы – к хроматическим.
Обращение
интервалов – это
такое изменение, при котором вершина и
основание меняются местами. Для этого
нужно либо нижний звук перенести на
октаву вверх, либо верхний на октаву
вниз. При этом соблюдается закономерность:
большие интервалы превращаются в малые
и наоборот, увеличенные в уменьшённые
и наоборот, а чистые остаются чистыми. 1
8, 2
7, 3
6, 4
5.
1
8, 2
7, 3
6, 4
5.
Page not found — Сайт ludustonalis!
Unfortunately the page you’re looking doesn’t exist (anymore) or there was an error in the link you followed or typed. This way to the home page.
- Главная страница
- Новое в образовании
- Информация об авторе
- Теория музыки
- Тема 1. Нотное письмо
- Буквенная нотация. Задание 1.1
- Запись высоты. Задание 1.2
- Запись длительностей. Задание 1.3
- Нотный текст. Задание 1.4
- Контрольная работа «Нотное письмо»
- Тема 2 Лад. Тональность
- Модальные лады. Задание 2.1
- Стабильные модальные. Задание 2.2
- Д.Шостакович. Фуга C-dur
- Тональные лады. Задание 2.3
- Кварто-квинтовый круг. Задание 2.4
- Транспонирование
- Другие виды ладов
- Альтерация. Задание 2.5
- Контрольная работа по теме Лад
- Тест по теме Лад
- Тема 3.
 Интервалы
Интервалы - Интервалы. Задания 3.1, 3.2
- Интервалы в натуральном мажоре и миноре. 3.3
- Характерные интервалы. 3.4
- Хроматические интервалы.3.5
- Контрольная работа по теме
- Тема 4. Аккорды
- Трезвучия. Задания 4.1, 4.2
- Способы изменения терцовой структуры аккорда.
- Септаккорды. Задания 4.3, 4.4
- Тема 5. Ритм
- Метроритмические признаки танцев
- Понятие метра. Такт. Размер
- Группировка в простых размерах. Задание 5.1
- Группировка в сложных размерах. Задание 5.2
- Ритмические рисунки. Задание 5.3
- Особые виды дробления. Задание 5.4
- Контрольная работа по теме
- Модуляция. Задание 6.6
- Презентация «Мелодия»
- Викторина «Мелодия»
- Презентация «Фактура»
- Викторина «Фактура»
- Тема 9. Звук. Тест 91
- Музыкальный строй. Тест 9..2
- Экзамен. Зачет
- Танцевальный mix 2022-2023
- Метроритмические признаки танцев
- Диалоговый тренажер
- Письменная работа
- Викторина «Скрипичный ключ»
- Письменная работа
- Инструментоведение
- Страницы истории оркестра
- Структура симфонического оркестра
- Оркестровая партитура
- О дирижерском искусстве
- Викторина 1
- Струнная группа оркестра
- Скрипка
- Альт
- Виолончель
- Контрабас
- Викторина 2
- «Своя игра» по итогам семестра
- Деревянные духовые инструменты
- Флейта
- Гобой
- Кларнет
- Фагот
- Webanketa по группе Fiati
- Игра «Кто хочет стать миллионером»
- Викторина Fl, Ob, Cl
- Медные духовые инструменты
- Труба
- Валторна
- Тромбон
- Туба
- викторина 4
- Викторина 5
- Ударные с определенной высотой
- Ударные без определенной высоты
- Полифония
- Виды полифонии
- Периодизация
- Строгий стиль
- Композиторские школы
- Основные жанры
- Свободный стиль
- Викторина 1
- Способы преобразования мелодии
- Игра «Кто хочет стать миллионером?»
- Контрапункт простой и сложный
- Имитационная техника
- Викторина 2
- Фуга и ее элементы.
 Викторина 3
Викторина 3 - Экспозиционная часть фуги. Викторина 4
- Развивающая часть фуги.
- Многотемные фуги
- Фугетта. Фугато. Инвенция.
- Полифонические циклы: Шостакович, Щедрин, Хиндемит
- Полифонические циклы И.С.Баха
- Итоговая викторина
- Медиатека
- Журналисты
- Этнографы
- Критерии оценки
- Конференция «Перекресток культур»
- Спектральная музыка
- Сонористика
- Стохастическая музыка
- Электронная музыка
- Алеаторика
- Минимализм
- Додекафония
- Квест «Наша родина — Россия»
- Статистик
- Лингвист
- Этнографы
- Путешественники
- Фольклористы
- Краеведы
- Корреспонденты
- Критерии оценки
- Физик
- Нейрофизиолог
- Преподаватель сольфеджио
- Историк музыки
- Методист
- Статистик
- Любитель музыкальных редкостей
- 02/28/2016 — Картинка для викторины
- 02/03/2016 — О сервисе Google — форма для создания викторин
- 01/29/2016 — Вопросы к экзамену по ЭТМ для групп 106 и 106а
- 01/27/2016 — Новый проект Пермской филармонии
- 01/09/2016 — Фоторепортаж интерактивной игры по теории 10.
 12.15
12.15 - 01/06/2016 — Информация для группы 107
- 12/29/2015 — Завершая 2015 год…
- 12/27/2015 — Экзамен по «Элементарной теории музыки» группа 207
- 12/25/2015 — ГАЛЕРЕЯ
- 12/25/2015 — Компьютерная графика и анимация GIMP
Озон — симметричная молекула, поэтому вклад I и II в наше представление об этой молекуле одинаков. Однако большинство резонансных гибридов несимметричны, и их вкладчики не играют равных ролей. Формамид представляет собой суперпозицию III и IV, но его структура и свойства больше напоминают III: атомы несут только небольшие заряды, связь CO ближе к двойной связи, а связь CN ближе к одинарной связи. В этом случае мы говорим, что III — это 9.0016 основной вкладчик и IV является второстепенным вкладчиком . Неоднозначная терминология. V играет гораздо меньшую роль, чем III или IV, поэтому мы могли бы назвать V второстепенным вкладчиком, а III и IV — главными вкладчиками. Иногда, однако, мы хотим, чтобы относительные роли всех трех участников были четкими. В этом случае мы используем следующую терминологию: Рейтинг участников. Существует несколько способов определить основных, второстепенных и очень незначительных участников:
|
2.4: Резонанс — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 106487
- Тим Содерберг
- Университет Миннесоты Моррис 9010 2
Что такое резонанс?
Если бы нам нужно было нарисовать структуру ароматической молекулы, такой как 1,2-диметилбензол, мы могли бы изобразить двойные связи двумя способами:
Какой из способов правильный? На этот вопрос есть два простых ответа: «оба» и «ни один». Оба способа изображения молекулы являются одинаково приемлемыми аппроксимациями картины связей молекулы, но ни один из них сам по себе не является точным изображением делокализованных пи-связей. Два альтернативных рисунка, однако, , рассматриваемые вместе с , дают гораздо более точную картину, чем каждый из них по отдельности. Это потому, что они вместе подразумевают, что углерод-углеродные связи являются не двойными связями, не одинарными связями, а примерно посередине между ними.
Два альтернативных рисунка, однако, , рассматриваемые вместе с , дают гораздо более точную картину, чем каждый из них по отдельности. Это потому, что они вместе подразумевают, что углерод-углеродные связи являются не двойными связями, не одинарными связями, а примерно посередине между ними.
Эти два рисунка являются примером того, что в органической химии называется участниками резонанса : две или более различных структур Льюиса, изображающих одну и ту же молекулу или ион, которые, если их рассматривать вместе, лучше аппроксимируют делокализованную пи-связь чем любая отдельная структура. По соглашению участники резонанса связаны двунаправленной стрелкой и иногда заключаются в квадратные скобки:
Чтобы было легче визуализировать разницу между двумя участниками резонанса, часто используются маленькие изогнутые стрелки. Каждая из этих стрелок изображает «движение» двух пи-электронов. Через несколько глав, когда мы начнем изучать органические реакции — процесс, при котором меняется плотность электронов и образуются ковалентные связи между атомами, — эта «обозначение изогнутой стрелкой» станет чрезвычайно важной для описания движения электронов. Однако при рисовании участников резонанса это «движение» электрона происходит только в нашем уме, когда мы пытаемся визуализировать делокализованные пи-связи. Тем не менее, использование обозначений изогнутых стрелок является важным навыком, который вам необходимо развить при рисовании участников резонанса.
Однако при рисовании участников резонанса это «движение» электрона происходит только в нашем уме, когда мы пытаемся визуализировать делокализованные пи-связи. Тем не менее, использование обозначений изогнутых стрелок является важным навыком, который вам необходимо развить при рисовании участников резонанса.
Изображение бензола с помощью двух резонансных вкладчиков A и B на рисунке выше , а не означает, что молекула в один момент выглядит как структура A, а в следующий момент смещается, чтобы выглядеть как структура B. Скорее, вообще моменты, молекула представляет собой комбинацию, или резонанс гибрид как А, так и В.
Осторожно ! Очень важно уяснить, что, рисуя два (или более) участника резонанса, мы не рисуем две разные молекулы: они просто различных изображений одной и той же молекулы . Кроме того, двунаправленная резонансная стрелка НЕ означает, что произошла химическая реакция. Обычно производные бензола (и фенильные группы, когда бензольное кольцо включено в более крупную органическую структуру) изображаются только с одним резонансным вкладчиком, и предполагается, что читатель понимает, что подразумевается резонансная гибридизация. Это соглашение будет использоваться в большей части этой книги. В других книгах или статьях вы можете иногда увидеть бензольную или фенильную группу, нарисованную кружком внутри шестиугольника, сплошным или пунктирным, как способ рисования резонансного гибрида.
Это соглашение будет использоваться в большей части этой книги. В других книгах или статьях вы можете иногда увидеть бензольную или фенильную группу, нарисованную кружком внутри шестиугольника, сплошным или пунктирным, как способ рисования резонансного гибрида.
Резонансные вкладчики для карбоксилатной группы
Принятие двух или более резонансных вкладчиков для аппроксимации одной структуры может показаться вам немного неуклюжим на данном этапе, но по мере приобретения опыта вы увидите, что практика на самом деле очень полезно при обсуждении того, как реагируют многие функциональные группы. Теперь рассмотрим карбоксилат-ион (сопряженное основание карбоновой кислоты). В качестве нашего примера мы будем использовать формиат, простейшую карбоксилатсодержащую молекулу. Сопряженная кислота формиата — это муравьиная кислота, которая вызывает болезненный укус, который вы чувствуете, если вас когда-либо укусил муравей.
Обычно вы увидите карбоксилатные группы, образованные одной двойной связью углерод-кислород и одной одинарной связью углерод-кислород, с отрицательным формальным зарядом, расположенным на атоме кислорода с одинарной связью. В действительности, однако, две углеродно-кислородные связи имеют одинаковую длину, и хотя общий формальный заряд группы действительно имеет отрицательный заряд, он поровну распределяется между двумя атомами кислорода. Следовательно, карбоксилат может быть более точно описан парой резонансных вкладчиков. В качестве альтернативы можно использовать единую структуру с пунктирной линией, изображающей резонансно-делокализованную пи-связь и отрицательный заряд, расположенный между двумя атомами кислорода.
В действительности, однако, две углеродно-кислородные связи имеют одинаковую длину, и хотя общий формальный заряд группы действительно имеет отрицательный заряд, он поровну распределяется между двумя атомами кислорода. Следовательно, карбоксилат может быть более точно описан парой резонансных вкладчиков. В качестве альтернативы можно использовать единую структуру с пунктирной линией, изображающей резонансно-делокализованную пи-связь и отрицательный заряд, расположенный между двумя атомами кислорода.
Давайте посмотрим, сможем ли мы соотнести эти условные обозначения с теорией валентной связи, изображающей связь в карбоксилатной группе. Мы знаем, что углерод должен быть sp 2 -гибридизированным (валентные углы близки к 120˚, а молекула плоская), и мы будем рассматривать оба атома кислорода как sp 2 -гибридизированные. Таким образом, обе сигма-связи углерод-кислород образуются в результате перекрывания орбиталей sp 2 углерода и орбиталей sp 2 кислорода.
Кроме того, углерод и оба атома кислорода имеют негибридную орбиталь 2 p z , расположенную перпендикулярно плоскости сигма-связей. Эти три орбитали 2 p z параллельны друг другу и могут перекрываться бок о бок, образуя делокализованную пи-связь.
Резонансный вкладчик А показывает, что кислород №1 делит пару электронов с углеродом в пи-связи, а кислород №2 удерживает неподеленную пару электронов в своих 2 p z орбитальный. С другой стороны, вкладчик резонанса B показывает, что кислород № 2 участвует в пи-связи с углеродом, а кислород № 1 удерживает неподеленную пару на своей орбитали 2 p z . В целом, ситуация представляет собой одну из трех параллельных, перекрывающихся 2p z орбиталей, разделяющих четыре делокализованных пи-электрона . Поскольку на один электрон больше, чем 2 p z орбиталей, общий заряд системы равен –1. Это своего рода 3D-изображение, для аппроксимации которого используются резонансные вкладчики, и как только вы немного попрактикуетесь, вы сможете быстро визуализировать перекрывающиеся 2 p z орбиталей и делокализованных пи-электронов всякий раз, когда вы видите использование резонансных структур. В этом тексте карбоксилатные группы обычно для простоты изображаются, показывая только один вклад в резонанс, но вы всегда должны помнить, что две связи C-O равны, и что отрицательный заряд делокализован к обоим атомам кислорода.
Это своего рода 3D-изображение, для аппроксимации которого используются резонансные вкладчики, и как только вы немного попрактикуетесь, вы сможете быстро визуализировать перекрывающиеся 2 p z орбиталей и делокализованных пи-электронов всякий раз, когда вы видите использование резонансных структур. В этом тексте карбоксилатные группы обычно для простоты изображаются, показывая только один вклад в резонанс, но вы всегда должны помнить, что две связи C-O равны, и что отрицательный заряд делокализован к обоим атомам кислорода.
Упражнение 2.13
Существует третий резонансный вклад формиата (который, как мы скоро узнаем, считается «второстепенным» вкладчиком). Нарисуйте этого резонансного вкладчика.
Вот еще один пример, на этот раз с карбокатионом. Напомним из раздела 2.1, что карбокатионы sp 2 -гибридизированы, с пустой 2p орбиталью, ориентированной перпендикулярно плоскости, образованной тремя сигма-связями. Если карбокатион находится рядом с двойной связью, то три орбитали 2p могут перекрываться и разделять два пи-электрона — еще один вид сопряженной пи-системы, в которой положительный заряд распределяется между двумя атомами углерода.
Если карбокатион находится рядом с двойной связью, то три орбитали 2p могут перекрываться и разделять два пи-электрона — еще один вид сопряженной пи-системы, в которой положительный заряд распределяется между двумя атомами углерода.
Упражнение 2.14
Нарисуйте составляющие резонанса, которые соответствуют изогнутым стрелкам движения двух электронов в выражениях резонанса ниже.
Упражнение 2.15
В каждом выражении резонанса нарисуйте изогнутые стрелки движения двух электронов на левой стороне вклада, которые показывают, как мы переходим к правому вкладчику. Не забудьте включить формальные обвинения.
Решения упражнений
Правила рисования резонансных структур
Работая над тем, чтобы научиться рисовать и интерпретировать резонансные структуры, следует помнить о нескольких основных правилах, чтобы избежать рисования бессмысленных структур. Все эти правила имеют смысл, если вы помните, что вкладчики резонанса — это просто придуманное человеком соглашение для описания делокализации пи-электронов в сопряженных системах.
Правила рисования резонансных структур:
1) Когда вы видите двух разных участников резонанса, вам не видя химическую реакцию! Скорее, вы видите одну и ту же молекулу или ион, изображенную двумя разными способами.
2) Резонансные вкладчики включают «воображаемое движение» электронов, связанных пи, или электронов неподеленной пары, которые соседствуют с ( т.е. . сопряженными с) пи связями. Вы не можете никогда изменить положение электронов в сигма-связях – если вы показываете образование или разрыв сигма-связи, вы показываете, что происходит химическая реакция (см. правило №1). Аналогично, позиции атомов в молекуле не могут меняться между двумя вкладчиками резонанса.
3) Все участники резонанса для молекулы или иона должны иметь одинаковый суммарный заряд.
4) Все составляющие резонанса должны быть изображены как правильные структуры Льюиса с правильными формальными зарядами. Никогда не показывайте изогнутые стрелки «движения электронов», которые привели бы к ситуации, когда элемент второго ряда (например, углерод, азот или кислород) имеет более восьми электронов: это нарушит «правило октетов». Однако иногда мы будем рисовать резонансные вкладчики, в которых атом углерода имеет только шесть электронов (т. е. карбокатион). В общем, все атомы кислорода и азота должны иметь полный октет валентных электронов.
Никогда не показывайте изогнутые стрелки «движения электронов», которые привели бы к ситуации, когда элемент второго ряда (например, углерод, азот или кислород) имеет более восьми электронов: это нарушит «правило октетов». Однако иногда мы будем рисовать резонансные вкладчики, в которых атом углерода имеет только шесть электронов (т. е. карбокатион). В общем, все атомы кислорода и азота должны иметь полный октет валентных электронов.
Чтобы немного расширить правило № 4, на самом деле есть только три вещи, которые мы можем сделать с изогнутыми стрелками при рисовании резонансных структур:
Во-первых, мы можем взять два электрона в пи-связи и сдвинуть их, чтобы они стали неподеленной парой соседний атом (стрелка «а» ниже).
Во-вторых, мы можем взять неподеленную пару атома и поместить эти два электрона в пи-связь на том же атоме (стрелка «b»).
В-третьих, мы можем сдвинуть пи-связь на одну позицию (стрелка c).
Резонансные стрелки также можно комбинировать — ниже мы показываем стрелки a и b вместе:
Обратите внимание, что мы не выходим за рамки правила октета ни для одного атома, когда перемещаем электроны стрелками a, b и c. Резонансная картина ниже показывает «незаконное» движение электронов, потому что это привело бы к углероду с пятью связями или 10 валентными электронами (это нарушит правило октетов):
Резонансная картина ниже показывает «незаконное» движение электронов, потому что это привело бы к углероду с пятью связями или 10 валентными электронами (это нарушит правило октетов):
Всегда будьте очень осторожны при рисовании резонансных структур, которые твои стрелы делают только три типа движения электрона, описанные выше, и что вы никогда не превышаете правило октета для элемента второй строки. Часто полезно (но не обязательно) включать в рисунок все неподеленные пары электронов кислорода и азота, чтобы отслеживать валентные электроны, не нарушать правило октета и распознавать, когда атомы имеют отрицательный или положительный формальный заряд. Правильный «учет электронов» — большая часть работы с резонансными вкладчиками.
Ниже приведены еще несколько примеров допустимых резонансных выражений. Убедитесь сами, что правило октетов не превышено ни для одного атома и что формальные обвинения верны.
Упражнение 2.
 16
16Каждое из приведенных ниже «недопустимых» резонансных выражений содержит одну или несколько ошибок. Объясните, что неверно в каждом из них.
Решения к упражнениям
Главные и второстепенные резонансные вкладчики
Различные резонансные вкладчики не всегда вносят одинаковый вклад в общую структуру гибрида — скорее, во многих случаях один вкладчик ближе к отображению фактической картины связи, чем другой. В случае карбоксилатов вкладчики A и B ниже эквивалентны с точки зрения их относительного вклада в гибридную структуру. Однако есть и третий резонансный вклад C, в котором углерод несет положительный формальный заряд, а оба атома кислорода имеют одинарную связь и несут отрицательный заряд.
Структура C вносит менее важный вклад в общую картину связей группы по сравнению с A и B. Откуда мы знаем, что структура C вносит «второстепенный» вклад? Есть четыре основных правила, которые вам необходимо усвоить, чтобы оценить относительную важность различных составляющих резонанса. Мы пронумеруем их от 5 до 8, чтобы их можно было добавить в список «правил для резонанса» выше на этой странице.
Мы пронумеруем их от 5 до 8, чтобы их можно было добавить в список «правил для резонанса» выше на этой странице.
Правила определения основных и второстепенных вкладчиков резонанса:
5) У углерода в участнике C нет октета – в общем, резонансные вкладчики, в которых углерод не соответствует правилу октета, относительно менее важны.
6) В структуре C было введено разделение зарядов, которого нет в A или B. В общем, резонансные вкладчики, в которых есть большее разделение зарядов, относительно менее важны.
7) В структуре C всего три связи по сравнению с четырьмя в A и B. В целом, резонансная структура с меньшим количеством общих связей относительно менее важна.
8) Резонансный элемент, в котором отрицательный формальный заряд расположен на более электроотрицательном атоме, обычно кислороде или азоте, более стабилен, чем тот, в котором отрицательный заряд расположен на менее электроотрицательном атоме, таком как углерод. Пример приведен в верхнем левом выражении на следующем рисунке.
Пример приведен в верхнем левом выражении на следующем рисунке.
Ниже приведены некоторые дополнительные примеры основных и второстепенных резонансных факторов:
Почему мы беспокоимся о резонансном источнике, если он второстепенный? Позже мы увидим, что очень часто второстепенный вклад все же может быть чрезвычайно важен для нашего понимания реакции молекулы.
Упражнение 2.17
а) Нарисуйте структуру малого резонанса для ацетона (название ИЮПАК 2-пропанон). Объясните, почему это второстепенный вклад.
b) Вносят ли ацетон и 2-пропанол резонансные вклады друг в друга? Объяснять.
Упражнение 2.18
Нарисуйте четыре дополнительных резонансных вклада для молекулы ниже. Пометьте каждый из них как основной или второстепенный (структура ниже относится к основному вкладчику).
Упражнение 2.19
Нарисуйте три резонансных компонента метилацетата (название ИЮПАК метилметаноат) и расположите их в порядке их относительной важности для связывающей картины молекулы. Объясните свои рассуждения.
Объясните свои рассуждения.
Решения к упражнениям
Резонанс и пептидные связи
В каком гибридизационном состоянии находится атом азота в амиде? На первый взгляд кажется логичным сказать, что это sp 3 -гибридизация, потому что, как и азот в амине, структура Льюиса показывает три одинарных связи и неподеленную пару. Однако картина выглядит совершенно иначе, если мы рассмотрим другой резонансный фактор, в котором азот имеет двойную связь с карбонильным углеродом: в этом случае мы должны были бы сказать, что применимой гибридизацией является sp 2 , а геометрия склеивания скорее плоско-тригональная, чем тетраэдрическая.
На самом деле, последняя картина более точна: неподеленная пара электронов на амидном азоте не локализована на орбитали sp 3 , а делокализована как часть сопряженной пи-системы, и геометрия связывания вокруг азота является тригонально-плоской, как и ожидалось для гибридизации sp 2 . Это хорошая иллюстрация важного момента: сопряжение и соответствующая делокализация электронной плотности являются стабилизирующими, поэтому, если сопряжение может произойти, оно, вероятно, произойдет.
Это хорошая иллюстрация важного момента: сопряжение и соответствующая делокализация электронной плотности являются стабилизирующими, поэтому, если сопряжение может произойти, оно, вероятно, произойдет.
Одним из наиболее важных примеров амидных групп в природе является «пептидная связь», которая связывает аминокислоты с образованием полипептидов и белков.
Важным для структуры белков является тот факт, что, хотя обычно она изображается как одинарная связь, связь C-N в пептидной связи имеет значительный барьер для вращения , что указывает на то, что в некоторой степени C-N пи перекрываются присутствует — иными словами, имеется какой-то характер двойной связи, а азот равен sp 2 гибрид с тригональной планарной геометрией.
Барьер вращения в пептидных связях является неотъемлемой частью структуры белка, придавая большую жесткость остову белка. Если бы не было барьера для вращения в пептидной связи, белки были бы гораздо более «гибкими», а трехмерная укладка была бы совсем другой.
Упражнение 2.20
Нарисуйте два рисунка, на которых показаны негибридные 2p орбитали и расположение пи-электронов в метиламиде. Одно изображение должно представлять основной источник резонанса, другое — второстепенный. Сколько перекрытий 2p орбиталей имеют общее количество электронов, связанных пи-связью?
Упражнение 2.21
Нарисуйте два рисунка, на которых показаны негибридные 2p орбитали и расположение пи-электронов в енолятном анионе, показанное ниже. Одно изображение должно представлять основной источник резонанса, другое — второстепенный. Сколько перекрывающихся 2 p орбиталей имеют общее количество электронов, связанных пи-связями?
Упражнение 2.22
Ниже представлен второстепенный источник резонанса вида, известного как «енамин», который мы более подробно изучим в главе 12. Нарисуйте основной источник резонанса для енамина и объясните, почему ваш вклад является основным (см. правила резонанса №5-8 из этого раздела).
правила резонанса №5-8 из этого раздела).
Решения к упражнениям
Решенный пример
Нарисуйте главный компонент резонанса структуры ниже. Включите в свой рисунок соответствующие изогнутые стрелки, показывающие, как вы пришли от данной структуры к вашей структуре. Объясните, почему ваш вкладчик является основным. На каких орбиталях находятся две неподеленные пары кислорода?
Решение
В приведенной выше структуре углерод с положительным формальным зарядом не имеет полного октета валентных электронов. Используя соглашение с изогнутой стрелкой, неподеленную пару кислорода можно переместить на соседнюю связь слева, а электроны в двойной связи сместиться влево (см. правила рисования резонансных вкладчиков, чтобы убедиться, что это законные ходы).
Результирующий вклад в резонанс, в котором кислород несет формальный заряд, является основным, потому что все атомы имеют полный октет, и имеется одна дополнительная связь (применяются оба правила резонанса #5 и #7). Эту систему можно представить как четыре параллельных 2p орбиталей (по одной на C 2 , C 3 и C 4 , плюс одна на кислороде), разделяющих четыре пи-электрона. Одна неподеленная пара на кислороде находится на негибридной орбитали 2p и является частью сопряженной пи-системы, а другая расположена на орбитали sp 2 .
Эту систему можно представить как четыре параллельных 2p орбиталей (по одной на C 2 , C 3 и C 4 , плюс одна на кислороде), разделяющих четыре пи-электрона. Одна неподеленная пара на кислороде находится на негибридной орбитали 2p и является частью сопряженной пи-системы, а другая расположена на орбитали sp 2 .
Также обратите внимание, что один дополнительный вкладчик может быть взят, но он тоже незначителен, поскольку имеет углерод с неполным октетом:
Упражнение 2.23
а) Нарисуйте три дополнительных резонансных вклада для карбокатиона ниже. Включите в свой рисунок соответствующие изогнутые стрелки, показывающие, как один вкладчик преобразуется в другой.
b) Заполните пропуски: сопряженная пи-система в этом карбокатионе состоит из ______ 2p орбиталей, разделяющих ________ делокализованных пи-электронов.
Упражнение 2.24
Нарисуйте главный вкладчик резонанса для каждого из анионов ниже.
c) Заполните пропуски: сопряженная пи-система в части (а) состоит из ______ 2p орбиталей, содержащих ________ делокализованных пи-электронов.
Упражнение 2.25
На рисунке ниже показано, как отрицательный формальный заряд кислорода может быть делокализован до углерода, указанного стрелкой. Можно привлечь больше резонансных вкладчиков, в которых отрицательный заряд делокализован на три других атома в молекуле.
а) Обведите эти атомы.
b) Нарисуйте два наиболее важных компонента резонанса для молекулы.
Решения к упражнениям
Совет
Становление экспертом в рисовании резонансных вкладчиков, использование изогнутых стрелок, чтобы показать, как один вкладчик может быть преобразован в другой, и понимание концепций сопряжения и делокализации резонанса — вот некоторые из самые сложные, но и самые важные работы, которые вы будете выполнять, когда будете изучать органическую химию. Если вы сейчас усердно поработаете, чтобы четко усвоить эти идеи, вы проделаете долгий путь к пониманию большей части того, что следует в вашем курсе органической химии. И наоборот, если вы не усвоите эти понятия сейчас, многое из того, что вы увидите позже в курсе, будет казаться набором загадочных и непонятных линий, точек и стрелок, и вас ждет тяжелая поездка. мягко говоря. В большей степени, чем многие другие темы органической химии, понимание связи, конъюгации и резонанса — это то, над чем большинству студентов действительно необходимо работать «лично» с инструктором или наставником , предпочтительно с использованием набора для молекулярного моделирования . Продолжайте решать проблемы, продолжайте задавать вопросы и продолжайте, пока все не станет понятным!
Если вы сейчас усердно поработаете, чтобы четко усвоить эти идеи, вы проделаете долгий путь к пониманию большей части того, что следует в вашем курсе органической химии. И наоборот, если вы не усвоите эти понятия сейчас, многое из того, что вы увидите позже в курсе, будет казаться набором загадочных и непонятных линий, точек и стрелок, и вас ждет тяжелая поездка. мягко говоря. В большей степени, чем многие другие темы органической химии, понимание связи, конъюгации и резонанса — это то, над чем большинству студентов действительно необходимо работать «лично» с инструктором или наставником , предпочтительно с использованием набора для молекулярного моделирования . Продолжайте решать проблемы, продолжайте задавать вопросы и продолжайте, пока все не станет понятным!
Видеоуроки Академии Хана
Рисование резонансных структур
Подробнее о резонансе
Органическая химия с акцентом на биологию Тима Содерберга (Университет Миннесоты, Моррис)
Эта страница под названием 2.
 Интервалы
Интервалы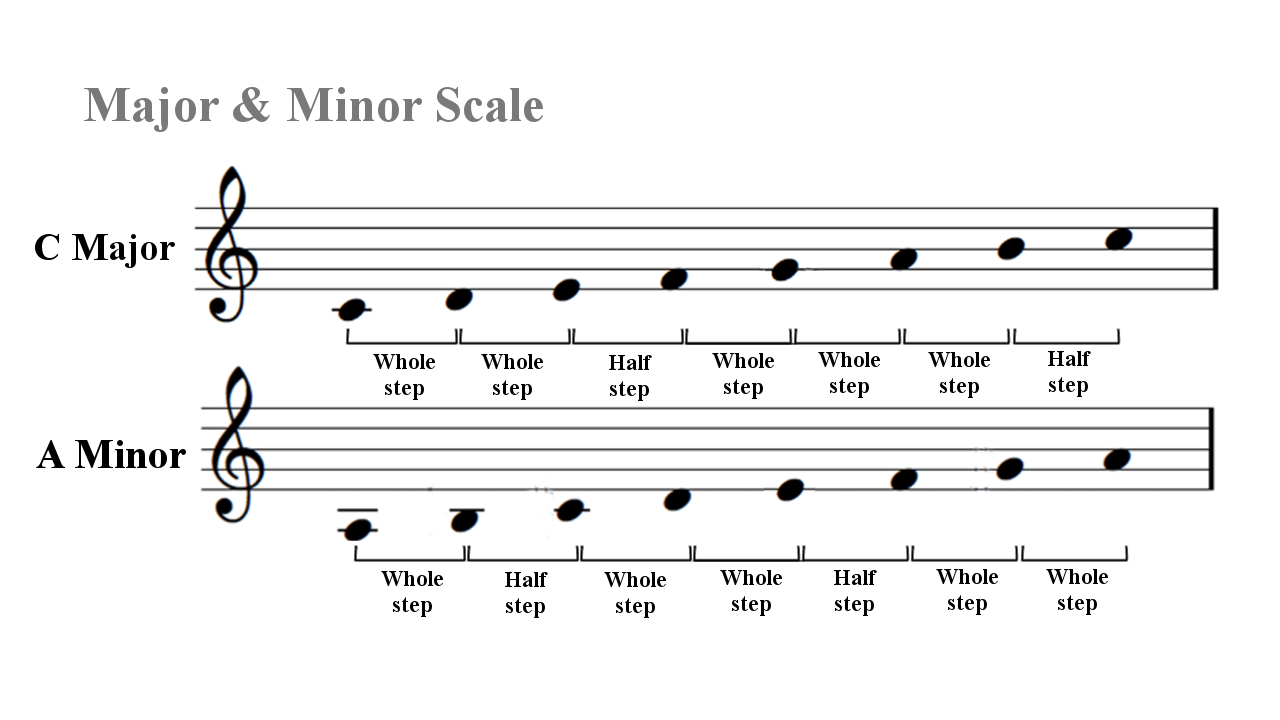 Викторина 3
Викторина 3 12.15
12.15 «Основной» и «второстепенный» все еще используются, когда молекула представляет собой суперпозицию трех или более участников. В этих ситуациях «основной» может применяться ко всем более крупным вкладчикам, а «второстепенный» — ко всем меньшим вкладчикам. Например, формамид иногда рассматривается как суперпозиция трех компонентов:
«Основной» и «второстепенный» все еще используются, когда молекула представляет собой суперпозицию трех или более участников. В этих ситуациях «основной» может применяться ко всем более крупным вкладчикам, а «второстепенный» — ко всем меньшим вкладчикам. Например, формамид иногда рассматривается как суперпозиция трех компонентов: Крупный участник, такой как III, обеспечивает наилучшее совпадение. Незначительный вклад, такой как IV, обеспечивает более слабое соответствие, но добавляет важную информацию к картине. Очень незначительный участник, такой как Ви, очень мало добавляет к картине и обычно игнорируется.
Крупный участник, такой как III, обеспечивает наилучшее совпадение. Незначительный вклад, такой как IV, обеспечивает более слабое соответствие, но добавляет важную информацию к картине. Очень незначительный участник, такой как Ви, очень мало добавляет к картине и обычно игнорируется. 