Что такое Лиды и Лидогенерация?
Наверное, многие слышали слово «лидогенерация», но не все понимают, что это такое, и кому может пригодиться.
В самом популярном случае, лид – это контакт человека, заинтересованного Вашим продуктом или проявивший интерес к Вашей сфере деятельности. Контакт может быть совершенно разным: например: адрес электронной почты, номер телефона, заполненная заявка, телефонный звонок, подписка в группе или профиль в социальных сетях.
Лиды бывают нескольких видов:
Холодный лид – это контакт человека, которому возможно интересен ваш продукт. Например, пользователь зашел на сайт интернет-магазина, ничего не купил, но подписался на получение новостей от магазина по электронной почте. Несмотря на то, что посетитель не стал клиентом, он стал «лидом» для владельцев магазина. Теперь задача владельца бизнеса – «разогреть» этот лид и сделать из него покупателя.
Горячий лид – контакт человека, у которого уже точно есть желание купить продукт у вас. Например, в том же интернет-магазине он заполнил форму заказа продукта, но еще не оплатил. Т.е остается пару шагов, чтобы сделать из него покупателя, однако часть людей на этом этапе отваливаются. То товара на складе нет, то денег вдруг не оказалось, то комплектация не подошла.
Валидный лид (качественный) – это когда есть все необходимые данные о человеке, и они удовлетворяют вашим потребностям. Например, вы выдаете кредиты, но только людям, которые имеют работу и в возрасте от 25-ти лет до 45-ти. Чтобы получить кредит нужно сначала заполнить заявку на вашем сайте и, рассмотрев ее, вы принимаете решение, выдавать кредит или нет. Например, пользователь заполнил ее, но указал свой возраст 18 лет. Следовательно, он является лидом, но не валидным, так как его невозможно превратить в клиента.
Лидогенерация – процесс привлечения и обработки лидов с целью конвертации их в клиентов. То есть нужно получить как можно больше контактов, пользователей, заинтересованных Вашей услугой. Затем нужно пообщаться с этими пользователями и превратить в клиентов.
Как используется лидогенерация в соц сетях?
В социальный маркетинг (SMM) владельцы бизнеса инвестируют со следующими целями*:
- 83% — повышение узнаваемости и лояльности к бренду**;
- 69% — увеличение трафика и мониторинг целевого рынка;
- 15% — увеличение посещаемости сайта и стимулирование продаж (переходы из соц. сетей).
* Источник: http://ikraine.net/ , http://lpgenerator.ru/
**Процент указан суммарный, с пересечением по нескольким целям.
На сегодняшний день около 40% продаж осуществляется с использованием соц. сетей. Для некоторых видов бизнеса процент приближается к 80%.
Преимуществом такого вида продвижения бизнеса является не только увеличение трафика на сайт, клиентской лояльности и конверсии в продажи, но и существенное снижении затрат на привлечение каждого клиента.
Сейчас легко «заблудится» в разнообразии предложений по продвижению в социальных сетях и не понятно, по каким критериям выбирать себе подрядчика. Мы не будем обещать вам «золотых гор» и увеличение продаж на 200% на второй день рекламной кампании. Но мы готовы нести ответственность за тот результат, который необходим клиенту. Какие гарантии? Клиент платит за конечный результат, а не за обещания.
Подробнее об услугах SMM
Валидные онкомаркеры: скрининг, диагностика, прогноз онкозаболеваний
Валидные онкомаркеры: скрининг, диагностика, прогноз онкозаболеванийСайт издательства «Медиа Сфера»
содержит материалы, предназначенные исключительно для работников здравоохранения. Закрывая это сообщение, Вы подтверждаете, что являетесь дипломированным медицинским работником или студентом медицинского образовательного учреждения.
Гуманова Н.Г.
ФГБУ «Национальный медицинский исследовательский центр терапии и профилактической медицины» Минздрава России
Валидные онкомаркеры: скрининг, диагностика, прогноз онкозаболеваний
Авторы:
Гуманова Н. Г.
Г.
Подробнее об авторах
Журнал: Профилактическая медицина. 2022;25(6): 108‑116
DOI: 10.17116/profmed202225061108
Как цитировать:
Гуманова Н.Г. Валидные онкомаркеры: скрининг, диагностика, прогноз онкозаболеваний.
Gumanova NG. Valid tumor markers: screening, diagnosis, prognosis of cancer. Profilakticheskaya Meditsina. 2022;25(6):108‑116. (In Russ.).
https://doi.org/10.17116/profmed202225061108
?>
Закрыть метаданные
Онкологические заболевания по смертности населения в развитых странах, уступая сердечно-сосудистым заболеваниям, занимают лидирующие позиции, и выживаемость при такой патологии напрямую зависит от срока распознавания. Поэтому вопросы разработки и внедрения надежных алгоритмов прогноза и методов ранней диагностики приобретают особенную остроту. Общей чертой онкомаркеров, ограничивающей возможности их клинического использования, зачастую является довольно низкая чувствительность и специфичность скрининга, диагностики или прогноза. Поэтому чрезвычайно важна процедура валидации биомаркера, с помощью которой среди массы других исследуемых претендентов можно выделить онкомаркеры, пригодные для использования в клинических целях. Понимание процесса валидации важно для клинициста с точки зрения надежности использования биомаркера в собственной практике. В настоящем обзоре представлены актуализированные на сегодняшний день валидные онкомаркеры, используемые как диагностические, скрининговые или прогностические тесты на ряд онкологических заболеваний. Возможно, эта информация будет полезна врачам разных профилей как дополнительный инструмент при ведении пациентов.
Поэтому вопросы разработки и внедрения надежных алгоритмов прогноза и методов ранней диагностики приобретают особенную остроту. Общей чертой онкомаркеров, ограничивающей возможности их клинического использования, зачастую является довольно низкая чувствительность и специфичность скрининга, диагностики или прогноза. Поэтому чрезвычайно важна процедура валидации биомаркера, с помощью которой среди массы других исследуемых претендентов можно выделить онкомаркеры, пригодные для использования в клинических целях. Понимание процесса валидации важно для клинициста с точки зрения надежности использования биомаркера в собственной практике. В настоящем обзоре представлены актуализированные на сегодняшний день валидные онкомаркеры, используемые как диагностические, скрининговые или прогностические тесты на ряд онкологических заболеваний. Возможно, эта информация будет полезна врачам разных профилей как дополнительный инструмент при ведении пациентов.
Ключевые слова:
онкологические заболевания
валидация
биомаркеры
онкомаркеры
неинвазивная диагностика
Авторы:
Гуманова Н. Г.
Г.
ФГБУ «Национальный медицинский исследовательский центр терапии и профилактической медицины» Минздрава России
Список литературы:
- Biomarkers Definitions Working Group: Biomarkers and surrogate endpoints: Preferred definitions and conceptual framework. Clinical Pharmacology and Therapeutics. 2001;69(3):89-95. https://doi.org/10.1067/mcp.2001.113989
- Sharma S. Tumor markers in clinical practice: General principles and guidelines. Indian Journal of Medical and Paediatric Oncology. 2009;30(1):1-8. https://doi.org/10.4103/0971-5851.56328
- Anderson N. The Clinical Plasma Proteome: A Survey of Clinical Assays for Proteins in Plasma and Serum. Clinical Chemistry. 2010;56(2):177-185. https://doi.org/10.1373/clinchem.2009.126706
- Addona TA, Abbatiello SE, Schilling B, Skates SJ, Mani DR, Bunk DM, Spiegelman CH, Zimmerman LJ, Ham AJ, Keshishian H, Hall SC, Allen S, Blackman RK, Borchers CH, Buck C, Cardasis HL, Cusack MP, Dodder NG, Gibson BW, Held JM, Hiltke T, Jackson A, Johansen EB, Kinsinger CR, Li J, Mesri M, Neubert TA, Niles RK, Pulsipher TC, Ransohoff D, Rodriguez H, Rudnick PA, Smith D, Tabb DL, Tegeler TJ, Variyath AM, Vega-Montoto LJ, Wahlander A, Waldemarson S, Wang M, Whiteaker JR, Zhao L, Anderson NL, Fisher SJ, Liebler DC, Paulovich AG, Regnier FE, Tempst P, Carr SA.
 Multi-site assessment of the precision and reproducibility of multiple reaction monitoring-based measurements of proteins in plasma. Nature Biotechnology. 2009;27(7):633-641. https://doi.org/10.1038/nbt.1546
Multi-site assessment of the precision and reproducibility of multiple reaction monitoring-based measurements of proteins in plasma. Nature Biotechnology. 2009;27(7):633-641. https://doi.org/10.1038/nbt.1546 - Füzéry A, Levin J, Chan M, Chan D. Translation of proteomic biomarkers into FDA approved cancer diagnostics: issues and challenges. Clinical Proteomics. 2013;10(1):13. https://doi.org/10.1186/1559-0275-10-13
- Draft Guidance for Industry and FDA Staff Medical Devices: The Pre-Submission Program and Meetings with FDA Staff. Issued July 13, 2012. Accessed March 22, 2022. https://www.federalregister.gov/documents/2012/07/13/2012-17078/draft-guidance-for-industry-and-food-and-drug-administration-staff-medical-devices-the
- World Health Organization. The Global Cancer Observatory. Cancer over Time. United Kingdom Source: Globocan 2020. Accessed March 22, 2022. https://gco.iarc.fr/today/data/factsheets/populations/826-united-kingdom-fact-sheets.pdf
- Jemal A, Center MM, DeSantis C, Ward EM.
 Global patterns of cancer incidence and mortality rates and trends. Cancer Epidemiology, Biomarkers and Prevention. 2010;19(8):1893-907. https://doi.org/10.1158/1055-9965.EPI-10-0437
Global patterns of cancer incidence and mortality rates and trends. Cancer Epidemiology, Biomarkers and Prevention. 2010;19(8):1893-907. https://doi.org/10.1158/1055-9965.EPI-10-0437 - Center MM, Jemal A, Smith R, Ward E. Worldwide variations in colorectal cancer. CA: Cancer Journal for Clinicians. 2009;59(6):366-378. https://doi.org/10.3322/caac.20038
- Elsafi S, Alqahtani N, Zakary N, Zahrani E. The sensitivity, specificity, predictive values, and likelihood ratios of fecal occult blood test for the detection of colorectal cancer in hospital settings. Clinical and Experimental Gastroenterology. 2015;8:279-284. https://doi.org/10.2147/CEG.S86419
- Saridemir S, Güven H, Aksel B, Doğan L. Serum AMDL DR-70 levels: A new concept in the diagnosis and follow-up of colorectal carcinoma. Biomarkers in Medicine. 2020;14(8):621-628. https://doi.org/10.2217/bmm-2020-0004
- Arhan M, Yılmaz H, Önal I, Kocabıyık M, Erdal H, İbiş M. DR-70 as a novel diagnostic biomarker for gastric cancer.
 The Turkish Journal of Gastroenterology. 2015;26(6):480-483. https://doi.org/10.5152/tjg.2015.0425
The Turkish Journal of Gastroenterology. 2015;26(6):480-483. https://doi.org/10.5152/tjg.2015.0425 - Dochez V, Caillon H, Vaucel E, Dimet J, Winer N, Ducarme G. Biomarkers and algorithms for diagnosis of ovarian cancer: CA125, HE4, RMI and ROMA, a review. Journal of Ovarian Research. 2019;12(1):28. https://doi.org/10.1186/s13048-019-0503-7
- Zhang Z. An In Vitro Diagnostic Multivariate Index Assay (IVDMIA) for Ovarian Cancer: Harvesting the Power of Multiple Biomarkers. Reviews in Obstetrics and Gynecology. 2012;5(1):35-41.
- Donepudi MS, Kondapalli K, Amos SJ, Venkanteshan P. Breast cancer statistics and markers. Journal of Cancer research and Therapeutics. 2014;10(3): 506-511.
- De Wit S, van Dalum S, Lenferink ATM, Tibbe AGJ, Hiltermann TJN, Groen HJM, van Rijn CJM, Terstappen LWMM. The detection of EpCAM+ and EpCAM– circulating tumor cells. Scientific Reports. 2015;5:12270. https://doi.org/10.1038/srep12270
- Raiter A, Zlotnik O, Lipovetsky J, Mugami S, Dar S, Lubin I, Sharon E, Cohen C, Yerushalmi R.
 A novel role for an old target: CD45 for breast cancer immunotherapy. Oncoimmunology. 2021;10(1):1929725. https://doi.org/10.1080/2162402X.2021.1929725
A novel role for an old target: CD45 for breast cancer immunotherapy. Oncoimmunology. 2021;10(1):1929725. https://doi.org/10.1080/2162402X.2021.1929725 - Choo AB, Tan HL, Ang SN, Fong WJ, Chin A, Lo J, Zheng L, Hentze H, Philp RJ, Oh SK, Yap M. Selection against undifferentiated human embryonic stem cells by a cytotoxic antibody recognizing podocalyxin-like protein-1. Stem Cells. 2008;26(6):1454-1463. https://doi.org/10.1634/stemcells.2007-0576
- Eyvazi S, Farajnia S, Dastmalchi S, Kanipour F, Zarredar H, Bandehpour M. Antibody Based EpCAM Targeted Therapy of Cancer, Review and Update. Current Cancer Drug Targets. 2018;18(9):857-868. https://doi.org/10.2174/1568009618666180102102311
- Spizzo G, Went P, Dirnhofer S, Obrist P, Simon R, Spichtin H, Maurer R, Metzger U, von Castelberg B, Bart R, Stopatschinskaya S, Köchli OR, Haas P, Mross F, Zuber M, Dietrich H, Bischoff S, Mirlacher M, Sauter G, Gastl G. High Ep-CAM expression is associated with poor prognosis in node-positive breast cancer.
 Breast Cancer Research and Treatment. 2004;86(3):207-213. https://doi.org/10.1023/B:BREA.0000036787.59816.01
Breast Cancer Research and Treatment. 2004;86(3):207-213. https://doi.org/10.1023/B:BREA.0000036787.59816.01 - Akita H, Nagano H, Takeda Y, Eguchi H, Wada H, Kobayashi S, Marubashi S, Tanemura M, Takahashi H, Ohigashi H, Tomita Y, Ishikawa O, Mori M, Doki Y. Ep-CAM is a significant prognostic factor in pancreatic cancer patients by suppressing cell activity. Oncogene. 2011;30(31):3468-3476. https://doi.org/10.1038/onc.2011.59
- Imrich S, Hachmeister M, Gires O. EpCAM and its potential role in tumor-initiating cells. Cell Adhesion and Migration. 2012;6(1):30-38. https://doi.org/10.4161/cam.18953
- Rheinländer A, Schraven B, Bommhardt U. CD45 in human physiology and clinical medicine. Immunology Letters. 2018;196:22-32. https://doi.org/10.1016/j.imlet.2018.01.009
- Wonodirekso N, Au C, Hadisaputra W, Affandi B, Rogers P. Cytokeratins 8, 18 and 19 in endometrial epithelial cells during the normal menstrual cycle and in women receiving Norplant®. Contraception.
 1993;48(5):481-493. https://doi.org/10.1016/0010-7824(93)90137-v
1993;48(5):481-493. https://doi.org/10.1016/0010-7824(93)90137-v - Gion M, Mione R, Leon AE, Lüftner D, Molina R, Possinger K, Robertson JF. CA27.29: A valuable marker for breast cancer management. A confirmatory multicentric study on 603 cases. European Journal of Cancer. 2001; 37(3):355-363. https://doi.org/10.1016/s0959-8049(00)00396-8
- Li X, Dai D, Chen B, Tang H, Xie X, Wei W. Clinicopathological and Prognostic Significance of Cancer Antigen 15-3 and Carcinoembryonic Antigen in Breast Cancer: A Meta-Analysis including 12,993 Patients. Disease Markers. 2018;2018:9863092. https://doi.org/10.1155/2018/9863092
- Duffy M, Evoy D, McDermott E. CA 15-3: uses and limitation as a biomarker for breast cancer. Clinica Chimica Acta; International Journal of Clinical Chemistry. 2010;411(23-24):1869-1874. https://doi.org/10.1016/j.cca.2010.08.039
- Li D, Mallory T, Satomura S. AFP-L3: A new generation of tumor marker for hepatocellular carcinoma. Clinica Chimica Acta; International Journal of Clinical Chemistry.
 2001;313(1-2):15-19. https://doi.org/10.1016/s0009-8981(01)00644-1
2001;313(1-2):15-19. https://doi.org/10.1016/s0009-8981(01)00644-1 - Abelev GI. Production of embryonal serum alpha-globulin by hepatomas: review of experimental and clinical. Cancer Research. 1968;28(7):1344-1350.
- Yang H, Zhang R, Zhao J, Hao D. Tumour-associated antigens and their anti-cancer applications. European Journal of Cancer Care. 2017;26(5):10.1111/ecc.12446. https://doi.org/10.1111/ecc.12446
- Duffy M. Tumor Markers in Clinical Practice: A Review Focusing on Common Solid Cancers. Medical Principles and Practice. 2012;22(1):4-11. https://doi.org/10.1159/000338393
- Jovanovic M, Soldatovic A, Janjic A, Vuksanovic A, Dzamic Z, Acimovic M, Hadzi-Djokic J. Diagnostic Value of the Nuclear Matrix Protein 22 Test and Urine Cytology in Upper Tract Urothelial Tumors. Urologia Internationalis. 2011;87(2):134-137. https://doi.org/10.1159/000330246
- Charpentier M, Gutierrez C, Guillaudeux T, Verhoes G, Pedeux R. Noninvasive Urine-Based Tests to Diagnose or Detect Recurrence of Bladder.
 Cancers. 2021;13(7):1650. https://doi.org/10.3390/cancers13071650
Cancers. 2021;13(7):1650. https://doi.org/10.3390/cancers13071650 - Jayaraman S, Chittiboyina S, Bai Y, Abad P, Vidi P, Stauffacher C, Lelièvre S. The nuclear mitotic apparatus protein NuMA controls rDNA transcription and mediates the nucleolar stress response in a p53-independent manner. Nucleic Acids Research. 2017;45(20):11725-11742. https://doi.org/10.1093/nar/gkx782
- Shariat S, Karam J, Lotan Y, Karakiewizc P. Critical Evaluation of Urinary Markers for Bladder Cancer Detection and Monitoring. Reviews in Urology. 2008;10(2):120-135.
- Luo G, Jin K, Deng S, Cheng H, Fan Z, Gong Y, Qian Y, Huang Q, Ni Q, Liu C, Yu X. Roles of CA19-9 in pancreatic cancer: Biomarker, predictor and promoter. Biochimica et Biophysica Acta. Reviews on Cancer. 2021;1875(2): 188409. https://doi.org/10.1016/j.bbcan.2020.188409
- Szymendera J. Clinical usefulness of three monoclonal antibody-defined tumor markers: CA 19-9, CA 50, and CA 125. Tumour Biology. 1986;7(5-6):333-342.

- Welander C. What do CA 125 and other antigens tell us about ovarian cancer biology? Acta Obstetricia et Gynecologica Scandinavica. Supplement. 1992; 155:85-93. https://doi.org/10.1111/j.1600-0412.1992.tb00012.x
- Leonard G, Low J, Berman A, Swain S. CA 125 elevation in breast cancer: A case report and review of the literature. The Breast Journal. 2004;10(2):146-149. https://doi.org/10.1111/j.1075-122x.2004.21374.x
- Le BV, Griffin CR, Loeb S, Carvalhal GF, Kan D, Baumann NA, Catalona WJ. [–2]Proenzyme prostate specific antigen is more accurate than total and free prostate specific antigen in differentiating prostate cancer from benign disease in a prospective prostate cancer screening study. Journal of Urology. 2010;183(4):1355-1359. https://doi.org/10.1016/j.juro.2009.12.056
- Duffy M. Biomarkers for prostate cancer: prostate-specific antigen and beyond. Clinical Chemistry and Laboratory Medicine. 2020;58(3):326-339. https://doi.org/10.1515/cclm-2019-0693
- Haugen BR, Alexander EK, Bible KC, Doherty GM, Mandel SJ, Nikiforov YE, Pacini F, Randolph GW, Sawka AM, Schlumberger M, Schuff KG, Sherman SI, Sosa JA, Steward DL, Tuttle RM, Wartofsky L.
 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid. 2016;26(1):1-133. https://doi.org/10.1089/thy.2015.0020
2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid. 2016;26(1):1-133. https://doi.org/10.1089/thy.2015.0020 - Algeciras-Schimnich A. Thyroglobulin measurement in the management of patients with differentiated thyroid cancer. Critical Reviews in Clinical Laboratory Sciences. 2018;55(3):205-218. https://doi.org/10.1080/10408363.2018.1450830
- Lin JD. Thyroglobulin and human thyroid cancer. Clinica Chimica Acta; International Journal of Clinical Chemistry. https://doi.org/10.1016/j.cca.2007.11.002
- Ge L, Pan B, Song F, Ma J, Zeraatkar D, Zhou J, Tian J. Comparing the diagnostic accuracy of five common tumour biomarkers and CA19-9 for pancreatic cancer: A protocol for a network meta-analysis of diagnostic test accuracy. BMJ Open. 2017;7(12):e018175. https://doi.org/10.1136/bmjopen-2017-018175
- Shen M, Wang H, Wei K, Zhang J, You C.
 Five common tumor biomarkers and CEA for diagnosing early gastric cancer: A protocol for a network meta-analysis of diagnostic test accuracy. Medicine (Baltimore). 2018;97(19):e0577. https://doi.org/10.1097/MD.0000000000010577
Five common tumor biomarkers and CEA for diagnosing early gastric cancer: A protocol for a network meta-analysis of diagnostic test accuracy. Medicine (Baltimore). 2018;97(19):e0577. https://doi.org/10.1097/MD.0000000000010577
 Wiener Klinische Wochenschrift. 2016;128(3-4):114-119. https://doi.org/10.1007/s00508-015-0867-7
Wiener Klinische Wochenschrift. 2016;128(3-4):114-119. https://doi.org/10.1007/s00508-015-0867-7 1999;14(1):129-135. https://doi.org/10.1359/jbmr.1999.14.1.129
1999;14(1):129-135. https://doi.org/10.1359/jbmr.1999.14.1.129 Association between alcohol and bone mineral density in a Mendelian randomization study: The Dong-gu study. Journal of Bone and Mineral Metabolism. 2022;40(1):167-173. https://doi.org/10.1007/s00774-021-01275-6
Association between alcohol and bone mineral density in a Mendelian randomization study: The Dong-gu study. Journal of Bone and Mineral Metabolism. 2022;40(1):167-173. https://doi.org/10.1007/s00774-021-01275-6 https://doi.org/10.1080/10408398.2021.1888691
https://doi.org/10.1080/10408398.2021.1888691Закрыть метаданные
валидит
valid.it заново изобретает систему обнаружения мошенничества для современного рынка. Платформа на основе искусственного интеллекта позволяет проводить дистанционное неинвазивное тестирование с максимальной точностью и простотой использования.
Заказать демонстрацию
Завоюйте доверие, используя только свой смартфон!
valid. it создал первую в мире платформу обнаружения мошенничества, основанную на биологических науках, для которой требуется только смартфон. Наша революционная платформа обеспечивает высокоточное обнаружение мошенничества удаленным и бесконтактным способом, а также легко проверяет заявления или заявления об отказе от ответственности.
it создал первую в мире платформу обнаружения мошенничества, основанную на биологических науках, для которой требуется только смартфон. Наша революционная платформа обеспечивает высокоточное обнаружение мошенничества удаленным и бесконтактным способом, а также легко проверяет заявления или заявления об отказе от ответственности.
Этот процесс создает основу доверия для масштабирования вашего бизнеса
и построения доверительных отношений с клиентами и сотрудниками.
Работает с любым смартфоном
Доступно в любое время и в любом месте
10-минутное тестирование
Нулевое обучение
Высокая адаптивность
Экономически эффективным
Межотраслевые решения
Наш обширный и уникальный опыт в обнаружении мошенничества за годы работы в израильских агентствах безопасности
позволил нам сформировать решение, которое легко подходит для всех цифровых платформ
для проверки доверия между людьми и компаниями в бесчисленном множестве разнообразных сектора.
- Подбор сотрудников
- Страховой андеррайтинг
- Финансовые отчеты
- Проверка претензий
- Пограничный контроль
Наша технология
Используя запатентованные алгоритмы искусственного интеллекта и машинного обучения, valid.it анализирует бионаучные и когнитивные ответы, чтобы определить, можно ли доверять участнику. Результатом является быстрое, автоматизированное, прозрачное, доступное и гибкое решение, обеспечивающее точность, аналогичную физическим испытаниям.
КАК ЭТО РАБОТАЕТ
Участник получает ссылку и загружает приложение.
Они входят в частную и безопасную учетную запись и предоставляют соответствующие данные.
Короткий, дискретный и неинвазивный тест проводится в любом месте и в любое время.
Администратор тестирования получает результаты и информацию в течение нескольких минут.
Заказать демонстрацию
Доверено
Лидерство
Авивит Йоркевич
Соучредитель и генеральный директор
Старший офицер и эксперт по исследованиям и разработкам на полиграфе в службах безопасности Израиля с более чем 20-летним опытом. Член АПА и МПА. Старший допуск к безопасности в качестве консультанта по оценке Министерства обороны Израиля.
Йосси Пениас
Соучредитель, главный операционный директор
Старший офицер израильской службы безопасности и специалист по гуманитарным вопросам с более чем 20-летним опытом. Специализируется на передовых методах полиграфа и детекции лжи.
Джеки Хазан
Старший руководитель отдела высоких технологий с 20-летним опытом руководства межфункциональными командами и запуска коммерческих продуктов для миллионов пользователей.
Алон Морадов
Data Scientist
Более 10 лет опыта работы в отделе кибербезопасности ВВС Израиля. Руководил научно-исследовательскими инициативами по обнаружению изощренных кибератак.
Руководил научно-исследовательскими инициативами по обнаружению изощренных кибератак.
Анаэль Шомрай
Руководитель отдела исследований и разработок
Старший инженер-программист полного стека. Руководитель отдела исследований и разработок Intervyo, создал решение для подбора персонала на основе ИИ как в Интернете, так и на мобильных устройствах.
Совет директоров
Ави Бордюры
Председатель правления
Президент и главный исполнительный директор Teuza Management, Кербс, обладающий более чем 20-летним опытом работы в сфере высоких технологий и управления, основал Teuza в 1992 году. компании. Он также занимал пост директора в советах директоров нескольких публичных компаний, акции которых торгуются на Nasdaq.
Кербс является членом Совета управляющих Техниона и Хайфского университета, а также занимал должность председателя Научно-академического клуба Хайфского университета.
Консультативный совет
Д-р Эли Оппер
Председатель клуба столетия Техниона, бывший главный научный сотрудник Министерства промышленности, торговли и труда Израиля, бывший президент европейского фонда исследований и разработок Eureka, старший партнер Giza Venture Capital, вице-президент по исследованиям и разработкам, Вице-президент по продвинутым темам и генеральный директор подразделения электронных систем Rafael.
Орит Став
Менеджер по международным инвестициям с более чем 20-летним опытом работы в области венчурного капитала и прямых инвестиций. Орит представлял Siemens Venture Capital в Израиле и был партнером PNV. Она является членом совета директоров не менее чем в восьми публичных компаниях.
Доктор Ор Яир
Кандидат технических наук в области машинного обучения, сигналов и считается экспертом по обработке изображений. Он имеет более 10 лет опыта в алгоритмическом структурировании и работал с ведущими отраслевыми компаниями над их самыми сложными проектами (Microsoft, WD, RAFAEL, IAI, RADA и т. д.).
ПОДДЕРЖЕН:
Просто загрузите его из всех основных магазинов приложений.
Нет. Автоматизированное удобное приложение интуитивно понятно и просто в использовании.
Тест обеспечивает точность 85%, аналогичную физическому тесту на детекторе лжи.
Большинство тестов выполняется менее чем за 10 минут. В некоторых случаях может быть несколько минут больше.
В некоторых случаях может быть несколько минут больше.
Да. Приложение очень интуитивно понятное и не требует обучения.
Да, все, что вам нужно, это тихое место, 10 минут концентрации и стабильное подключение к Интернету — и, конечно же, ваш смартфон.
Тест включает встроенные перерывы для максимального удобства.
действителен. доступен для всех устройств
* Доступно на iPhone, iPad и всех устройствах Android
Действительный ИТ-решения Eurofins Food Safety Solutions
Действительный IT-код
Вам необходимо войти в систему, чтобы использовать Valid IT
1. Обзор
Valid-IT управляется Eurofins от имени участвующих розничных продавцов для контроля риска загрязнения определенных ГМ материалов ГМО. Используемая модель представляет собой модель цепочки поставок, в которой все поставщики чувствительных материалов, за исключением производителей, должны быть одобрены Valid-IT. Частью процесса утверждения будет оценка контроля производителей для обеспечения статуса не-ГМО.
Частью процесса утверждения будет оценка контроля производителей для обеспечения статуса не-ГМО.
Одобрение Valid-IT само по себе не гарантирует, что любая отдельная партия материала не будет загрязнена ГМО, но оценивает существующие системы для сведения к минимуму риска такого загрязнения.
2. Сфера действия
Все пищевые продукты и добавки розничной торговли, которые содержат ингредиенты, подлежащие контролю, или полученные из материалов, подлежащих контролю, подпадают под действие этой политики.
Контролируемые ингредиенты определяются конкретным продавцом и в настоящее время
- Кукуруза и продукты из нее
- Соя и продукты из нее
- Семена хлопчатника и продукты из них
- Рапсовое масло не из ЕС или полученное из рапса не из ЕС и продуктов из него
Технологические добавки, переходящие добавки и другие вещества, которые не указаны на этикетке продукта, исключены из политики. Эти ингредиенты могут подлежать особому контролю в соответствии с политикой розничного продавца. Одобрение Valid-IT относится только к загрязнению ГМО и не указывает на соответствие каким-либо другим соответствующим политикам розничной торговли. Поставщики по-прежнему несут ответственность за обеспечение соблюдения всех правил розничной торговли.
Эти ингредиенты могут подлежать особому контролю в соответствии с политикой розничного продавца. Одобрение Valid-IT относится только к загрязнению ГМО и не указывает на соответствие каким-либо другим соответствующим политикам розничной торговли. Поставщики по-прежнему несут ответственность за обеспечение соблюдения всех правил розничной торговли.
3. Процесс признания действительным ИТ
Системы
Должна существовать наглядная система контроля материалов, потенциально загрязненных ГМО. Обычно они относятся к 3 категориям:
- Сертификация IP
Сертификат и аудиторский отчет от признанного инспекционного органа, работающего по стандарту, эквивалентному аудиту ИС Eurofins, предоставляются для проверки. Продукты, требующие одобрения Valid-IT, должны быть подробно описаны в рамках аудита интеллектуальной собственности. - Сертификация BRC/IFS/BS
Для проверки предоставляется сертификат и аудиторский отчет от признанного инспекционного органа. Контроль материалов ИС должен быть конкретно в рамках аудита (материалы Valid-IT должны подлежать контролю, эквивалентному материалам ИС). Продукты, требующие одобрения Valid-IT, должны быть подробно описаны в рамках аудита.
Контроль материалов ИС должен быть конкретно в рамках аудита (материалы Valid-IT должны подлежать контролю, эквивалентному материалам ИС). Продукты, требующие одобрения Valid-IT, должны быть подробно описаны в рамках аудита. - Сертификация отсутствует
Сертификация не является требованием системы Valid-IT, но при ее отсутствии должны быть предоставлены документальные подтверждения, эквивалентные тем, которые требуются для аккредитации интеллектуальной собственности Eurofins. Это будет включать:- Контроль поставщиков
- Контроль сырья
- Сегрегация при хранении
- Технологический поток
- Режимы проверки и испытаний
- Любая другая информация, имеющая отношение к управлению GM
 Об этом будет сообщено до начала оценки представленных доказательств.
Если представленных доказательств недостаточно для обеспечения уверенности в действующем контроле, может потребоваться запросить стороннюю проверку перед утверждением. Эта проверка будет за счет заявителей. Eurofins не может рекомендовать какой-либо конкретный аудиторский орган, поскольку это может привести к конфликту интересов.
Об этом будет сообщено до начала оценки представленных доказательств.
Если представленных доказательств недостаточно для обеспечения уверенности в действующем контроле, может потребоваться запросить стороннюю проверку перед утверждением. Эта проверка будет за счет заявителей. Eurofins не может рекомендовать какой-либо конкретный аудиторский орган, поскольку это может привести к конфликту интересов.
Поставщики
Все поставщики, за исключением поставщиков сельскохозяйственной продукции, должны быть перечислены в Valid-IT.
Поставщики, которые уже перечислены в Valid-IT, могут быть использованы для поставки любых материалов в рамках их списка.
Если вашего поставщика нет в списке Valid-IT, вы можете зарегистрировать его в качестве единственного поставщика для вас. Все требуемые доказательства должны быть представлены от имени поставщика, а условия включения в список будут такими же, как и для любого другого поставщика. Этот поставщик будет отображаться только в вашей записи на веб-сайте и обычно не будет доступен для поставки материалов Valid-IT. Стоимость для каждого зарегистрированного единственного поставщика будет такой же, как и для индивидуальной заявки.
Н.Б. Сертификации IP недостаточно для поставки материалов Valid-IT. Только одобрение Valid-IT, поскольку это модель цепочки поставок.
Этот поставщик будет отображаться только в вашей записи на веб-сайте и обычно не будет доступен для поставки материалов Valid-IT. Стоимость для каждого зарегистрированного единственного поставщика будет такой же, как и для индивидуальной заявки.
Н.Б. Сертификации IP недостаточно для поставки материалов Valid-IT. Только одобрение Valid-IT, поскольку это модель цепочки поставок.
Должны быть доступны доказательства, либо из аудиторских отчетов, либо из представленных документов, о контроле поставщиков сельскохозяйственной продукции для обеспечения статуса не-ГМО.
Тестирование
К заявке должны быть приложены три последних анализа, проведенных независимой лабораторией, аккредитованной для анализа ГМО.
Продление
Продление требуется ежегодно. Доказательства, представляемые для продления, должны быть такими же, как и для нового заявления, как указано выше.
Вариации
О любых существенных изменениях статуса аккредитации или процессов, которые могут существенно повлиять на статус GM продукта, необходимо уведомлять Eurofins. Нет необходимости информировать Eurofins о каких-либо изменениях в поставщиках, если они являются поставщиками, утвержденными Valid-IT, и закупаемые материалы входят в объем поставщиков, как указано в Valid-IT. Эти изменения могут быть зафиксированы при обновлении.
Любые поставщики, не одобренные Valid-IT, не должны использоваться для поставки материалов Valid-IT до тех пор, пока их одобрение Valid-IT не будет завершено.
Если поставщики теряют свое одобрение Valid-IT, вы будете уведомлены об этом, и вы должны прекратить использовать этих поставщиков до тех пор, пока их одобрение не будет восстановлено.
Eurofins следует уведомлять о любых случаях изъятия несоответствующих материалов или продукции, имеющих отношение к этой политике и влияющих на вашу цепочку поставок.
Нет необходимости информировать Eurofins о каких-либо изменениях в поставщиках, если они являются поставщиками, утвержденными Valid-IT, и закупаемые материалы входят в объем поставщиков, как указано в Valid-IT. Эти изменения могут быть зафиксированы при обновлении.
Любые поставщики, не одобренные Valid-IT, не должны использоваться для поставки материалов Valid-IT до тех пор, пока их одобрение Valid-IT не будет завершено.
Если поставщики теряют свое одобрение Valid-IT, вы будете уведомлены об этом, и вы должны прекратить использовать этих поставщиков до тех пор, пока их одобрение не будет восстановлено.
Eurofins следует уведомлять о любых случаях изъятия несоответствующих материалов или продукции, имеющих отношение к этой политике и влияющих на вашу цепочку поставок.
4. Альтернативы
Систему можно использовать для составления списка ингредиентов, альтернативных материалам, контролируемым Valid-IT, напр. подсолнечный лецитин вместо соевого лецитина. Это не
контролируемых материалов, но при необходимости будет взиматься плата за листинг. Если альтернативные ингредиенты производятся на том же предприятии, что и контролируемые
ингредиенты подробности о процедурах разделения, чтобы гарантировать отсутствие
должно быть обеспечено перекрестное загрязнение контролируемыми ингредиентами.
Если альтернативные ингредиенты производятся на том же предприятии, что и контролируемые
ингредиенты подробности о процедурах разделения, чтобы гарантировать отсутствие
должно быть обеспечено перекрестное загрязнение контролируемыми ингредиентами.
5. Другая информация
Веб-сайт: http://www.valid-it.com
Справки: [email protected]
1. Обзор
Valid-IT администрируется Eurofins от имени участвующих розничных продавцов для контроля риска загрязнения определенных специй незаконными красителями. Используемая модель представляет собой модель цепочки поставок, в которой все поставщики чувствительных материалов, за исключением производителей, должны быть одобрены Valid-IT.
Одобрение Valid-IT само по себе не гарантирует, что любая отдельная партия материала не будет загрязнена незаконными красителями, но оценивает существующие системы для сведения к минимуму риска такого загрязнения.
2. Сфера действия
Все пищевые продукты и добавки розничной торговли, которые содержат ингредиенты, подлежащие контролю, или полученные из материалов, подлежащих контролю, подпадают под действие этой политики.
Контролируемые ингредиенты определяются конкретным продавцом и в настоящее время
- Стручковый перец (паприка, чили, кайенский перец)
- Куркума
- Составные ингредиенты, содержащие контролируемые специи
Свежие специи, сушеные и нарезанные специи и экстракты специй, включая красители и живичные смолы, не подпадают под действие этой политики, однако имейте в виду, что некоторые ингредиенты, используемые в вышеуказанных продуктах, могут подпадать под действие политики отсутствия ГМО. Эти ингредиенты также могут подлежать особому контролю в соответствии с политикой розничного продавца. Одобрение Valid-IT относится только к загрязнению незаконными красителями и не указывает на соблюдение каких-либо других соответствующих политик розничной торговли. Поставщики по-прежнему несут ответственность за обеспечение соблюдения всех правил розничной торговли.
Одобрение Valid-IT относится только к загрязнению незаконными красителями и не указывает на соблюдение каких-либо других соответствующих политик розничной торговли. Поставщики по-прежнему несут ответственность за обеспечение соблюдения всех правил розничной торговли.
3. Процесс признания Valid-IT
Системы
Должна существовать наглядная система контроля материалов, потенциально загрязненных нелегальными красителями. Обычно они относятся к 2 категориям:
- Сертификация BRC/IFS/BS
Для проверки предоставляется сертификат и аудиторский отчет от признанного инспекционного органа. Контроль уязвимых материалов должен быть конкретно в рамках аудита. - Сертификация отсутствует
Сертификация не является требованием системы Valid-IT, но при ее отсутствии должны быть предоставлены документальные доказательства, эквивалентные тем, которые требуются для аккредитованного аудита. Это будет включать:
Это будет включать:- Контроль поставщиков
- Прослеживаемость от первого измельчения до готового продукта
- Документированная система качества
Поставщики
Все поставщики, за исключением сельскохозяйственных поставщиков или поставщиков освобожденных материалов,
должны быть указаны в Valid-IT. Поставщики, которые уже перечислены в Valid-IT, могут быть использованы для поставки любых материалов в рамках их списка.
Если вашего поставщика нет в списке Valid-IT, вы можете зарегистрировать его в качестве единственного поставщика для вас. Все требуемые доказательства должны быть представлены от имени поставщика, а условия включения в список будут такими же, как и для любого другого поставщика. Этот поставщик будет отображаться только в вашей записи на веб-сайте и не будет общедоступным для поставки материалов Valid-IT. Стоимость для каждого зарегистрированного единственного поставщика будет такой же, как и для отдельного приложения.
Поставщики, которые уже перечислены в Valid-IT, могут быть использованы для поставки любых материалов в рамках их списка.
Если вашего поставщика нет в списке Valid-IT, вы можете зарегистрировать его в качестве единственного поставщика для вас. Все требуемые доказательства должны быть представлены от имени поставщика, а условия включения в список будут такими же, как и для любого другого поставщика. Этот поставщик будет отображаться только в вашей записи на веб-сайте и не будет общедоступным для поставки материалов Valid-IT. Стоимость для каждого зарегистрированного единственного поставщика будет такой же, как и для отдельного приложения.
Тестирование
Каждая партия/партия материала Valid-IT должна быть проверена в аккредитованной лаборатории на наличие запрещенных красителей.
Вместе с заявкой должны быть представлены три самых последних из этих анализов для каждой перечисляемой специи. Минимальные требования – это испытания на суданские красители I-IV и Para Red с использованием общепризнанного метода. В тех случаях, когда оценка риска диктует необходимость тестирования следующих цветов, в соответствии с рекомендациями Агентства по пищевым стандартам: Суданский красный B, Суданский красный 7B, Суданский красный G, Масло желтое, Метаниловый желтый, Оранжевый G, Родамин B, Оранжевый II , толуидин красный, аннато, биксин и норбиксин.
Минимальные требования – это испытания на суданские красители I-IV и Para Red с использованием общепризнанного метода. В тех случаях, когда оценка риска диктует необходимость тестирования следующих цветов, в соответствии с рекомендациями Агентства по пищевым стандартам: Суданский красный B, Суданский красный 7B, Суданский красный G, Масло желтое, Метаниловый желтый, Оранжевый G, Родамин B, Оранжевый II , толуидин красный, аннато, биксин и норбиксин.
Продление
Продление требуется ежегодно. Доказательства, представляемые для продления, должны быть такими же, как и для нового заявления, как указано выше.
Вариации
Eurofins необходимо уведомлять о любых существенных изменениях статуса аккредитации или процессов, которые могут существенно повлиять на статус продукта.
Нет необходимости информировать Eurofins о каких-либо изменениях в поставщиках, если они являются поставщиками, утвержденными Valid-IT, и закупаемые материалы входят в объем поставщиков, как указано в Valid-IT.
 Multi-site assessment of the precision and reproducibility of multiple reaction monitoring-based measurements of proteins in plasma. Nature Biotechnology. 2009;27(7):633-641. https://doi.org/10.1038/nbt.1546
Multi-site assessment of the precision and reproducibility of multiple reaction monitoring-based measurements of proteins in plasma. Nature Biotechnology. 2009;27(7):633-641. https://doi.org/10.1038/nbt.1546 Global patterns of cancer incidence and mortality rates and trends. Cancer Epidemiology, Biomarkers and Prevention. 2010;19(8):1893-907. https://doi.org/10.1158/1055-9965.EPI-10-0437
Global patterns of cancer incidence and mortality rates and trends. Cancer Epidemiology, Biomarkers and Prevention. 2010;19(8):1893-907. https://doi.org/10.1158/1055-9965.EPI-10-0437 The Turkish Journal of Gastroenterology. 2015;26(6):480-483. https://doi.org/10.5152/tjg.2015.0425
The Turkish Journal of Gastroenterology. 2015;26(6):480-483. https://doi.org/10.5152/tjg.2015.0425 A novel role for an old target: CD45 for breast cancer immunotherapy. Oncoimmunology. 2021;10(1):1929725. https://doi.org/10.1080/2162402X.2021.1929725
A novel role for an old target: CD45 for breast cancer immunotherapy. Oncoimmunology. 2021;10(1):1929725. https://doi.org/10.1080/2162402X.2021.1929725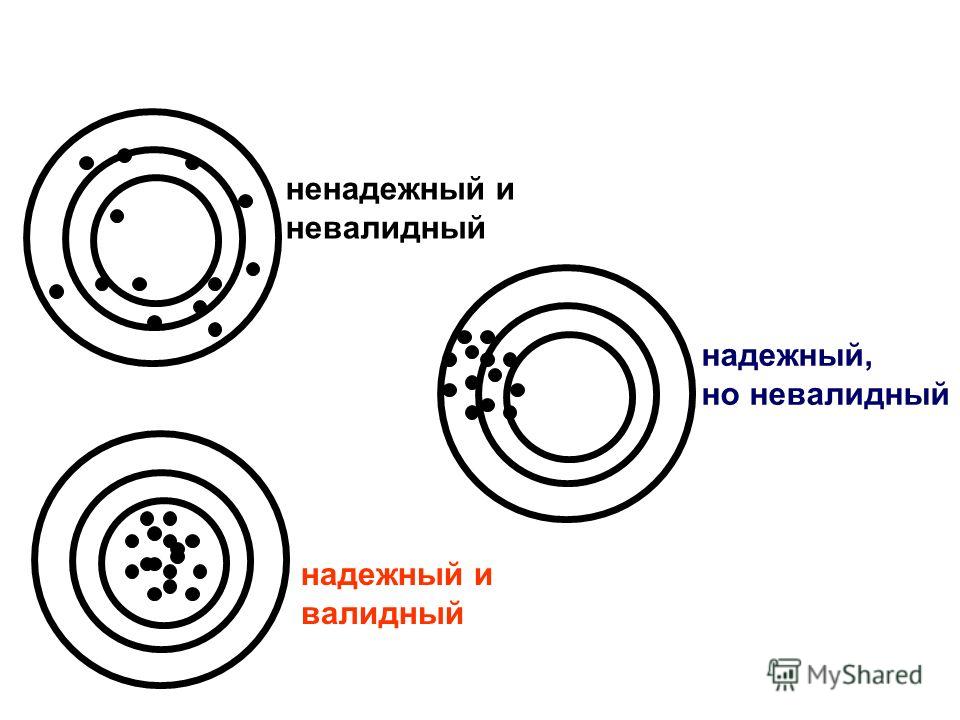 Breast Cancer Research and Treatment. 2004;86(3):207-213. https://doi.org/10.1023/B:BREA.0000036787.59816.01
Breast Cancer Research and Treatment. 2004;86(3):207-213. https://doi.org/10.1023/B:BREA.0000036787.59816.01 1993;48(5):481-493. https://doi.org/10.1016/0010-7824(93)90137-v
1993;48(5):481-493. https://doi.org/10.1016/0010-7824(93)90137-v 2001;313(1-2):15-19. https://doi.org/10.1016/s0009-8981(01)00644-1
2001;313(1-2):15-19. https://doi.org/10.1016/s0009-8981(01)00644-1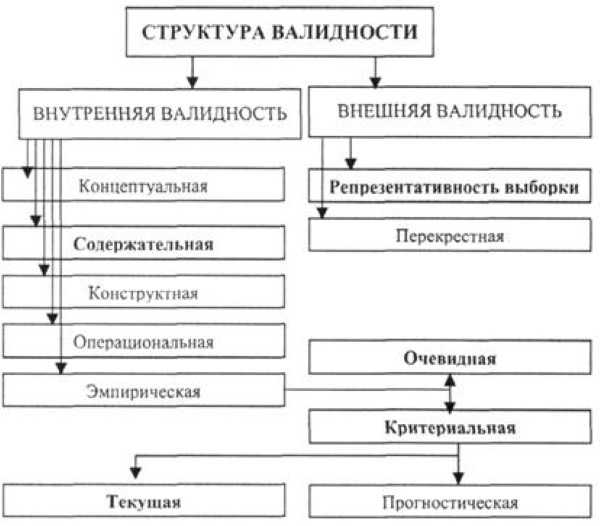 Cancers. 2021;13(7):1650. https://doi.org/10.3390/cancers13071650
Cancers. 2021;13(7):1650. https://doi.org/10.3390/cancers13071650
 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid. 2016;26(1):1-133. https://doi.org/10.1089/thy.2015.0020
2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid. 2016;26(1):1-133. https://doi.org/10.1089/thy.2015.0020 Five common tumor biomarkers and CEA for diagnosing early gastric cancer: A protocol for a network meta-analysis of diagnostic test accuracy. Medicine (Baltimore). 2018;97(19):e0577. https://doi.org/10.1097/MD.0000000000010577
Five common tumor biomarkers and CEA for diagnosing early gastric cancer: A protocol for a network meta-analysis of diagnostic test accuracy. Medicine (Baltimore). 2018;97(19):e0577. https://doi.org/10.1097/MD.0000000000010577 Контроль материалов ИС должен быть конкретно в рамках аудита (материалы Valid-IT должны подлежать контролю, эквивалентному материалам ИС). Продукты, требующие одобрения Valid-IT, должны быть подробно описаны в рамках аудита.
Контроль материалов ИС должен быть конкретно в рамках аудита (материалы Valid-IT должны подлежать контролю, эквивалентному материалам ИС). Продукты, требующие одобрения Valid-IT, должны быть подробно описаны в рамках аудита. Об этом будет сообщено до начала оценки представленных доказательств.
Если представленных доказательств недостаточно для обеспечения уверенности в действующем контроле, может потребоваться запросить стороннюю проверку перед утверждением. Эта проверка будет за счет заявителей. Eurofins не может рекомендовать какой-либо конкретный аудиторский орган, поскольку это может привести к конфликту интересов.
Об этом будет сообщено до начала оценки представленных доказательств.
Если представленных доказательств недостаточно для обеспечения уверенности в действующем контроле, может потребоваться запросить стороннюю проверку перед утверждением. Эта проверка будет за счет заявителей. Eurofins не может рекомендовать какой-либо конкретный аудиторский орган, поскольку это может привести к конфликту интересов. Это будет включать:
Это будет включать: