404 Cтраница не найдена
- Университет
- Руководство
- Ректорат
- Обращение к ректору
- Ученый совет
- Университету 90 лет
- Телефонный справочник
- Документы
- Структура
- СМИ о вузе
- Символика БГМУ
- Электронный ящик доверия
- Комплексная программа развития БГМУ
- Антитеррор
- Абитуриенту
- Обращение граждан
- Фотогалерея
- Карта сайта
- Видеогалерея
- Оплата банковской картой
- Реорганизация вуза
- Календарь мероприятий
- Образование
- Учебно-методическое управление
- Центр практических навыков
- Факультеты
- Кафедры
- Институт дополнительного профессионального образования
- Приемная комиссия
- Медицинский колледж
- Деканат по работе с иностранными обучающимися
- Управление международной деятельности
- Отдел ординатуры
- Расписание
- Менеджмент качества
- Федеральный аккредитационный центр
- Научно-образовательный медицинский кластер «Нижневолжский»
- Государственная итоговая аттестация
- Первичная аккредитация
- Первичная специализированная аккредитация
- Внутренняя оценка качества образования
- Информация для инвалидов и лиц с ограниченными возможностями здоровья
- Информация для студентов
- Я-профессионал
- Всероссийская студенческая олимпиада по хирургии с международным участием
- Медицинский инспектор
- Онлайн обучение
- Социальная работа в системе здравоохранения
- Новые образовательные программы
- Электронная учебная библиотека
- Периодическая аккредитация
- Независимая оценка качества образования
- Профессиональное обучение
- Наука и инновации
- Наука и университеты
- Структура и документы
- Указ Президента Российской Федерации «О стратегии научно-технологического развития Российской Федерации»
- Стратегия развития медицинской науки до 2025 года
- Научно-исследовательские подразделения
- Клинические исследования и испытания, ЛЭК
- Диссертационные советы
- Докторантура
- Аспирантура
- Грантовая политика БГМУ
- Актуальные гранты, стипендии, конкурсы
- Конференции и форумы
- Гранты, премии, конкурсы, конференции для молодых ученых
- Полезные интернет-ссылки
- Научные издания
- Проблемные научные комиссии
- Патентная деятельность
- БГМУ в рейтингах университетов
- Публикационная активность
- НИИ кардиологии
- Институт урологии и клинической онкологии
- Репозиторий БГМУ
- Евразийский НОЦ
- Лечебная работа
- Клиника БГМУ
- Всероссийский центр глазной и пластической хирургии
- Уф НИИ ГБ
- Клиническая стоматологическая поликлиника
- Клинические базы
- Отчеты по лечебной работе
- Договорная работа с клиническими базами
- Отделения клиники БГМУ
- Лицензии
- Санаторий-профилакторий БГМУ
- Жизнь БГМУ
- Воспитательная и социальная работа
- Отдел по культурно-массовой работе
- Отдел по связям с общественностью
- Общественные объединения и органы самоуправления
- Отдел по воспитательной и социальной работе
- Творческая жизнь
- Спортивная жизнь
- Профсоюз обучающихся БГМУ
- Профсоюзный комитет
- Совет кураторов
- Совет обучающихся
- Ассоциация выпускников
- Работа музеев на кафедрах
- Выпускники БГМУ – ветераны ВОВ
- Золотой фонд БГМУ
- БГМУ — ВУЗ здорового образа жизни
- Юбиляры
- Жизнь иностранных студентов БГМУ
- Университету 90 лет
- Университету 85 лет
- Празднование 75-летия Победы в Великой Отечественной войне
- Научная библиотека
- Приоритет 2030
- О программе
- Проектный офис
- Стратегические проекты
- Миссия и стратегия
- Цифровая кафедра
- Конкурсы для студентов
- Отчетность
- Публикации в СМИ
- Программа развития
- Научные семинары для студентов и ученых БГМУ
- Новости
Сведения об общеобразовательной организации
Муниципальное автономное общеобразовательное учреждение средняя общеобразовательная школа имени С. Е. Кузнецова с. Чемодановка
Е. Кузнецова с. Чемодановка
Пензенская область, Бессоновский район, с. Чемодановка, улица Школьная, дом 1а
- Сведения об образовательной организации
- Документы
- Правоустанавливающие документы
- Локальные акты
- Отчеты о результатах самообследования
- Об оказании платных услуг
- Результаты проверок
- О защите ПДн
- Общие документы
- Финансовая деятельность
- Учебные планы
- План-график
- Образовательные программы
- График проведения оценочных процедур
- Здоровьесбережение
- Физическая культура и спорт
- Школьное питание
- Профилактика
- Дорожная безопасность
- Инклюзивное образование
- Психологическая служба
- Школа здоровья
- Меры профилактики вирусных инфекций
- Информация
- Для первоклассников
- Для выпускников
- Фотогалерея
- Видеогалерея
- Школьная газета
- Школьный музей
- Пушкинская карта
- Родителям
- Электронный дневник
- Дополнительная информация
- Образование
- Новости
- Всероссийская олимпиада школьников
- ВПР
- РДДМ
- Главная страница
- ›
- Сведения об общеобразовательной организации
- ›
- Образовательные программы
Личный кабинет
Выйти
Химические реакции – анатомия и физиология
Химический уровень организации
OpenStaxCollege
Цели обучения
К концу этого раздела вы сможете:
- Различать кинетическую и потенциальную энергию, экзергонические и эндергонические химические реакции
- Определите четыре формы энергии, важные для жизнедеятельности человека
- Опишите три основных типа химических реакций
- Определите несколько факторов, влияющих на скорость химических реакций
Одной из характеристик живого организма является метаболизм, представляющий собой совокупность всех химических реакций, происходящих для поддержания здоровья и жизни этого организма.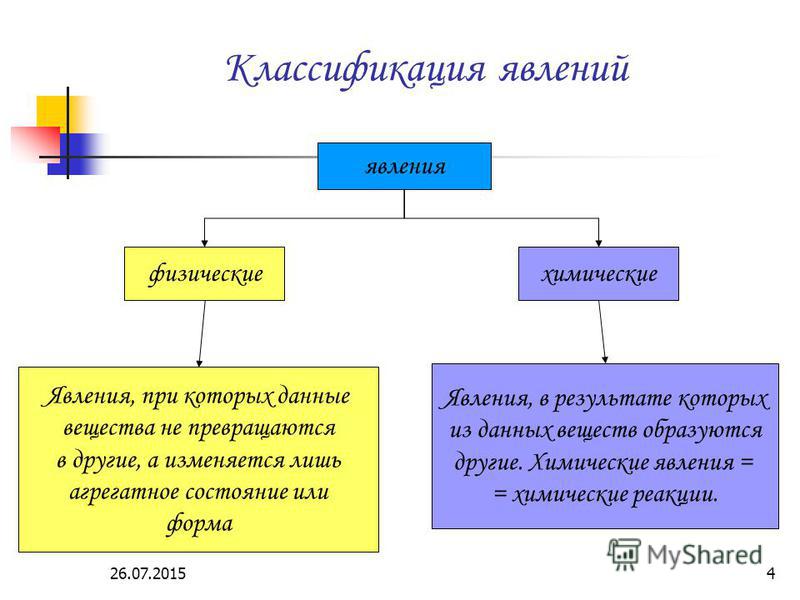 Процессы связывания, о которых вы узнали до сих пор, представляют собой анаболические химические реакции; то есть они образуют более крупные молекулы из более мелких молекул или атомов. Но вспомним, что метаболизм может протекать и в другом направлении: в катаболических химических реакциях связи между компонентами более крупных молекул разрываются, высвобождая более мелкие молекулы или атомы. Оба типа реакций связаны с обменом не только веществом, но и энергией.
Процессы связывания, о которых вы узнали до сих пор, представляют собой анаболические химические реакции; то есть они образуют более крупные молекулы из более мелких молекул или атомов. Но вспомним, что метаболизм может протекать и в другом направлении: в катаболических химических реакциях связи между компонентами более крупных молекул разрываются, высвобождая более мелкие молекулы или атомы. Оба типа реакций связаны с обменом не только веществом, но и энергией.
Химические реакции требуют достаточного количества энергии, чтобы вызвать столкновение вещества с достаточной точностью и силой, чтобы можно было разорвать старые химические связи и образовать новые. В общем, кинетическая энергия — это форма энергии, приводящая в движение любой тип материи. Представьте, что вы строите кирпичную стену. Энергия, необходимая для того, чтобы поднять и поставить один кирпич на другой, называется кинетической энергией — энергией, которой материя обладает благодаря своему движению. Как только стена установлена, она накапливает потенциальную энергию.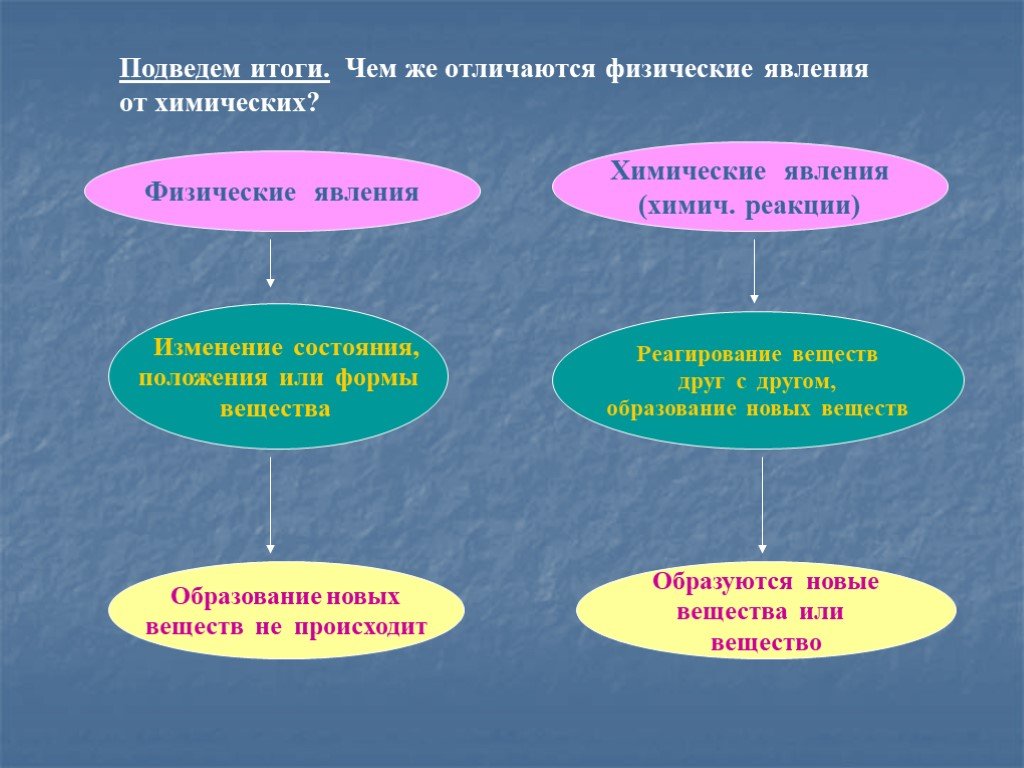 Потенциальная энергия — это энергия положения, или энергия, которой обладает материя благодаря расположению или структуре ее компонентов. Если кирпичная стена рухнет, накопленная потенциальная энергия высвобождается в виде кинетической энергии при падении кирпичей.
Потенциальная энергия — это энергия положения, или энергия, которой обладает материя благодаря расположению или структуре ее компонентов. Если кирпичная стена рухнет, накопленная потенциальная энергия высвобождается в виде кинетической энергии при падении кирпичей.
В человеческом теле потенциальная энергия хранится в связях между атомами и молекулами. Химическая энергия – это форма потенциальной энергии, в которой энергия хранится в химических связях. Когда эти связи образуются, в них вкладывается химическая энергия, а когда они разрываются, химическая энергия высвобождается. Обратите внимание, что химическая энергия, как и всякая энергия, не создается и не уничтожается; скорее, он преобразуется из одной формы в другую. Когда вы едите энергетический батончик перед тем, как отправиться в поход, мед, орехи и другие продукты, содержащиеся в батончике, расщепляются и перестраиваются в молекулы, которые ваши мышечные клетки преобразуют в кинетическую энергию.
Химические реакции, при которых выделяется больше энергии, чем поглощается, характеризуются как экзергонические. Примером может служить катаболизм продуктов в вашем энергетическом батончике. Часть химической энергии, хранящейся в батончике, поглощается молекулами, которые ваше тело использует в качестве топлива, а часть высвобождается, например, в виде тепла. Напротив, химические реакции, которые поглощают больше энергии, чем выделяют, являются эндергоническими. Эти реакции требуют ввода энергии, и полученная молекула сохраняет не только химическую энергию исходных компонентов, но и энергию, которая подпитывала реакцию. Поскольку энергия не создается и не уничтожается, откуда берется энергия, необходимая для эндергонических реакций? Во многих случаях это происходит из-за экзергонических реакций.
Примером может служить катаболизм продуктов в вашем энергетическом батончике. Часть химической энергии, хранящейся в батончике, поглощается молекулами, которые ваше тело использует в качестве топлива, а часть высвобождается, например, в виде тепла. Напротив, химические реакции, которые поглощают больше энергии, чем выделяют, являются эндергоническими. Эти реакции требуют ввода энергии, и полученная молекула сохраняет не только химическую энергию исходных компонентов, но и энергию, которая подпитывала реакцию. Поскольку энергия не создается и не уничтожается, откуда берется энергия, необходимая для эндергонических реакций? Во многих случаях это происходит из-за экзергонических реакций.
Вы уже узнали, что химическая энергия поглощается, сохраняется и высвобождается химическими связями. Помимо химической энергии, в жизнедеятельности человека важную роль играют механическая, лучистая и электрическая энергии.
- Механическая энергия, хранящаяся в физических системах, таких как машины, двигатели или человеческое тело, напрямую приводит в движение материю.
 Когда вы устанавливаете кирпич на стену, ваши мышцы обеспечивают механическую энергию, которая перемещает кирпич.
Когда вы устанавливаете кирпич на стену, ваши мышцы обеспечивают механическую энергию, которая перемещает кирпич. - Лучистая энергия – это энергия, излучаемая и передаваемая в виде волн, а не материи. Эти волны различаются по длине от длинных радиоволн и микроволн до коротких гамма-волн, излучаемых распадающимися атомными ядрами. Полный спектр лучистой энергии называется электромагнитным спектром. Организм использует ультрафиолетовую энергию солнечного света для превращения соединения в клетках кожи в витамин D, необходимый для функционирования человека. Человеческий глаз эволюционировал, чтобы видеть длины волн, которые составляют цвета радуги, от красного до фиолетового, поэтому этот диапазон спектра называется «видимым светом».
- Электрическая энергия, поставляемая электролитами в клетках и жидкостях организма, способствует изменениям напряжения, которые помогают передавать импульсы в нервных и мышечных клетках.
Все химические реакции начинаются с реагента, общего термина для одного или нескольких веществ, вступающих в реакцию. Ионы натрия и хлорида, например, являются реагентами при производстве поваренной соли. Одно или несколько веществ, образующихся в результате химической реакции, называются продуктом.
Ионы натрия и хлорида, например, являются реагентами при производстве поваренной соли. Одно или несколько веществ, образующихся в результате химической реакции, называются продуктом.
В химических реакциях все компоненты реагентов — участвующие элементы и число атомов каждого из них — присутствуют в продукте(ах). Точно так же в продуктах нет ничего, чего нет в реагентах. Это связано с тем, что химические реакции регулируются законом сохранения массы, который гласит, что материя не может быть создана или уничтожена в результате химической реакции.
Так же, как вы можете выразить математические вычисления в уравнениях, таких как 2 + 7 = 9, вы можете использовать химические уравнения, чтобы показать, как реагенты превращаются в продукты. Как и в математике, химические уравнения строятся слева направо, но вместо знака равенства в них используется стрелка или стрелки, указывающие направление, в котором протекает химическая реакция. Например, химическая реакция, в которой один атом азота и три атома водорода производят аммиак, будет записана как . Соответственно, разложение аммиака на его компоненты запишется как
Соответственно, разложение аммиака на его компоненты запишется как
Обратите внимание, что в первом примере атом азота (N) и три атома водорода (H) связаны, образуя соединение. Эта анаболическая реакция требует энергии, которая затем хранится в связях соединения. Такие реакции называются реакциями синтеза. Реакция синтеза — это химическая реакция, в результате которой происходит синтез (соединение) ранее отдельных компонентов ([ссылка] и ). Опять же, азот и водород являются реагентами в реакции синтеза, которая дает аммиак в качестве продукта. Общее уравнение реакции синтеза:
Три фундаментальные химические реакции
Атомы и молекулы, участвующие в трех фундаментальных химических реакциях, можно представить в виде слов.
Во втором примере аммиак расщепляется на более мелкие компоненты, и высвобождается потенциальная энергия, запасенная в его связях. Такие реакции называются реакциями разложения. Реакция разложения — это химическая реакция, которая разрушает или «разлагает» что-то большее на составные части (см. [ссылка] б ). Общее уравнение реакции разложения: .
[ссылка] б ). Общее уравнение реакции разложения: .
Реакция обмена — это химическая реакция, в которой происходят как синтез, так и распад, образуются и разрываются химические связи, поглощается, запасается и высвобождается химическая энергия (см. [ссылка] c ). Простейшей формой реакции обмена может быть: . Обратите внимание, что для получения этих продуктов В и С должны были распасться в реакции разложения, тогда как А и В должны были соединиться в реакции синтеза. Более сложной реакцией обмена может быть: Другой пример может быть: .
Теоретически любая химическая реакция может протекать в любом направлении при определенных условиях. Реагенты могут синтезироваться в продукт, который позже разлагается. Обратимость также является свойством обменных реакций. Например, может затем вернуться к . Эта обратимость химической реакции обозначена двойной стрелкой: . Тем не менее, в организме человека многие химические реакции протекают в предсказуемом направлении, так или иначе. Вы можете думать об этом более предсказуемом пути как о пути наименьшего сопротивления, потому что, как правило, альтернативное направление требует больше энергии.
Вы можете думать об этом более предсказуемом пути как о пути наименьшего сопротивления, потому что, как правило, альтернативное направление требует больше энергии.
Если в пищевую соду налить уксус, реакция будет мгновенной; смесь будет пузыриться и шипеть. Но многие химические реакции требуют времени. На скорость химических реакций влияют различные факторы. Однако в этом разделе будут рассмотрены только самые важные для человеческого функционирования.
Свойства реагентов
Если химические реакции должны протекать быстро, атомы в реагентах должны иметь свободный доступ друг к другу. Таким образом, чем больше площадь поверхности реагентов, тем легче они будут взаимодействовать. Когда вы кладете кубик сыра в рот, вы жуете его, прежде чем проглотить. Помимо прочего, жевание увеличивает площадь поверхности пищи, так что пищеварительные химические вещества могут легче добраться до нее. Как правило, газы имеют тенденцию реагировать быстрее, чем жидкости или твердые тела, опять же потому, что для разделения частиц вещества требуется энергия, а газы по определению уже имеют пространство между своими частицами. Точно так же, чем больше молекула, тем больше общее количество связей, поэтому можно ожидать, что реакции с участием меньших молекул с меньшим количеством общих связей будут протекать быстрее.
Точно так же, чем больше молекула, тем больше общее количество связей, поэтому можно ожидать, что реакции с участием меньших молекул с меньшим количеством общих связей будут протекать быстрее.
Кроме того, помните, что некоторые элементы более реакционноспособны, чем другие. Реакции с участием высокореакционноспособных элементов, таких как водород, протекают быстрее, чем реакции с участием менее реакционноспособных элементов. Реакции с участием стабильных элементов, таких как гелий, вряд ли вообще произойдут.
Температура
Почти все химические реакции протекают быстрее при более высоких температурах. Напомним, что кинетическая энергия – это энергия движущегося вещества. Кинетическая энергия субатомных частиц увеличивается в ответ на увеличение тепловой энергии. Чем выше температура, тем быстрее движутся частицы и тем больше вероятность того, что они вступят в контакт и вступят в реакцию.
Концентрация и давление
Если в клубе танцует всего несколько человек, вряд ли они наступят друг другу на пятки. Но по мере того, как все больше и больше людей встают танцевать, особенно если музыка быстрая, вероятны столкновения. То же самое и с химическими реакциями: чем больше частиц присутствует в данном пространстве, тем больше вероятность того, что эти частицы столкнутся друг с другом. Это означает, что химики могут ускорить химические реакции не только за счет увеличения концентрации частиц — количества частиц в пространстве, — но и за счет уменьшения объема пространства, что соответственно повысит давление. Если бы в этом клубе было 100 танцоров, а менеджер резко переместил вечеринку в комнату вдвое меньшего размера, то концентрация танцоров в новом пространстве удвоилась бы, и соответственно увеличилась вероятность столкновений.
Но по мере того, как все больше и больше людей встают танцевать, особенно если музыка быстрая, вероятны столкновения. То же самое и с химическими реакциями: чем больше частиц присутствует в данном пространстве, тем больше вероятность того, что эти частицы столкнутся друг с другом. Это означает, что химики могут ускорить химические реакции не только за счет увеличения концентрации частиц — количества частиц в пространстве, — но и за счет уменьшения объема пространства, что соответственно повысит давление. Если бы в этом клубе было 100 танцоров, а менеджер резко переместил вечеринку в комнату вдвое меньшего размера, то концентрация танцоров в новом пространстве удвоилась бы, и соответственно увеличилась вероятность столкновений.
Ферменты и другие катализаторы
Чтобы два химических вещества в природе вступили в реакцию друг с другом, они сначала должны вступить в контакт, а это происходит посредством случайных столкновений. Поскольку тепло способствует увеличению кинетической энергии атомов, ионов и молекул, оно способствует их столкновению. Но в организме очень высокая температура — например, очень высокая температура — может повредить клетки тела и быть опасной для жизни. С другой стороны, нормальная температура тела недостаточно высока, чтобы способствовать химическим реакциям, поддерживающим жизнь. Вот тут-то и приходят на помощь катализаторы.
Но в организме очень высокая температура — например, очень высокая температура — может повредить клетки тела и быть опасной для жизни. С другой стороны, нормальная температура тела недостаточно высока, чтобы способствовать химическим реакциям, поддерживающим жизнь. Вот тут-то и приходят на помощь катализаторы.
В химии катализатор — это вещество, которое увеличивает скорость химической реакции, не претерпевая при этом никаких изменений. Вы можете думать о катализаторе как о агенте химического изменения. Они помогают увеличить скорость и силу столкновения атомов, ионов и молекул, тем самым увеличивая вероятность взаимодействия электронов их валентных оболочек.
Важнейшими катализаторами в организме человека являются ферменты. Фермент — это катализатор, состоящий из белка или рибонуклеиновой кислоты (РНК), оба из которых будут обсуждаться далее в этой главе. Как и все катализаторы, ферменты работают за счет снижения уровня энергии, необходимой для химической реакции. Энергия активации химической реакции — это «пороговый» уровень энергии, необходимый для разрыва связей в реагентах. Как только эти связи будут разорваны, могут сформироваться новые договоренности. Без фермента, который действует как катализатор, требуется гораздо больше энергии, чтобы запустить химическую реакцию ([ссылка]).
Как только эти связи будут разорваны, могут сформироваться новые договоренности. Без фермента, который действует как катализатор, требуется гораздо больше энергии, чтобы запустить химическую реакцию ([ссылка]).
Ферменты
Ферменты уменьшают энергию активации, необходимую для протекания данной химической реакции. а) Без фермента для начала реакции требуется большое количество энергии. б) С помощью фермента для начала реакции требуется меньше энергии.
Ферменты имеют решающее значение для здорового функционирования организма. Например, они помогают расщеплять пищу и превращать ее в энергию. На самом деле, большинство химических реакций в организме облегчаются ферментами.
Химические реакции, при которых происходит разрыв и образование химических связей, требуют первоначальных затрат энергии. Кинетическая энергия, энергия движущейся материи, подпитывает столкновения атомов, ионов и молекул, необходимые для разрыва их старых связей и образования новых. Все молекулы хранят потенциальную энергию, которая высвобождается при разрыве их связей.
Все молекулы хранят потенциальную энергию, которая высвобождается при разрыве их связей.
Четыре формы энергии, необходимые для жизнедеятельности человека: химическая энергия, которая накапливается и высвобождается при образовании и разрыве химических связей; механическая энергия, непосредственно питающая физическую активность; лучистая энергия, испускаемая в виде волн, например, при солнечном свете; и электрическая энергия, мощность движущихся электронов.
Химические реакции начинаются с реагентов и заканчиваются продуктами. Реакции синтеза связывают реагенты вместе, процесс, который требует энергии, тогда как реакции разложения разрывают связи внутри реагента и тем самым высвобождают энергию. В обменных реакциях происходит как разрыв, так и образование связей, происходит обмен энергией.
На скорость протекания химических реакций влияют несколько свойств реагентов: температура, концентрация и давление, а также наличие или отсутствие катализатора. Фермент – каталитический белок, ускоряющий химические реакции в организме человека.
Энергия, запасенная в футе снега на крутой крыше, равна ________.
- потенциальная энергия
- кинетическая энергия
- лучистая энергия
- энергия активации
A
Связывание кальция, фосфора и других элементов приводит к образованию минеральных кристаллов, которые находятся в костях. Это пример a(n) ________ реакции.
- катаболический
- синтез
- разложение
- обмен
B
— это общее обозначение реакции (n) ________.
- анаболический
- эндергонический
- разложение
- обмен
C
________ реакции выделяют энергию.
- Катаболический
- Экзергоник
- Разложение
- Катаболизм, экзергонизм и разложение
D
Какая из следующих комбинаций атомов наиболее вероятно приведет к химической реакции?
- водород и водород
- водород и гелий
- гелий и гелий
- неон и гелий
A
При пережевывании кусочка хлеба он смешивается со слюной и способствует химическому расщеплению. Это скорее всего из-за того что ________.
Это скорее всего из-за того что ________.
- во рту поддерживается очень высокая температура
- жевание накапливает потенциальную энергию
- жевание облегчает реакции синтеза
- слюна содержит ферменты
Д
Является ли это законным примером реакции обмена? Почему или почему нет?
Это не так. Реакцией обмена может быть или . Во всех химических реакциях, в том числе и в реакциях обмена, компоненты реагентов идентичны компонентам продуктов. Компонент, присутствующий среди реагентов, не может исчезнуть, а компонент, отсутствующий в реагентах, не может внезапно появиться в продуктах.
Когда вы стираете, почему бы вам просто не бросить кусок мыла в стиральную машину? Другими словами, почему стиральный порошок продается в виде жидкости или порошка?
Напомним, что чем больше площадь поверхности реагентов, тем быстрее и легче они будут взаимодействовать. Для разделения частиц вещества требуется энергия. Порошковые и жидкие моющие средства для стирки с относительно большей площадью поверхности на единицу могут быстро растворяться в своих реактивных компонентах при добавлении в воду.
Для разделения частиц вещества требуется энергия. Порошковые и жидкие моющие средства для стирки с относительно большей площадью поверхности на единицу могут быстро растворяться в своих реактивных компонентах при добавлении в воду.
Глоссарий
- энергия активации
- количество энергии, превышающее энергию, содержащуюся в реагентах, которую необходимо преодолеть, чтобы реакция протекала
- катализатор
- вещество, увеличивающее скорость химической реакции, но само не изменяющееся в процессе
- химическая энергия
- форма энергии, которая поглощается при образовании химических связей, запасается при их поддержании и высвобождается при их разрыве
- концентрация
- количество частиц в заданном пространстве
- реакция разложения
- тип катаболической реакции, при которой одна или несколько связей в более крупной молекуле разрываются, что приводит к высвобождению более мелких молекул или атомов
- фермент
- белок или РНК, катализирующие химические реакции
- реакция обмена
- тип химической реакции, при которой образуются и разрываются связи, что приводит к переносу компонентов
- кинетическая энергия
- энергия, которой обладает вещество из-за своего движения
- потенциальная энергия
- запасенная энергия, которой обладает вещество из-за расположения или структуры его компонентов
- продукт
- одно или несколько веществ, образующихся в результате химической реакции
- реагент
- одно или несколько веществ, вступающих в реакцию
- реакция синтеза
- тип анаболической реакции, при которой два или более атома или молекулы связываются, что приводит к образованию более крупной молекулы
Идентификация физических и химических изменений
Эта основная идея исследуется посредством:
- Противопоставление взглядов студентов и ученых
- Критические идеи обучения
- Преподавательская деятельность
Противопоставление студенческих и научных взглядов
Повседневный опыт учащихся
Учащиеся с трудом различают физические и химические изменения, несмотря на формальное преподавание, и это различие является несколько произвольным. Однако понимание различий между чисто физическими процессами, такими как плавление, испарение и кипение, и изменениями, происходящими в химических реакциях, особенно представление об образовании новых веществ, важно для понимания химии, и учащиеся очень часто путают эти два явления. . Типичны следующие разговоры:
Однако понимание различий между чисто физическими процессами, такими как плавление, испарение и кипение, и изменениями, происходящими в химических реакциях, особенно представление об образовании новых веществ, важно для понимания химии, и учащиеся очень часто путают эти два явления. . Типичны следующие разговоры:
Пэт (записывает записи группы о праке): Что случилось?
Ким: Он зашипел.
Пэт: Вы видели какие-нибудь новые вещества?
Ким: Нет.
Сэм: Что мне записать образовалось?
Крис: Синий цвет.
Исследование: Loughran, Mulhall & Berry (2002)
Исследования показывают, что учащиеся часто используют термин «химическое изменение» для описания изменений в физическом состоянии. Замораживание и кипение считаются примерами химических реакций. Это зависит от их представления о субстанции. Если учащиеся рассматривают лед как вещество, отличное от жидкой воды, они, вероятно, будут классифицировать таяние льда как химическое изменение. Одно исследование показало, что 80% студентов считают разницу в цвете между реагентом и продуктом свидетельством химического изменения. Учащиеся могут рассматривать растворение перманганата калия (кристаллы Конди) в воде как химическое изменение из-за сильной разницы в цвете. Некоторые студенты также считали плавление и расширение при нагревании свидетельством химических изменений.
Одно исследование показало, что 80% студентов считают разницу в цвете между реагентом и продуктом свидетельством химического изменения. Учащиеся могут рассматривать растворение перманганата калия (кристаллы Конди) в воде как химическое изменение из-за сильной разницы в цвете. Некоторые студенты также считали плавление и расширение при нагревании свидетельством химических изменений.
Исследование: Driver, Rushworth & Wood-Robinson (1994)
Многие студенты не понимали, что химическое изменение характеризуется образованием вещества, свойства которого отличаются от свойств исходного вещества, и значительная часть студентов, которые это сделали, не смогли предложить подходящие причины для выделения «нового» вещества.
Исследование: Driver, Rushworth & Wood-Robinson (1994)
Учащиеся могут полагать, что вспенивание пива является примером химического изменения, а созревание яблока — физическим изменением.
Исследование: Цапарлис (2003)
Студенты обычно считают, что физические изменения обратимы, а химические – нет. Студенты также часто считают, что исходное вещество в химической реакции полностью и навсегда исчезает. Обычным повседневным применением обратимой химической реакции является зарядка и разрядка перезаряжаемых аккумуляторов, в том числе автомобильных аккумуляторов; однако учащиеся могут полагать, что батареи являются контейнером накопленного электричества, а не химических веществ, которые реагируют таким образом, что химическая энергия преобразуется в электрическую.
Студенты также часто считают, что исходное вещество в химической реакции полностью и навсегда исчезает. Обычным повседневным применением обратимой химической реакции является зарядка и разрядка перезаряжаемых аккумуляторов, в том числе автомобильных аккумуляторов; однако учащиеся могут полагать, что батареи являются контейнером накопленного электричества, а не химических веществ, которые реагируют таким образом, что химическая энергия преобразуется в электрическую.
Другое распространенное мнение состоит в том, что химические изменения вызываются смешиванием веществ/реагентов или что необходимо добавить тепло (которое считается некоторой формой материала).
Научная точка зрения
При физическом изменении внешний вид или форма материи меняется, но вид материи в веществе не меняется. Однако при химическом изменении изменяется вид материи и образуется по крайней мере одно новое вещество с новыми свойствами.
Различие между физическими и химическими изменениями нечеткое. Часто студентов убеждают, что изменение является либо физическим, либо химическим. На самом деле это следует рассматривать скорее как континуум. Например, растворение соли в воде обычно считается физическим изменением, однако химические вещества в солевом растворе (гидратированные ионы натрия и хлора) отличаются от веществ в твердой соли. Растворение растворимого кофе в воде кажется физическим изменением, но в большинстве случаев растворение сопровождается изменением энергии и, вероятно, лучше рассматривать его как химический процесс, хотя исходные компоненты можно восстановить физическими средствами. Многие примеры растворения материалов (например, алка-зельтер в воде, металл в кислоте и воздействие кислотных дождей на мрамор и бетон) связаны как с химическими, так и с физическими процессами.
Часто студентов убеждают, что изменение является либо физическим, либо химическим. На самом деле это следует рассматривать скорее как континуум. Например, растворение соли в воде обычно считается физическим изменением, однако химические вещества в солевом растворе (гидратированные ионы натрия и хлора) отличаются от веществ в твердой соли. Растворение растворимого кофе в воде кажется физическим изменением, но в большинстве случаев растворение сопровождается изменением энергии и, вероятно, лучше рассматривать его как химический процесс, хотя исходные компоненты можно восстановить физическими средствами. Многие примеры растворения материалов (например, алка-зельтер в воде, металл в кислоте и воздействие кислотных дождей на мрамор и бетон) связаны как с химическими, так и с физическими процессами.
– Исследования: Fensham (1994)
Большинство химических реакций обратимы, хотя на практике это может быть сложно. Во многих учебниках по естествознанию для младших классов утверждается, что химические изменения необратимы, в то время как физические изменения можно обратить вспять. Разрезание бумаги на мелкие кусочки или дробление камня — очевидные физические изменения, но восстановить первоначальный лист бумаги или камень сложно. Аккумуляторы используют одну химическую реакцию при разрядке, а перезарядка включает обратную реакцию, превращая продукты обратно в исходные реагенты. Электрический генератор (генератор переменного тока) в автомобиле постоянно подзаряжает автомобильный аккумулятор при работающем двигателе автомобиля.
Разрезание бумаги на мелкие кусочки или дробление камня — очевидные физические изменения, но восстановить первоначальный лист бумаги или камень сложно. Аккумуляторы используют одну химическую реакцию при разрядке, а перезарядка включает обратную реакцию, превращая продукты обратно в исходные реагенты. Электрический генератор (генератор переменного тока) в автомобиле постоянно подзаряжает автомобильный аккумулятор при работающем двигателе автомобиля.
Критические обучающие идеи
- При физическом изменении природа вещества, частицы, из которых оно состоит, и число частиц остаются неизменными.
- При химическом изменении свойства новых веществ отличаются от первоначальных, частицы другие и количество частиц может измениться.
- Хотя различие между физическими и химическими изменениями является полезным, его следует рассматривать скорее как континуум.
- Химические реакции можно обратить вспять, но на практике это может быть затруднительно.
Изучите взаимосвязь между идеями о физических и химических изменениях на Картах развития концепций — (состояния вещества, химические реакции)
При обучении физическим и химическим изменениям важно, чтобы учащиеся рассматривали классификацию как континуум. Они должны уметь наблюдать ряд изменений и формулировать свое мнение о видах изменений и проблемах, связанных с процессом классификации. Студенты должны прийти к пониманию того, что химические реакции производят новые химические вещества, отличные от исходных материалов, но химические процессы можно обратить вспять. Изучение примеров обратимых химических реакций и рассмотрение того, почему многие химические изменения трудно обратить вспять, может быть очень полезным.
Они должны уметь наблюдать ряд изменений и формулировать свое мнение о видах изменений и проблемах, связанных с процессом классификации. Студенты должны прийти к пониманию того, что химические реакции производят новые химические вещества, отличные от исходных материалов, но химические процессы можно обратить вспять. Изучение примеров обратимых химических реакций и рассмотрение того, почему многие химические изменения трудно обратить вспять, может быть очень полезным.
Учебные занятия
Способствовать осмыслению и разъяснению существующих идей
Следующие задания предназначены для того, чтобы учащиеся определили, а затем усовершенствовали свои представления о физических и химических изменениях. Студентам важно наблюдать за рядом изменений и фиксировать свое мнение о происходящем. Они могли бы зафиксировать это в буклете, где они пишут и рисуют результаты и наблюдения. Их следует поощрять формулировать и фиксировать гипотезы о том, что происходит, зная, что их мнения не будут оцениваться на данном этапе.
Пример этой методики см.: Использование журналов учета электроэнергии в 10-м году.
Это может помочь выявить их существующие идеи и помочь им бросить вызов и расширить свои существующие убеждения.
Студенты могут исследовать:
- Нагревание стальной ваты на воздухе и сбор полученного черного порошка, затем взвешивание реагента и продукта (должно быть увеличение). Это можно сделать как POE (Предсказать-Наблюдать-Объяснить): студентов просят предсказать, что произойдет с весом стальной ваты, когда она сгорит. Что было добавлено к стальной вате во время горения?
- Растворение сахара и соли в воде и сравнение того, что происходит с электропроводностью двух растворов в процессе растворения. Восстановление соли путем испарения показывает, что соль все еще там, но проводимость указывает на то, что образуется что-то новое.
- Сравнивая кипящую воду со смесью уксуса и пищевой соды — оба производят пузыри, но в чем разница? Пищевая сода и уксус могут быть смешаны в пакете для сэндвичей Ziploc, чтобы показать производство нового вещества, которое взрывает пакет.

- Реакции осаждения, особенно те, которые приводят к явному изменению цвета, такие как соли Эпсома и раствор аммиака. Это можно сравнить с добавлением марганцовки в воду. Каковы различия?
- Кислотно-основные реакции можно проиллюстрировать с помощью индикаторов как природных (капустный сок), так и синтетических. Изменения цвета помогают проиллюстрировать, что могут образовываться новые материалы.
Практика использования и создание воспринимаемой полезности научной модели или идеи
Важно, чтобы примеры изменений не ограничивались только материалами и химическими веществами, которым учащиеся подвергаются в классе. В качестве домашнего задания учащихся можно попросить собрать примеры изменений, которые они видят вокруг себя, и классифицировать их по своей шкале физических и химических изменений. Некоторые примеры, которые они могут собрать, включают сжигание топлива, приготовление пищи и такие процессы, как пищеварение, дыхание и фотосинтез.
Прояснение и консолидация идей для/путем общения с другими и с другими
Чтобы закрепить свои взгляды, учащихся в группах можно попросить выбрать два изменения, одно на физическом конце континуума и одно на химическом конце, и объяснить классу, в чем заключаются различия. Общение своих идей с другими может помочь учащимся прояснить и закрепить новые и существующие идеи об изменениях.
Практика использования научной модели или идеи и формирование воспринимаемой полезности
Наука – это область, в которой постепенно создается более глубокое значение ряда ключевых идей путем их использования в различных ситуациях и подчеркивания того, как одна и та же идея помогает смысл многих ситуаций. Это особенно касается ключевых идей в химических науках, которые нельзя «открыть», «доказать» или даже продемонстрировать с помощью экспериментов в классе. И элементы, и соединения (ключевая идея на макроуровне), и атомы и молекулы (которые предполагают то же самое мышление на микроуровне) являются примерами этого, но их полезность можно развить, показав (среди прочего), как они могут помогают разобраться в физических и химических изменениях. Эти идеи могут быть представлены здесь или упомянуты, если они были представлены ранее. Написание химических уравнений в словесной и символической форме может быть введено как полезный способ описания некоторых изменений, которые наблюдали учащиеся, а также для демонстрации преимуществ химических символов в отслеживании элементов (или атомов) способами, недоступными для слов. Если точные химические формулы не могут быть написаны (как в случае с большинством биохимических веществ), радикальное упрощение все же может быть полезным. Например, древесина — это в основном целлюлоза, полимер глюкозы, и такое представление, как (C 6 H 10 O 5 ) n можно использовать для отслеживания изменений в таких процессах, как горение.
Эти идеи могут быть представлены здесь или упомянуты, если они были представлены ранее. Написание химических уравнений в словесной и символической форме может быть введено как полезный способ описания некоторых изменений, которые наблюдали учащиеся, а также для демонстрации преимуществ химических символов в отслеживании элементов (или атомов) способами, недоступными для слов. Если точные химические формулы не могут быть написаны (как в случае с большинством биохимических веществ), радикальное упрощение все же может быть полезным. Например, древесина — это в основном целлюлоза, полимер глюкозы, и такое представление, как (C 6 H 10 O 5 ) n можно использовать для отслеживания изменений в таких процессах, как горение.
Здесь могут помочь модели и схемы. Например, в большинстве школ есть наборы для молекулярного моделирования, которые можно адаптировать, чтобы показать, как молекулы изменились, а атомы перегруппировались в результате изменений. Схемы размеров плакатов также могут быть нарисованы учащимися для помощи в объяснениях.
Схемы размеров плакатов также могут быть нарисованы учащимися для помощи в объяснениях.
Оспорить некоторые существующие идеи
Хотя трудно продемонстрировать обратимость химических изменений, учащиеся хорошо знакомы с необходимостью подзарядки своих мобильных телефонов, фотоаппаратов и других перезаряжаемых устройств. Это можно было бы просто обсудить, хотя исследование химических реакций, приводящих в действие эти устройства, могло бы стать полезным исследовательским проектом. Предупреждение здесь заключается в том, что большая часть доступной информации может быть очень технической.
Побуждать к размышлениям о том, как изменились идеи учащихся.
Повторное изучение их исходных дневниковых записей может способствовать размышлениям о том, как изменились взгляды учащихся. Затем учащиеся могут применить свои новые идеи к большему количеству примеров изменений. Для обсуждения видов происходящих изменений и трудностей классификации некоторых изменений как физических или химических можно использовать следующие действия:
- Растворение металлов в кислоте (магния и цинка) и тестирование образовавшегося газа.

 Когда вы устанавливаете кирпич на стену, ваши мышцы обеспечивают механическую энергию, которая перемещает кирпич.
Когда вы устанавливаете кирпич на стену, ваши мышцы обеспечивают механическую энергию, которая перемещает кирпич.
