Психология. Эмоции и чувства. Тест для самопроверки – пройти тест онлайн бесплатно
Авторам
8-800-333-85-44
Оформить заявку
Вход
- Справочник
- Онлайн-калькуляторы
- Тесты с ответами
Выполним любые типы работ
- Курсовые работы
- Рефераты
- Контрольные работы
- Отчет по практике
- Эссе
Психология
Психология
Психология
Психология
Психология
Психология
Психология
Психология
Психология
Контрольная работа
от 1 дня /
от 100 руб
Курсовая работа
от 5 дней /
от 1800 руб
Реферат
от 1 дня /
от 700 руб
Онлайн-помощь
от 1 дня /
от 300 руб
Оставляй заявку — и мы пройдем все тесты за тебя!
Тест с ответами: «Эмоции и их виды»
I вариант.
1. Тип эмоциональных переживаний:
а) неуравновешенность
б) эмоциональный стресс +
в) воображение
2. Положительные эмоции в детском возрасте развиваются через:
а) игру +
б) общение
в) внимание
3. Что относится к фазе стресса:
а) фаза истерики
б) фаза возбуждения
в) фаза истощения +
4. Длительные, устойчивые, предметные отношения к какому – либо объекту, это:
а) чувства +
б) внимание
в) симпатия
5. Наиболее мощный вид эмоциональных реакций это:
а) настроение
б) чувство
в) аффект +
6. Реакция не только на текущие события, но и воспоминания это:
а) характер
б) эмоции +
в) темперамент
7. Эмоциональное состояние, сопереживание к другому объекту это:
а) настроение
б) амбивалентность
в) симпатия +
8. Отрицательные эмоции обусловлены:
а) неустойчивостью +
б) характером
в) закономерностью
9. Какое из этих понятий относится к виду чувств:
а) сострадательные
б) депрессивные
в) моральные +
10. Выделите, какая теория относится к психологическим эмоциям:
Выделите, какая теория относится к психологическим эмоциям:
а) нравственная
б) эволюционная +
в) характерная
11. Что такое эмоция:
а) переживание +
б) болезнь
в) увлечение
12. При помощи чего эмоция передается точнее всего:
а) молчания
б) мимики +
в) речи
13. Какая эмоция является положительной:
а) ликование +
б) злость
в) ярость
14. Как называется эмоция, возникающая как защитная реакция организма при возникновении угрозы его благополучию или здоровью:
а) ярость
б) радость
в) страх +
15. Что не поможет справиться с отрицательными эмоциями:
а) полное погружение в негативные эмоции +
б) общение с друзьями
в) любимая музыка
16. Первопричинами возникновения эмоциональных состояний являются изменения физиологического характера, происходящие в организме согласно теории:
а) Анохина
б) Кеннона – Барда
в) Джеймса – Ланге +
17. Эмоции, как оценка величины потребности и вероятности ее удовлетворения в данный момент рассматриваются в:
а) информационной теории эмоций П.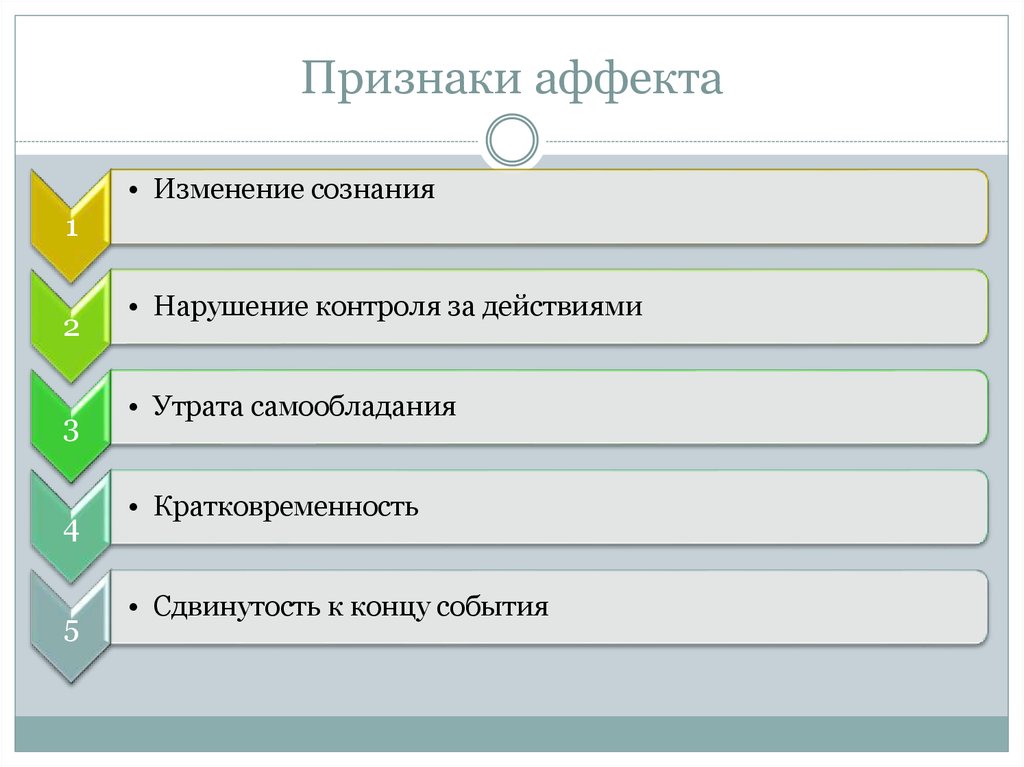 В.Симонов +
В.Симонов +
б) теории эмоций Джеймса – Ланге
в) биологической концепции эмоций Ч.Дарвина
18. Чувства, связанные с познавательной деятельностью, называются такими чувствами:
а) практическими
б) интеллектуальными +
в) моральными
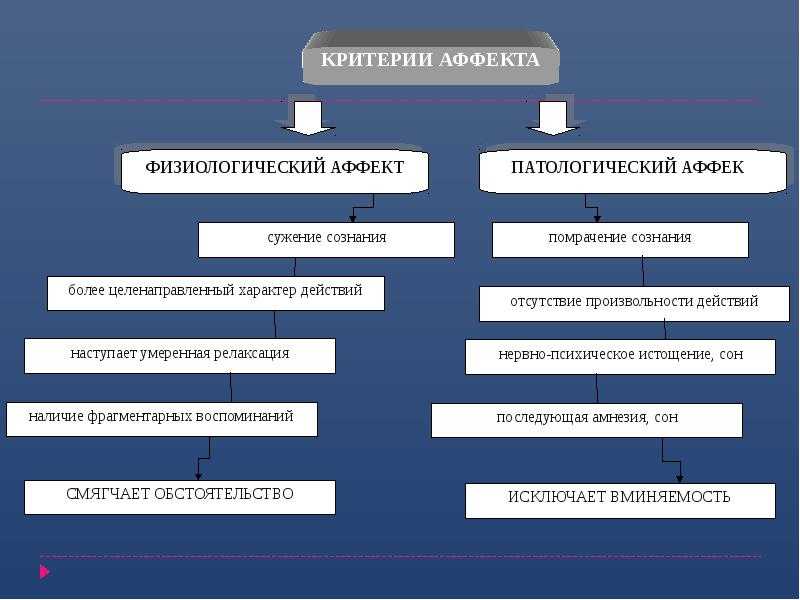
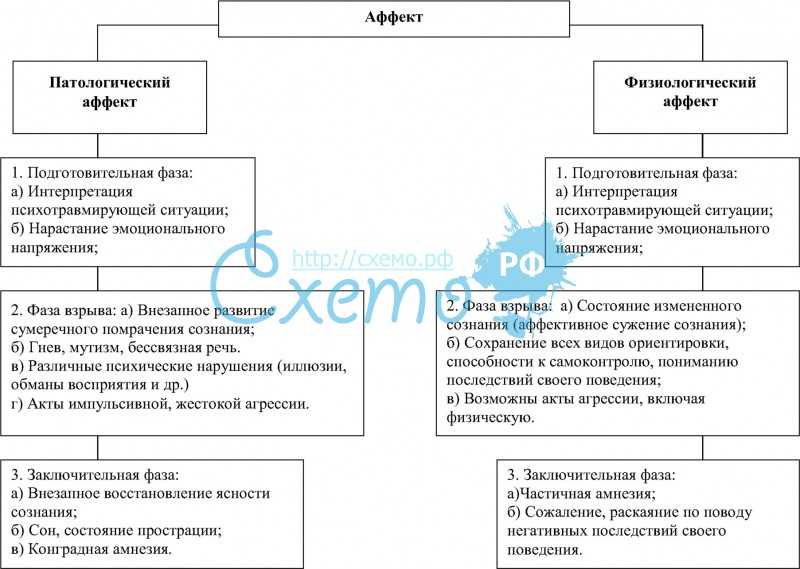
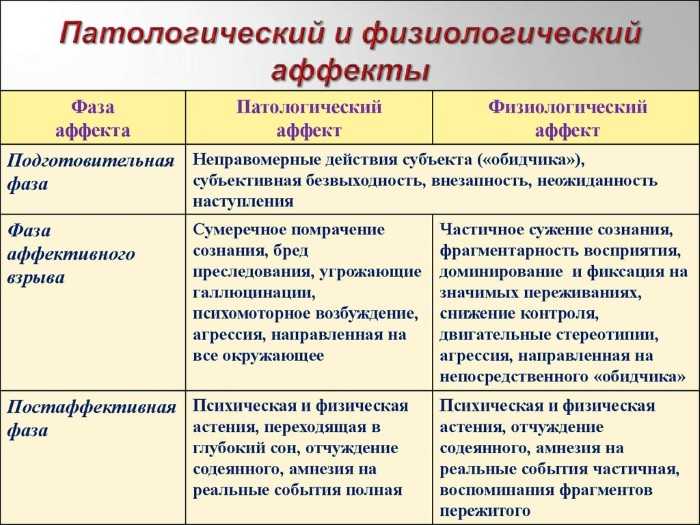
19. Показателем аффекта является:
а) сохранение контроля воли за своими действиями
б) незначительное изменение сознании
в) нарушение контроля воли за своими действиями +
20. Постижение эмоциональных состояний другого человека в форме сопереживания и сочувствия называется:
а) эмпатией +
б) симпатией
в) идентификацией
II вариант.
1. Чувства, связанные с переживанием прекрасного или уродливого в окружающем мире называются:
а) эстетические +
б) познавательные
в) моральные
2. То, что эмоциональные переживания и соответствующие им органические изменения порождаются одновременно и их источником является гипоталамус, утверждает теория эмоций:
а) Изарда
б) Кеннона – Барда +
в) Джеймса – Ланге
3. Основанием разделения эмоций на астенические и стенические является (ются):
Основанием разделения эмоций на астенические и стенические является (ются):
а) сила и длительность проявлений
б) потребности
в) мобилизация ресурсов организма +
4. Устойчивой склонностью человека воспринимать угрозу своему “Я” в разных ситуациях характеризуется такое его эмоциональное состояние, как
а) настроение
б) тревога +
в) стресс
5. Процесс передачи эмоционального состояния между индивидами без решающего смыслового влияния называется:
а) идентификацией
б) подражанием
в) заражением +
6. Более или менее длительное эмоциональное состояние, окрашивающее все поведение человека называется:
а) чувством
б) настроением +
в) аффектом
7. Переживание собственной неспособности оказаться на высоте тех требований, которые человек предъявляет к самому себе, переживание неудовлетворенности собой – это:
а) стыд
б) гнев
в) страх
8. Сильное, стойкое, длительное чувство, которое захватывает человека и владеет им, называется:
а) аффектом
б) настроением
в) страстью +
9. Эмоциональные процессы и состояния в жизни организма выполняют функцию (и):
Эмоциональные процессы и состояния в жизни организма выполняют функцию (и):
а) приспособительную, мобилизационную и интегративную +
б) только приспособительную
в) только мобилизационную
10. Эмоции связаны с определенными физиологическими реакциями согласно этой теории эмоций:
а) кибернетической
б) периферической +
в) информационной
11. Выберите тип эмоциональных переживаний:
а) воображение
б) эмоциональный стресс+
в) неуравновешенность.
12. Каким образом в детстве развиваются положительные эмоции?
а) посредством внимания
б) через общение
в) через игру+
13. Фаза стресса:
а) фаза возбуждения
б) фаза истерики
в) фаза истощения+
14. Что понимается под длительными, устойчивыми, предметными отношениями к какому-либо объекту?
а) внимание
б) чувства+
в) симпатия
15. Мощный вид эмоциональных реакций:
а) аффект+
б) чувство
в) настроение
16. Определите, что за реакция не только на текущие события, но и на те, который человек вспоминает?
а) темперамент
б) характер
в) эмоции+
17. Что такое эмоциональное состояние, сопереживание к другому объекту?
Что такое эмоциональное состояние, сопереживание к другому объекту?
а) амбивалентность
б) симпатия+
в) настроение
18. Чем обусловлены отрицательные эмоции?
а) неустойчивостью+
б) закономерностью
в) характером
19. Вид чувств:
а) моральные+
б) сострадательные
в) депрессивные
20. Эта теория относится к психологическим эмоциям:
а) характерная
б) эволюционная+
в) нравственная
ФГБНУ НЦПЗ. ‹‹Аффективные и шизоаффективные психозы››
Форма обратной связи
Вопрос по работе сайтаВопрос специалистуВопрос в администацию клиники
Адрес email
Имя
Текст сообщения
А.С.Тиганов
Москва, Россия
Последние десятилетия изучение аффективных состояний
занимает значительное место в исследованиях многих зарубежных и отечественных
клиницистов. Подобный интерес, с одной стороны, вызван ростом удельного веса
больных с аффективной патологией, с другой, не только видоизменением классических
аффективных картин, но и более тщательным анализом синдромов, в формировании
которых аффективные расстройства занимают значительное место.
Подобный интерес, с одной стороны, вызван ростом удельного веса
больных с аффективной патологией, с другой, не только видоизменением классических
аффективных картин, но и более тщательным анализом синдромов, в формировании
которых аффективные расстройства занимают значительное место.
Изучение аффективных расстройств в картине различных психопатологических синдромов при различных заболеваниях позволяет не только понять роль и значимость аффективных нарушений в процессе синдромообразования, но и исследовать различные клинические аспекты этих симптомокомплексов, включая их прогностическую значимость.
Вряд ли необходимо подробно останавливаться на
роли аффективных нарушений в картинах непрерывно текущих шизофренических психозов,
в частности параноидной шизофрении; не вызывает сомнения, что развитие маниакального
аффекта в картине паранойяльного состояния свидетельствует о формировании стабильного,
инертного, терапевтически резистентного состояния, при этом паранойяльный бред
приобретает характер гротеска, а чрезмерная активность является причиной госпитализации.
Вместе с этим при развитии экспансивных парафренных состояний стойкий повышенный аффект, как и в случаях с паранойяльными синдромами, является показателем стабильности состояния и отсутствия трансформации его в другие формы и виды парафренного бреда или картину шизофрении.
Чрезвычайно важным в прогностическом отношении
является развитие аффективных расстройств на фоне вялого течения болезни с преобладанием
расстройств неврозоподобного регистра; появление аффективных нарушений циклотимического
уровня и нарастание глубины депрессивных или маниакальных состояний свидетельствует
о развитии в будущем у таких больных очерченных аффективных, а иногда и аффективно-бредовых
приступов; последним обычно предшествует изменение характера аффекта с экстатичностью,
восторженностью, особой проникновенностью.
Описанные особенности инициального периода аффективных приступов, развивающихся при рекуррентном и приступообразно-прогредиентном течении эндогенных заболеваний также свидетельствуют о формировании в последующем острого чувственного бреда.
Вместе с этим исследование аффективных приступов при приступообразно-прогредиентном течении показывает не только отсутствие типичных этапов развития психоза, но и чрезвычайно характерную для этих приступов дисеоциативность, проявляющуюся в сочетании маниакального аффекта с нигилистическим бредом и мучительными сенестопатиями или иными сочетаниями расстройств, придающих аффективному синдрому черты смешанного состояния.
Таким образом аффективные расстройства имеют непосредственное отношение к формированию широкого круга психопатологических образований, отражающих, как известно, различную глубину и различный объем поражения психической деятельности.
Здесь же следует еще раз подчеркнуть, что характер
аффекта, а также ряд особенностей аффективных нарушений позволяет прогнозировать
дальнейшее саморазвитие синдрома и оценивать его прогностическую значимость,
при этом нередко характер аффективных расстройств не только влияет на психопатологическую
структуру синдрома, но и имеет ряд характерных признаков, типичных для того
или иного психопатологического симптомокомплекса.
Как известно, навязчивое мудрствование относится к достаточно широко распространенному кругу обсессивных расстройств и обладает такими типичными признаками обсессий как чуждость, сознание болезненности, критическое отношение к ним, в то же время это расстройство, возникающее в картине гипомании приобретает иной характер: склонность к рассуждению на ту или иную тему расценивается больным как новое качество, появившееся у него, дающее возможность лучше и глубже понять окружающий его мир и не воспринимаемое как чуждое и болезненное. В этом случае аффект не только меняет суть психопатологического расстройства, но и вносит известную коррекцию в классическое определение расстройств обсессивного круга.
Столь же существенно меняется структура импульсивных
расстройств, развивающихся в большей части случаев в картине полярных аффективных
расстройств; импульсивные влечения, возникающие в картине депрессии приобретают
характер мучительного с чувством безъисходности непреодолимого состояния, в
то время как аналогичное расстройство в картине мании сопровождается не только
чувством восторга, радости, экзальтации, но и нередко сближается с картиной
сверхценных образований.
Существует точка зрения, что вслед за импульсивным
влечением возникают различные состояния в зависимости от полюса аффекта, сопровождающего
импульсивное влечение: если речь идет о депрессии, преобладают идеи самоуничижения,
самообвинения и раскаяния, после маний — чувство облегчения и удовлетворения.
Наблюдение это верно лишь для части случаев, нередко характер и полюс аффективных
расстройств в состоянии, следующем за реализацией импульсивного влечения, резко
меняется: приходится наблюдать идеи самообвинения на фоне депрессии вслед за
импульсивным влечением, сопровождающимся развитием мании, и напротив, после
импульсивных влечений, возникающих на фоне депрессии, развивается чувство облегчения,
умиротворенности, приподнятый фон настроения.
Тщательное изучение роли и значения аффективных расстройств в синдромах, относящихся к различным психопатологическим регистрам, существенным образом расширяет наше представление о значимости аффективных нарушений при формировании того или иного психопатологического синдрома.
Не вызывает сомнения роль нозологии, в которой развивается тот или иной психопатологический синдром; здесь важны особенности предшствующего течения болезни, степень выраженности изменений личности, нередко отражающихся на структуре синдрома. Не менее важны возраст, наследственная отягощенность, особенности преморбида.
И вместе с этим нельзя не согласиться с мнением А.В.Снежневского, который считал аффективные расстройства неотъемлемым компонентом почти каждого синдрома психического заболевания, влияющего на его суть и структуру.
Индикаторы — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 36199
Цели обучения
- Объяснить изменение цвета индикаторов.

- Определить кислотные константы диссоциации К a или К ai индикаторов.
Индикаторы – это вещества, растворы которых меняют цвет из-за изменения рН. Их называют кислотно-щелочными индикаторами. Обычно это слабые кислоты или основания, но их сопряженные основания или кислоты имеют разные цвета из-за различий в их спектрах поглощения. Знаете ли вы, что окраска цветков гортензии зависит от рН почвы, в которой они растут? 9-}\) доминирует цвет, тогда как цвет из-за \(\mathrm{\color{Blue} HIn}\) доминирует, если \(\ce{[H+]} < \dfrac{K_{\large\textrm{ai}} {10}\). Приведенное выше уравнение показывает, что изменение цвета является наиболее чувствительным, когда \(\ce{[H+]} = K_{\large\textrm{ai}}\) в числовом значении.
Определим p K ai = — log( K ai ), а значение p K ai также является значением pH, при котором цвет индикатора наиболее чувствителен к изменениям pH . 9-}] = [\ mathrm{\color{Blue} HIn}]\). Другими словами, когда pH такой же, как p K ai , количество кислотных и основных форм равно. Когда две формы имеют одинаковую концентрацию, изменение цвета наиболее заметно.
9-}] = [\ mathrm{\color{Blue} HIn}]\). Другими словами, когда pH такой же, как p K ai , количество кислотных и основных форм равно. Когда две формы имеют одинаковую концентрацию, изменение цвета наиболее заметно.
Цвета веществ делают мир прекрасным местом. Благодаря цветам и структурам цветы, растения, животные и минералы демонстрируют свои уникальные черты. Многие индикаторы извлекаются из растений. Например, сок краснокочанной капусты и пигменты чая показывают разные цвета при разном pH. Цвет чая темнеет в щелочном растворе, но становится светлее при добавлении лимонного сока. Сок краснокочанной капусты окрашивается в синий цвет в щелочном растворе, но в кислом растворе он имеет ярко выраженный красный цвет.
| Имя | Кислотный краситель | pH Диапазон изменения цвета | Основной цвет | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Метилвиолет | Желтый | 0,0 — 1,6 | Синий | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тимоловый синий | Красный | 1,2 — 2,8 | Желтый | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Метиловый оранжевый | Красный | 3,2 — 4,4 | Желтый | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Бромкрезоловый зеленый | Желтый | 3,8 — 5,4 | Синий | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Метиловый красный | Красный | 4,8–6,0 | Желтый | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Лакмус | Красный | 5,0–8,0 | Синий | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Бромтимоловый синий | Желтый | 6,0 — 7,6 | Синий | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тимоловый синий | Желтый | 8,0 — 9,6 | Синий | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фенолфталеин | Бесцветный | 8,2 — 10,0 | Розовый | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тимолфталеин | Бесцветный | 9,4 — 10,6 | Синий | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ализарин желтый R | Желтый | 10,1 — 12,0 9{-6}\)) с 0,100 М \(\ce{NaOH}\) раствором. Раствор Сначала следует оценить рН в точке эквивалентности, при которой раствор составляет 0,0500 М \(\ce{NaA}\). Это проблема гидролиза, но следующий метод использует общий принцип равновесия. \[\begin{array}{ccccccc} Фенолфталеин в таблице выше имеет p K ai значение 9,7, что является ближайшим значением рН к точке эквивалентности в данном титровании. Этот индикатор бесцветен в кислом растворе, но при pH > 8 появляется светло-розовый цвет. Цвет становится более ИНТЕНСИВНО-РОЗОВЫМ по мере повышения pH. Парад интенсивностей цвета показан ниже: Точка эквивалентности наступает, когда цвет изменяется наиболее быстро, а не когда раствор изменил цвет. Неправильное использование индикаторов приведет к неточности результатов титрования. Цвета индикаторного раствораИндикаторы постепенно меняют цвет при различных pH. Предположим, что кислая форма имеет синий цвет, а основная форма — красный цвет. Ниже показано изменение цвета при разных pH. Цвет фона влияет на их внешний вид и наше восприятие.
Длинный растянутый цвет в середине последней строки имеет одинаковую интенсивность СИНЕГО и КРАСНОГО. Вопросы
Решения
Авторы и авторствоIndicators распространяется по незадекларированной лицензии, автором, ремиксом и/или куратором является LibreTexts.
кислотно-основные индикаторы
Кислотно-основные индикаторы | Центр знаний КаролиныКислотно-основные индикаторы Кислотно-основные индикаторы представляют собой слабые органические кислоты. Однако, в отличие от большинства кислот, кислотная и основная формы индикаторов имеют разные цвета. Наиболее важным свойством индикатора является его диапазон pH, который зависит от силы кислоты индикатора. Диапазон рН индикатора — это диапазон значений рН, в котором индикатор меняет цвет с кислой формы на основную. Он простирается от самого высокого pH, при котором видна только кислотная форма, до самого низкого pH, при котором видна только основная форма. Индикатор не чувствителен к изменениям рН за пределами своего диапазона, поскольку индикатор не меняет цвет при превышении этих значений рН. Например, метиловый красный не меняет цвет при значениях pH от 1 до 4 или 6 и выше. Диапазон рН составляет от 4 до 6 (см. Таблицу 1). Таблица 1. Руководство Каролины по индикаторам. ТаблицаТитрования Поскольку вблизи точки эквивалентности кислотно-щелочного титрования происходит заметное изменение pH, для обозначения окончания титрования можно использовать индикатор. Если вы не знаете, как меняется рН в точке эквивалентности вашего титрования, обратитесь к учебнику по общей химии. Большинство учебников содержат кривые титрования для простых титрований, таких как слабая кислота-сильное основание или сильная кислота-слабое основание. Измерение pHЛакмус, извлеченный из лишайника, является одним из старейших и простейших индикаторов pH. Студенты могут быть уже знакомы с ним. Лакмусовая бумага бывает трех видов: нейтральная, красная и синяя. Нейтральная лакмусовая бумажка пурпурная; он становится красным в присутствии кислоты и синим в присутствии основания. Для определения рН используйте индикаторную бумагу, универсальный индикаторный раствор или рН-метр. pH-метры могут определять pH до 0,01 единицы pH. Этот тип точности обычно зарезервирован для передовой науки, колледжа или исследовательской курсовой работы. В большинстве лабораторий общей химии вместо измерителей используется рН-бумага или универсальный индикаторный раствор. рН-бумага содержит несколько индикаторов и объединяет их диапазоны рН, обеспечивая расширенный диапазон чувствительности к рН. Эти бумаги отображают уникальный цвет для каждой единицы pH и имеют собственную цветовую диаграмму. Универсальные индикаторные растворы работают аналогично и могут быть наиболее экономичным вариантом, поскольку обычно требуется только 1 капля. Для развлечения измерьте pH обычных бытовых жидкостей с помощью индикатора pH по вашему выбору. Результаты могут вас удивить (см. Таблицу 2)!
Демонстрация Представьте себе удивление ваших учеников, когда слова внезапно появляются на, казалось бы, чистом листе бумаги, сбрызнутом «водой»! Чего ваши ученики не знают, так это того, что бумага была предварительно обработана раствором индикатора и активирована рН «воды» (кислого или щелочного раствора). Быстрое изменение цвета индикаторов — это «волшебство», стоящее за многими классическими «исчезающими» демонстрационными примерами химии чернил. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 Если раствор имеет цвет, соответствующий этому, pH будет таким же, как p K ai индикатора, при условии, что сопряженные формы индикатора имеют СИНИЙ и КРАСНЫЙ цвета.
Если раствор имеет цвет, соответствующий этому, pH будет таким же, как p K ai индикатора, при условии, что сопряженные формы индикатора имеют СИНИЙ и КРАСНЫЙ цвета.

 У него очень сложная молекула, которую мы упростим до HLit. «Н» — это протон, который можно отдать чему-то другому. «Лит» — это остаток молекулы слабой кислоты.
У него очень сложная молекула, которую мы упростим до HLit. «Н» — это протон, который можно отдать чему-то другому. «Лит» — это остаток молекулы слабой кислоты.
 В щелочном растворе метиловый оранжевый имеет желтый цвет и имеет следующую структуру:
В щелочном растворе метиловый оранжевый имеет желтый цвет и имеет следующую структуру:





 Очевидно, вам нужно выбрать индикатор, который меняет цвет как можно ближе к этой точке эквивалентности. Это варьируется от титрования к титрованию.
Очевидно, вам нужно выбрать индикатор, который меняет цвет как можно ближе к этой точке эквивалентности. Это варьируется от титрования к титрованию. Если решение становится красным, вы уходите дальше от точки эквивалентности.
Если решение становится красным, вы уходите дальше от точки эквивалентности. Фенолфталеин закончит изменяться задолго до точки эквивалентности, а метиловый оранжевый вообще исчезнет с графика.
Фенолфталеин закончит изменяться задолго до точки эквивалентности, а метиловый оранжевый вообще исчезнет с графика.
 Поскольку цвет индикатора зависит от pH раствора, индикаторы находят широкое применение в приложениях, связанных с изменениями pH, таких как титрование, тестирование pH и научные демонстрации.
Поскольку цвет индикатора зависит от pH раствора, индикаторы находят широкое применение в приложениях, связанных с изменениями pH, таких как титрование, тестирование pH и научные демонстрации. При выборе индикатора для кислотно-щелочного титрования выбирайте индикатор, диапазон pH которого попадает в диапазон изменения pH реакции. Например, при титровании сильной кислоты сильным основанием pH быстро изменяется от 3 до 11. Таким образом, индикатор фенолфталеин, диапазон значений pH которого колеблется от 8 до 10, является хорошим выбором для этого типа титрования.
При выборе индикатора для кислотно-щелочного титрования выбирайте индикатор, диапазон pH которого попадает в диапазон изменения pH реакции. Например, при титровании сильной кислоты сильным основанием pH быстро изменяется от 3 до 11. Таким образом, индикатор фенолфталеин, диапазон значений pH которого колеблется от 8 до 10, является хорошим выбором для этого типа титрования. Красная лакмусовая бумага становится синей в присутствии основания. Синяя лакмусовая бумажка становится красной в присутствии кислоты. Лакмусовая бумажка не показывает pH раствора, а только то, является ли он кислотой или основанием.
Красная лакмусовая бумага становится синей в присутствии основания. Синяя лакмусовая бумажка становится красной в присутствии кислоты. Лакмусовая бумажка не показывает pH раствора, а только то, является ли он кислотой или основанием. Универсальный индикаторный раствор Bogen, который содержит индикаторы метиловый красный, фенолфталеин и бромтимоловый синий, измеряет pH в диапазоне от 4 до 10. Еще одним популярным универсальным индикаторным раствором является натуральный сок краснокочанной капусты.
Универсальный индикаторный раствор Bogen, который содержит индикаторы метиловый красный, фенолфталеин и бромтимоловый синий, измеряет pH в диапазоне от 4 до 10. Еще одним популярным универсальным индикаторным раствором является натуральный сок краснокочанной капусты. 5
5