Строение мажорной и минорной гаммы. Виды мажора и минора
Ладом в музыке называется система устойчивых и неустойчивых звуков, объединённых тяготением к главному центру – тонике. В музыке большинства стран основными ладами являются мажор и минор.
Мажором называется семиступенный лад, устойчивые звуки которого образуют мажорное (большое) трезвучие. Его строение тон-тон-полутон-3 тона-полутон. Минором называется семиступенный лад, устойчивые звуки которого образуют минорное (малое) трезвучие. Его строение тон-полутон-2 тона-полутон-2 тона.
Существуют различные виды мажора и минора: натуральный, гармонический и мелодический.
В
гармоническом мажоре понижается VI
ступень. В связи с этим в таком ладу
возникают характерные интервалы (2ув-7ум
и 4ум-5ув), Уменьшённый вводный септаккорд
на VII
ступени и увеличенное трезвучие на VI
пониженной ступени, а все аккорды
субдоминантовой группы становятся
минорными.
В гармоническом миноре повышается VII ступень. В связи с этим в таком ладу возникают характерные интервалы (2ув-7ум и 4ум-5ув), Уменьшённый вводный септаккорд на VII повышенной ступени и увеличенное трезвучие на III ступени, а все аккорды доминантовой группы становятся мажорными.
В мелодическом миноре повышаются и VI, и VII ступени.
Тональность – это высотное положение лада. Система построения мажорных и минорных тональностей называется кварто-квинтовым кругом. Её принцип состоит в том, что в тональностях, идущих по квинтам вверх (или по квартам вниз) увеличивается количество диезов, а в тональностях, идущих по квинтам вниз (или по квартам вверх) увеличивается количество бемолей.
Гамма – поступенное движение от тоники до её повторения.
Интервалом называется
расстояние между какими-либо объектами
в пространстве (напр.
Мелодическими (в которых звуки взяты последовательно) и гармоническими (в которых звуки взяты одновременно). Нижний звук интервала называется основанием, верхний – вершиной.
Интервал характеризуют 2 величины: ступеневая (количественная) указывает на расстояние между основанием и вершиной и обозначается арабскими цифрами; а тоновая (качественная) уточняет вид интервала – большой, малый, увеличенный, уменьшённый или чистый, и обозначается соответственными буквами.
Интервалы
от примы до октавы (прима, секунда,
терция, кварта, квинта, секста, септима,
октава) называются 
Все чистые, большие, малые интервалы и тритон относятся к диатоническим, все увеличенные, уменьшённые, дважды увеличенные и дважды уменьшённые интервалы – к хроматическим.
Обращение
интервалов – это
такое изменение, при котором вершина и
основание меняются местами. Для этого
нужно либо нижний звук перенести на
октаву вверх, либо верхний на октаву
вниз. При этом соблюдается закономерность:
большие интервалы превращаются в малые
и наоборот, увеличенные в уменьшённые
и наоборот, а чистые остаются чистыми.
Тональности. Основы практической теории музыки
Основы практической теории музыки«…назад вперед…»
Для практического использования лада необходимо задать его высотное положение. Высотное положение лада называется тональностью. Название любой тональности однозначно определяется названием звука тоники, ладовым наклонением (мажор или минор) и видом (натуральный, гармонический и мелодический). В качестве примера ниже показаны основные виды до-мажора и ля-минора
Рис. 1. Виды мажорных ладов от ноты до
Рис. 2. Виды минорных ладов от ноты ля
В музыке часто приходится определять тональность и её ступени. Для этого вначале нужно найти тонику заданной или выбранной тональности, а затем при помощи знания интервального строения лада и альтерированных ступеней (повышенных или пониженных) определить все ступени.
Если посмотреть на клавиатуру фортепиано, то все белые клавиши от клавиши до будут ступенями натурального мажорного лада, а все белые клавиши от ля – ступенями натурального минорного лада.
В мелодических тональностях нужно изменить высоту у двух соседних ступеней. Это могут быть только VI и VII ступени, так как попытка изменить что-то в ступенях с I по V приведёт к нарушению определения, в котором говорится, что I, III и V ступени образуют мажорное или минорное трезвучие. В какую сторону изменять высоту? Будем отталкиваться от противного, и отбросим невозможные ситуации.
Посмотрите на клавиши до-мажорной тональности. Если обе ступени повысить, то тогда седьмая повышенная ступень станет си-диезом, что приведёт к образованию лада, состоящего из 6 ступеней:
до — ре- ми — фа — соль — ля.
То, что названий ступеней семь роли не играет, так как количество ступеней определяется тем, что в семиступенных ладах должно быть 7 разных звуков, а здесь разных звуков только 6. Значит, нужно понизить IV и VII ступени для получения мелодического мажора.
Значит, нужно понизить IV и VII ступени для получения мелодического мажора.
Аналогичные рассуждения будут и для получения мелодического минора. Посмотрите на ступени натурального ля-минора. Если понизить обе ступени IV и VII, то это приведёт к образованию лада из 6 ступеней:
ля — си — до — ре — ми — соль
Значит, нужно эти ступени повысить.
Для получения гармонических видов нужно принять во внимание тот факт, в них существует интервал увеличенной секунды (1,5 тона). Этот интервал может быть только между VI и VII ступенью, так как остальные ступени мы трогать не можем по определению ладов. Посмотрим на клавиши тональности до-мажор. Изменение высоты VII ступени не даст возможность получить интервал в полтора тона (если её повысит, то получится лад из 6 ступеней). Значит, нужно понизить шестую ступень. Аналогичные рассуждения приводят к тому, что для получения гармонического минора нужно повысить седьмую ступень.
Подведём небольшой итог. В системе лада звук приобретает новые характеристики – степень устойчивости и функциональность. Сам лад входит в систему строя, а строй – в систему звукоряда.
Сам лад входит в систему строя, а строй – в систему звукоряда.
Рис. 3. Взаимосвязь между звуком и окружающими его системами
Взаимосвязь тональностей
От 12 хроматических ступеней октавы можно построить большое количество мажорных и минорных тональностей. На практике ограничиваются 15 мажорными и 15 минорными тональностями, руководствуясь принципом разумности. Зачем что-то усложнять, если то же самое можно сделать просто? Никто не запрещает, например, использовать тональность си-диез-мажор.
Рис. 4. Тональность си-диез-мажор
Попробуйте сыграть эту гамму (крестики перед ступенями — дубль-диез – повышение на 1 тон). Непросто? А на самом деле это тональность до-мажор. В до-мажоре нет знаков при ключе, а в тональности си-диез-мажор их будет двенадцать.
Как научиться строить любую тональность без их заучивания? Для этого достаточно помнить интервальное строение ладов, а также изменения ступеней для получения основных видов, поcле чего ступени тональности можно найти путём расчёта.
Диезы следуют в таком порядке:
фа-до-соль-ре-ля-ми-си
Бемоли следуют в таком порядке:
си-ми-ля-ре-соль-до-фа
После этого находим закономерность. Тоника мажорной тональности определяется по последнему диезу, повышенному на полтона. Например, перечисляем диезы:
фа-до-соль-ре
Последний диез – ре. Повышаем его на полтона и получаем звук ми. Значит, данная тональность – это ми-мажор.
Для определения мажорной тональности с бемолями можно либо определить её по предпоследнему бемолю (если он есть, конечно), либо от последнего бемоля отложить вниз интервал кварты. Например, бемоли си и ми. Предпоследний бемоль си. Значит, тональность си-бемоль мажор. Или от последнего бемоля ми откладываем вниз кварту,. Получится звук си-бемоль.
Теперь попробуем найти тональности и определить знаки визуальным способом.
Пример 1. Требуется построить тональность ми-мажор и определить знаки для неё. Вспомним, что мажорный лад – это белые клавиши от до. Мысленно представим их расположение, откуда получаем тоновое строение т-т-п-т-т-т-п. Применяем это строение от ноты ми:
| т | т | п | т | т | т | п | |
| ми | фа-диез | соль-диез | ля | си | до-диез | ре-диез | ми |
В тональности ми-мажор четыре диеза: фа, до, соль, ре.
Пример 2. Требуется построить тональность ми-минор. Мысленно вспоминаем минорную тональность от клавиши ля и их тоновое строение.
| т | п | т | т | п | т | т | |
| ми | фа-диез | соль | ля | си | до | ре | ми |
В тональности ми-минор один знак — фа-диез.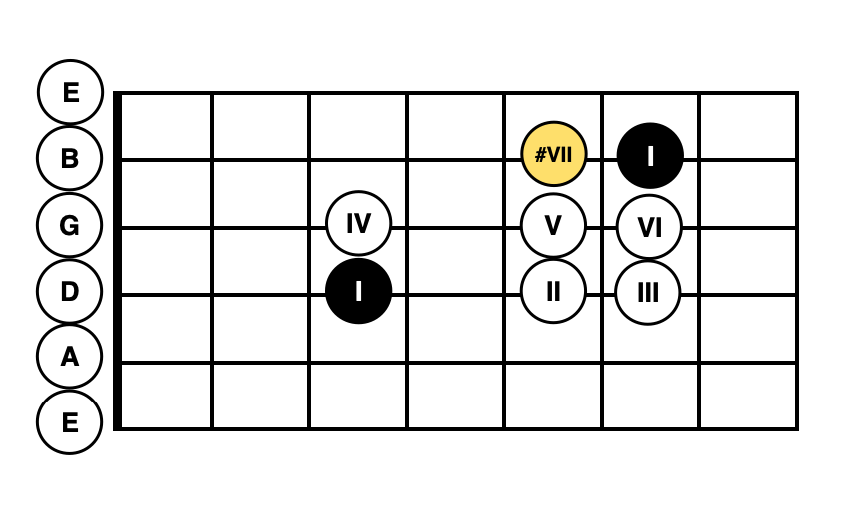 Почему фа-диез, а не соль-бемоль? Потому что в последнем случае получится следующее:
Почему фа-диез, а не соль-бемоль? Потому что в последнем случае получится следующее:
| т | п | т | т | п | т | т | |
| ми | соль-бемоль | соль | ля | си | до | ре | ми |
Вместо семи ступеней используется шесть ступеней (пропущена фа) или в диатоническом ладу не может быть хроматики, а она тут есть соль-бемоль – соль.
Минорные тональности можно определять при помощи мажорных тональностей. Для этого используется понятие параллельных тональностей. Параллельные тональности – это парные тональности мажора и минора, имеющие идентичные ключевые знаки. Тоника параллельного минора расположена на полтора тона (на малую терцию) ниже тоники мажора.
Пример 3. Что есть соль-минор? Откладываем малую терцию вверх и определяем тональность – си-бемоль мажор. Откладываем кварту вверх и находим ми-бемоль. Вспоминаем последовательность бемолей си-ми-ля-ре-соль-до-фа и находим все бемоли, которые идут до ми-бемоль включительно. Это си и ми. Значит, в соль-миноре два бемоля си и ми. Для проверки можно посмотреть тоновое строение.
12 мажорных тональностей, построенных от каждой ступени равномерно-темперированного строя немало. Зачем нужно столько мажорных тональностей? С точки зрения интервального строения все мажорные лады одинаковые и имеют одинаковый интервальный состав (т-т-п-т-т-т-п). А вот с точки зрения характера звучания один мажорный лад отличается от другого мажорного лада. Проверить это просто, используя формулу для определения частот ступеней в равномерно темперированном строе F=440*2i/12. Давайте определим, какой диапазон частот заключен в одном тоне между ступенями первой октавы ля и си, до и ре. В первом случае 440*20/12 — 440*21/12 = 53,8833 Гц, а во втором 440*2-9/12 — 440*2-7/12 = 32,0392 Гц. Разница видна невооруженным взглядом. На практике это означает то, что песня в одной мажорной тональности будет звучать ярче, чем в другой мажорной тональности. Это как с оттенками цвета. Есть красный цвет, но вместе с ним существуют оттенки красного, которые могут быть менее яркими и насыщенными.
А вот с точки зрения характера звучания один мажорный лад отличается от другого мажорного лада. Проверить это просто, используя формулу для определения частот ступеней в равномерно темперированном строе F=440*2i/12. Давайте определим, какой диапазон частот заключен в одном тоне между ступенями первой октавы ля и си, до и ре. В первом случае 440*20/12 — 440*21/12 = 53,8833 Гц, а во втором 440*2-9/12 — 440*2-7/12 = 32,0392 Гц. Разница видна невооруженным взглядом. На практике это означает то, что песня в одной мажорной тональности будет звучать ярче, чем в другой мажорной тональности. Это как с оттенками цвета. Есть красный цвет, но вместе с ним существуют оттенки красного, которые могут быть менее яркими и насыщенными.
Тоже самое можно сказать о любых тональностях. Переход в другую тональность при транспонировании не изменяет гармонию, но приводит к изменению окраски и характера звучания композиции. Проверить это можно путем сравнения звучания midi-файла в разных тональностях.
Проверить это можно путем сравнения звучания midi-файла в разных тональностях.
Основы практической теории музыки«…назад вперед…»
Александр Страшко
Вконтакте
30.01.11
Озон — симметричная молекула, поэтому вклад I и II в наше представление об этой молекуле одинаков. Однако большинство резонансных гибридов несимметричны, и их вкладчики не играют равных ролей. Формамид представляет собой суперпозицию III и IV, но его структура и свойства больше напоминают III: атомы несут только небольшие заряды, связь CO ближе к двойной связи, а связь CN ближе к одинарной связи. В этом случае мы говорим, что III — это 9.0016 основной вкладчик и IV является второстепенным вкладчиком . Неоднозначная терминология. V играет гораздо меньшую роль, чем III или IV, поэтому мы могли бы назвать V второстепенным вкладчиком, а III и IV — главными вкладчиками. Иногда, однако, мы хотим, чтобы относительные роли всех трех участников были четкими. В этом случае мы используем следующую терминологию: Рейтинг участников. Существует несколько способов определения основных, второстепенных и очень незначительных участников:
|
2.5: Правила для резонансных форм
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 31387
Цели
После завершения этого раздела вы сможете
- использовать понятие резонанса для объяснения структурных особенностей молекул и ионов.
- понимают взаимосвязь между резонансом и относительной стабильностью молекул и ионов.
Правила рисования и работы с элементами резонанса
Распознавание, рисование и оценка относительной стабильности участников резонанса необходимы для понимания механизмов органических реакций. При обучении рисованию и интерпретации резонансных структур вам помогут несколько основных рекомендаций. .
При обучении рисованию и интерпретации резонансных структур вам помогут несколько основных рекомендаций. .
1) Для каждой молекулы или иона существует ТОЛЬКО ОДНА РЕАЛЬНАЯ СТРУКТУРА. Эта реальная структура (резонансный гибрид ) берет свой характер от среднего значения всех индивидуальных вкладчиков резонанса . Глядя на участников резонанса, мы видим одну и ту же молекулу или ион, изображенные по-разному. Резонансные гибриды на самом деле представляют собой единую неизменную структуру.
Основные вкладчики резонанса иона формиата
Представления гибрида резонанса формиата
2) Гибрид резонанса более стабилен, чем любые отдельные резонансные структуры. Часто резонансные структуры представляют собой движение заряда между двумя или более атомами. Заряд распределен среди этих атомов и поэтому более стабилизирован. Если посмотреть на картинку выше, резонансные вкладчики представляют отрицательный заряд как на одном кислороде, так и на другом. Резонансный гибрид показывает, что отрицательный заряд поровну распределяется между двумя атомами кислорода. В резонансном гибриде отрицательный заряд распределяется по большей части молекулы и поэтому более стабилен.
Резонансный гибрид показывает, что отрицательный заряд поровну распределяется между двумя атомами кислорода. В резонансном гибриде отрицательный заряд распределяется по большей части молекулы и поэтому более стабилен.
3) Резонансные вкладчики не обязательно должны быть эквивалентны. Из-за этого резонансные структуры обязательно вносят одинаковый вклад в резонансный гибрид. Две резонансные структуры, показанные ниже, не эквивалентны, потому что одна показывает отрицательный заряд на кислороде, а другая показывает его на углероде. Позже мы покажем, что вкладчик с отрицательным зарядом на кислороде является более стабильным из двух. Кроме того, это означает, что резонансный гибрид не будет точной смесью двух структур.
4) Все составляющие резонанса должны быть правильными структурами Льюиса. Каждый атом должен иметь полную валентную оболочку и быть показан с правильными формальными зарядами. Карбкатион (углерод только с 6 валентными электронами) является единственным допустимым исключением из правил валентной оболочки. Структура ниже является недопустимой резонансной структурой, хотя она показывает только движение пи-связи. Полученная структура содержит углерод с десятью электронами, что нарушает правило октетов и делает его недействительным.
Структура ниже является недопустимой резонансной структурой, хотя она показывает только движение пи-связи. Полученная структура содержит углерод с десятью электронами, что нарушает правило октетов и делает его недействительным.
5) Все участники резонанса должны иметь одинаковую молекулярную формулу, одинаковое количество электронов и одинаковый суммарный заряд. Молекулы на рисунке ниже не являются резонансными структурами одной и той же молекулы, поскольку имеют разные молекулярные формулы (C 2 H 5 NO против C 2 H 6 NO). Кроме того, две структуры имеют разные суммарные заряды (нейтральные и положительные).
6) Резонансные вкладчики различаются только положением пи-связи и электронов неподеленной пары. Сигма-связи никогда не разрываются и не образуются, потому что атомы должны сохранять свое положение. Молекулы на рисунке ниже не являются резонансными структурами одной и той же молекулы, даже если они имеют одинаковую молекулярную формулу (C 3 H 6 O). Эти молекулы считаются структурными изомерами, потому что их различие связано с разрывом сигма-связи и перемещением атома водорода.
Эти молекулы считаются структурными изомерами, потому что их различие связано с разрывом сигма-связи и перемещением атома водорода.
Главные и второстепенные участники резонанса
Как уже говорилось ранее, истинная структура резонансного гибрида представляет собой комбинацию всех возможных резонансных структур. Если резонансные структуры равны по устойчивости, они вносят одинаковый вклад в структуру гибрида. Однако, если резонансные структуры имеют разную стабильность, они вносят свой вклад в структуру гибрида в пропорциях, связанных с их относительной стабильностью. Можно сказать, что структура резонансного гибрида напоминает наиболее устойчивую резонансную структуру. Из-за этого важно уметь сравнивать устойчивость резонансных структур. В приведенном ниже примере структура B гораздо менее важен с точки зрения его вклада в гибрид, поскольку он содержит нарушенный октет карбокатиона. Относительная стабильность этих двух структур настолько сильно различается, что молекулы, содержащие связь C=O, почти исключительно записываются в форме, подобной структуре A . Однако, как вы узнаете из главы 19, положительно заряженный углерод, созданный структурой B , объясняет, как связь C=O будет реагировать с частицами, богатыми электронами.
Однако, как вы узнаете из главы 19, положительно заряженный углерод, созданный структурой B , объясняет, как связь C=O будет реагировать с частицами, богатыми электронами.
Правила оценки устойчивости резонансных структур
1. Резонансные структуры, в которых все атомы имеют полные валентные оболочки, более устойчивы. Это означает, что большинство атомов имеют полный октет. В приведенном ниже примере структура A имеет атом углерода с положительным зарядом и, следовательно, является неполным октетом. На основании этого критерия структура A менее стабильна и вносит меньший вклад в резонансный гибрид, чем структура B .
2. Структуры с наименьшим числом формальных зарядов более стабильны. Исходя из этого, структура B менее стабильна, так как имеет два атома с формальными зарядами, а структура A не имеет ни одного. Структура A будет основным источником резонанса.
Структура A будет основным источником резонанса.
3. Структуры с отрицательным зарядом на более электроотрицательном атоме будут более устойчивыми. Разница между двумя резонансными структурами заключается в размещении отрицательного заряда. Структура B является более стабильным и вносит основной вклад в резонанс, потому что он помещает отрицательный заряд на более электроотрицательный кислород.
4. Структуры с положительными зарядами на наименее электроотрицательном атоме (наиболее электроположительном) более стабильны.
5. Структуры с наименьшим разделением формальных зарядов более стабильны. Единственная разница между двумя приведенными ниже структурами заключается в относительном расположении положительных и отрицательных зарядов. В структуре A заряды расположены ближе друг к другу, что делает его более стабильным.
6. Резонансные формы, которые эквивалентны, не имеют разницы в устойчивости . Глядя на две приведенные ниже структуры, нельзя сделать никакой разницы, используя правила, перечисленные выше. Это означает, что две структуры эквивалентны по стабильности и будут вносить одинаковый структурный вклад в резонансный гибрид.
Примеры основных и второстепенных вкладчиков
Пример 1:
Пример 2:
Пример 3:
Карбоксилат Пример
В случае карбоксилатов, участники A и 111111111111111111111111111111 год. к гибридной структуре. Однако существует и третий резонансный фактор C , в котором углерод несет положительный формальный заряд (карбокатион), а оба атома кислорода имеют одинарную связь и несут отрицательный заряд.
Структура C вносит менее важный вклад в общую картину связей группы по сравнению с A и B . Откуда мы знаем, что структура C является «второстепенным» вкладчиком? Примените правила ниже
Откуда мы знаем, что структура C является «второстепенным» вкладчиком? Примените правила ниже
- У углерода в вкладчике C нет октета. В общем, резонансные вкладчики, в которых углерод не соответствует правилу октета, относительно менее важны. (правило №1)
- В составе C имеется только три облигации по сравнению с четырьмя в A и B . В общем, резонансная структура с меньшим количеством общих связей относительно менее важна. (правило №2)
- Структура C также имеет больше формальных зарядов, чем присутствует в A или B . В общем, резонансные вкладчики, в которых больше/больше разделение зарядов, относительно менее важны. (правило №3)
- Конструкции А и B эквивалентны и будут вносить одинаковый вклад в резонансный гибрид. (правило №5).
- Резонансный элемент, в котором отрицательный формальный заряд расположен на более электроотрицательном атоме, обычно кислороде или азоте, более стабилен, чем тот, в котором отрицательный заряд расположен на менее электроотрицательном атоме, таком как углерод.
 Пример приведен в верхнем левом выражении на следующем рисунке. (правило №4)
Пример приведен в верхнем левом выражении на следующем рисунке. (правило №4)
Пример с 3 резонансными структурами
Молекулы с более чем двумя резонансными структурами также можно рассматривать с использованием правил, перечисленных выше. Из перечисленных ниже резонансных структур структура A будет наиболее стабильной, поскольку все неводородные атомы имеют полный октет, а отрицательный заряд приходится на более электроотрицательный атом (кислород). Структура C будет следующей по стабильности, потому что все неводородные атомы имеют полные октеты, хотя теперь отрицательный заряд приходится на углерод, а не на кислород. Структура B был бы наименее стабильным из трех, потому что в нем есть карбокатион, не имеющий октета. Из этих трех структура A будет основной резонансной структурой и будет больше всего напоминать структуру истинного резонансного гибрида. Структура B считается второстепенным вкладчиком в резонанс и очень мало повлияет на структуру резонансного гибрида.
Пример \(\PageIndex{1}\)
Нарисуйте главный компонент резонанса структуры ниже. Включите в свой рисунок соответствующие изогнутые стрелки, показывающие, как вы пришли от данной структуры к вашей структуре. Объясните, почему ваш вкладчик является основным. На каких орбиталях находятся две неподеленные пары кислорода?
Решение
В приведенной выше структуре углерод с положительным формальным зарядом не имеет полного октета валентных электронов. Используя соглашение с изогнутой стрелкой, неподеленная пара кислорода может быть перемещена на соседнюю связь слева, а электроны в двойной связи сдвинуты влево (см. правила рисования резонансных вкладчиков, чтобы убедиться, что это ‘ законные ходы).
Результирующий вклад в резонанс, в котором кислород несет формальный заряд, является основным, потому что все атомы имеют полный октет, и имеется одна дополнительная связь (применяются оба правила резонанса №1 и №2). Эту систему можно представить как четыре параллельных 2p орбиталей (по одной на C 2 , C 3 и C 4 , плюс одна на кислороде), разделяющих четыре пи-электрона. Одна неподеленная пара на кислороде находится на негибридной орбитали 2p и является частью сопряженной пи-системы, а другая расположена на орбитали sp 2 .
Одна неподеленная пара на кислороде находится на негибридной орбитали 2p и является частью сопряженной пи-системы, а другая расположена на орбитали sp 2 .
Также обратите внимание, что один дополнительный вкладчик может быть нарисован, но он тоже незначителен, поскольку имеет углерод с неполным октетом:
Упражнения
1) Расположите следующие резонансные структуры в порядке их стабильности. Укажите, что вносит основной вклад в резонансный гибрид.
2) Нарисуйте четыре дополнительных резонанса для молекулы ниже. Пометьте каждый из них как основной или второстепенный (структура ниже относится к основному вкладчику).
3) Нарисуйте три резонансных компонента метилацетата (сложный эфир со структурой CH 3 COOCH 3 ) и расположите их в порядке их относительной важности для картины связывания молекулы. Объясните свои рассуждения.
4) Ниже представлен второстепенный вклад в резонанс вещества, известного как «енамин», который мы изучим более подробно в Разделе 19.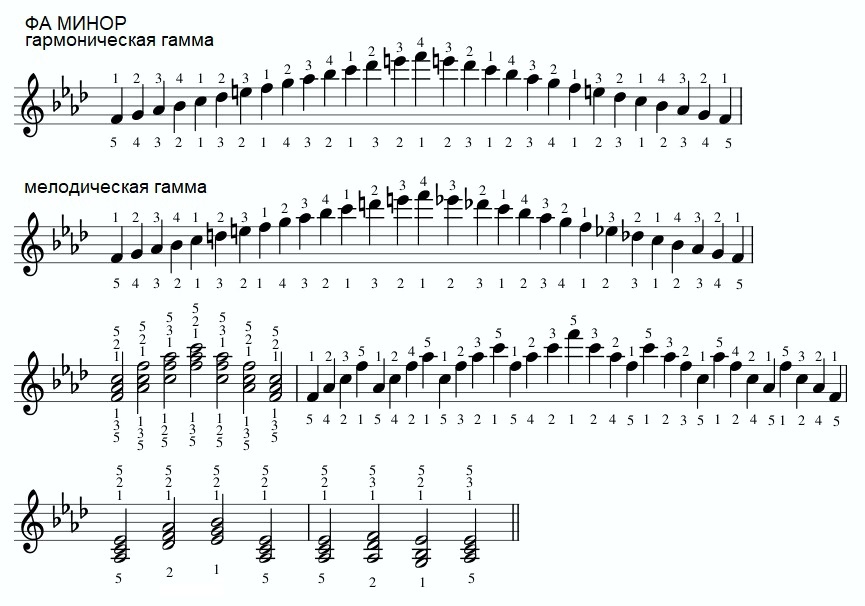 8 (образование енаминов) Разделе 23.12 (реакции енаминов). Нарисуйте основной вклад в резонанс для енамина и объясните, почему ваш вклад является основным.
8 (образование енаминов) Разделе 23.12 (реакции енаминов). Нарисуйте основной вклад в резонанс для енамина и объясните, почему ваш вклад является основным.
5) Нарисуйте основной вклад в резонанс для каждого из анионов ниже:
Решения
1) Структура I была бы наиболее стабильной, потому что все неводородные атомы имеют полный октет, а отрицательный заряд находится на более электроотрицательный азот. Структура III будет следующей по стабильности, потому что все неводородные атомы имеют полные октеты. Структура II была бы наименее стабильной, потому что она имеет нарушенный октет карбокатиона.
2)
3)
Вкладчик слева самый стабильный: формальных обвинений нет.
Вкладчик справа наименее стабилен: есть формальные заряды, углерод имеет неполный октет.
Вкладчик в середине — промежуточная стабильность: есть формальные заряды, но все атомы имеют полный октет.
4) Этот вкладчик является крупным, поскольку формальных обвинений нет.
5)
Упражнения
Вопросы
Q2.5.1
Являются ли длины связи одинаковы в ионе карбоната, CO 3 2 — ??
Растворы
S2.5.1 Да, длины связей в карбонат-ионе одинаковы. Ион карбоната существует как резонансный гибрид трех нижеприведенных резонансных форм.
Дополнительные резонансные темы
Распознавание резонанса
Факторы резонанса включают «воображаемое движение» электронов, связанных пи-связями, или электронов неподеленной пары, которые соседствуют с пи-связями (т. е. сопряжены с ними). Вы никогда не сможете изменить расположение электронов в сигма-связях — если вы показываете образование или разрыв сигма-связи, вы показываете протекающую химическую реакцию. Точно так же положение атомов в молекуле не может меняться между двумя участниками резонанса.
Поскольку бензол будет появляться на протяжении всего курса, важно признать стабильность, достигнутую за счет резонансной делокализации шести пи-электронов в шести атомах углерода. Бензол также иллюстрирует один из способов распознавания резонанса — когда можно нарисовать две или более эквивалентные структуры Льюиса. Если бы нам нужно было нарисовать структуру ароматической молекулы, такой как 1,2-диметилбензол, мы могли бы изобразить двойные связи двумя способами:
Бензол также иллюстрирует один из способов распознавания резонанса — когда можно нарисовать две или более эквивалентные структуры Льюиса. Если бы нам нужно было нарисовать структуру ароматической молекулы, такой как 1,2-диметилбензол, мы могли бы изобразить двойные связи двумя способами:
Какой путь правильный? На этот вопрос есть два простых ответа: «оба» и «ни один». Оба способа изображения молекулы являются одинаково приемлемыми аппроксимациями картины связей молекулы, но ни один из них сам по себе не является точным изображением делокализованных пи-связей. Однако два альтернативных рисунка, рассматриваемые вместе, дают гораздо более точную картину, чем любой из них по отдельности. Это потому, что они вместе подразумевают, что углерод-углеродные связи являются не двойными связями, не одинарными связями, а примерно посередине между ними.
Когда возможно нарисовать более одной допустимой структуры для соединения или иона, мы идентифицировали участников резонанса : две или более различных структур Льюиса, изображающих одну и ту же молекулу или ион, которые, если рассматривать их вместе, лучше справляются с задачей приближается к делокализованной пи-связи, чем к любой отдельной структуре.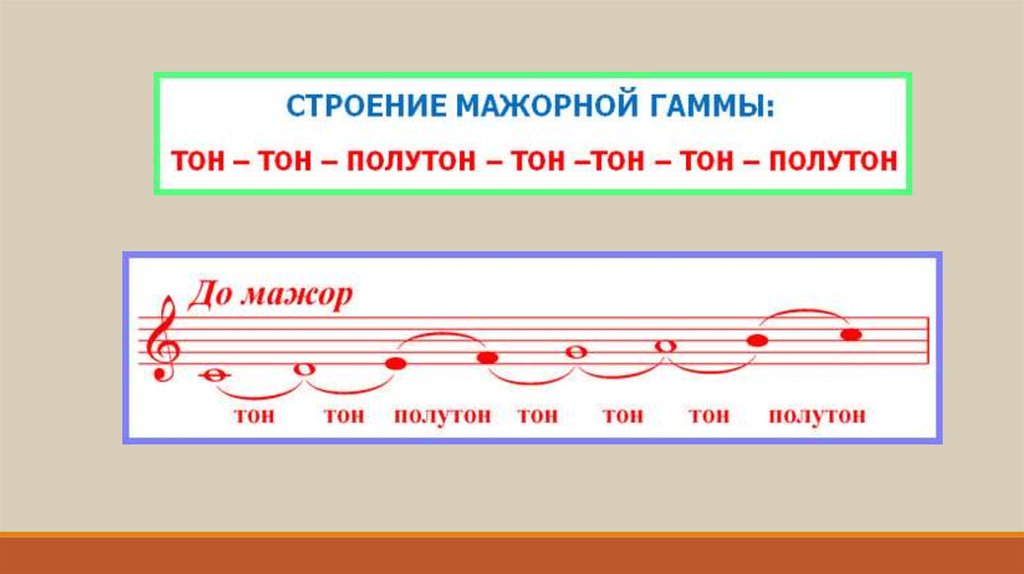 По соглашению участники резонанса связаны двунаправленной стрелкой и иногда заключены в квадратные скобки:
По соглашению участники резонанса связаны двунаправленной стрелкой и иногда заключены в квадратные скобки:
Чтобы было легче визуализировать разницу между двумя участниками резонанса, часто используются маленькие изогнутые стрелки. Каждая из этих стрелок изображает «движение» двух пи-электронов. Однако при рисовании участников резонанса это «движение» электрона происходит только в нашем уме, когда мы пытаемся визуализировать делокализованные пи-связи. Тем не менее, использование обозначений изогнутых стрелок является важным навыком, который вам необходимо развить при рисовании участников резонанса.
Изображение бензола с помощью двух резонансных вкладчиков A и B на рисунке выше , а не означает, что молекула в один момент выглядит как структура A, а затем в следующий момент смещается, чтобы выглядеть как структура B. Скорее, вообще моменты, молекула представляет собой комбинацию, или резонанс гибрид обоих A и B.
Осторожно ! Очень важно уяснить, что, рисуя два (или более) резонансных вкладчика, мы не рисуем две разные молекулы: они просто различных изображений одной и той же молекулы .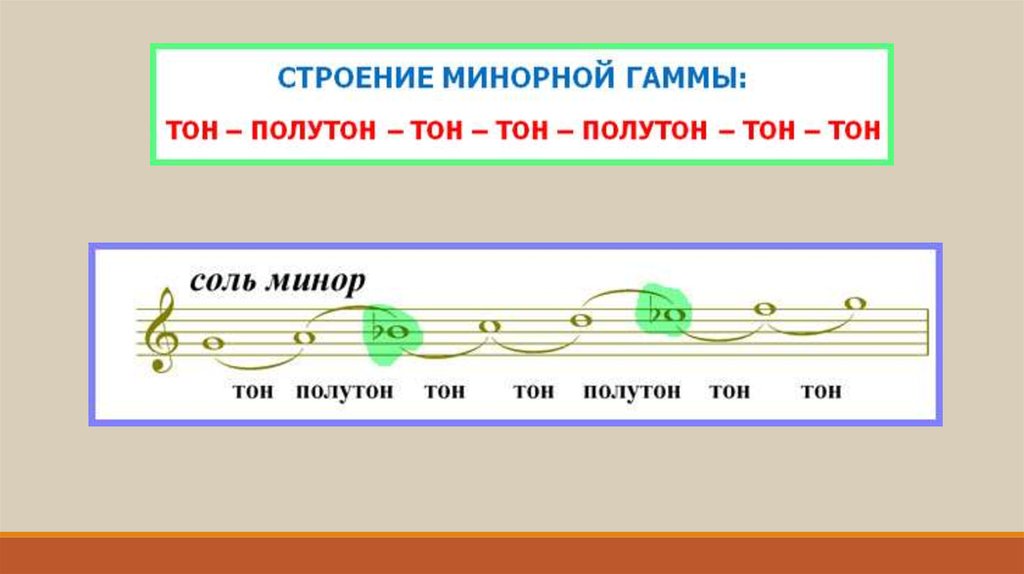 Кроме того, двунаправленная резонансная стрелка НЕ означает, что произошла химическая реакция.
Кроме того, двунаправленная резонансная стрелка НЕ означает, что произошла химическая реакция.
Бензол часто называют только одним из двух возможных участников резонанса (предполагается, что читатель понимает, что подразумевается резонансная гибридизация). Однако иногда бензол изображается кругом внутри шестиугольника, сплошным или пунктирным, как способ рисования резонансного гибрида.
Examples of Resonance
Molecules with a Single Resonance Configuration
Example 1:
Example 2:
Example 3:
Example 4 :
Приведенные выше резонансные структуры показывают, что электроны делокализованы внутри молекулы, и благодаря этому процессу молекула приобретает дополнительную стабильность. Озон с обоими его противоположными формальными зарядами создает нейтральную молекулу, и благодаря резонансу это стабильная молекула. Дополнительный электрон, который создал отрицательный заряд одного концевого кислорода, может быть делокализован резонансом через другой концевой кислород.
Дополнительный электрон, который создал отрицательный заряд одного концевого кислорода, может быть делокализован резонансом через другой концевой кислород.
Бензол является чрезвычайно стабильной молекулой благодаря своей геометрии и взаимодействию молекулярных орбиталей, но, что наиболее важно, благодаря своей резонансной структуре. Делокализованные электроны в бензольном кольце делают молекулу очень стабильной, и с ее характеристиками нуклеофила она будет реагировать только с сильным электрофилом, и после первой реакционной способности замещенный бензол будет зависеть от своего резонанса, чтобы направить следующее положение для реакции. для добавления второго заместителя.
Пример 2.5.1: Множественный резонанс других молекул
Молекулы и ионы с более чем одной резонансной формой:
Некоторые структурные резонансные конформации являются основным фактором или доминирующими формами существования молекулы. Например, если мы посмотрим на приведенные выше правила оценки стабильности молекулы, мы увидим, что для третьей молекулы первая и вторая формы вносят основной вклад в общую стабильность молекулы.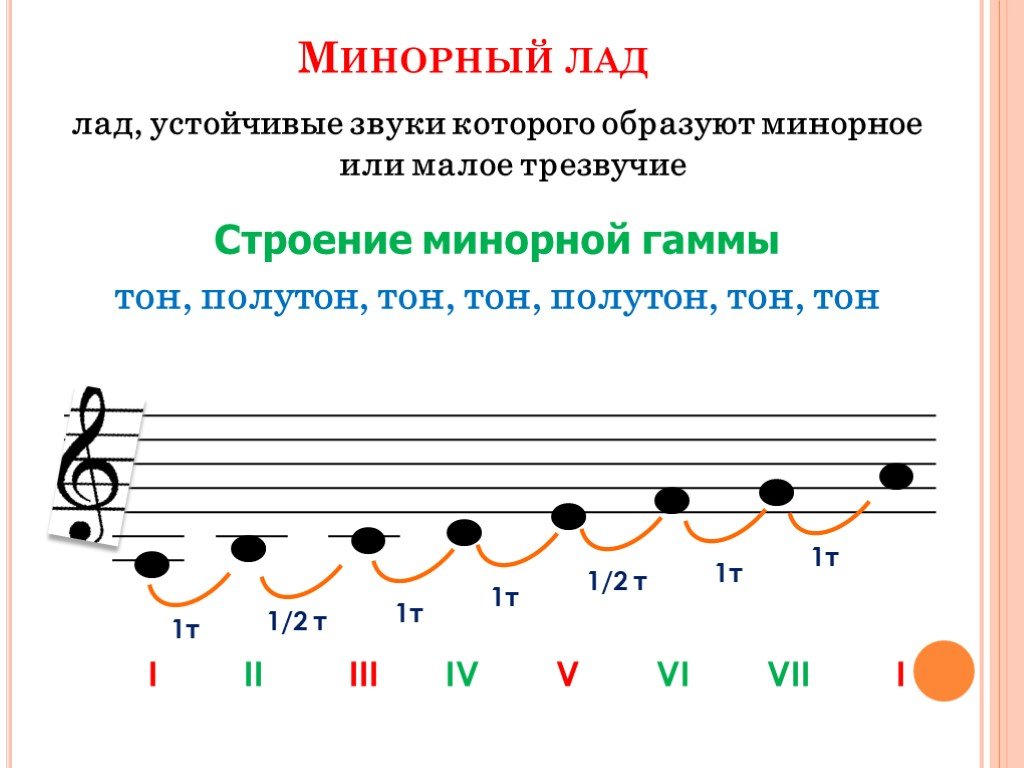 Азот более электроотрицательный, чем углерод, поэтому он может обрабатывать отрицательный заряд лучше, чем углерод. Углерод с отрицательным зарядом является наименее благоприятной конформацией для существования молекулы, поэтому последняя резонансная форма очень мало способствует стабильности иона.
Азот более электроотрицательный, чем углерод, поэтому он может обрабатывать отрицательный заряд лучше, чем углерод. Углерод с отрицательным зарядом является наименее благоприятной конформацией для существования молекулы, поэтому последняя резонансная форма очень мало способствует стабильности иона.
Гибридный резонанс
Различные формы резонанса молекулы помогают предсказать реактивность молекулы в определенных местах.
Формы гибридного резонанса показывают различные структуры Льюиса с делокализованным электроном. Это очень важно для реакционной способности хлорбензола, потому что в присутствии электрофила он будет реагировать, а образование другой связи будет направленным и определяемым резонансом. Неподеленная пара электронов, делокализованная в ароматическом замещенном кольце, — это то место, где она потенциально может образовать новую связь с электрофилом, поскольку показано, что есть три возможных места, где может иметь место реакционная способность.
 «Основной» и «второстепенный» все еще используются, когда молекула представляет собой суперпозицию трех или более участников. В этих ситуациях «основной» может применяться ко всем более крупным вкладчикам, а «второстепенный» — ко всем меньшим вкладчикам. Например, формамид иногда рассматривается как суперпозиция трех компонентов:
«Основной» и «второстепенный» все еще используются, когда молекула представляет собой суперпозицию трех или более участников. В этих ситуациях «основной» может применяться ко всем более крупным вкладчикам, а «второстепенный» — ко всем меньшим вкладчикам. Например, формамид иногда рассматривается как суперпозиция трех компонентов: Крупный участник, такой как III, обеспечивает наилучшее совпадение. Незначительный вклад, такой как IV, обеспечивает более слабое соответствие, но добавляет важную информацию к картине. Очень незначительный участник, такой как Ви, очень мало добавляет к картине и обычно игнорируется.
Крупный участник, такой как III, обеспечивает наилучшее совпадение. Незначительный вклад, такой как IV, обеспечивает более слабое соответствие, но добавляет важную информацию к картине. Очень незначительный участник, такой как Ви, очень мало добавляет к картине и обычно игнорируется. 
 Пример приведен в верхнем левом выражении на следующем рисунке. (правило №4)
Пример приведен в верхнем левом выражении на следующем рисунке. (правило №4)